干细胞聚集体的群体的制备方法与流程
本发明涉及干细胞聚集体的群体的制备方法。
背景技术:
已知使多能干细胞聚集而形成类胚体的方法(专利文献1)。上述方法中针对类胚体(EB,embryoid body)使用酶而使细胞实质上个体化(权利要求9)。使个体化的细胞再聚集(权利要求18)。上述方法适于将多能干细胞分化为内皮细胞。
现有技术文献
专利文献
专利文献1:日本特表2012-519005号公报
非专利文献
非专利文献1:Kenji Osafune,Leslie Caron,Malgorzata Borowiak,Rita J Martinez,Claire S Fitz-Gerald,Yasunori Sato,Chad A Cowan,Kenneth R Chien&Douglas A Melton,"Marked differences in differentiation propensity among human embryonic stem cell lines",Nature Biotechnology,Published online:17February 2008,26,313-315
技术实现要素:
发明要解决的问题
上述方法中为了准备大量的类胚体而对类胚体进行破碎而形成多个细胞块,分别对上述细胞块进行培育而成为新的类胚体。然而,通常类胚体中还包含已经开始进行分化的细胞。因此,上述方法作为实质上保持多能干细胞聚集体的未分化状态而增加多能干细胞聚集体的方法是不适合的。
发明人等在发明的过程中得到了以下见解。非专利文献1显示了由于细胞的培养时期不同而分化的进度不同(非专利文献1的补充图1.)。若对分化进度不同的细胞直接进行传代,则分化的进度被传代后所形成的聚集体继承。因此可预料到每重复进行1次传代,就使聚集体之间的未分化状态的均质性降低。可认为其原因在于,由于聚集体的大小不同而分化、未分化的方向性发生变化。另外,作为出现上述现象的理由,可认为由于细胞生存所需的营养没有适宜地扩散至聚集体内部,因此对于聚集体的中心部没能供给上述营养。另外,未进行气体、无用物质的扩散也会阻碍聚集体的内部的细胞的生存。另外聚集体变得过大时,不仅从内部分化,还有引起细胞死亡的担心。另一方面,若聚集体一直较小则扩大培养的效率差。因此,发明人等认为使聚集体的大小保持一定大小,并使进行传代的时机一致对于制备未分化细胞聚集体而言是重要的。
本发明基于上述见解以在制备干细胞聚集体的群体时提高聚集体之间的未分化状态的均质性作为课题。
用于解决问题的方案
[1]一种干细胞聚集体的群体的制备方法,其为如下方法:
分别在二个以上彼此大小均等的分区分配二个以上细胞块,
使前述二个以上细胞块在各前述分区内彼此靠近,
使前述彼此靠近的二个以上细胞块聚集并进行培育而形成聚集体,
前述分配的前述细胞块彼此分离并彼此混合,
前述细胞块分别由干细胞构成。
[2]根据[1]所述的干细胞聚集体的群体的制备方法,其中,
分解前述形成的聚集体而生成细胞块,
使由不同的前述聚集体生成的前述细胞块彼此混合,
分别在二个以上分区分配二个以上前述混合的细胞块,
使前述二个以上混合的细胞块在各前述分区内彼此靠近,
使前述彼此靠近的二个以上细胞块再次聚集。
[3]根据[2]所述的干细胞聚集体的群体的制备方法,其中,
在前述聚集体的直径为1mm以下的时刻分解前述聚集体。
[4]根据[2]所述的干细胞聚集体的群体的制备方法,其中,
进行前述培育时,将前述聚集体培育2天以上且14天以下的时间。
[5]根据[2]所述的干细胞聚集体的群体的制备方法,其中,
进行前述培育时,将前述聚集体培育3天以上且7天以下的时间。
[6]根据[2]所述的干细胞聚集体的群体的制备方法,其中,
进一步重复1次或2次以上如下过程:
分解前述聚集体、混合前述细胞块、使其靠近、分配并再次聚集。
[7]根据[1]所述的干细胞聚集体的群体的制备方法,其中,
对前述干细胞进行平板培养而形成集落,
分解前述集落而生成前述细胞块,
将前述生成的前述细胞块彼此混合,
将前述细胞块用于前述分配。
[8]根据[7]所述的干细胞聚集体的群体的制备方法,其中,
通过物理破碎对前述集落进行前述分解,
对前述集落不进行酶处理。
[9]根据[7]所述的干细胞聚集体的群体的制备方法,其中,
仅通过酶处理对前述集落进行前述分解,
对前述集落不进行物理破碎。
[10]根据[7]所述的干细胞聚集体的群体的制备方法,其中,
分解前述集落时,
对前述集落进行酶处理和物理破碎。
[11]根据[1]所述的干细胞聚集体的群体的制备方法,其中,
前述分区由平板所具有的孔形成,
前述孔为贯通孔或凹部,
前述孔在前述平板所具有的顶面侧具有顶部开口,
前述顶部开口在前述分区间具有彼此相等的面积,
前述顶部开口的直径为1.5mm以下。
[12]根据[1]所述的干细胞聚集体的群体的制备方法,其中,
前述分区由平板所具有的贯通孔形成,
前述贯通孔在前述平板所具有的底面侧具有底部开口,
底部开口的直径为1mm以下,
通过使前述聚集体通过前述底部开口来从前述平板回收前述聚集体。
[13]根据[12]所述的干细胞聚集体的群体的制备方法,其中,
前述细胞块是在配置于前述分区中的培养液中被培养的,
前述培养液形成液滴,
前述液滴附着在前述底部开口并以从前述底部开口垂下的方式突出,
前述分区的底面由前述液滴的弯液面形成。
[14]根据[1]所述的干细胞聚集体的群体的制备方法,其中,
前述分区的内切球的直径为5×101μm以上且1×103μm以下,
前述内切球与前述分区所具有的底面相切。
[15]根据[1]所述的干细胞聚集体的群体的制备方法,其中,
前述细胞块是在配置于前述分区中的培养液中被培养的,
前述培养液介由前述分区的顶部与配置于储存分区中的培养液连接,
前述储存分区的前述培养液中未配置细胞。
[16]根据[1]所述的干细胞聚集体的群体的制备方法,其中,
前述分区由平板所具有的孔形成,
前述孔为贯通孔或凹部,
前述孔在前述平板所具有的顶面侧具有顶部开口,
进行前述分配时,用前述细胞块的悬浮液覆盖前述顶面。
[17]根据[16]所述的干细胞聚集体的群体的制备方法,其中,
前述悬浮液中包含相对于前述顶面的单位面积(1cm2)为1个以上且5000个以下的细胞块。
[18]根据[1]所述的干细胞聚集体的群体的制备方法,其中,
前述细胞块是在配置于前述分区中的培养液中被培养的,
前述培养液中悬浮或溶解有细胞外基质。
[19]一种细胞培养方法,其为如下方法:
由干细胞形成聚集体,
边对前述聚集体进行悬浮培养或贴壁培养边使前述干细胞分化,
形成前述聚集体时,
分别在二个以上彼此大小均等的分区分配二个以上细胞块,
使前述二个以上细胞块在各前述分区内彼此靠近,
使前述彼此靠近的二个以上细胞块聚集并进行培育而形成聚集体,
在前述分配前使前述细胞块彼此分离并彼此混合,
前述细胞块分别由干细胞构成。
[20]根据[19]所述的细胞培养方法,其中,
进一步在前述分区内,使前述聚集体中的细胞分化为外胚层、中胚层和内胚层中的任一种。
[21]一种聚集体的群体,其中,
从前述群体中选择1个前述聚集体;
从前述选择的聚集体中选择10个以上细胞;
通过对前述10个以上细胞判定Nanog、Oct3/4和TRA-1-60中的至少任一个多能干细胞标记物是否为阳性来测量阳性率;
对所述群体进行3次上述阳性率的测量时;
3次的阳性率的平均值为80%以上。
[22]根据[21]所述的聚集体的群体,其中,
从前述群体中选择10个聚集体,
在对前述选择的10个聚集体判定Nanog、Oct3/4和TRA-1-60中的至少任一个多能干细胞标记物是否为阳性时,
前述标记物的阳性率为80%以上。
[23]根据[21]所述的聚集体的群体,其中,
利用试管内分化诱导系统由前述聚集体诱导的类胚体的比例为80%以上,
前述类胚体是混合有三胚层组织的细胞聚集体。
发明的效果
根据本发明,能够在干细胞聚集体的群体的制备中使聚集体的大小均等化。因此本发明能够提高聚集体间的未分化状态的均质性。因此本发明适于未分化细胞聚集体的制备。
附图说明
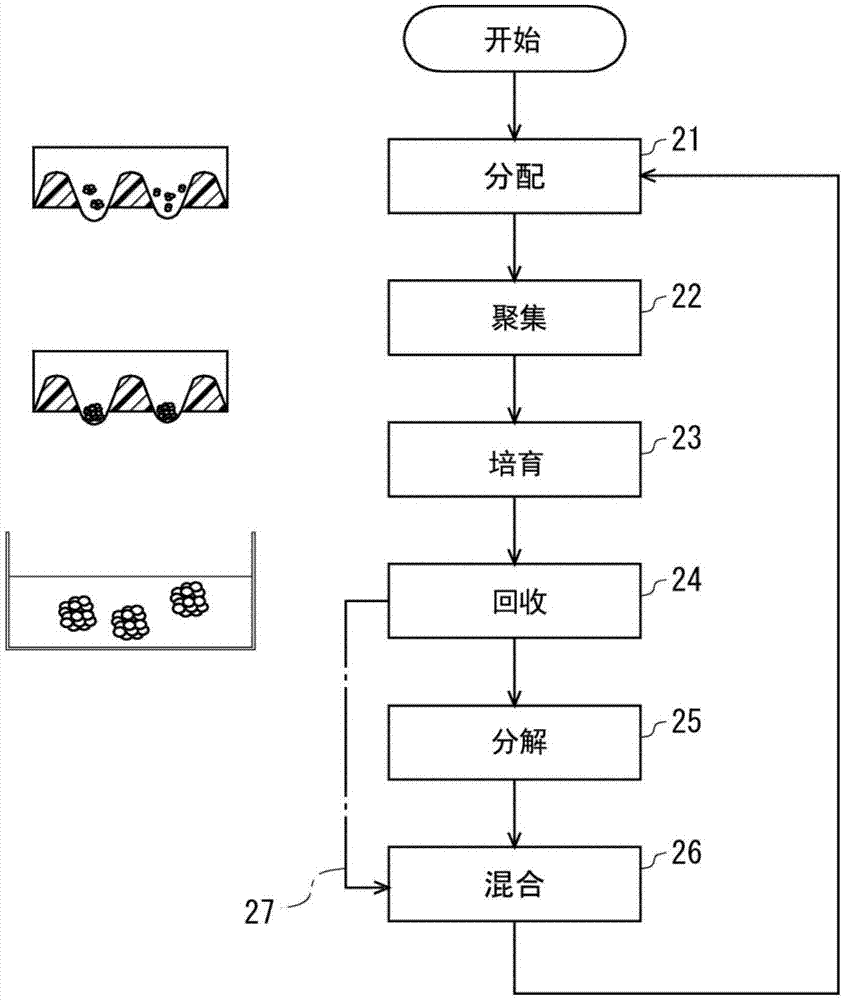
图1是聚集体的群体的制备方法的流程图。
图2是示出培养器的截面图。
图3是细胞块和平板的放大截面图。
图4是聚集体和平板的放大截面图。
图5是示出容器和托盘的分离的图。
图6是示出容器和聚集体的分离的图。
图7是示出容器和聚集体的分离的放大图。
图8是示出聚集体大小的分布的图表。
图9是实施例的聚集体的观察图像1。
图10是实施例的聚集体的观察图像2。
图11是实施例的聚集体的观察图像3。
图12是实施例的聚集体的观察图像4。
图13是FACS的2参数柱状图。
图14是由实施例的聚集体得到的细胞的观察图像。
图15是实施例的聚集体的群体的观察图像。
图16是实施例的聚集体的观察图像5。
图17是实施例的聚集体的观察图像6。
图18是FACS的2参数柱状图。
图19是FACS的1参数柱状图。
图20是示出TRA-1-60的表达强度的图表。
图21A是实施例的聚集体的荧光观察图像。
图21B是实施例的聚集体的荧光观察图像。
图21C是实施例的聚集体的荧光观察图像。
图21D是对实施例的聚集体的荧光观察进行数值化的图。
具体实施方式
[术语]
本说明书中聚集体(cell aggregate)的术语表示由多能干细胞构成的球状的细胞块(block of cells)。聚集体还可以是球状。聚集体还可以是球体。聚集体还可以是所谓的球状体(spheroid)。有时将球状体表示为团块(clump)。聚集体优选通过悬浮培养而形成。聚集体是包含未分化的多能干细胞的细胞块。聚集体是具有培养其时产生出各种细胞类型的能力的细胞块。聚集体特别优选为由100个以上且50000个以下的细胞构成的细胞块。
本说明书中细胞块(block of cells)是指细胞彼此聚集并结合而成的状态。其中,以下在使用细胞块的术语时,只要没有特别说明就按如下方式处理。细胞块的术语表示比聚集体的大小更小的状态。细胞块的术语表示的是在大小和形状方面是不规则的。细胞块的术语中包括将集落(colony)或聚集体进行分割所形成的块(aggregate)。
本说明书中,群体(population)的术语表示细胞块或聚集体的集合。群体的术语中包括保持在一定体积的液体中的它们的集合。群体具有规定的密度。规定的密度是用细胞块或聚集体的个数除以液体的体积而得到的值。
[概要]
图1表示本实施方式的多能干细胞聚集体的群体的制备方法的流程图。上述方法中,在步骤21中分别在二个以上彼此大小均等的分区(compartments)分配二个以上细胞块(aggregates)。由此使二个以上细胞块在各分区内靠近。在步骤22中使彼此靠近的二个以上细胞块聚集(clumping或assembling)。利用上述方法可以得到大小被均等化了的聚集体的群体,从而可以得到未分化状态被均质化了的聚集体的群体。
然后经过图1所示的步骤23-24而得到聚集体。有时在步骤25中通过分解所述聚集体而得到新的细胞块。进而有时经由步骤26并返回步骤21,对细胞块进行再次分配。由此使聚集体内的细胞增殖、以及变大的聚集体的破碎、和这些步骤的循环得以进一步进行。因此,可以得到大量大小被均等化了的聚集体,结果可以得到大量未分化状态被均质化了的聚集体。
[培养器]
图2示出适于实施上述一系列步骤的培养器20。培养器20具备:具有平板30和支撑体45的容器50、及托盘55。在培养器20中培养细胞时,还可以静置培养器20。
图2所示的平板30具备孔31a、31b所代表的孔。图中的孔31a、31b为贯通孔。孔31a、31b还可以是不具有底部开口的凹部。在俯视平板30时孔31a、31b所代表的孔构成格子。格子可以是六角格子、正方格子和其它格子。图中孔31a、31b中填充有培养液35。培养液35只要适于培养多能干细胞即可。
图2所示的支撑体45具备侧壁46和凸缘47,侧壁46包围平板30和支撑体45的内腔。平板30位于支撑体45的内腔的下方。平板30所具有的顶面朝向支撑体45的内腔。侧壁46的下方与平板30接触。优选侧壁46的下端与平板30接触。
图2所示的平板30与支撑体45成为一体而形成容器50。优选平板30与支撑体45无间隙地接触。平板30与支撑体45成为一体并包围容器50的内腔。还可以将平板30与支撑体45成型为一体。
图2所示的容器50的内腔构成储存分区37。储存分区37蓄积培养液35。平板30所具有的顶面和支撑体45所具有的侧壁46的内侧面与培养液35接触。储存分区37与孔31a、31b的内腔一起形成了连续的空间。
图2所示的侧壁46和平板30可以作为一个整体插入托盘55的内腔中。凸缘47位于侧壁46的外侧。托盘55具备侧壁56和底部57。侧壁56支撑凸缘47。凸缘47优选与侧壁56的上端接触。托盘55支撑凸缘47。托盘55支撑支撑体45。托盘55支撑容器50。底部57与平板30对置。在底部57与平板30之间设置有空间58。
图2所示的平板30优选为树脂成型品。所成型的树脂优选为丙烯酸系树脂、聚乳酸、聚乙醇酸、苯乙烯系树脂、丙烯酸/苯乙烯系共聚树脂、聚碳酸酯系树脂、聚酯系树脂、聚乙烯醇系树脂、乙烯/乙烯醇系共聚树脂、热塑性弹性体氯乙烯系树脂、有机硅树脂和硅树脂中的任一种。还可以组合这些树脂来进行成型。平板30还可以是金属、玻璃等无机物的成型品。对于培养器50所具备的其它构件是同样的。
优选对图2所示的孔31a、31b的表面进行改性处理。改性处理优选为等离子体处理、电晕放电和UV臭氧处理中的至少任一种。通过改性处理而可在上述表面上形成官能团。官能团优选为亲水性。亲水性的表面使细胞块顺畅地流入孔31a、31b内。改性处理在孔31a、31b的开口部小的情况下特别优选。改性处理在树脂为疏水性的情况下特别优选。对于平板30所具有的顶面和底面是同样的。
还可以在图2所示的孔31a、31b的表面覆盖规定的物质。物质可以是无机物。物质还可以是金属。物质可以是2个、3个和4个以上规定分子聚合而成的物质。还可以用组合了它们而成的物质覆盖表面。覆盖后的表面优选具有一定的疏水性。由于具有一定的疏水性的表面,因而即使在使用了表面张力小的培养基的情况下也容易形成后述的液滴。对于平板30所具有的顶面和底面是同样的。
还可以在图2所示的孔31a、31b的表面设置微细结构。微细结构优选为所谓纳米级。微细结构的结构单元的大小优选为0.1nm以上且1μm以下。也可通过在表面设置凹凸而制成微细结构。
[分区]
图3是细胞块和平板30的放大图。在规定的分区培养细胞块。分区32a、32b所代表的分区分别由孔31a、31b所代表的孔形成。孔31a、31b所代表的孔具有彼此均等的大小。本实施方式可以仅由孔31a、31b构成分区32a、32b,但不限定于此。
图3所示的平板30具有隔壁29。各孔被隔壁29彼此分离。隔壁29从平板30的底部朝向顶部逐渐变窄。孔31a、31b从平板30的顶部朝向底部逐渐变窄。
图3所示的孔31a、31b分别在平板30所具有的顶面侧具有顶部开口33a、33b。孔31a、31b分别在前述平板所具有的底面侧具有底部开口34a、34b。
图3所示的顶部开口33a、33b优选具有彼此相等的面积。不限定于顶部开口33a、33b,各孔所具有的多个顶部开口、优选为全部顶部开口优选具有彼此相等的面积。通过使顶部开口具备彼此相等的面积,从而可使每分区的细胞数得以均衡。因此由一分区形成一个聚集体时,能使聚集体的大小一致。
图3所示的顶部开口33a、33b可以是圆形。顶部开口33a、33b的直径优选为2.00mm、1.5mm、1.4mm、1.3mm、1.2mm、1.1mm、1.0mm、0.9mm、0.8mm、0.7mm、0.6mm、0.5mm、0.4mm、0.3mm、0.2mm和0.1mm中任意的值以下。
图3所示的顶部开口33a、33b的直径优选为10μm、20μm、30μm、40μm、50μm、60μm、70μm、80μm和90μm中任意的值以上。
图3所示的顶部开口33a、33b可以是三角形、四边形、五边形、六边形和其它多边形及椭圆形。顶部开口33a、33b的内切圆的直径可以设为与上述直径同样的范围。
图3所示的孔31a、31b不具有底部开口34a、34b的情况下也可以采用顶部开口33a、33b。另外在此情况下顶部开口33a、33b也能发挥其效果。顶部开口33a、33b优选分别大于底部开口34a、34b。
[细胞块的分配]
图1所示的步骤21中,将图3所示的细胞块的群体41分配在分区32a、32b所代表的二个以上分区中。群体41中包含含有细胞块42a-42c的多个细胞块。群体41优选包含在悬浮液38中。悬浮液38中无偏差地分散有细胞块42a-42c。群体41中混合有小的细胞块42a、大的细胞块42c。悬浮液38包含群体41的同时还可以包含实质上被个体化的单细胞(single cell(s))。相对于悬浮液38中的构成细胞块的细胞数、与处于单细胞状态的细胞数的总计,处于单细胞状态的细胞数的比例可以是10%以上、30%以上、50%以上、80%以上、或90%以上。
进行分配时,优选将图3所示的悬浮液38散布在平板30的顶面。散布悬浮液38时,优选覆盖平板30的顶面。优选用悬浮液38无偏差地覆盖平板30的顶面。
散布悬浮液38时,优选悬浮液38中包含相对于顶面的单位面积(1cm2)为1个以上且5000个以下的细胞块。每单位面积的细胞块的个数优选为2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900、1000、2000、3000、4000和5000个中的任一者。
图3所示的散布悬浮液38的方法相比于将悬浮液38分别地分注到各分区的方法是有效的。悬浮液38由于重力沉降而进入分区32a、32b中。因此包含细胞块42a-42c的悬浮液38被随机地分配至各分区中。进而细胞块在分区32a、32b内沉降。通过沉降而使分散的细胞块离开储存分区37并集结在各分区32a、32b内。由此使细胞块彼此靠近。
图3所示的隔壁29优选随着接近平板30的顶部而变窄。隔壁29的截面可以是在平板30的顶部附近向上凸的形状。上述形状可以是半圆的,还可以是三角形。
构成图3所示的悬浮液38的分散介质充满分区32a、32b并被配置于储存分区37中。还可以将悬浮液38的分散介质制成与培养液35为相同组成的培养液。分配后,对于储存分区37中的分散介质还可以进一步加注适宜的培养液。分配后,还可以将储存分区37中的分散介质置换成适宜的培养液。
在图3所示的群体41中,被分配的这些细胞块彼此分离。使这些细胞块彼此混合。群体41中包含比细胞块42a小的细胞块42b。群体41中包含比细胞块42a大的细胞块42c。在群体41中使大小不同的细胞块彼此混合。
细胞块42a-42c分别由多能干细胞(a pluripotent cell)构成。多能干细胞可以是ES细胞还可以是iPS细胞。多能干细胞的动物种类可以列举出以人和小鼠为代表的哺乳类动物,但不限定于这些。成为iPS细胞的来源的体细胞可以列举出成纤维细胞,但不限定于这些。体细胞还可以从成为来源的个体的体内的任意组织中获得。
如图3所示,在配置于分区32a、32b中的培养液35中培养细胞块。图中作为上述细胞块的代表将细胞块42a、42b分配在这些分区。培养液35形成了液滴36a、36b。液滴36a、36b分别附着在底部开口34a、34b并以从前述底部开口垂下的方式突出。液滴36a、36b向平板30的底面侧突出。本实施方式中进行所谓悬滴型的培养。
图3所示的分区32a、32b可以理解为分别由顶部开口33a、33b;孔31a、31b的内腔面;及液滴36a、36b的带有圆角的界面构成。上述界面朝向平板30的底面侧的空间。分区32a、32b的底面分别由液滴36a、36b的上述界面形成。界面带有圆角是由于培养液35的表面张力所致。即液滴36a、36b的界面成为弯液面(meniscus)。
如图3所示培养液35充满分区32a、32b。分区32a、32b可以理解为由分别位于孔31a、31b内的培养液35及液滴36a、36b构成。换言之培养细胞块42a、42b的分区32a、32b连续至平板30外的液滴36a、36b。
图3所示的分区32a、32b的大小优选如下方式设定。即将与分区32a、32b内切的内切球的直径设在规定的范围。规定的范围为5×101μm以上且1×103μm以下。内切球是假定的立体。内切球优选与分区32a、32b的底面相切。通过如上述那样设定分区32a、32b的大小而可促进聚集体的形成。
图3所示的液滴36a、36b的大小只要不破坏液滴就可随意确定。还可以仅在液滴36a、36b内培养细胞块42a、42b。即还可以不在孔31a、31b内培养细胞块42a、42b。
还可以不形成图3所示的液滴36a、36b。分区32a、32b还可以分别位于孔31a、31b内。其相当于未设置底部开口34a、34b的情况。
图3所示的分区32a、32b介由分区32a、32b的顶部、即顶部开口33a、33b与储存分区37连接。分区32a、32b内的培养液35介由分区32a、32b的顶部与配置于储存分区37的培养液35连接。储存分区37中未配置以细胞块42a、42b为代表的细胞。
如图3所示,通过使培养液在分区32a、32b与储存分区37之间成为一体而具有以下优点。首先在分区32a、32b与储存分区37之间进行培养液35的移动。因此对于悬滴型的培养而言也能对细胞块42a、42b供给充足的营养。
另外,由于图3所示的储存分区37中不存在细胞,因此进行后述培育时的培养液35的更换是容易的。另外与仅在分区32a、32b配置培养液的情况相比,使得培养液35大量存在,因此培养液35中不易引起pH、温度的变化。
返回图2。培养器20通常设置在孵化器内,但有时由于搬运而不得不在外部空气中移动。孵化器内与外部空气中的氧气浓度和温度不同。因此培养器20内的培养液35有时会受到外部空气的氧气浓度和温度的影响。
现有的悬滴法中未使用图2所示的储存分区37,因此该影响会强烈地传递给包覆细胞的培养液的液滴。因此培养液的pH、氧气浓度发生急剧地变化。上述急剧的变化对细胞的增殖、功能产生影响。进而,由于培养基更换较难,因此营养成分不足、无法去除废物,而对细胞的增殖、生存产生影响。本实施方式的培养器20能够减轻这样的影响。
图2所示的培养器20所发挥的效果依赖于形成了储存分区37的平板30。培养器20中的培养液35不易受到由外部环境变化所致的影响。因此也使对由细胞块形成的聚集体的影响减小。
[细胞块彼此的靠近]
在图3所示的群体41中彼此分离的各细胞块被分配在各分区32a、32b内,而彼此靠近。如上所述,孔31a、31b从平板30的顶部朝向底部逐渐变窄,因此能够促进靠近。通过使其彼此靠近,从而能使细胞块有效地聚集。
[细胞块的聚集]
图1所示的步骤22中,分别使二个以上细胞块在图3所示的各分区32a、32b内聚集。作为一个例子,使包含细胞块42a的二个以上细胞块在分区32a内聚集。作为另一个例子,使包含细胞块42b的二个以上细胞块在分区32b内聚集。
图4是聚集体40和平板30的放大截面图。细胞块的聚集的结果可在各分区32a、32b内形成聚集体40。
图3所示的包含细胞块42c的二个以上细胞块也可以在任意的分区内聚集。分配在各分区中的细胞块的大小实质上是不规则的。因此使分别具有不规则大小的细胞块的群体在各分区中聚集。例如还可以使包含细胞块42a-42c中任意者的细胞块的群体在分区内聚集。
如上所述,图1所示的步骤21中,通过如图3所示那样散布悬浮液38而将群体41分成小份地分配在各分区中。上述分配后使这些细胞块聚集。因此可减轻聚集前的细胞块的大小的偏差。另外如上所述,还能使每个分区的细胞块大小的分布状态得以均衡。因此,如图4所示使通过聚集而在各分区形成的聚集体40均质化。另外使聚集体40的大小均匀化。
分配在图3所示的分区32a、32b之前,细胞块彼此是分离的。此外,通过分配而使这些细胞块靠近。因此使细胞块开始聚集的时期与上述分配结束时一致。为了使细胞块彼此分离且彼此混合,分配前的移液是适宜的。还可以使用其它方法。
[聚集体的培育和聚集体的回收]
图1所示的步骤23中对图2所示的聚集体40进行培育。在进行步骤25所示的聚集体的分解之前进行步骤23。图4是放大示出所形成的聚集体和平板30的图。通过在各分区32a、32b的培育而使聚集体40变大。通过步骤23和步骤24而形成聚集体。
对于上述形成,图1所示的步骤22、23还可以同时在图3所示的分区32a、32b内进行。还可以在培育细胞块42a、42b的过程中聚集而形成图4所示的聚集体40。还可以在细胞块42a、42b彼此迅速地聚集而形成聚集体40后对聚集体40进行培育。
图1所示的步骤23中,将图4所示的聚集体40培育2天以上且14天以下的时间。上述期间优选为3~7天。优选的是:在聚集体的直径为规定值以下的时刻停止聚集体的培育并进行步骤24所示的回收。
包括图4所示的40在内,聚集体的直径表示聚集体的外接球的直径。聚集体直径的规定值为底部开口34a、34b的直径的3/4以下、优选为2/3以下。
聚集体直径的规定值优选为1mm、0.9mm、0.8mm、0.7mm、0.6mm、0.5mm、0.4mm、0.3mm、0.2mm和0.1mm中任意的值。通过如上所述回收聚集体,能预防混入具有更加巨大化而在内部分化加剧的担心的聚集体。
图1所示的步骤24中首先如图5所示分离容器50和托盘55。接着,如图6所示将平板30的底面浸渍在托盘60中的回收液65中。托盘60还可以制成与托盘55同等的物质。
如图6所示使聚集体40通过平板30的底面。将聚集体40从培养液35移动至回收液65中。或者使培养液35与聚集体40一起流入托盘60内。上述操作可以通过重力进行,还可以通过吸引进行。通过上述工艺而从平板30上分离聚集体40。由此将聚集体40回收至回收液65中。回收液65可以是培养基还可以是缓冲液。
需要说明的是,如上所述,图5、6所示的孔31a、31b如果为凹部就无法通过平板30的底面。上述情况还可以通过移液来回收聚集体40。使聚集体40通过平板30的底面的方法的优点在于对聚集体40的物理刺激少。上述简便的方法损伤聚集体的未分化状态的可能性小。
图7是放大示出容器与聚集体的分离的图。聚集体43a-43c是将聚集体40按大小进行分类的表示。聚集体43a小于聚集体43b。聚集体43c大于聚集体43b。
如图7所示聚集体43a、43b的直径小于底部开口34a的直径。因此聚集体43a、43b通过底部开口34a。通过上述分离而可得到由上述聚集体构成的群体44a。
聚集体43c的直径大于底部开口34b的直径。因此聚集体43c不会通过底部开口34a、34b。通过上述分离而使由上述聚集体构成的群体44b残留在平板30上。
图5所示的聚集体40的群体通过图6所示的平板30的作用而分成图7所示的群体44a和群体44b。即平板30具有过滤器作用。
图8是示出聚集体大小的分布的图。横轴为聚集体的大小。纵轴表示以比例示出聚集体的数量。群体44a中所含的聚集体43a、43b的大小小于阈值39。群体44b中所含的聚集体43c的大小大于底部开口34a、34b的阈值39。
图8所示的阈值39依赖于底部开口34a、34b的直径。阈值39与底部开口34a、34b的直径相等。如图7所示从平板30上分离的聚集体43a、43b的大小可以通过底部开口34a、34b的直径加以控制。平板30通过阈值39来筛分聚集体。
回收的图7所示的聚集体43a、43b的直径优选为1mm以下的情况如上所述。具有上述直径的聚集体例如可以通过调整培育期间、培育条件来实现。另外通过上述过滤器作用而能够选拔具有上述直径的聚集体43a、43b。对于平板30的过滤器作用可以进一步期待下述优选的效果。
与正常细胞相比增殖快的细胞包含在图3所示的细胞块42a、42b中时,有时该细胞块聚集而成的聚集体40(图4)也比通常情况大。例如由于细胞的核型异常而引起上述增殖速度的变化。
具有核型异常的细胞不仅比正常细胞的增殖快,而且生存率也高。因此,即使对相同大小的细胞块进行相同期间的培育,包含具有核型异常的细胞的细胞块也大于正常细胞块。另外这样的聚集体的出现频率也是无法忽视的。
具有核型异常的细胞优选不包含在聚集体中。其原因在于聚集体有可能用于各种试验、医疗等中,因此优选聚集体发挥通常的功能。另一方面,即使调整上述培育期间、培育条件也会以一定的概率发生核型异常。
通过图7所示的平板30的过滤器作用,能够从群体44a中排除聚集体43c。聚集体43c可以被视为例如由于上述核型异常而比通常情况大的聚集体。因此通过平板30的过滤器作用而能够从群体44a中排除具有核型异常的聚集体。
为了得到上述效果,图7所示的底部开口34a、34b的直径优选为1.0mm、0.9mm、0.8mm、0.7mm、0.6mm、0.5mm、0.4mm、0.3mm、0.2mm和0.1mm中任意的值以下。
图7所示的底部开口34a、34b优选具有彼此相等的内切圆直径。不限定于底部开口34a、34b,各孔所具有的多个底部开口、优选为全部底部开口优选具有彼此相等的内切圆直径。通过底部开口具有彼此相等的内切圆直径,从而能使回收的聚集体大小的上限一致。底部开口优选进一步具有彼此相等的面积。
[聚集体的分解和细胞块的混合]
图1所示的步骤25中将回收的聚集体进行分解。优选在聚集体的直径为1mm以下的时刻进行聚集体的分解。由此,在如后所述进一步增加聚集体时,能够不使分化的细胞混入聚集体中。换言之,能够保持聚集体之间均质的未分化状态。
分解的聚集体如图7所示是包含在回收的群体44a中的聚集体。分解聚集体而生成多个细胞块。分解还可以通过聚集体的物理破碎来进行。物理破碎可以通过移液来进行。分解还可以通过酶处理来进行。还可以对经酶处理的聚集体进行物理破碎。还可以对经物理破碎的聚集体进行酶处理而生成细胞块。
图1所示的步骤26中进一步使上述细胞块彼此混合。混合的细胞块是由不同的聚集体生成的。混合可以通过移液来进行。由于通过移液来进行破碎而还可以同时进行混合。
[工序的循环化]
再次返回图1所示的步骤21,如图3所示将混合的细胞块的群体41分配在二个以上分区32a、32b所代表的分区中。分别在二个以上分区分配二个以上混合的细胞块。图2所示的培养器优选为新准备的容器。
图1所示的步骤22中,使分配的细胞块在各分区32a、32b内再次靠近。使彼此靠近的二个以上细胞块再次聚集。即,以(聚集)->(分解)->(聚集)的顺序执行各步骤。在将混合的细胞块分配在各分区后使细胞块再聚集,从而能够使聚集体之间保持均质化并增加均质化的聚集体。
图1所示的流程图中,从步骤26返回步骤21的次数没有限制。因此将增加了的聚集体进行分解,混合经分解而得到的细胞块、进行分配并使其靠近、再次聚集、这样的循环可以进一步重复1次或2次以上。
上述方法中以(聚集)->(分解)->(聚集)->(分解)->(聚集)->…的顺序重复各步骤。从而能够使聚集体之间保持均质化并增加均质化的聚集体。
进而如由图1所示的箭头27所示,还可以在任意的循环中省略步骤25。在此情况下,如上所述,在步骤22中再次聚集而形成的聚集体不会在步骤25分解。因此通过从步骤24跳到步骤26而使聚集体彼此混合。
经由图1所示的箭头27后,从步骤26返回至步骤21。对于在步骤26中混合的聚集体,犹如图3所示的细胞块42a-42c那样,分别分配在二个以上分区32a、32b。使二个以上混合的聚集体在各分区内彼此靠近。
步骤22中使彼此靠近的二个以上聚集体在各分区32a、32b内聚集。
上述方法中例如以(聚集)->(分解)->(聚集)->(聚集)的顺序执行各步骤。利用上述方法,能够抑制均质化状态的降低并增大在聚集体之间经均质化的聚集体。
一个例子中,还可以完全不实施图1所示的步骤25。步骤26中,使形成的不同的聚集体彼此混合。返回步骤21,将混合的聚集体分配在二个以上分区中。使二个以上混合的聚集体在各分区内彼此靠近。步骤22中,使彼此靠近的二个以上聚集体在各分区内进一步聚集。
上述方法中以(聚集)->(聚集)的顺序执行各步骤。利用上述方法,能够抑制均质化状态的降低并增大聚集体之间经均质化的聚集体。
一个例子中,如上所述,还可以重新在步骤25分解未经过图1所示的步骤25而形成得较大的聚集体。即,如上所述,将进一步在步骤22中聚集体聚集而形成的聚集体,在步骤25分解。由较大地形成的聚集体生成上述细胞块。
图1所示的步骤26中,使由不同的聚集体生成的细胞块彼此混合。返回步骤21,将混合的细胞块分配在二个以上分区。使二个以上混合的聚集体在各分区内彼此靠近。步骤22中,使彼此靠近的二个以上细胞块在各分区内再次聚集。上述方法中例如以(聚集)->(聚集)->(分解)->(聚集)的顺序执行各步骤。
[最初的细胞块的制备]
图1所示的步骤21中,成为聚集体形成的起点的细胞块可以利用任意的方法来制备。作为一个例子,还可以对多能干细胞进行平板培养而形成集落。依据步骤25,分解上述集落而生成细胞块。依据步骤26,使上述细胞块彼此混合。
将上述细胞块的群体作为图3所示的群体41,在第1次的步骤21(图1)中用于分配。利用上述方法,也可以由经平板培养的细胞得到聚集体之间经均质化的聚集体。
如上所述在分解集落时,还可以进行移液。可以仅通过酶处理来分解集落。还可以仅进行物理破碎。还可以进行酶处理和物理破碎这两者。
[聚集体的使用]
如上所述,可以通过悬浮培养或贴壁培养对得到的聚集体进行培养。在上述培养中,还可以依据规定的方法使聚集体中的多能干细胞分化。作为规定的方法,可以使用例如试管内分化诱导系统。
本实施方式中,可以以群体的形式得到聚集体。本实施方式中各循环中收集的多能干细胞聚集体的大小在整个工序中得以均等化。因此,上述群体中,聚集体之间保持了均质的未分化状态。因此,本实施方式的聚集体适于如上所述使多能干细胞分化时在多能干细胞之间实现分化状态的均质化。
保持了上述群体的未分化状态的特征在于多能干细胞标记物的阳性率。作为一个例子聚集体的群体在全部聚集体中只要80%以上为阳性即可。阳性率是以聚集体的群体中、多能干细胞标记物为阳性的聚集体的比例的形式计算出的。
作为一个例子,聚集体在一个群体中,多能干细胞标记物为阳性的聚集体若为80%以上,则可以判断保持了上述群体的未分化状态。
测定方法可利用以下方法进行。首先,从群体中选择10个聚集体。对于选择的1个聚集体选择100个细胞。选择的细胞可以是100个以上。针对该100个细胞,通过判定多能干细胞标记物是否为阳性来测量一个聚集体的阳性率。对于该判定,若100个细胞中,3个以上细胞的多能干细胞标记物为阳性,则判定该聚集体的多能干细胞标记物为阳性。需要说明的是,进行该判定时,选择1000个以上细胞时,若该细胞中3%以上细胞为阳性,则判断该聚集体的多能干细胞标记物为阳性。
利用上述方法,求出10个聚集体中多能干细胞标记物为阳性的聚集体的比例(阳性率)。对于同一群体再进行2次该阳性率的测量,即总计进行3次。将3次的阳性率的平均值作为上述阳性率的平均值。
多能干细胞标记物可以是例如TRA-1-60。TRA-1-60是否为阳性,例如可以通过使用流式细胞仪通过与阴性的细胞群体相比研究是否出现阳性的细胞群体来判定。另外作为其它方法,还可以利用PCR来检测多能干细胞标记物。此时,作为多能干细胞标记物,还可以选自Nanog和Oct3/4中的至少任一者。以例如成纤维细胞等未表达的分化细胞作为对照检测这些标记物基因的表达。
聚集体的群体中,优选聚集体之间在其功能方面也是均质的。在功能方面是均质的情况可以通过生物体内分化诱导法例如畸胎瘤的形成能力进行判定。通过将聚集体或聚集体中的多能干细胞移植至小鼠中,从而能够判定在小鼠体内是否生成畸胎瘤。在群体中的聚集体的内部,形成分化为三胚层的畸胎瘤的聚集体的比例优选为80%以上、更优选为95%以上、最优选为100%。在上述情况下,在功能方面能够将上述群体判定为均质。
聚集体的群体中,优选聚集体之间保持了其分化能力的均质性。在分化能力方面为均质的情况可以通过例如在分化诱导聚集体时,聚集体中的细胞是否分化为三胚层的细胞来判定。
例如从群体中选择10个聚集体。选择的聚集体可以是10个以上。分别使该10个聚集体在各试管内诱导分化成三胚层中任一者。作为其它方式,诱导聚集体分化而形成类胚体。此处类胚体是指受精卵或如胚那样包含各种分化细胞的细胞聚集体。对于各种聚集体,优选的是所形成的80%以上的类胚体表达三胚层内任意胚层的标记物。优选选择的10个或者10个以上的聚集体全部满足该必要条件。
还可以通过使用PCR法逐个地测定前述类胚体的基因表达量来判定。
另外作为其它方式,利用试管内分化诱导系统由各种聚集体诱导的类胚体的比例优选为80%以上。优选的是:选择的10个或者10个以上的聚集体全部满足该必要条件。此处类胚体是指混合了三胚层组织的细胞聚集体。
分化标记物优选为外胚层、内胚层和中胚层中的至少任一者的分化标记物。还可以将外胚层的分化标记物设为Pax6、SOX2、PsANCAM和TUJ1中的至少任一者。还可以将内胚层的分化标记物设为FOXA2、AFP、细胞因子8.18和SOX17中的至少任一者。还可以将中胚层的分化标记物设为短尾基因(brachyury)和MSX1中的至少任一者。
需要说明的是,本发明不限定于上述实施方式和下述实施例,可以在不脱离主旨的范围进行适宜变更。例如上述实施方式中,由细胞块形成聚集体后回收了聚集体。然而,还可以使二个以上细胞块聚集而形成大的细胞块后回收上述大的细胞块。上述大的细胞块还可以未达到上述聚集体的大小。即还可以重复上述循环而最终得到具有足够大小和功能的聚集体。另外本发明的一个实施方式是多能干细胞的细胞培养方法。该实施方式中,还可以出于使多能干细胞增殖、维持多能干细胞生存的目的,与上述实施方式同样地培育细胞。
实施例
[实施例1]
<iPS细胞的取得>
作为多能干细胞,使用了人工多能干细胞细胞(iPS细胞),该细胞被确认表达了未分化标记物的Nanog、OCT3/4、TRA1-60或与这些类似的未分化标记物并且分化为三胚层。
(细胞培养)
将上述iPS细胞作为成为聚集体形成的起点的细胞块。首先在6孔板内,在饲养层细胞上培养iPS细胞5-7天。确认iPS细胞达到70-80%汇合后,利用吸引器从孔中去除培养基。在各孔中以每孔500μL添加人ES/iPS细胞解离液(Dissociation Solution for human ES/iPS Cells)(CTK液、ReproCELL Incorporated)。将6孔板在CO2孵化器(37度、5%CO2)中孵育3分钟。
孵育后,从CO2孵化器中取出6孔板。通过轻轻敲击孔板或孔来使饲养层细胞剥离。然后,用吸引器去除CTK液并在每孔中添加1ml的PBS。
利用显微镜确认6孔板上的饲养层细胞被剥离。然后,用吸引器从培养皿中去除PBS。然后,在每孔当中添加500μl的TrypLE Select Enzyme(1x)(商标;Thermo Fisher Scientific制;以下称为TrypLE Select。)后在CO2孵化器中孵育5分钟。
作为ES细胞或iPS细胞用的培养培养基,如下方式制作了培养基Y。首先作为基础培养基准备了人ES培养基(reprocell公司)。进而在上述培养基中添加0.2ml的10μg/ml碱性成纤维细胞生长因子(bFGF)(Thermofisher PHG0266)。
孵育后,从CO2孵化器中取出6孔板。在各孔中以每孔500μl添加培养基。通过利用自动移液器(P1000)从而对iPS细胞进行10~30次悬浮。实施例3及之后的实施例也同样进行了悬浮。由此制作了含有细胞块的群体的悬浮液。上述悬浮液还包含通过悬浮而产生的iPS细胞的单细胞。进行培养基更换,最终将细胞块的群体悬浮在市售的无饲养层的培养液中。本实施例中将无饲养层的培养液称为培养液A(Medium A)。
作为用于形成聚集体的平板(以下只要没有特别提及则称为平板。),使用Kuraray Co.,Ltd.制的<Elplasia>平板。使用<Elplasia>平板中的多孔型(Multiple Pore Type)的平板。如图9所示,Multiple Pore Type的平板具备多个由贯通孔形成的孔。
图9中示出俯视平板时的聚集体的观察图像。如图9所示各孔的大小彼此均等。贯通孔的顶部开口及底部开口均为四边形。具体而言顶部开口及底部开口均为正方形。在俯视顶部开口和底部开口时,它们所具有的角的方向彼此一致。另外它们所具有的中心一致。
顶部开口的一边长度为650μm。底部开口的一边长度为500μm。相对于具有7cm2的面积的底面在平板上规则地配置了680个孔。由孔形成的分区的数N=680。具体而言孔被配置成四角格子状。格子的单位是一边为500μm的正方形。
为了分别在由各孔形成的各分区分配二个以上细胞块,而对平板整面无偏差地接种培养液。培养液遍及至各孔中。以每个分区包含1×105个细胞的方式分配细胞块(每分区的细胞数n=1×105)。顶部开口的大小是均匀的,且孔均等地配置成格子状,因此可认为分配在各分区的细胞数是均等的。
培养液A中的每单位体积的细胞数、即细胞浓度C[1/ml]依据数学式C=N·n/V来确定。此处N表示分区数,n表示每分区的细胞数,V表示每平板中使用的培养液A的体积。
培养液A的液滴从各孔的底部开口突出(图3)。通过培养液A所具有的表面张力而形成了作为液滴与大气的界面的弯液面。由于朝向弯液面细胞块发生聚集,从而在由孔内表面和弯液面形成的分区内使细胞块彼此靠近。由此在配置于分区中的培养液A中培养了细胞块。需要说明的是,如前说明所述本实施例中弯液面也作为分区的一部分构成要素。
如图9的培养液A的第1天和第2天所示,使彼此靠近的细胞块聚集。第1天表示接种后经过1天,第2天表示经过2天。在其它图中,天或天后面的数字表示最初在平板中接种的日子起经过的天数。由此边使细胞块彼此聚集边通过对细胞进行培育,从而得到多能干细胞聚集体。
[实施例2]
实施例1中使用人ES/iPS细胞解离液(Dissociation Solution for human ES/iPS Cells),从孔中剥离了饲养层细胞和iPS细胞。另外使用TrypLE Select Enzyme对iPS细胞进行了处理。
相对与此,实施例2中仅用刮棒刮取iPS细胞,未进行酶处理。对iPS细胞进行悬浮的次数少于10次。其它与实施例1同样地进行。
实施例2中,在用于形成聚集体的平板上展开(spread)的悬浮液中所含的细胞的80%是构成细胞块的细胞。
[实施例3]
本实施例中,将分配在一个分区中的细胞数n设为1×106个,除此以外与上述实施例1同样地培养了细胞。图10示出俯视平板时的聚集体的观察图像。图10的右侧列中示出每分区分配1×106个细胞时的结果。左侧列中示出作为对照与之前的实施例同样地每分区分配105个细胞时的结果。图10示出接种后第2天和第4天的结果。
可知的是:在分配在一分区中的细胞在1×105个至1×106个的范围内,能制作均质的大小的聚集体。
[实施例4]
图11中示出俯视平板时的聚集体的观察图像。本实施例中,如图11所示,将顶部开口和底部开口的形状制成圆形。俯视平板时,它们的中心是一致的。观察图像中看到的左右方向的条的长度表示1000μm。其它条件与实施例1同样地培养了iPS细胞。
顶部开口的直径的大小为650μm。底部开口的直径的大小为500μm。相对于具有7cm2的面积的底面在平板上规则地配置了648个孔。
图11中示出接种细胞块后第1、3、5、7天的状态的聚集体。对于各日期,可以得到各分区之间大小均匀的聚集体。对于各分区,可以得到大致1个聚集体。对于聚集体随着时间经过而增大的速度,未观察到各分区之间存在差异。因此,启示出各分区之间均匀地保持了细胞的品质。
在第7天,每分区的细胞数可期待达到2000个以上且5000个以下。
[实施例5]
只要没有特别提及则与实施例4同样地培养了细胞。培养第7天时从平板中回收了得到的聚集体。回收时,使聚集体通过底部开口的方式来进行。具体而言,如图6所示,通过使平板的底面与回收液接触,从而使培养液的界面消失而进行了回收。以下将上述回收法称为接触法。将该回收液回收至15ml管中。
以270G对管进行离心分离后,去除上清液。在管内添加500μl的TrypLE Select,并将管在37度孵化器中孵育10分钟。离心后,去除上清液并将管内的细胞悬浮在1ml的培养液A中。利用血细胞计数平板,对悬浮的细胞数进行计数。基于细胞数的计算结果,将2×105个iPS细胞悬浮在2ml的培养液A中。进而添加2μl的ROCK(Rho-associated coiled-coil forming kinase/Rho结合激酶)抑制剂(ROCK抑制剂,ROCK inhibitor),然后将iPS细胞接种在平板上。培养过程中用在1ml的培养液A中添加了1μl的ROCK抑制剂的培养基更换了旧的培养基。每天进行培养基更换。
针对相同形状的平板重新接种培养液。培养液遍及至各孔中。分别在二个以上分区分配混合的二个以上细胞块。每分区的细胞数与第1次接种相同。在各分区内使细胞块彼此靠近。由此使细胞块再次聚集。
分解聚集体而得到细胞块,混合细胞块,使其靠近、分配、再次聚集,通过重复这些工序来进行传代。重复2次(P2)、3次(P3)、4次(P4)和5次(P5)传代。需要说明的是传代的次数的计算方法是将最初在平板上接种由iPSC集落得到的细胞块时的行程(passage)作为1次(P1)。
每7天进行1次传代。图12中示出最初接种至平板上至第14、21、28和35天所代表的聚集体的观察图像。观察图像中看到的左右方向的条的长度表示1000μm。即使经过1个月这样的长期间也可以得到各分区之间大小均匀的聚集体。用流式细胞仪进行了长期培养后的多能干细胞的评价。
<流式细胞仪和荧光活性化细胞挑选(FACS)>
利用上述接触法回收培养第10天和第20天时得到的聚集体并收集在15ml管内。以270G对管进行离心分离后,去除上清液。在管内添加500μl的TrypLE Select并将管在37度孵化器内孵育10分钟,从而使细胞个体化。将管孵育10分钟后,在管内添加500μl的培养液A。用自动移液器使聚集体和培养液A悬浮10~30次,使聚集体破碎。在管中添加9ml的培养液A后,进而以270G对管进行离心。
离心后,从管内吸取上清液后,将沉淀的细胞悬浮在1ml的培养液A中。利用血细胞计数平板,对悬浮的细胞数进行计数。基于细胞数的计算结果,将细胞以1×106个分注在新的管中。再次以270G对管进行离心。离心后,吸取管内的上清液。对于50μl的PBS悬浮了用于检测TRA-1-60的抗体2.5μl。在管内添加上述抗体悬浮液后,将管在室温、有遮光的条件下孵育30分钟。
经过30分钟后,在管中添加1ml的PBS。以270G对管进行离心后,从管内去除上清液。利用流式细胞仪Cytoflex测定了iPS细胞的TRA-1-60阳性率。
图13中示出4个FACS的柱状图。柱状图的纵轴表示TRA-1-60的强度。横轴表示自身荧光的强度。
图13的左上方的柱状图(Old method)表示阳性对照的结果。阳性对照的情况,与现有方法同样地通过使用饲养层细胞来维持分化多能性并进行了传代培养。图中示出进行第2次传代时的流式细胞仪的结果。
左下方的柱状图(P2)由本实施例中第10天的时刻的细胞得到。传代为第2次。右下方的柱状图(P4)由本实施例中第20天的时刻的细胞得到。传代为第4次。
柱状图中绘制的1个点(以下称为标绘点。)表示1个细胞。柱状图中的左上方的区域(P4)位于红色标绘点的集合部分(颜色浅的部分)表示维持iPS细胞的功能的细胞的群体。其它黑色标绘点的部分(颜色深的部分)表示iPS细胞标记物的表达水平低的细胞。
右上方的柱状图(NC)表示基于并非为iPS细胞的细胞的阴性对照的结果。偏离具有iPS细胞功能的区域(P4)的分布(黑色标绘点)。
如图13的下方所示,通过在具有分区的平板上培养而得到的iPS细胞即使在第10天(第2次传代)、第20天(第3次传代)时大部分也为TRA-1-60阳性。TRA-1-60阳性细胞的强度或占全部细胞的比例与阳性对照为同等程度。
基于FACS的试验的结果显示出:在需要进行多次传代来制备多能干细胞聚集体的群体的情况下,本实施例的方法中,能够以均质性高的状态维持聚集体间的未分化状态。另外即使在未使用饲养层细胞的情况下,通过使用具有分区的平板也可维持iPS细胞的未分化状态。
<抗体染色>
利用上述接触法回收培养第10天时得到的iPS细胞的聚集体并收集在15ml管内。与上述同样地用TrypLE Select对聚集体进行处理而使细胞个体化后,以270G对管进行离心分离后,去除上清液。利用适当的培养基使iPS细胞悬浮后,将iPS细胞接种在预先培养在6孔板上的饲养层细胞上。
从细胞接种至经过5天~7天后,按照以下的步骤对饲养层上的iPS细胞进行了染色。
1.从6孔板的各孔中去除培养基并对于各孔添加1ml的PBS。
2.去除PBS并添加4%PFA(多聚甲醛)500μl。
3.在4℃的冰箱内使细胞与PFA反应15分钟。
4.从孔中去除PFA并添加1ml的PBS。
5.用包含5%加强型小牛血清(CCS:Cosmic Calf Serum)和0.1%Triton的PBS将第一抗体稀释200倍。在孔中添加上述稀释抗体液500μl。第一抗体是抗OCT3/4抗体(C-10、SC-5279、Santacruz)和抗NANOG抗体(abcam、ab21624)。
6.在室温下使抗体与细胞反应1小时。
7.去除稀释抗体液并用1ml PBS清洗孔。再次用PBS清洗孔。
8.用包含5%加强型小牛血清(CCS:Cosmic Calf Serum)和0.1%Triton的PBS将第二抗体稀释1000倍,并在孔中添加上述稀释抗体液。第二抗体是驴抗小鼠IgG(H+L)第二抗体,Alexa Fluor 488conjugate和驴抗山羊IgG(H+L)第二抗体,Alexa Fluor 647conjugate。Alexa Fluor为商标。
9.在室温下使抗体与细胞反应30分钟。
10.用PBS对孔进行2次清洗。利用荧光显微镜EVOS(Thermo Fisher Scientific)观察了细胞。
图14中示出基于抗体染色的细胞的观察图像。观察图像中看到的左右方向的条的长度表示400μm。左上方是明视角的图像。右上方是对Oct3/4进行染色的结果。左下方是对Nanog进行染色的结果。
由染色结果可知:在具有分区的平板上培养的iPS细胞表达了作为多能干细胞的标记物基因的OCT3/4和NANOG(OCT3/4和NANOG阳性)。由该结果显示出:在具有分区的平板上培养的iPS细胞维持了分化多能性。
<与平板培养的比较>
本试验中,使用上述的iPS细胞株系1、系2和系3。
图15中示出回收的聚集体的群体的观察图像。上半部分的观察图像(KRR培养皿、KRR Dish)表示在具有分区的平板上传代培养各细胞的结果。下半部分的观察图像(非粘附培养皿、Non-adhesion dish)表示在实施了细胞低粘附处理的平板培养皿上对各细胞进行传代培养的结果。对于任意的传代培养均未使用饲养层细胞。另外所有的传代次数均为1次(P1)。如图15所示,可知:在制备多能性在干细胞聚集体的群体时,本实施例的方法有利于使聚集体的大小均等化。
iPS细胞通常具有达到一定大小以上则分化的性质。进而,培养基中的营养不易扩散至聚集体的内部。因此,由在实施了细胞低粘附处理的平板培养皿上培养的细胞构成的聚集体的大小是不均匀的。另外在这些细胞中诱导了分化、细胞死。另一方面,对于在具有分区的平板上培养的细胞则未受到这些影响。可以说本实施例的培养方法与现有的平板培养法相比,适于iPS细胞的培养。
[实施例6]
本实施例中,与实施例4同样地培养了上述iPS细胞系1和系2。图16的左侧示出iPSC系1的聚集体的观察图像。右侧示出iPSC系2的聚集体的观察图像。传代为第1次。为最初接种在平板上时起的第5天。本实施例中也与实施例4同样地在制备多能干细胞聚集体的群体时,使得聚集体的大小均等化。因此上述实施例的方法不依赖于细胞株的种类,均有助于得到大小均等化的聚集体。
[实施例7]
本实施例中代替系1、2和3使用了与这些细胞株同样表达了未分化标记物并具有分化为三胚层的性质的iPS细胞的细胞系4。其它条件与实施例4同样地培养了细胞。
图17是接种在本实施例的平板上的系4的观察图像。图17的上半部分表示刚接种后的系4。下半部分表示在第7天从平板上回收的系4。如图17的左侧一列所示,利用与实施例1同样的方法培养系4时,系4形成聚集体的效率低于系1、2和3。然而,维持了系生存活性。发明人等认为:培养液A的组成对于系4聚集而言是不充分的。
使用在培养液A中添加了细胞外基质的培养基进行了培养。如图17的右侧一列所示,系4形成了聚集体。
本实施例中以成10μL/mL以上的浓度的方式在培养液A中添加了市售的Matrigel(商标)。可认为培养基中的细胞外基质的浓度只要为10μL/mL以上的范围即可。可认为细胞外基质只要为Matrigel、层粘连蛋白、胶原蛋白、纤维连接蛋白、玻璃粘连蛋白和作为Lamin的变异体的Lamin 551中的任一种、或包括这些组合的物质即可。其它条件与实施例同样。
上述的结果显示出:即使是在不包含细胞外基质的培养基中未形成聚集体的细胞,通过使用添加了细胞外基质的培养基也能使其聚集。
[实施例8]
本实施例中,以TRA-1-60表达强度作为基准,对基于本实施例的分区进行的培养、及在涂布有现有的细胞外基质的平板上的培养进行了比较。
<细胞的准备>
(w/饲养层细胞(w/feeder))
作为阳性对照,使用用细胞外基质涂层的培养皿。以下将上述阳性对照称为“w/feeder”。
1.培养容器的准备:作为需要涂布在培养皿上的细胞外基质使用了Matrigel。在冰上对于DMEM 12ml添加180μl的Matrigel而得到溶液。将溶液适量注入至使用了具有12孔培养皿的培养平板的(以下将上述培养容器简称为培养皿。)各培养皿中。在CO2孵化器中将培养皿放置1小时以上。在即将使用培养皿之前,去除培养基。以下将上述培养皿称为细胞外基质培养皿。
2.按照与实施例1同样的步骤,使用饲养层细胞培养了iPS细胞。然后,从培养产物中仅去除了饲养层细胞。接着,在6孔板的各孔中培养了iPS细胞。培养后在各孔中注入培养基Y每孔1ml。用刮棒使iPS细胞从孔上剥离。进行充分地悬浮以使iPS细胞个体化并成为单细胞。
3.对于如前所述准备的细胞外基质培养皿,每培养皿接种2×105个iPS细胞。将细胞外基质培养皿在CO2孵化器中孵育。培养基使用在培养液A培养基中添加了1/1000量的ROCK抑制剂而成的物质。
4.从接种起经过1天后,从孵化器中取出细胞外基质培养皿。之后使用与上述相同地添加了ROCK抑制剂的培养液A培养基每天进行了培养基更换。
5.从接种起经过7~10天后,从细胞外基质培养皿中去除培养基。在培养皿内添加1ml的PBS。用吸引器去除PBS。在培养皿内添加500μl的TrypLE Select。将培养皿在CO2孵化器中孵育5分钟。
6.孵育后,在培养皿内添加500μl培养基Y。利用自动移液器进行悬浮,从而使iPS细胞个体化而成为单细胞。
(w/o饲养层细胞(w/o feeder))
作为比较例,进行了平板培养。使用实施了细胞低粘附处理的平板培养皿。以下将上述比较例称为“w/o feeder”。
实施了细胞低粘附处理的平板培养皿与[实施例5]的<与平板培养的比较>中示出的同样。从接种起经过7~10天为止进行在平板培养皿上的培养。传代的次数为1次(P1)。
将培养后的细胞悬浮液回收在15ml管中。以270G对管进行离心后,通过吸引而去除了上清液。在管中添加500μl的TrypLE Select后,将管在37℃的孵化器中孵育10分钟。孵育后,在管中添加培养基Y 500μl。利用自动移液器使管和细胞悬浮,由此使iPS细胞个体化而成为单细胞。
(KRR)
在本实施例的具有分区的平板上进行了iPS细胞的培养。以下将上述实施例称为“KRR”。
按照与实施例4同样的步骤,从接种起经过7天~10天为止在本实施例的具有分区的平板上培养了iPS细胞。按照与实施例5同样的步骤将iPS细胞回收至15ml管中。以270G对管进行离心分离后,通过吸引而去除了上清液。添加500μl的TrypLE Select后,将管在37℃的孵化器中孵育10分钟。孵育后,在管中添加培养基Y 500μl。利用自动移液器使管和细胞悬浮,由此使iPS细胞个体化而成为单细胞。
<FACS>
准备上述的w/feeder、w/o feeder和KRR的细胞后,按下述步骤进行了细胞的分析。
1.将成为个体化的单细胞的iPS细胞回收至1.5ml管中。利用血细胞计数平板对细胞数进行计数。然后,以270G对管进行离心后去除了上清液。
2.对于5×105个iPS细胞添加PBS 50μl。PBS中预先添加了抗TRA-1-60抗体2.5μl。抗TRA-1-60抗体为了发出荧光而预先进行了化学处理。在室温且遮光的条件下将管孵育了30分钟。
3.孵育后,在管中添加1ml的PBS。以270G对管进行离心分离后,从管中去除了上清液。
4.利用流式细胞仪CytoFlex解析了TRA-1-60阳性细胞的荧光强度。
<结果>
如下所述,与在细胞外基质培养皿上培养的iPS细胞相比,在具有分区的平板上培养的iPS细胞能够较高地维持未分化标记物的表达。
图18是ACS的2参数柱状图。纵轴是自身荧光(Auto fluorescence)的强度。横轴是TRA-1-60的荧光强度。KRR中可以得到与W/feeder同样的图案。
图19是FACS的1参数柱状图。横轴是TRA-1-60的荧光强度。纵轴的count表示细胞的个数。KRR中可以得到与W/feeder同样的图案。
由图18和19所示的结果可知:KRR表示出与w/feeder同等的柱状图。例如可以通过附图中具有颜色最深的灰色部分的位置来判定。
[实施例9]
进行了在具有分区的平板上培养的各细胞块的未分化标记物表达率的测定。
按照与实施例4同样的步骤,接种后培养了7天~10天(P1)。从平板上回收聚集体时,逐个回收了聚集体。以下将上述聚集体称为单块(single clump)或团块(clump)。将总计10~12个单块回收至预先注入了300μl的TrypLE Select的1.5ml管内。
将管在37度下孵育10分钟。孵育后,在管内添加PBS 700μl。将细胞悬浮10次~30次。以270G对管进行离心分离。然后依据[实施例5]的<抗体染色>的步骤8.~10.进行了处理。
将对得到的染色像进行解析的结果示于图20的表示TRA-1-60的表达强度的图中。10~12个块中,80%以上的块的TRA-1-60阳性率为70%以上。
[实施例10]
进行了在具有分区的平板上培养的各块所具有的分化多能性的试验。
1.利用与实施例4同样的方法将iPS细胞培养了3天。用不含有bFGF类型的培养基Y置换培养基。进而培养了7天。每2天进行1次培养基更换。
2.结束上述7天的培养后,从具有分区的平板上回收iPS细胞块。在涂布了明胶的10cm培养皿中接种iPS细胞。然后,进而进行了7天培养。每2天进行1次培养基更换。
3.结束7天的培养后,使用以下的抗体,根据以下的方案进行了免疫染色。
4.用PBS清洗培养皿后,去除PBS并在培养皿内添加含有4%PFA的500μl的PBS。
5.在4℃的冰箱中使PFA与细胞反应15分钟。
6.从培养皿中去除PFA并添加了1ml的PBS
7.用包含5%CCS和0.1%Triton的PBS稀释第一抗体。在培养皿中添加稀释抗体液500μl。第一抗体是将TUJI-1抗体、FOXA2单克隆抗体和短尾基因(Brachyury)抗体稀释200倍而得到的物质。
8.在室温下使抗体与细胞反应1小时。
9.从培养皿中去除稀释抗体液。用1ml的PBS清洗细胞。再次进行了清洗。
10.用包含5%CCS和0.1%Triton的PBS将第二抗体稀释1000倍。第二抗体使用以下物质。
驴抗大鼠IgG(H+L)第二抗体,Alexa Fluor 488conjugate
驴抗小鼠IgG(H+L)第二抗体,Alexa Fluor 555conjugate
驴抗山羊IgG(H+L)第二抗体,Alexa Fluor 647conjugate
11.在室温下使第二抗体的稀释液与细胞反应30分钟。
12.用PBS对细胞进行2次清洗。利用荧光显微镜EVOS对细胞进行了观察。
图21A-C中示出聚集体的荧光观察图像。
图21A是TUJI-1、图21B是FOXA2、图21C是短尾基因的染色图案。图21A-C中,各自的左上方为系1、右上方为系2、左下方为系3。TUJ-1为外胚层的分化标记物。图21A所示的结果示出了:聚集体中的细胞具有向神经细胞等由外胚层产生的细胞分化的分化诱导能力。FOXA1是内胚层的分化标记物。FOXA1特别是在肝组织形成的最初期的过程中所必需的分化标记物。图21B所示的结果示出了:聚集体中的细胞具有分化为肝脏等由内胚层产生的细胞的分化诱导能力。短尾基因是初期中胚层的分化标记物。图21B所示的结果示出了:聚集体中的细胞具有分化为肌肉等由中胚层产生的细胞分化的分化诱导能力。
图21D是以全部细胞数作为基准、分别用柱状图示出表达了各类胚体标记物的细胞数的比例的图表。图表示出利用试管内分化诱导系统由聚集体诱导的类胚体的比例为80%以上。
[24]根据[2]所述的干细胞聚集体的群体的制备方法,其中,
使前述再次聚集而形成的前述聚集体不进行分解而彼此混合,
分别在二个以上分区分配前述混合的聚集体,
使二个以上前述混合的聚集体在各前述分区内彼此靠近,
使前述彼此靠近的二个以上聚集体进一步聚集。
[25]根据[2]所述的干细胞聚集体的群体的制备方法,其中,重复1次或2次以上如下过程:
在形成前述聚集体后分解前述聚集体前,
使形成的二个以上前述聚集体彼此混合,
分别在二个以上分区分配前述混合的聚集体,
使二个以上前述混合的聚集体在各前述分区内彼此靠近,
使前述彼此靠近的二个以上聚集体进一步聚集,
形成比前述混合的聚集体大的聚集体。
[26]根据[1]所述的干细胞聚集体的群体的制备方法,其中,
使形成的二个以上前述聚集体彼此混合,
分别在二个以上分区分配前述混合的聚集体,
使二个以上前述混合的聚集体在各前述分区内彼此靠近,
使前述彼此靠近的二个以上聚集体进一步聚集。
[27]根据[19]所述的聚集体的群体,其中,
进行生物体内分化诱导时,形成分化为三胚层的畸胎瘤的聚集体的比例为80%以上。
[28]根据[19]所述的聚集体的群体,其中,
从前述群体中选择10个聚集体,
利用试管内分化诱导系统由前述聚集体分化诱导内胚层的情况下,
对于前述聚集体,判定FOXA2和AFP中的至少任一个内胚层标记物是否为阳性时,
前述内胚层标记物的阳性率为80%以上。
[29]根据[19]所述的聚集体的群体,其中,
从前述群体中选择10个聚集体,
利用试管内分化诱导系统由前述聚集体分化诱导中胚层的情况下,
对于前述聚集体,判定短尾基因和MSX1中的至少任一个中胚层标记物是否为阳性时,
前述中胚层标记物的阳性率为80%以上。
[30]根据[19]所述的聚集体的群体,其中,
从前述群体中选择10个聚集体,
利用试管内分化诱导系统由前述聚集体分化诱导外胚层的情况下,
对于前述聚集体,通过使用PCR法逐个测定前述类胚体的基因表达量来判定Pax6、SOX2、PsANCAM和TUJ1中的至少任一个外胚层标记物是否为阳性时,
前述外胚层标记物的阳性率为80%以上。
[31]一种干细胞聚集体的群体的制备方法,
分别在二个以上彼此大小均等的分区分配二个以上聚集前单元,此处,前述聚集前单元是指细胞块和单细胞中的至少任一者,
在各前述分区内使前述二个以上前述聚集前单元彼此靠近,
使前述彼此靠近的二个以上前述聚集前单元聚集并进行培育而形成聚集体,
其中,前述分配的前述聚集前单元彼此分离并彼此混合,
前述细胞块分别由干细胞构成。
[32]根据[1]或[31]所述的干细胞聚集体的群体的制备方法,其中,
前述干细胞为多能干细胞。
[33]根据[31]或[32]所述的干细胞聚集体的群体的制备方法,其中,
前述聚集前单元为细胞块。
本申请主张基于2015年12月29日申请的美国临时申请62/272524的优先权,将其全部公开内容纳入本说明书中。
附图标记说明
20 培养器、21-26 步骤、27 箭头、29 隔壁、30 平板、31a、31b孔、32a、32b 分区、33a、33b 顶部开口、34a、34b 底部开口、35 培养液、36a、36b 液滴、37 储存分区、38 悬浮液、39 阈值、40 聚集体,41 群体、42a-42c 细胞块,43a-43c 聚集体,44a、44b 群体、45 支撑体、46 侧壁、47 凸缘、50 容器、55 托盘、56 侧壁、57 底部、58 空间、60 托盘、65 回收液。
- 还没有人留言评论。精彩留言会获得点赞!