一种牡蛎来源的新型功能肽及其用途的制作方法
本发明属于功能肽领域,具体涉及一种牡蛎来源的新型功能肽及其用途。
背景技术:
牡蛎(Oyster),属软体动物门(Mollusca),瓣鳃纲(Lanellibranchia),异柱目(Anisomyaria)牡蛎科(Ostreidae)动物,是一种食用价值和药用价值都极高的海洋双壳贝类。牡蛎的种类繁多,目前全世界已经发现有100多种,而中国沿海地区盛产牡蛎,约有20多种,是我国四大养殖贝类之一。
牡蛎不仅风味鲜美,且营养成分全,可作药用,中医典籍中也有用牡蛎治病的记载。根据已有报道,干牡蛎肉中,蛋白质含量约占45%~52%,氨基酸组成完善。据世界粮农组织评定,牡蛎肉中必需氨基酸完全程度和质量比例优于牛乳和人乳。干牡蛎肉中脂肪含量约为7%~11%,多为具有生理活性的复合磷脂、磷酸肌醇、二十碳五烯酸(EPA),二十二碳六烯酸(DHA)等,这些成分都可以防止动脉硬化、抗血栓以及抗衰老等作用。牡蛎中总糖含量为19%~38%,据报道,牡蛎中的糖原可直接被机体吸收,从而可以减轻胰腺负担,对糖尿病的防止十分有效。此外,还含有丰富的维生素A、B1、B2、D等,含碘量比牛乳或蛋黄高200倍。此外,牡蛎壳中含有80%~95%的钙盐(碳酸钙、磷酸钙和硫酸钙),同时也含有镁、铁、硅、铝和锌等金属元素。
牡蛎等海洋生物已经成为功能能肽的重要来源。功能肽又称活性肽,通常包含3到20个氨基酸残基,它们的生理活性依赖于它们的氨基酸组成和序列,由于其特殊的生理功能也越来越受到人们的关注,一些生物活性肽已应用于保健品、药品等领域。有研究表明:人们摄取蛋白质通过消化道的多种酶水解后,不仅仅像以前认为的那样以氨基酸的形式吸收,更多的是以肽的形式被直接吸收,而且二肽和三肽的吸收速度要比同一组成的游离氨基酸更快。功能肽不仅可以提供人体生长发育所需要的营养物质,还具有重要的生理功能,如清除自由基、促进矿物质吸收、防治肝病脑病、抗菌,抑制血管紧张素转化酶活力、提高人体免疫力以及延缓衰老等功能。目前,国内商品化的生物活性肽产品,活性成分明确的,除酪蛋白磷酸肽外还不多见。目前虽有较多文献报道利用牡蛎制备含功能肽的水解蛋白,但其中有效成分并不明确。深入研究牡蛎水解蛋白的有效成分,发现活性良好的新结构活性肽类,明确其分子结构,对于强效新产品的开发、明确活性产生机理、优化生产工艺、强化质量控制,乃至牡蛎资源的高效利用都有重要的意义。
技术实现要素:
本发明的第一个目的是提供一种具有良好的清除生物体内自由基功能的牡蛎来源的功能肽。
本发明的功能肽,含14个氨基酸残基,其氨基酸序列为半胱氨酸-亮氨酸-半胱氨酸-缬氨酸-亮氨酸-天冬酰胺酸-谷氨酰胺酸-谷氨酰胺酸-赖氨酸-缬氨酸-甘氨酸-色氨酸-丙氨酸-精氨酸(CLCVLNQQKVGWAR,其序列如SEQ ID NO.1所示),是一个新结构肽类。
本发明所述的功能肽是以牡蛎(Crassostrea gigas)为原料,用酶制剂,包括SCSIO 01819酶制剂、中性蛋白酶、碱性蛋白酶、胰蛋白酶、木瓜蛋白酶和菠萝蛋白酶等,作为催化剂,在催化牡蛎蛋白的水解反应,制备所得新型清除自由基活性的水解蛋白中的有效成分。经超滤、色谱方法将其从水解蛋白中分离纯化后,使用基质辅助的飞行时间质谱方法(MALDI-TOF-TOF)分析,鉴定其分子量为1618.83Da,氨基酸序列为半胱氨酸-亮氨酸-半胱氨酸-缬氨酸-亮氨酸-天冬酰胺酸-谷氨酰胺酸-谷氨酰胺酸-赖氨酸-缬氨酸-甘氨酸-色氨酸-丙氨酸-精氨酸(CLCVLNQQKVGWAR)。经NCBI中的SWISS-PROT数据库的检索,未发现明显同源的序列,该结果可以表明这种纯化的肽是从牡蛎产生的新结构肽。
本发明的第二个目的是提供上述功能肽在制备自由基清除剂中的应用。
一种自由基清除剂,其特征在于,包括上述功能肽作为活性物质。
本发明的第三个目的是提供上述功能肽在制备具有自由基清除能力的功能食品或功能饲料中的应用。
一种具有自由基清除能力的功能食品或功能饲料,其特征在于,包括上述功能肽作为活性物质。
本发明的功能肽具有良好的清除生物体内自由基的功能,因此本发明的功能肽可以用于制备自由基清除剂、以及具有自由基清除功能的功能食品和功能饲料。
附图说明:
图1是AHO–II-5-2ODS HPLC色谱图;
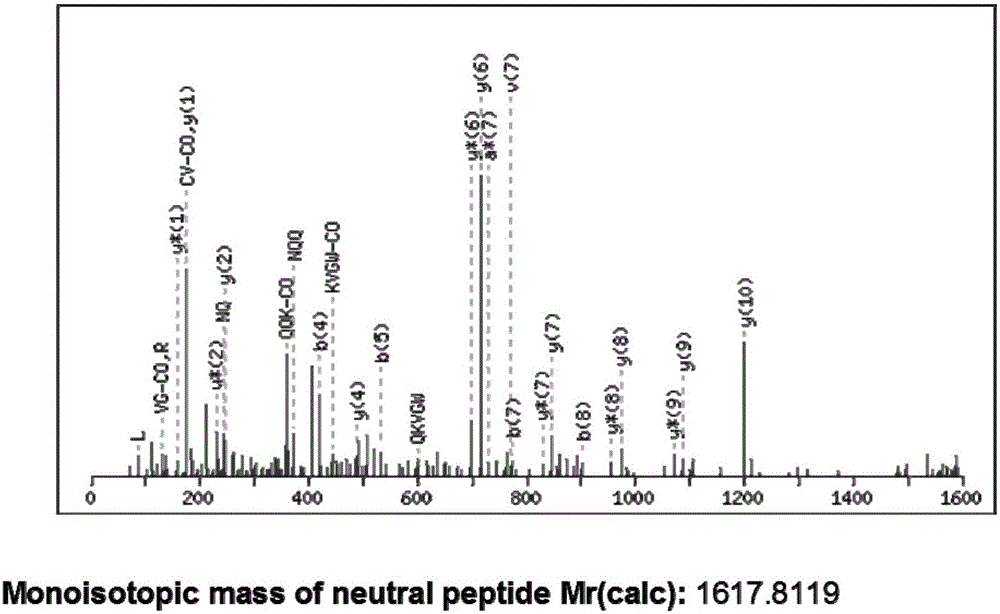
图2是目标功能肽(CLCVLNQQKVGWAR)的MALDI-TOF-TOF质谱图。
具体实施方式:
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
实施例1:牡蛎酶解蛋白的制备
1、原料和试剂
实施例中的牡蛎肉购自广州市黄沙水产市场市场,酶解前粉碎分袋包装并密封,于-20℃保存。
SCSIO 01819酶制剂为自制,参照专利《一种海洋来源小单孢菌SCSIO 01819、酶制剂溶液及其制备方法和应用》(申请号:CN201510366099.1,公开(公告)号:CN104894034A)中的方法制备,即为该专利中的SCSIO 01819酶制剂溶液-2。中性蛋白酶(酶活力为40万U/g),碱性蛋白酶(酶活力为40万U/g),木瓜蛋白酶(酶活力为40万U/g),菠萝蛋白酶(酶活力为40万U/g),均购自广西南宁庞博生物工程有限公司;胰蛋白酶(酶活力为250U/mg),购自美国sigma公司;DEAE-52纤维素阳离子交换树脂购自whatman公司,Sephadex G-15凝胶树脂购自GE公司。乙醇、甲醛、异丙醇、氢氧化钠、磷酸氢二钠、磷酸二氢钠等其他试剂均为国产分析纯。试验用水均为超纯水。
2、牡蛎的脱脂处理
将粉粹的牡蛎肉与异丙醇按照1g:4ml(w/v)的比例混合,在35℃下反应3小时,过滤,在4500×g下离心20min,取下层脱脂的牡蛎肉,晾干,-20℃下保存。
3、牡蛎肉酶解蛋白的制备
步骤2脱脂后的牡蛎肉在表1所示的蛋白酶的最适酶解条件下分别进行酶解,水解时间4小时,酶底比4000U/g。酶解结束后,在4℃,4500×g下离心,除去不溶性杂质,再在15000r/min下低温离心,所得上清液进行过滤,使其透过0.22um的滤膜。将所得样品溶液(滤液)冻干即得牡蛎水解蛋白,-20℃下保存备用。
表1.六种酶催化牡蛎蛋白水解的温度和pH值
4.DPPH自由基清除作用的测定。
本实验采用用DPPH实验评价样品的自由基清除能力。根据文献(Hsu,K.C.;Lu,G.H.;Jao,C.L.,Antioxidative properties of peptides prepared from tuna cooking juice hydrolysates with orientase (Bacillus subtilis).Food Research International 2009,42,(5-6),647-652.)的方法,测定牡蛎肉酶解物的清除DPPH自由基活性的能力。将步骤3的牡蛎水解蛋白溶解于水中得样品溶液,取100μl样品溶液加入到96孔板第一行,使其终浓度为5mg/ml,用超纯水进行浓度梯度稀释,再分别加入100μl浓度为2x10-4mol/L的DPPH乙醇溶液,每个浓度做三个平行实验,空白试验是由无水乙醇代替样品溶液。将混合物放置37℃在黑暗处反应30min。在517nm处测定吸光值。DPPH自由基的清除率按照以下公式进行计算:
式中:S为样品加DPPH的反应后的吸光度;SB为样品加的无水乙醇吸光度;C为无水乙醇加DPPH的吸光度;CB为空白对照的吸光度
根据结果绘制量效曲线,并计算DPPH清除活性的EC50值(半数清除浓度)。用SCSIO 01618酶制剂、木瓜蛋白酶(papain)、中性蛋白酶(neutral protease)、胰蛋白酶(trypsin)、碱性蛋白酶(alcalase)、菠萝蛋白酶(bromelain)制备的牡蛎水解蛋白,EC50值分别为:0.62mg/ml,0.88mg/ml,0.71mg/ml,1.41mg/ml,1.92mg/ml,0.89mg/ml。
实施例2从酶解蛋白中分离制备新型功能肽
1、取实施例1中用SCSIO 01819酶制剂酶解得到的牡蛎水解蛋白5g,溶解于10mL水制成样品溶液,用截留分子量为3kDa的超滤膜过滤,截留部分和滤液分别冻干,得两个样品:AHO-I(分子量>3kDa),AHO-II(分子量<3kDa)。
2、用离子交换柱对AHO-II(200mg)进行分离,产生了5个色谱片段(AHO–II-1~5),分别冻干后,检测其DPPPH自由基清除活性的EC50值,分别为3.53mg/ml,2.33mg/ml,2.88mg/ml,1.62mg/ml,0.461mg/ml(AHO–II-5)。
所述的用离子交换柱进行分离,其分离条件为将AHO-II溶液加入预平衡的DEAE-52纤维素柱(1.6×50cm),并依次用150mL的0.1,0.5和1.0M NaCl溶液洗脱,流速为1.0mL/min。按5mL/份收集洗脱流分(5mL),根据UV谱图(检测波长280nm),合并为五个片段(AHO–II-1至AHO–II-5),分别使用D101大孔树脂对每个片段脱盐,然后后冻干,测试DPPPH自由基清除活性。
3、取上一步骤中活性最强的AHO–II-5(52mg),用G15凝胶柱进行分离,获得4个组分片段AHO–II-5-1~4,分别冻干后,检测其DPPPH自由基清除活性的EC50值,分别为1.17mg/ml,0.53mg/ml(AHO–II-5-2),4.31mg/ml,0.93mg/ml,2.36mg/ml.
所述的G15凝胶柱分离,其分离条件为AHO–II-5样品溶解于5mL去离子水中,并通过预先用纯水平衡的Sephadex G-15凝胶过滤柱(2.6×100cm)纯化。用去离子水以1mL/min的流速洗脱柱,按每份2.5mL收集洗脱液,根据UV(280nm)检测的色谱图,将洗脱液合并为4个片段(AHO–II-5-1、AHO–II-5-2、AHO–II-5-3、AHO–II-5-4),分别冻干冻干保存。
4、取上一步骤制备的样品片段中活性最强的片段AHO–II-5-2(12mg),用HPLC(ODS柱)分离,收集22分钟处色谱峰流分(图2),得目标功能肽溶液,冻干后得到目标功能肽,测试目标功能肽的DPPPH活性,其EC50值为0.22mg/mL。
所述的HPLC分离,其分离条件为AHO–II-5-2样品溶于1mL0.1%三氟乙酸(TFA)水溶液中。色谱仪为(RP-HPLC)Agilent1200HPLC型高效液相色谱仪,色谱柱为Zorbax,SBC-18柱(柱尺寸:4.6mm×250mm,5μm粒径,Agilent),检测波长280nm。溶剂系统:A,0.1%三氟乙酸水溶液,B,乙腈(默克公司,色谱纯)。流速:1.0mL/min;洗脱程序:0-5分钟,5%B;5-50min,5%B-95%B每次分离进样量50mL,收集保留时间22min处色谱峰片段(目标功能肽)。共分离45次,合并峰片段后冻干。
5、结构鉴定
使用基质辅助-飞行时间质谱方法(MALDI-TOF-TOF),鉴定目标功能肽的分子量为1618.83Da,分析目标功能肽的质谱数据(图1),确认目标功能肽的氨基酸序列为:半胱氨酸-亮氨酸-半胱氨酸-缬氨酸-亮氨酸-天冬酰胺酸-谷氨酰胺酸-谷氨酰胺酸-赖氨酸-缬氨酸-甘氨酸-色氨酸-丙氨酸-精氨酸(CLCVLNQQKVGWAR)。经NCBI中的SWISS-PROT数据库的检索,未发现明显同源的序列,该结果可以表明这种纯化的肽是从牡蛎产生的新结构肽。
序列表
<110> 中国科学院南海洋洋研究所
<120> 一种牡蛎来源的新型功能肽及其用途
<160> 1
<210> 1
<211> 14
<212> PRT
<213> 牡蛎(ostrea gigas thunberg)
<400> 1
Cys Leu Cys Val Leu Asn Gln Gln Lys Val Gly Trp Ala Arg
1 5 10 14
- 还没有人留言评论。精彩留言会获得点赞!