一种皮肤及毛囊再生的气液界面三维培养方法与流程
本发明皮肤及毛囊再生技术领域,具体涉及一种皮肤及毛囊再生的气液界面三维培养方法。
背景技术:
:
毛囊周围具有皮肤,皮肤作为机体最大的器官,包裹着整个机体,同时也是内环境与自然环境间的第一道重要保护屏障,保护机体免受环境中各种因素的侵袭,维持内环境的稳态。其中毛囊作为皮肤的主要附属器官在胚胎时期已经开始发育,毛囊是包围在毛发根部的囊状组织,内层是上皮组织性毛囊与表皮相连,外层是结缔组织性毛囊与真皮相连。成熟毛囊由上皮部分的外根鞘和内根鞘以及真皮部分的毛乳头和真皮鞘组成。毛囊的发育经过表皮和真皮之间一系列复杂的相互作用而形成,具有自我更新和周期性生长的特点。另外毛囊的生长周期可分为生长期、衰退期及休眠期,在三个周期内毛囊的形态特征各异。
最近国内外已经成功研制出含有真皮和表皮的人工皮肤,但是这些皮肤并不含有毛囊,其保护屏障作用的能力大大缩小,众所周知,毛囊在皮肤损伤修复中发挥重要作用,不含毛囊的人工皮肤移植患处后,如果发生二次损害,将会对患者的创面形成难以愈合的瘢痕。另外,目前国内外对毛囊细胞生物学及毛囊干细胞修复创面的机制研究主要集中在活体皮肤上,同时对毛囊再生机制的研究方面也主要以体内的毛囊生长情况为主。这些研究材料的来源以活体为主,而活体受到环境的各种因素影响,因此最终的研究结果并不一定可以反映出毛囊细胞安静状态下的生物学特征,同时活体的可移动性也为实验研究带来不便。所以,到目前为止,对毛囊再生机制以及毛囊干细胞修复创面机制的研究依旧不甚明了。
一些研究学者使用毛囊真皮乳头细胞,毛囊外根鞘细胞进行不同比例的混合,然后注射无毛小鼠背部,尝试诱导出毛囊组织,虽然结果可以发现一些生长的毛囊样组织,但毛囊的形态观察并不清晰,所观察的毛囊样组织为成团样,并不能区分出毛囊结构,因此也就不能成为研究毛囊再生机制的模型。另外也有一些研究学者采用小鼠触须毛囊进行同体和异体移植来进行研究毛囊生物学,虽然发现毛囊细胞具有一定的免疫豁免性,但是移植后的毛囊其生长状态和豁免机制的研究并没有深入进行,同时又有研究学者对小鼠触须毛囊进行不同横切面的离断,然后进行体外培养,观察生长状态,但是最终的结果并不理想,离断的毛囊组织生长率太低,同时和培养皿发生粘连,而且毛囊组织完全侵入培养基中,细胞新陈代谢所释放的有害物质极易杀死毛囊细胞,因此所培养的毛囊组织再生情况并不如意,也不能清晰观察毛囊再生状态。
另外,在皮肤无瘢痕愈合机制方面的研究中,到目前为止,皮肤无瘢痕愈合的机制依旧没有明确,创面无疤痕愈合的现象从目前的研究结果来看,创面无瘢痕这一现象仅仅发生在组织胚胎前中期,到胚胎后期却无法达到创面的无瘢痕愈合结局。而且研究胚胎创面无瘢痕愈合机制所需要的孕鼠量大,而且跟踪大量小鼠发情期,以及为小鼠受孕,并记录小鼠胚胎天数,工作量大,且极易出现混乱。同时对活体孕鼠子宫进行外科造创,然而造创后且缝合子宫的孕鼠后期生存率极低,手术操作不当会造成孕鼠伤口感染,导致孕鼠大量死亡,因此最终得到的实验结果并不是预期实验结果。
目前,毛囊和皮肤是细胞生物学和皮肤创面修复及皮肤病学等学科研究的热点,它涉及毛囊干细胞的定位、毛囊的形态学分析、毛囊信号转导、生长因子、细胞因子和真皮和表皮之间的相互作用等多个方面的生物学功能研究。而且现在已经初步阐明和定位毛囊干细胞的所在位置,即毛囊外根鞘的隆突部。因此,如何利用毛囊干细胞研究毛囊再生机制以及研究毛囊干细胞对创面修复的机制已成为当前研究的发展趋势。
现有技术中没有在体外成功建立毛囊再生模型及胚胎皮肤无瘢痕愈合模型;目前的培养方法模拟机体生理环境,不稳定,容易受外界环境影响;不能在体外快速建立所需再生模型和无瘢痕愈合模型,在试验前期建模中,浪费大量时间和物力。
由上述可知,研制出一种体外重建毛囊组织形态和建立皮肤无瘢痕愈合模型,且具有一定生理功能的模型方法,将对研究毛囊再生机制及创面无瘢痕愈合机制具有重要现实意义和应用前景。
技术实现要素:
:
为了解决上述问题,本发明提供一种皮肤及毛囊再生的气液界面三维培养方法,所述方法通过培养触须毛囊外根鞘使毛囊再生,并重建毛囊的三维形态,利用新生毛囊存活时间较长,新生形态规整,毛囊不易塌陷的特点,培养小室模拟机体环境,培养具有一定的生理功能的再生毛囊或无瘢痕愈合的胚胎皮肤;
进一步地,所述方法包括:
S1:制作气液界面支架
使用40μL鼠尾I型胶原蛋白混合等量PBS,无菌条件下均匀涂抹在一次性的90mm直径的培养皿内壁上,无菌眼科镊夹取Nuclepore聚碳酸酯膜,平铺在涂满鼠尾胶原的培养皿中,封口膜封住培养皿,紫外线照射30min,待其鼠尾I型胶原蛋白和Nuclepore聚碳酸酯膜自然干燥后,放入4℃冰箱备用;
S2:制备培养液
使用低糖MEM作为基础培养液,加入胎牛血清FCS,制作成5%FCS+MEM的培养液,2mL的5%FCS+MEM培养液中加入青链霉素100mg,培养毛囊外根鞘时加入BFGF(成纤维细胞碱性生长因子)10ng/mL,培养胚胎皮肤时加入EGF(表皮生长因子)8ng/mL;
S3:获取触须毛囊外根鞘并培养
断颈法处死新生1-5d的乳鼠,整个乳鼠放入75%酒精中消毒,然后转移到超净工作台,在解剖显微镜下用眼科剪沿乳鼠嘴角剪下双侧触须部皮肤组织,把皮肤组织放入无菌MEM培养液中,在无菌液体三维环境下利用眼科镊,分离出完整的触须毛囊,利用眼科显微外科刀切除毛囊毛球部部分,拔出毛囊内根鞘,不损伤毛囊外根鞘的中上部,获得的形态完整的毛囊外根鞘中上部,保留毛囊隆突部的完整性;
S4:获取并培养胚胎皮肤
30mm培养皿中加入2mL配比好的培养液,将处理好的Nuclepore聚碳酸酯膜漂浮在培养液之上,利用无菌眼科镊把毛囊外根鞘转移到漂浮的Nuclepore聚碳酸酯膜上,放在37℃、5%CO2培养箱中进行培养;
进一步地,S1中所述气液界面的材料采用Nuclepore聚碳酸酯微孔膜,皮重轻,可漂浮,不污染培养液,所述的Nuclepore聚碳酸酯膜,由高质量聚碳酸酯薄膜制成,每张Nuclepore聚碳酸酯膜成圆形,规格不同,孔径不同;
进一步地,S1中所述支架由Nuclepore聚碳酸酯微孔膜经过I型鼠尾胶原蛋白处理制得;
进一步地,S2中所述培养添加物为干细胞增殖标记物EdU,激素,抗生素或细胞因子;
进一步地,S2中所述气液界面培养中的培养基为DMEM、MEM或RPMI-1640培养液;
进一步地,S2中所述胎牛血清选用灭活支原体的进口胎牛血清;
进一步地,S3中所述小鼠触须毛囊的获取时间选取小鼠刚出生的1-5d,用于获取小鼠触须毛囊外根鞘,所述小鼠触须毛囊外根鞘培养选取时间是1-6d;
进一步地,S4中所述胎鼠皮肤获取时间是E14-E17d,所述胎鼠皮肤培养选取时间是1-7d;
本发明的有益效果如下:
1)模拟机体环境在气液界面上培养动物组织(毛囊、胎鼠皮肤),所培养的动物毛囊、胚胎皮肤具有一定的生理功能,且胚胎皮肤人工微创后胚胎皮肤可以实现无疤痕愈合;
2)皮肤及毛囊再生的气液界面三维培养方法为培养干细胞及快速建立医学再生模型的方法,能够从体外探索毛囊再生及皮肤无瘢痕愈合机制;
3)本发明方法设计合理,操作简单,易在短时间内建立体外组织再生及创伤愈合模;
4)在体外成功建立毛囊再生模型及胚胎皮肤无瘢痕愈合模型;
5)培养方法模拟机体生理环境,稳定,不容易受外界环境影响;
6)能在体外快速建立所需再生模型和无瘢痕愈合模型,在试验前期建模中,节约大量时间和物力。
附图说明:
图1为皮肤及毛囊再生的气液界面三维培养组装实物图;
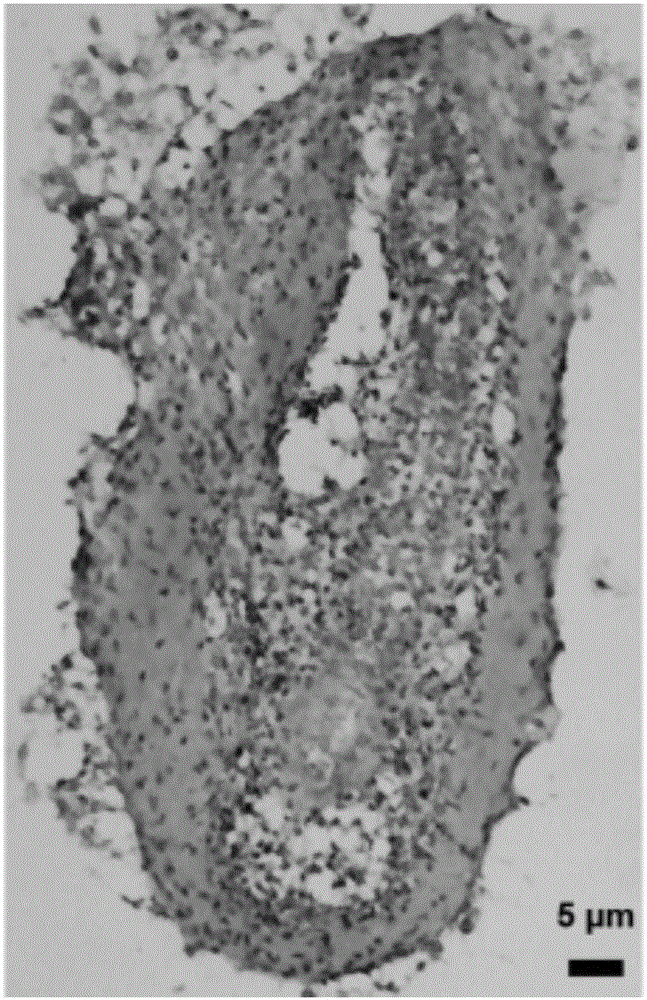
图2为毛囊外根鞘培养3d时,冰冻切片H.E染色观察毛囊结构;
图3为毛囊外根鞘培养5d时,冰冻切片H.E染色观察毛囊结构;
图4为蔡司倒置荧光显微镜在紫光通道下,毛囊再生结构,细胞排列图;
图5为毛囊外根鞘培养5d时,α-SMA荧光染色观察毛囊结构(绿色)图;
图6为胚胎皮肤人工微创培养3d时,冰冻切片H.E染色观察胚胎皮肤愈合形态图;
图7为胚胎皮肤人工微创培养7d时,冰冻切片H.E染色观察胚胎皮肤愈合形态图;
图8为添加适量干细胞标记物EdU,毛囊外根鞘培养12h,免疫荧光染色观察毛囊新生细胞(绿色),核复染(红色)形态图;
图9为添加适量干细胞标记物EdU,胚胎皮肤培养12h,免疫荧光染色观察皮肤新生细胞(绿色),核复染(红色)形态。
具体实施方式:
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细描述。应当理解,此处所描述的具体实施例仅仅用于解释本发明,并不用于限定本发明。相反,本发明涵盖任何由权利要求定义的在本发明的精髓和范围上做的替代、修改、等效方法以及方案。进一步,为了使公众对本发明有更好的了解,在下文对本发明的细节描述中,详尽描述了一些特定的细节部分。对本领域技术人员来说没有这些细节部分的描述也可以完全理解本发明。
下面结合附图和具体实施例对本发明作进一步说明,但不作为对本发明的限定。下面为本发明的举出最佳实施例:
如图1-图9所示,本发明的目的是提供一种胚胎皮肤及触须毛囊体外培养的支架方法,模拟机体生理环境,使得胚胎皮肤和毛囊活性在体外的活性提高并延长生长时间,从而更方便的研究胚胎皮肤无疤痕愈合及毛囊再生机制。
皮肤毛囊再生的气液界面三维培养方法,其包括以下步骤:
S1:气液界面支架的制作
Nuclepore聚碳酸酯膜,由高质量聚碳酸酯薄膜制成,每张Nuclepore聚碳酸酯膜成圆形,规格不同,孔径不同,使用40μL鼠尾I型胶原蛋白混合等量PBS,无菌条件下均匀涂抹在一次性的90mm直径的培养皿内壁上,无菌眼科镊夹取Nuclepore聚碳酸酯膜,平铺在涂满鼠尾胶原的培养皿中,封口膜封住培养皿,紫外线照射30min,待其鼠尾I型胶原蛋白和Nuclepore聚碳酸酯膜自然干燥后,放入4℃冰箱备用。
S2:培养液的制备
试验中使用低糖MEM作为基础培养液,加入胎牛血清(FCS),制作成5%FCS+MEM的培养液,2mL的5%FCS+MEM培养液中加入青链霉素100mg,培养毛囊外根鞘时加入BFGF(成纤维细胞碱性生长因子)10ng/mL,培养胚胎皮肤时加入EGF(表皮生长因子)8ng/mL。
S3:触须毛囊外根鞘的获取及培养
断颈法处死新生1-5d的乳鼠,整个乳鼠放入75%酒精中消毒,然后转移到超净工作台,在解剖显微镜下用眼科剪沿乳鼠嘴角剪下双侧触须部皮肤组织,把皮肤组织放入无菌MEM培养液中,在无菌液体三维环境下利用眼科镊,分离出完整的触须毛囊,利用眼科显微外科刀切除毛囊毛球部部分,小心拔出毛囊内根鞘,不要损伤毛囊外根鞘的中上部,获得的形态完整的毛囊外根鞘中上部,保留毛囊隆突部的完整性。
在30mm培养皿中加入2mL配比好的培养液,将处理好的Nuclepore聚碳酸酯膜漂浮在培养液之上,利用无菌眼科镊把毛囊外根鞘转移到漂浮的Nuclepore聚碳酸酯膜上,放在37℃、5%CO2培养箱中进行培养。
S4:胚胎皮肤的获取及培养
取孕龄为14-17d(E14-E17)之间的孕鼠,断颈法处死孕鼠,浸泡于75%酒精10min,无菌PBS中清洗3次,超净台内无菌条件下,将子宫取出,在无菌PBS中清洗3次,清除表面残留血液及粘液。剪开子宫后,取出带有胎膜的胚胎,无菌PBS中清洗3次。用镊子撕破胎膜,取出胎鼠。将胎鼠在无菌PBS中冲洗后用眼科剪剪去尾巴及四肢,并用眼科剪沿背部两侧剪开,用镊子小心剥离胎鼠背部皮肤,使用显微眼科手术刀把胚胎皮肤切成规则四边形。并用打孔器在四边形皮肤中心造创,测量并记录造创口直径。30mm培养皿中加入2mL配比好的培养液,将处理好的Nuclepore聚碳酸酯膜漂浮在培养液之上,利用无菌眼科镊把毛囊外根鞘转移到漂浮的Nuclepore聚碳酸酯膜上,放在37℃、5%CO2培养箱中进行培养。
实施例1:
(1)气液界面支架的制作:
Nuclepore聚碳酸酯膜,由高质量聚碳酸酯薄膜制成,每张Nucle-pore聚碳酸酯膜成圆形,规格不同,孔径不同,使用40μL鼠尾I型胶原蛋白混合等量PBS,无菌条件下均匀涂抹在一次性的90mm直径的培养皿内壁上,无菌眼科镊夹取Nuclepore聚碳酸酯膜,平铺在涂满鼠尾胶原的培养皿中,封口膜封住培养皿,紫外线照射30min,待其鼠尾I型胶原蛋白和Nuclepore聚碳酸酯膜自然干燥后,放入4℃冰箱备用。
(2)培养液的制备:
实验中使用低糖MEM作为基础培养液,加入胎牛血清(FCS),制作成5%FCS+MEM的培养液,2mL的5%FCS+MEM培养液中加入青链霉素50mg/mL,培养毛囊外根鞘时加入BFGF(成纤维细胞碱性生长因子)10ng/mL,培养胚胎皮肤时加入EGF(表皮生长因子)8ng/mL。
(3)触须毛囊外根鞘的获取及培养
断颈法处死新生1-5d的乳鼠,整个乳鼠放入75%酒精中消毒,然后转移到超净工作台,在解剖显微镜下用眼科剪沿乳鼠嘴角剪下双侧触须部皮肤组织,把皮肤组织放入无菌MEM培养液中,在无菌液体三维环境下利用眼科镊,分离出完整的触须毛囊,利用眼科显微外科刀切除毛囊毛球部部分,小心拔出毛囊内根鞘,不要损伤毛囊外根鞘的中上部,获得的形态完整的毛囊外根鞘中上部,保留毛囊隆突部的完整性。
35mm培养皿中加入2mL配比好的培养液,将处理好的Nuclepore聚碳酸酯膜漂浮在培养液之上(图1),利用无菌眼科镊把毛囊外根鞘转移到漂浮的Nuclepore聚碳酸酯膜上,放在37℃、5%CO2培养箱中进行培养。
毛囊外根鞘培养3d时,H.E染色,可以看到新生毛囊形态(图2)。培养5d时,H.E染色,可以清晰看到新生毛囊形态较为饱满(图3)。蔡司倒置荧光显微镜在紫光通道下,观察毛囊再生结构,可见新生毛囊细胞有序排列(图4)。毛囊外根鞘培养5d时,α-SMA荧光染色观察毛囊新生骨架结构(绿色)(图5)。
实施例2:
取孕龄为14-17d(E14-E17)之间的孕鼠,断颈法处死孕鼠,浸泡于75%酒精lOmin,无菌PBS中清洗3次,超净台内无菌条件下,将子宫取出,在无菌PBS中清洗3次,清除表面残留血液及粘液。剪开子宫后,取出带有胎膜的胚胎,无菌PBS中清洗3次。用镊子撕破胎膜,取出胎鼠。将胎鼠在无菌PBS中冲洗后用眼科剪沿背部两侧剪开,用镊子小心剥离胎鼠背部皮肤,使用显微眼科手术刀把胚胎皮肤切成规则四边形。并用打孔器在四边形皮肤中心造创,测量并记录造创口直径。
在30mm培养皿中加入2mL配比好的培养液,将处理好的Nucle-pore聚碳酸酯膜漂浮在培养液之上,利用无菌眼科镊把毛囊外根鞘转移到漂浮的Nuclepore聚碳酸酯膜上,放在37℃、5%CO2培养箱中进行培养。胚胎皮肤人工造创后,培养3d时,H.E染色,观察创面愈合情况(图6),胚胎皮肤人工造创后,培养7d时,H.E染色,观察创面愈合情况(图7)。
实施例3:
在Nuclepore聚碳酸酯膜上,滴加2μL干细胞增殖标记物EdU,无菌眼科镊把解剖获得的毛囊外根鞘转移到漂浮的Nuclepore聚碳酸酯膜上,并且毛囊外根鞘和干细胞增殖标记物EdU充分接触,放在37℃、5%CO2培养箱中进行培养12h,免疫荧光染色观察毛囊干细胞增殖状态(图8)。
实施例4:
在Nuclepore聚碳酸酯膜上,滴加2μL干细胞增殖标记物EdU,无菌眼科镊把解剖获得的胚胎皮肤转移到漂浮的Nuclepore聚碳酸酯膜上,并且胚胎皮肤和干细胞增殖标记物EdU充分接触,放在37℃、5%CO2培养箱中进行培养12h,免疫荧光染色观察胚胎皮肤干细胞增殖状态(图9)。
本发明中,Nuclepore聚碳酸酯膜:由高质量聚碳酸酯薄膜制成,孔径精确,有着极好的耐浸润和耐热性,膜光滑平整,对样品无污染。
鼠尾I型胶原蛋白:是一种天然培养基,具有促进体外培养细胞(特别是上皮细胞)贴壁的作用,同时也是一种天然的黏附剂。
以上所述的实施例,只是本发明较优选的具体实施方式的一种,本领域的技术人员在本发明技术方案范围内进行的通常变化和替换都应包含在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!