一种大豆高效启动子盐诱导功能元件及其应用的制作方法
本发明涉及一种盐诱导功能元件及应用,尤其涉及一种大豆的新型高效启动子盐诱导功能元件及其应用。
背景技术:
大豆(Glycine max(L.)Merill)是一种传统的可食用豆科作物,也是公认的重要双子叶植物,种子为人类提供了丰富的蛋白、高质量的植物油、矿物质和维生素等资源。另外,大豆异黄酮、皂角苷、磷脂酰胆碱等也作为重要的功能化合物存在于大豆种子中。
根据高盐胁迫下植物正常生长的比率对植物进行盐胁迫耐受性分级,分级结果显示栽培大豆是一种中度耐盐的农作物,土地高盐碱含量限制了大豆种植业的发展。
高等植物自身生长发育和对环境变化的响应是通过调控目的基因的表达来实现的。而转录因子和基因顺式作用元件的相互作用,可以作为基因表达调控的分子开关。正是转录因子与抗逆功能基因启动子区域顺式作用元件的相互作用激活了抗逆相关基因的表达,提高了植物的综合抗逆性。
利用逆境诱导型启动子驱动抗逆基因在转基因植物中表达是培育抗逆作物新品种的有效方法。目前能应用于转基因研究的诱导型启动子元件仍然很少,对于新的抗逆相关启动子功能元件的发现、克隆、分析以及与顺式元件相互作用的转录因子的研究仍然是今后研究的重点,将功能明确的抗逆启动子功能元件成功应用到转基因植物中调控抗逆基因的表达是植物抗逆基因工程的研究方向。
目前在植物中,研究较深入的有:脱落酸响应元件(ABA-responsive element,ABRE)、乙烯响应元件(ethylene-responsive element,ERE)、茉莉酸类物质应答元件(jasmonate-responsive element,JRE)、低温响应元件(low-temp rature reponsive element,LTRE)和干旱应答元件(dehydration-responsive element,DRE)等。
植物盐胁迫相关启动子元件的研究,有助与了解盐胁迫下基因转录调控表达模式和其调控机制,有助得到耐盐的转基因植物。
申请人实验室前期工作中已经证明来源于耐盐品种——圣豆9号的GmNAC4基因为盐响应基因,且对盐胁迫为正调节作用(专利CN102660554A)。研究大豆启动子盐诱导功能元件可以更好地帮助阐释耐盐大豆植株的盐胁迫应答分子机制,同时可为获得通用型的盐诱导型启动子功能元件提供重要参考,可用于转基因耐盐作物的培育。经过检索,未见有关于该盐诱导启动子功能元件的相关报道。
技术实现要素:
针对现有技术的不足,本发明的目的是提供一种大豆的新型高效启动子盐诱导功能元件及其应用。
本发明所述的大豆高效启动子盐诱导功能元件,其特征在于:所述盐诱导功能元件命名为大豆高效启动子盐诱导功能元件GmBM1,该盐诱导功能元件的核苷酸序列如SEQ ID No.1所示,其与拟南芥TUB2启动子融合的核苷酸序列如SEQ ID No.2所示。
本发明还提供了一种含有上述大豆高效启动子盐诱导功能元件的植物双荧光报告载体,其特征在于:所述载体命名为植物双荧光报告载体pGmBM1-pGreen II-0800LUC,该载体克隆区域核苷酸序列如SEQ ID No.3所示。
本发明所述大豆高效启动子盐诱导功能元件在提高植株盐胁迫耐受性中的应用。
其中:所述植株优选是大豆或拟南芥。进一步的,所述拟南芥是Col-0野生型,大豆品种是圣豆9号。
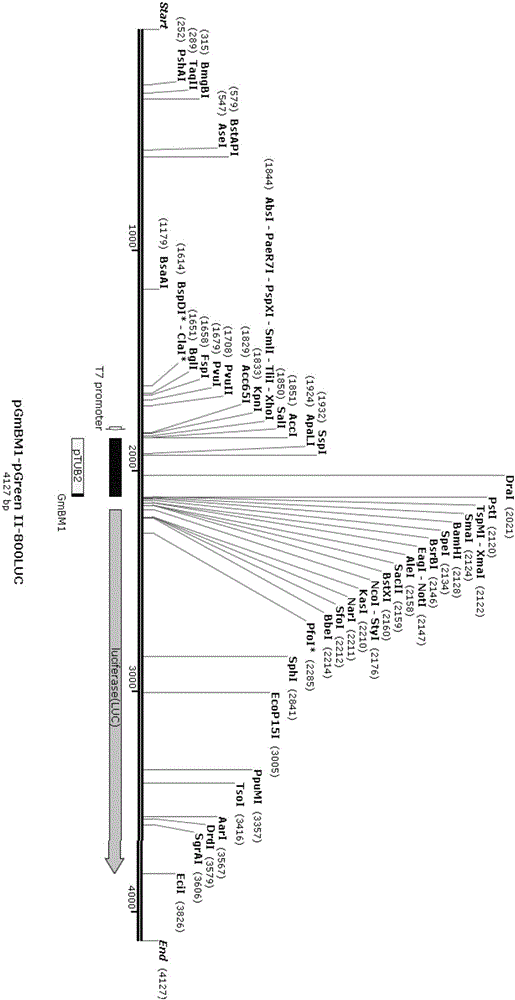
本发明所述大豆启动子盐诱导功能元件受盐胁迫诱导能高效启动目标基因表达。通过对GmNAC4转录因子识别并结合的下游基因的启动子序列分析,发现了盐胁迫下GmNAC4调节的大部分下游基因的启动子区域都含有一段保守的序列(pGmBM1):CCTCCACCC(见图1)。将该功能元件融合拟南芥TUB2启动子构建pGmBM1::pGreenII-0800LUC载体(见图2)转入拟南芥叶片原生质体中,通过拟南芥和大豆叶肉细胞原生质体瞬时转染体系,检测盐、非盐条件下启动子LUC质粒转化的原生质体相对荧光素酶活性,结果表明该功能元件可快速高效的响应高盐诱导(见图3)。
实验证实:本发明所述大豆启动子盐诱导功能元件能够在盐诱导条件下上调目标基因的表达,可望用于转基因耐盐植物的培育。
本发明有益效果体现在:本发明首次发现了得到了大豆启动子盐诱导功能元件,通过拟南芥叶肉细胞原生质体瞬时转染体系,经过比较分析证明,转基因拟南芥原生质体能在盐诱导下较非盐条件下能更高效的表达LUC报告基因。预示本发明所述的盐诱导功能元件可广泛用于培育抗盐的植物品种及转基因耐盐作物的相关功能研究。
附图说明
图1为启动子盐诱导功能元件:pGmBM1。
图2为pGmBM1::pGreenII-0800LUC载体T-DNA图谱。
图3为启动子盐诱导功能元件在盐和非盐条件下相对荧光素酶测定结果,
其中,mock:为转化原生质体正常培养6h的相对荧光素酶活性;NaCl:为转化原生质体150mM NaCl处理6h的相对荧光素酶活性;-:阴性对照,为无启动子驱动的pGreenII空载对照相对荧光素酶活性;+:阳性对照,为35S::pGreenII,35S启动子驱动的相对荧光素酶活性。
具体实施方式
实施例1大豆圣豆9号基因高效启动子盐诱导功能元件的获得
根据已报到的大豆圣豆9号转GmNAC4大豆植株在盐/非盐条件下的RNAseq结果,找到高盐胁迫下受转录因子GmNAC4上调表达的基因,利用http://meme-suite.org/网站比较这些基因的启动子区段共同含有的保守序列—CCTCCACCC,并设计特异性引物将该段序列与拟南芥TUB2启动子融合,命名为pGmBM1。
1.1 pGmBM1的克隆
高保真酶HIFI扩增的反应体系如下(20μl体系):
扩增条件如下:
反应结束后,反应液于0.8%TAE琼脂糖凝胶电泳检测。
1.2克隆基因片段的纯化回收(天根试剂盒)
1)将切下带有目的片段的凝胶放入1.5ml离心管并称凝胶重量,加入3倍体积的溶胶液,60℃溶胶10min,溶胶期间不断的翻转;
2)凝胶完全融化后,全部吸取到回收柱中,放置片刻;
3)室温,12000rpm,离心30Sec,弃溶液;
4)在柱中加入700μl的漂洗液,12000rpm,离心1min,弃漂洗液;
5)在柱中加入500μl的漂洗液,12000rpm,离心1min,弃漂洗液;
6)空柱,12000rpm,离心2min;
7)回收柱开盖晾干1-2min,放入新的干净的1.5ml离心管,加入60℃预热的40μl灭菌水或者EB缓冲液,放置2min;
8)12000rpm离心1min,所得溶液即为回收片段。
1.3连接pGmBM1与T载体
反应体系如下(20μl体系):
16℃过夜连接。
1.4大肠杆菌的质粒转化(无菌操作)
(1)将1-5μl质粒DNA或者连接产物加入50μl的感受态细胞中,轻弹离心管混匀,冰浴30min;
(2)42℃,温水浴热激90sec,立即冰浴2-3min;
(3)加入1ml LB培养基,37℃培养40-50min;
(4)室温,4000rpm,离心3min,收集菌体;
(5)将菌涂布于含有相应抗生素的培养平板上,37℃倒置培养过夜。
1.5大肠杆菌PCR验证
反应体系如下(20μl体系):
扩增条件如下:
反应结束后,反应液于0.8%TAE琼脂糖凝胶电泳检测。
1.6DNA测序
挑取含有重组质粒的阳性单菌落用含有Amp(50mg/L)的液体LB摇过夜,然后送上海铂尚生物技术有限公司测序,得到测序结果,启动子DNA序列如序列表SEQ ID No.2所示。
1.7大肠杆菌质粒DNA的提取得到pGmBM1-pMD18-T质粒(天根试剂盒)
(1)将测序正确的菌接种于10ml含有氨苄霉素的LB液体培养基中,37℃培养8小时-过夜;
(2)室温,12000rpm,离心1min,收集菌体;
(3)弃上清,加入250μl低温预冷的P1,振荡悬浮菌体;
(4)加250溶液P2轻柔颠倒混匀,静置5min;
(5)溶液澄清后加入350μl溶液P3,轻轻混匀后放置5min;
(6)12000rpm,离心12min,同时在过滤柱中加入600μl BL平衡液,室温放置2min,12000rpm离心1min,将收集管中的液体倒掉;
(7)转移质粒提取管中上层水相于过滤柱中,室温2min,12000rpm离心1min,将收集管中的液体倒掉;
(8)在过滤柱中加入600μl漂洗液PW,室温2min,12000rpm离心1min,将收集管中的液体倒掉,重复一次;
(9)将吸附柱CP3放入收集管中,12000rpm离心5min;
(10)将吸附柱CP3置于一个干净的离心管中,向吸附柱的中间部位滴加55μl预热55℃的灭菌水,室温放置2min,12000rpm离心2min将质粒溶液收集到离心管中,-20℃保存备用。
实施例2.利用拟南芥原生质体瞬时转化技术验证关键元件pGmBM1受盐诱导。
2.1 pGmBM1-pGreen II-0800LUC载体的构建
2.1.1克隆含有酶切位点的pGmBM1启动子片段
利用双酶切-连接法构建pGmBM1的双荧光报告载体pGmBM1-pGreen II-0800LUC。利用Primer5pGmBM1上的限制性酶切位点分析,与pGreen II-0800LUC上的多克隆位点(如图2所示)进行比较,筛选出可用酶切位点为Sal I和Pst I。
利用pGmBM1含有酶切位点的引物(F:5’-ACG CGT CGA CAC CGT CGT GTT CAC AAA TC-3’,R:5’-AAC TGC AGT TTT TCA AAA ACA CAA TTT CG-3’)PCR扩增pGmBM1。
高保真酶HIFI扩增的反应体系如下(20μl体系):
扩增条件如下:
反应结束后,反应液于0.8%TAE琼脂糖凝胶电泳检测。
2.1.2胶回收PCR产物(同1.3)
2.1.3 Sal I和Pst I分别双酶切PCR产物和pGreen II-0800LUC载体过夜。
反应体系如下:
37℃过夜充分酶切。
2.1.4第二天胶回收酶切产物及pGreen II-0800LUC载体(同1.2)。
2.1.5将回收的酶切产物和载体进行连接反应过夜。
2.1.6大肠杆菌感受态质粒转化(同1.4)。
2.1.7大肠杆菌PCR验证(同1.5)。
2.1.8 DNA测序(同1.6)。
2.1.9大肠杆菌质粒DNA的提取得到pGmBM1::pGreenII-0800LUC质粒:无内毒素质粒纯化DNA纯化体系(NucleoBond Xtra Midi EF)(MACHEREY-NAGEL)
(1).菌体培养收集:4500×g,15min,4℃
(2).菌体裂解:8ml Buffer RES-EF彻底重悬菌体,加入8ml Buffer LYS-EF裂解菌体,轻柔混匀,常温裂解5min;
(3).平衡柱子和滤头:15ml Buffer EQU-EF
(4).中和:8ml NEU-EF,轻柔混合10-15次,冰上放置5min
(5).净化和装柱裂解液:颠倒试管3次,将裂解液倒入柱子中
(6).1st洗:5ml Buffer FIL-EF
(7).去除过滤柱:去除Nucleobond Xtra Column Filter
(8).2ed洗:35ml Buffer ENDO-EF
(9).溶解:5ml ELU-EF
(14)沉淀:3.5ml异丙醇,15000g,4℃,30min
(15)清洗和干燥DNA沉淀:2ml 70%乙醇常温,5min,15000g,常温,5min
(16).溶解DNA:加入适量体积的H2O-EF,使DNA浓度达到1000ug/ml,-20℃保存。
2.2pGmBM1启动子拟南芥叶肉细胞原生质体瞬时转化
(1)准备在土里生长的3~4周拟南芥幼苗(拟南芥未受胁迫,未抽苔,生长良好),取5-8片展开的真叶;
(2)用新的单面刀片将叶片的中部切成0.5-1mm的小条,保证切片没有组织的挤压;
(3)将叶片条迅速且轻柔的转移到备好的酶液中,用平头镊子将叶条两边的切面都浸入酶液;
(4)将叶条在黑暗中抽真空30min黑暗中酶解3小时,轻摇后酶液呈绿色,说明原生质体解离下来;
(5)用显微镜检查原生质体,正常拟南芥叶肉细胞原生质体应约为30-50μm;
(6)用W5溶液将酶/原生质体等体积稀释;
(7)用水将75μm尼龙网上的乙醇洗净并吸去多余水分,并用W5浸湿,然后过滤上述混合物;
(8)将上清转入30ml圆底离心管,200g离心2min,尽可能去除上清,并轻柔转动重悬原生质体;
(9)用血球计数板在100倍显微镜下对原生质体计数,按2×105个/ml的比例用W5重悬原生质体,冰上静止30min;
(10)用移液器尽量吸去W5,不要碰到沉淀。按照2×105个/ml的比例用MMG重悬原生质体,并放置室温;
(11)在2ml离心管中加入10ul pGmBM1::pGreenII-0800LUC质粒;
(12)加入100ul原生质体(2×104个),轻柔混合;
(13)加入110ulPEG溶液,轻敲离心管充分混合,室温放置10min;
(14)在6孔板的每个孔中加入1ml 5%的牛血清溶液,晃动几下,使溶液覆盖好孔的内壁(防止原生质体贴壁),将牛血清移去,加入1mlW5溶液清洗六孔板,移去W5溶液;
(16)在转化体系中加入440ul W5稀释,轻柔混合以终止转化反应;
(17)100g离心2min,去除上清,加入200ul W5溶液悬浮原生质体;
(18)在六孔板中加入1ml W5溶液,将转化后的原生质体转入刘孔板中,黑暗中过夜培养;
(19)重悬原生质体,100g离心2min收集,去上清,留100ul左右的液体,直接进行LUC测定,或放入-80℃保存。
2.3 pGmBM1::pGreenII-0800LUC相对荧光素酶活性测定
利用Promega Dual-Luciferase Assay System检测启动子LUC质粒转化的原生质体相对荧光素酶活性,操作参照说明书。
将-80℃的原生质体拿出放在冰上融化,取20ul原生质体溶液+20ul Dual-Luciferase Reagent,25℃反应10min后测定萤火虫发光值,加入20ul Dual-Stop&Reagent测定,25℃反应10min,测定海肾发光值。计算相对荧光素酶活性值,相对活性值=萤火虫发光值/海肾发光值。pGmBM1::pGreenII-0800LUC的相对活性值和受盐诱导情况如图3所示,结果证明,在盐诱导下,pGmBM1能上调驱动报告基因在转基因拟南芥原生质体中的表达,pGmBM1启动子具有盐诱导功能,能够用于今后转基因耐盐调控机制研究,并广泛地应用于培育耐盐转基因植物。
序列表
<110> 山东大学
<120>一种大豆高效启动子盐诱导功能元件及其应用
<141> 2017-2-22
<160> 3
<210> 1
<211> 9
<212> cDNA
<213> 大豆(Glycine max?(L.) Merr)
<221>大豆高效启动子盐诱导功能元件GmBM1
<222>(1)…(9)
<400>1
cctccaccc 9
<210> 2
<211> 272
<212> DNA
<213> 人工序列
<221> 含有盐诱导功能元件与拟南芥TUB2启动子的融合序列pGmBM1
<222>(1)…(272)
<400> 2
gtcgacacat gtgctcttcc aattttcatt ttcagcaacc cttcatgaat gggcccaaag 60
cctgccacaa acatgtgcac aatattacaa actctaaaaa caaaaacaaa ataaaacatt 120
cttttttccc aatttgtatt ttaatatcaa tttgaatcaa actcatagtt ttaaaactca 180
attttgtaat cgaaaacaat tttttttttt ttttttaagg aaacttacac agtagagaaa 240
gaaacggacc attttaacct ccacccctgc ag 272
<210> 3
<211> 4127
<212> DNA
<213> 人工序列
<221> 含有pGmBM1的植物双荧光报告载体pGmBM1-pGreen II-0800LUC
<222>(1)…(4127)
<400>
agatcttggc aggatatatt gtggtgtaac gttatcgtac ccctactcca aaaatgtcaa 60
agatacagtc tcagaagacc aaagggctat tgagactttt caacaaaggg taatttcggg 120
aaacctcctc ggattccatt gcccagctat ctgtcacttc atcgaaagga cagtagaaaa 180
ggaaggtggc tcctacaaat gccatcattg cgataaagga aaggctatca ttcaagatgc 240
ctctgccgac agtggtccca aagatggacc cccacccacg aggagcatcg tggaaaaaga 300
agacgttcca accacgtctt caaagcaagt ggattgatgt gacatctcca ctgacgtaag 360
ggatgacgca caatcccact atccttcgca agacccttcc tctatataag gaagttcatt 420
tcatttggag aggacagccc accaccatga cttcgaaagt ttatgatcca gaacaaagga 480
aacggatgat aactggtccg cagtggtggg ccagatgtaa acaaatgaat gttcttgatt 540
catttattaa ttattatgat tcagaaaaac atgcagaaaa tgctgttatt tttttacatg 600
gtaacgcggc ctcttcttat ttatggcgac atgttgtgcc acatattgag ccagtagcgc 660
ggtgtattat accagacctt attggtatgg gcaaatcagg caaatctggt aatggttctt 720
ataggttact tgatcattac aaatatctta ctgcatggtt tgaacttctt aatttaccaa 780
agaagatcat ttttgtcggc catgattggg gtgcttgttt ggcatttcat tatagctatg 840
agcatcaaga taagatcaaa gcaatagttc acgctgaaag tgtagtagat gtgattgaat 900
catgggatga atggcctgat attgaagaag atattgcgtt gatcaaatct gaagaaggag 960
aaaaaatggt tttggagaat aacttcttcg tggaaaccat gttgccatca aaaatcatga 1020
gaaagttaga accagaagaa tttgcagcat atcttgaacc attcaaagag aaaggtgaag 1080
ttcgtcgtcc aacattatca tggcctcgtg aaatcccgtt agtaaaaggt ggtaaacctg 1140
acgttgtaca aattgttagg aattataatg cttatctacg tgcaagtgat gatttaccaa 1200
aaatgtttat tgaatcggac ccaggattct tttccaatgc tattgttgaa ggtgccaaga 1260
agtttcctaa tactgaattt gtcaaagtaa aaggtcttca tttttcgcaa gaagatgcac 1320
ctgatgaaat gggaaaatat atcaaatcgt tcgttgagcg agttctcaaa aatgaacaat 1380
aattctagcc ggtacgctga aatcaccagt ctctctctac aaatctatct ctctctattt 1440
tctccataaa taatgtgtga gtagtttccc gataagggaa attagggttc ttatagggtt 1500
tcgctcatgt gttgagcata taagaaaccc ttagtatgta tttgtatttg taaaatactt 1560
ctatcaataa aatttctaat tcctaaaacc aaaatccagt actaaaatcc agatcgataa 1620
cattaacgtt tacaatttcc attcgccatt caggctgcgc aactgttggg aagggcgatc 1680
ggtgcgggcc tcttcgctat tacgccagct ggcgaaaggg ggatgtgctg caaggcgatt 1740
aagttgggta acgccagggt tttcccagtc acgacgttgt aaaacgacgg ccagtgaatt 1800
gtaatacgac tcactatagg gcgaattggg taccgggccc cccctcgagg tcgacacatg 1860
tgctcttcca attttcattt tcagcaaccc ttcatgaatg ggcccaaagc ctgccacaaa 1920
catgtgcaca atattacaaa ctctaaaaac aaaaacaaaa taaaacattc ttttttccca 1980
atttgtattt taatatcaat ttgaatcaaa ctcatagttt taaaactcaa ttttgtaatc 2040
gaaaacaatt tttttttttt tttttaagga aacttacaca gtagagaaag aaacggacca 2100
ttttaacctc cacccctgca gcccggggga tccactagtt ctagagcggc cgccaccgcg 2160
gtggagatcg aattcccatg gaagacgcca aaaacataaa gaaaggcccg gcgccattct 2220
atccgctgga agatggaacc gctggagagc aactgcataa ggctatgaag agatacgccc 2280
tggttcctgg aacaattgct tttacagatg cacatatcga ggtggacatc acttacgctg 2340
agtacttcga aatgtccgtt cggttggcag aagctatgaa acgatatggg ctgaatacaa 2400
atcacagaat cgtcgtatgc agtgaaaact ctcttcaatt ctttatgccg gtgttgggcg 2460
cgttatttat cggagttgca gttgcgcccg cgaacgacat ttataatgaa cgtgaattgc 2520
tcaacagtat gggcatttcg cagcctaccg tggtgttcgt ttccaaaaag gggttgcaaa 2580
aaattttgaa cgtgcaaaaa aagctcccaa tcatccaaaa aattattatc atggattcta 2640
aaacggatta ccagggattt cagtcgatgt acacgttcgt cacatctcat ctacctcccg 2700
gttttaatga atacgatttt gtgccagagt ccttcgatag ggacaagaca attgcactga 2760
tcatgaactc ctctggatct actggtctgc ctaaaggtgt cgctctgcct catagaactg 2820
cctgcgtgag attctcgcat gccagagatc ctatttttgg caatcaaatc attccggata 2880
ctgcgatttt aagtgttgtt ccattccatc acggttttgg aatgtttact acactcggat 2940
atttgatatg tggatttcga gtcgtcttaa tgtatagatt tgaagaagag ctgtttctga 3000
ggagccttca ggattacaag attcaaagtg cgctgctggt gccaacccta ttctccttct 3060
tcgccaaaag cactctgatt gacaaatacg atttatctaa tttacacgaa attgcttctg 3120
gtggcgctcc cctctctaag gaagtcgggg aagcggttgc caagaggttc catctgccag 3180
gtatcaggca aggatatggg ctcactgaga ctacatcagc tattctgatt acacccgagg 3240
gggatgataa accgggcgcg gtcggtaaag ttgttccatt ttttgaagcg aaggttgtgg 3300
atctggatac cgggaaaacg ctgggcgtta atcaaagagg cgaactgtgt gtgagaggtc 3360
ctatgattat gtccggttat gtaaacaatc cggaagcgac caacgccttg attgacaagg 3420
atggatggct acattctgga gacatagctt actgggacga agacgaacac ttcttcatcg 3480
ttgaccgcct gaagtctctg attaagtaca aaggctatca ggtggctccc gctgaattgg 3540
aatccatctt gctccaacac cccaacatct tcgacgcagg tgtcgcaggt cttcccgacg 3600
atgacgccgg tgaacttccc gccgccgttg ttgttttgga gcacggaaag acgatgacgg 3660
aaaaagagat cgtggattac gtcgccagtc aagtaacaac cgcgaaaaag ttgcgcggag 3720
gagttgtgtt tgtggacgaa gtaccgaaag gtcttaccgg aaaactcgac gcaagaaaaa 3780
tcagagagat cctcataaag gccaagaagg gcggaaagat cgccgtgtaa ttctagagaa 3840
ttcgctgaaa tcaccagtct ctctctacaa atctatctct ctctattttc tccataaata 3900
atgtgtgagt agtttcccga taagggaaat tagggttctt atagggtttc gctcatgtgt 3960
tgagcatata agaaaccctt agtatgtatt tgtatttgta aaatacttct atcaataaaa 4020
tttctaattc ctaaaaccaa aatccagtac taaaatccag atccactagc cttgacagga 4080
tatattggcg ggtaaactaa gtcgctgtat gtgtttgttt gagatct 4127
- 还没有人留言评论。精彩留言会获得点赞!
- 大豆低温诱导型启动子、包含该启动子的重组表达载体及应用的制作方法与工艺
- 受植物激素调控的启动子及其应用的制作方法与工艺
- 一种受盐诱导的特异性诱导型启动子DNA序列及应用的制作方法与工艺
- 受维甲酸调控的具有浓度依赖效应的重组启动子及其使用的制作方法与工艺
- 一种磷酸盐诱导启动子降低黑曲霉β‑葡萄糖苷酶表达酶活的方法与流程
- 一种疫霉诱导性人工合成启动子PMP1及其重组表达载体和应用的制作方法与工艺
- 一种植物盐/干旱诱导型启动子soyEQ及其应用的制作方法与工艺
- 新型的L-苏氨酸-诱导型启动子及其应用的制作方法与工艺
- 一种植物茉莉酸甲酯诱导表达启动子PosMeJ1及其应用的制作方法与工艺
- 一个逆境诱导启动子SlWRKY31P的克隆及应用的制造方法与工艺