一种固定化漆酶载体的制备方法和降解微量有机污染物的方法与流程
本发明属于固定化酶技术领域,具体涉及一种固定化漆酶载体的制备方法和降解微量有机污染物的方法。
背景技术:
微量有机污染物具有浓度低、毒性大的特点,其化学性质稳定,能持久存在于自然环境中,脂溶性强、极易被机体吸收,但不易被机体降解。相关研究显示种类繁多的有机污染物的致突变性和致癌性之间存在一定的相关性。据相关文献报道,在各种环境样品如地表水、地下水、污泥沉积物甚至在饮用水中微量有机污染物都能被检测出来,其浓度从ng/L到μg/L不等。因此,如何有效地降解环境中的微量有机污染物近年来受到了极大关注。与采用膜技术、反渗透技术、高级氧化技术和电化学技术等处理微量有机污染物的技术相比,采用酶处理降解微量有机污染物被认为是目前最有前景的技术,它的反应条件温和,具有较高反应特异性和速率,与大多数化学催化过程相比,酶处理消耗的能量较少,成本低廉。
漆酶(Laccase EC 1.10.3.2)是一种含铜多酚氧化酶,其作用主要是催化氧化还原反应。漆酶主要分为:真菌漆酶与细菌漆酶。大多数漆酶有4有个铜离子,共同构成漆酶的活性中心,在催化反应中起关键作用。这四个铜离子结合在蛋白内高度保守区域,根据其电子顺磁共振和光谱特征可分为以下三类:1个Ⅰ型铜离子,1个Ⅱ型铜离子和2个Ⅲ型铜离子。漆酶对底物的催化主要通过四个铜离子的协同作用完成。大量研究表明,Ⅰ型铜离子是漆酶催化氧化底物、接受底物电子的“入口”,而Ⅱ型和Ⅲ型铜离子构成的三核铜离子簇则是氧气还原为水的位置。电子在漆酶分子内是由Ⅰ型铜离子向三核铜离子族传递。漆酶能将分子氧直接还原为水,在没有过氧化氢和其它次级代谢产物存在下,可催化大量的酚类和芳香胺类化合物的氧化降解,是一种环境友好型的酶,在废水处理、造纸工业、环境保护等方面具有重要应用价值。
游离的漆酶在使用过程中易随环境的变化而变性失活,储存稳定性低,易掺入杂质分离回收困难,这些都进一步限制了漆酶的推广和应用。固定化酶技术是近十几年发展起来的酶应用技术,固定化酶在保持其高效专一性及温和的酶催化反应特性的同时,又克服了酶的不足之处,故对漆酶进行固定化是改善游离态漆酶的稳定性和实现循环利用的有效方法。目前酶固定化载体的材料主要为壳聚糖、硅胶、活性炭、高分子滤膜和电纺纤维等,但现有的酶固定化载体不同程度存在酶结合率低、分离效果差、重复使用率低、制备工艺复杂和成本较高等问题。
技术实现要素:
有鉴于此,本发明的目的在于提供一种固定化漆酶载体的制备方法,其制备工艺简单,而且由此得到的固定化漆酶活性稳定、重复使用率高,可有效应用于降解环境中的微量有机污染物。
本发明的技术方案如下:
本发明提供了一种固定化漆酶载体的制备方法,包括以下步骤:
a)将二氧化硅置于3-氨丙基三乙氧基硅烷溶液中,反应,得到3-氨丙基三乙氧基硅烷表面修饰的二氧化硅;
b)将步骤a)中得到的3-氨丙基三乙氧基硅烷表面修饰的二氧化硅置于交联剂中进行交联反应,得到所述固定化漆酶载体。
优选的,步骤b)中所述交联剂为戊二醛、顺丁烯二酸酐或碳化二亚胺。
更优选的,所述戊二醛为戊二醛和磷酸钾缓冲液的混合溶液;
所述混合溶液中戊二醛的体积百分比浓度为2.5%~10%;
更优选的,所述交联反应的时间为1h~6h,所述交联反应的温度为25℃-40℃。
优选的,步骤a)中所述3-氨丙基三乙氧基硅烷溶液为3-氨丙基三乙氧基硅烷的丙酮溶液;
所述3-氨丙基三乙氧基硅烷溶液中3-氨丙基三乙氧基硅烷的体积百分比浓度为2%~10%。
优选的,步骤a)中所述二氧化硅为二氧化硅小球;
所述二氧化硅小球的直径为1~2cm。
本发明还提供了一种固定化漆酶的制备方法,将上述制备方法得到的固定化漆酶载体和漆酶溶液混合,得到所述固定化漆酶。
优选的,所述漆酶的活度为1.5~3.0U/mL。
优选的,所述混合在摇床上进行,其转速为90rpm~120rpm;
所述混合的时间为24h~48h。
本发明还提供了一种降解微量有机污染物的方法,将前述制备方法得到的固定化漆酶和含微量有机污染物的样品混合,降解微量有机污染物。
优选的,所述降解的温度为30~80℃,pH为2~8;
所述降解的时间为4h~10h。
综上所述,本发明提供了一种固定化漆酶载体的制备方法,其制备工艺简单,成本低廉,得到的固定化漆酶载体与酶的结合率高,不仅维持了漆酶自身的反应活性,还改善了漆酶的稳定性和实现了漆酶循环使用的目的。本发明还提供了一种固定化漆酶的制备方法,通过将前述固定化漆酶载体和漆酶混合固定得到,制备过程简单,得到的固定化漆酶具有活性稳定、可长期保存、易于分离回收和可循环使用等优点;将其应用于降解环境样品中的微量有机污染物时,其降解效率高达92%,降解时间短,而且降解产物无二次污染,绿色环保。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
图1为实施例3中固定化漆酶对2,2-双(4-羟基苯基)丙烷的降解率和漆酶活性的影响;
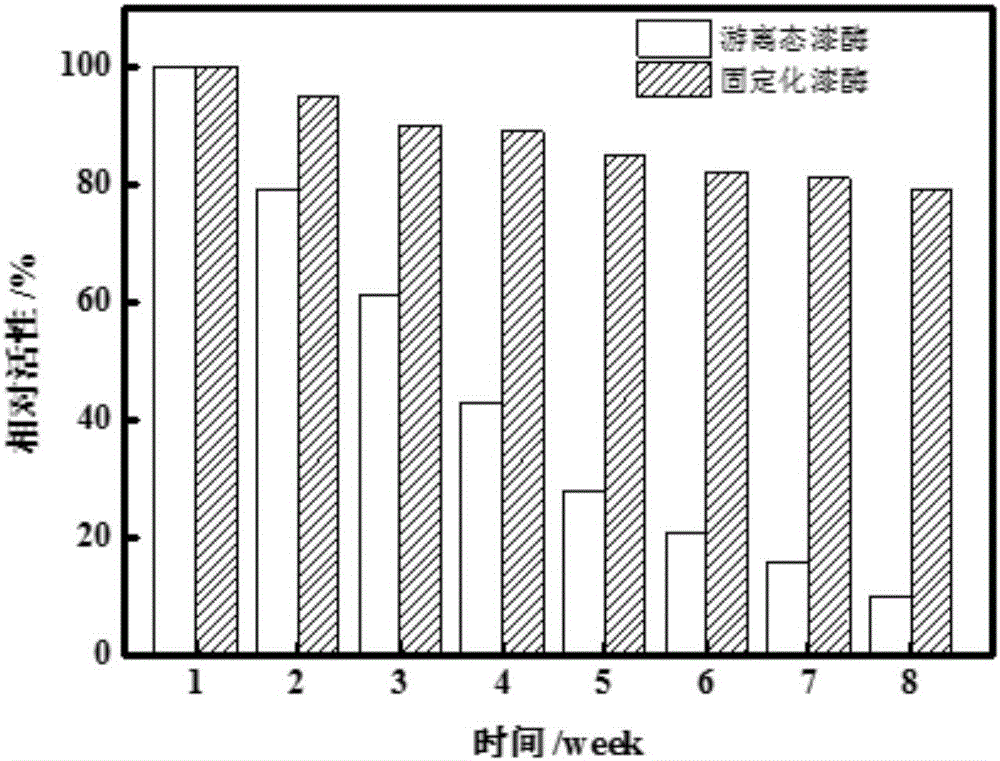
图2为实施例4中固定化漆酶的储存稳定性考察结果。
具体实施方式
下面将结合本发明具体实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例只是本发明一部分实施例,而不是全部的实施例。本领域技术人员应当理解,对本发明的具体实施例进行修改或者对部分技术特征进行同等替换,而不脱离本发明技术方案的精神,均应涵盖在本发明保护的范围中。
实施例1固定化漆酶的制备
1)取均匀分布有蜂窝状微孔的市售矿石SiO2,磨制成多个质量约为0.5g、直径约为1.1cm的SiO2小球(比表面积为1.7005m2/g);接着,采用去离子水洗涤SiO2小球,并将其置于电热鼓风干燥箱中以45℃条件干燥24h,待用。
2)将步骤1)中经干燥后的SiO2小球浸没于12.5mL浓度为6vol%的3-氨丙基三乙氧基硅烷溶液(APTES)中进行表面修饰24h,然后用去离子水冲洗4次以清洗停留在载体表面的有机相,再置于45℃温度条件下干燥24h。
3)将步骤2)中经表面修饰后的SiO2小球浸没于12.5mL浓度为7.5vol%的戊二醛溶液中,并置于轨道式摇床上30℃、90rpm交联2h,然后用50mL去离子水清洗数次,再在45℃条件下干燥48h,得到固定化漆酶载体。
4)将步骤3)中得到的固定化漆酶载体置于5mL活度为2U/mL的漆酶溶液中,置于轨道摇床上以30℃、100rpm振荡24h,使得漆酶能均匀地固定在载体上,得到固定化漆酶。
对步骤4)中得到的固定化漆酶进行酶活性测试,以2'-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)为底物,然后通过紫外可见分光光度计测定ABTS在420nm(εmax=3.6×104M-1cm-1)处的吸光度的变化来测定酶对其的氧化速度。具体过程为:在室温下,将步骤(4)中得到的固定化漆酶和3mL的0.001mol/LABTS(pH=4.5)溶液混匀,置于轨道式摇床以120rpm摇匀,5min后收集溶液立即采用紫外分光光度计测量其吸光度,得到固定化漆酶的活性。
实施例2考察APTES、戊二醛对SiO2小球与漆酶固定化结合率的影响
1)配制体积百分比浓度分别为2%、4%、6%、8%和10%的APTES溶液。
2)配制体积百分比浓度分别为2.5%、5.0%、7.5%和10.0%的戊二醛溶液。
3)将实施例1步骤1)中经干燥后的SiO2小球分别浸没于步骤1)配制的5种APTES溶液中,然后按照实施例1中的步骤2)至步骤4)所述过程制备固定化漆酶,接着采用紫外可见分光光度计测定595nm处的吸光度,根据吸光度的变化来测定固定化漆酶载体上的蛋白质含量,从而计算漆酶和载体的结合率,结果如表1所示,表明采用浓度为6vol%的APTES溶液得到的固定化漆酶载体的结合率最高。
4)将实施例1步骤1)中经干燥后的SiO2小球分别浸没于步骤2)配制的5种戊二醛溶液中,然后按照实施例1中的步骤2)和步骤4)所述过程制备固定化漆酶,接着采用紫外可见分光光度计测定595nm处的吸光度,根据吸光度的变化来测定固定化漆酶载体上的蛋白质含量,从而计算漆酶和载体的结合率,结果如表2所示,表明采用浓度为7.5vol%的戊二醛溶液得到的固定化漆酶载体的结合率最高。
表1
表2
实施例3固定化漆酶对BPA的降解率及漆酶活性的影响
以活度为2U/mL的游离态漆酶作为对照,考察实施例1中得到的固定化漆酶对2,2-双(4-羟基苯基)丙烷(BPA)的降解效率以及漆酶活性的影响。在50℃下,将固定化漆酶和BPA溶于柠檬酸盐缓冲液(0.05mol/L,pH4.5)中,BPA的终浓度为100mg/L。然后,每隔1h取样并采用高效液相分析待测溶液中BPA的浓度变化。结果显示,1h后,固定化漆酶对BPA的降解率达71%,游离态漆酶对BPA的降解率为61%,固定化漆酶的活性为初始活性的78%,而游离态漆酶仅为初始活性的40%。6h后,BPA的降解率已达92%,此时固定化漆酶的活性为53%,仍能维持相对较高的活性;而游离态漆酶的活性仅有16%,BPA的降解效率也只达85%。结果如图1所示,与游离态漆酶相比,固定化漆酶在酶活、稳定性与降解BPA效率上都有显著的提升,因此本发明制备的固定化漆酶可通过重复使用与提高降解效率达到降低处理成本的要求。
实施例4
将实施例1中的固定化漆酶保存于磷酸钾缓冲液(0.5mol/L,pH=7.0)中,于4℃冰箱保存,每隔一周,测试漆酶的活性。测定结果如图2所示,第3周的固定化漆酶相对活性为90%,高出游离态漆酶29%;第7、8周的游离态漆酶相对活性分别为15%、9%,固定化漆酶的相对活性为81%、79%,表明固定化漆酶储存稳定性相较于游离态漆酶有大幅度的提升。
- 还没有人留言评论。精彩留言会获得点赞!