一种截短的重组褐藻胶裂解酶rAly1‑T185N及其编码基因与应用的制作方法
本发明涉及一种截短的重组褐藻胶裂解酶rAly1-T185N及其编码基因与应用,属于基因工程技术和蛋白质表达技术领域。
背景技术:
褐藻胶是由甘露糖醛酸(Mannuronate,M)及其C-5差像异构体古罗糖醛酸(Guluronate,G)通过糖苷键链接而成线性酸性多糖,分子内存在均一的聚M段、聚G段,以及杂合的MG或GM段。褐藻胶广泛存在于海带、马尾藻等药、食两用大型海洋褐藻的细胞壁和细胞间基质中。目前,日用化工、食品和医药领域应用的主体是海藻来源的褐藻胶。糖生物学的深入研究发现,褐藻胶寡糖具有重要生物学活性。例如,褐藻胶寡糖具有动态调节抗炎/促炎与抗氧化/促氧化、抑制α-葡萄糖苷酶活性等重要功能。聚M段褐藻胶寡糖具有成为抗阿尔兹海默综合症药物的潜力。综上,具有特定M/G比例和聚合度的褐藻胶寡糖具有重要应用价值和经济价值,实现这类寡糖的高效制备具有重要意义。
褐藻胶裂解酶通过β-消去机制催化糖苷键的断裂,产生非还原性末端含不饱和共轭结构且在235nm附近具有特征吸收的系列寡糖产物。与化学或物理学降解方法相比,褐藻胶的酶法降解具有条件温和、易控制、环境污染小等优势特征,因而具有推广应用的潜质。通常内切酶可随机、高效降解多糖,生成聚合度不同的系列不饱和寡糖;外切酶可有序降解底物,专一性生成基本糖单元,供生物体吸收利用。由于褐藻胶是由M、G两种糖单元组成的,因此根据酶对底物的选择性以及酶的底物降解模式,通常可将褐藻胶裂解酶分为M-专一性内切酶、M-专一性外切酶、G-专一性内切酶、G-专一性外切酶、以及M/G-兼性内切酶、M/G-兼性外切酶等六大类。
褐藻胶裂解酶主要来源于海螺的消化系统、海藻降解菌或病毒等。目前,关于褐藻胶裂解酶的专利申请和科研文献虽然数量较多,但主要集中于产酶菌株和酶的资源发掘等初级研究;酶的专一性分析多以纯度有限的聚M段、聚G段为测试底物,而关于酶的寡糖产物的结构特征分析缺少寡糖终产物的核磁共振波谱数据,关于寡糖生成特性即相应底物降解机制(如最小底物、最小产物、最小产物在底物中的生成位置以及酶的底物倾向性等)的阐释相对较少;分子酶学研究以基因克隆与异源表达、重组酶的纯化与功能鉴定为主,关于活性位点突变、功能模块截短等分子改造的研究较少。关于分子酶学改造与褐藻胶降解模式之间关系的规律性认知更少。综上,褐藻胶裂解酶的传统研究基础薄弱、深度不足,这导致与β-琼胶酶、纤维素酶等同类产品相比,少见商品化褐藻胶裂解酶的广泛应用,严重制约了寡糖酶法制备技术的发展。
通常,褐藻胶裂解酶由一个催化模块结构域和一个或多个非催化区组成。催化结构域决定酶对褐藻胶底物的识别、结合与降解,从而决定该酶的生化特性;非催化区虽然不能降解褐藻胶,但对酶的催化性能可产生多方面的影响。最近,关于内切型褐藻胶裂解酶Aly2(来自Agarivorans sp.strain L11,兼性)和Aly5(也即AlgL-5,来自Flammeovirga sp.strain MY04,G专一性,专利文献CN104293754A,申请号201410469861.4)的研究表明,非催化区的存在可以帮助催化结构域更加有效地结合、降解小分子量的寡糖底物。然而差别在于,截短兼性的Aly2后,可有效地相对提高酶对聚M片段底物的倾向;但对G专一性的Aly5进行同样截短操作后,未见这种底物倾向性的显著变化。那么,为什么非催化区只能对这种兼性的褐藻胶裂解酶产生底物倾向性的影响,而对专一性的褐藻胶裂解酶基本没有影响?对于兼性的褐藻胶裂解酶,非催化区域又是如何影响催化区域进而改变底物倾向性的呢?目前,仅见相关实验现象的报道,未见详细机制的探讨。
技术实现要素:
本发明针对现有技术的不足,提供一种截短的重组褐藻胶裂解酶rAly1-T185N及其编码基因与应用。该截短的褐藻胶裂解酶Aly1-T185N(后文简称T185N)对原有的Aly-1(申请号201610838337.9)进行了分子改造,根据蛋白质分子内的非催化区域对催化区域功能的影响及特征,分析了相关的内在机制。
本发明的技术方案如下:
一种截短的重组褐藻胶裂解酶rT185N,将全长重组褐藻胶裂解酶Aly-1的N端截掉185个非催化氨基酸残基,构建得到T185N截短酶。
上述截短的重组褐藻胶裂解酶rT185N,氨基酸序列如SEQ ID NO.2所示。
上述一种截短的重组褐藻胶裂解酶rT185N与全长蛋白rAly-1相比较,经异源表达,酶的产量提高,酶活增强,实现了增产、节能、提高经济效益的目的。相比之下,截短体rT185N的最适温度、pH和金属离子、化学试剂的影响等基本酶学基本性质无显著差异。但是,截短体rT185N所能降解寡糖底物的降解率、最适底物的M/G比例,以及底物切割模式等酶学特性出现了显著改变。与全长蛋白rAly-1相比:(1)截短后的重组酶rT185N既能降解来自褐藻胶的古罗糖醛酸寡糖片段,也能降甘露糖醛酸寡糖片段,仍然是兼性的褐藻胶裂解酶;(2)重组酶rT185N降解褐藻胶后仍然最终产生以不饱和二糖、不饱和三糖为主产物的系列寡糖产物,其摩尔比仍然接近1:1,其中:不饱和二糖终产物中几乎全部都是ΔG,不饱和三糖产物含有ΔG、ΔM等两种非还原性末端,且二者摩尔比接近5:8,表明含ΔM末端的三糖产物的含量提高了约17%;(3)重组酶rT185N降解大于三糖的系列不饱和寡糖、大于四糖的系列M寡糖或G寡糖时,采用经典的内切酶模式,其最小产物是二糖片段;(4)在降解M四糖或G四糖时,生成不饱和三糖产物,且伴生单糖产物。(5)在降解饱和M五糖或G五塘,rT185N可以从还原性末端或非还原性末端分别生成二糖产物,且最终主产物都是不饱和三糖产物。二者的显著区别在于,截短后的rT185N对不饱和四糖片段、饱和M四糖、饱和M五糖,以及荧光标记的饱和型聚M五糖(2AB-M5)、饱和型聚G四糖(2AB-G4)的降解率显著提高,但未见对饱和G四糖、饱和G五糖及更大寡糖底物的显著变化。特别值得注意的是,过量的全长酶rAly-1与荧光标记后的G四糖(2AB-G4)反应前后未产生变化,但rT185N可完全降解荧光标记的G四糖(2AB-G4)生成等摩尔量的2AB-UG3,并伴生饱和单糖。
一种截短的重组褐藻胶裂解酶rT185N的编码基因,核苷酸序列如SEQ ID NO.1所示。
上述截短的重组褐藻胶裂解酶rT185N的编码基因,全长共780bp,所编码蛋白质含有259个氨基酸,分子量约为30.0kD。
一种重组载体,在载体中插入了上述截短的重组褐藻胶裂解酶rT185N的编码基因。
上述载体选自大肠杆菌表达载体、酵母表达载体、枯草杆菌表达载体、乳酸菌表达载体、链霉菌表达载体、噬菌体载体、丝状真菌表达载体、植物表达载体、昆虫表达载体、或哺乳动物细胞表达载体。
一种重组菌或转基因细胞系,在宿主细胞或细胞系中转入了上述重组载体。
上述宿主细胞或细胞系选自大肠杆菌宿主细胞、酵母菌宿主细胞、枯草杆菌宿主细胞、乳酸菌宿主细胞、放线菌宿主细胞、丝状真菌宿主细胞、昆虫细胞或哺乳动物细胞。
用于重组表达截短的褐藻胶裂解酶rT185N的重组菌或转基因细胞系,可以是大肠杆菌宿主细胞(如Escherichia coli BL21、Escherichia coli JM109、Escherichia coli DH5α等)、酵母菌宿主细胞(如Saccharomyces cerevisiae、Pichia pastoris、Kluyveromyces Iactis等)、枯草杆菌宿主细胞(如Bacillus subtilis R25、Bacillus subtilis 9920等)、乳酸菌宿主细胞(如Lactic acid bacteria C0CC101等)、放线菌宿主细胞(如Streptomyces spp.等)、丝状真菌宿主细胞(如Trichoderma viride,Trichoderma reesei,Aspergillus niger、Aspergillus nidulans等)、昆虫细胞(如Bombyxmori,Antharaea eucalypti等)或哺乳动物细胞(如中国仓鼠卵巢细胞CHO,幼小仓鼠肾脏细胞BHK、中国仓鼠肺细胞CHL等)。
上述截短的重组褐藻胶裂解酶rT185N的编码基因、重组载体、重组菌或转基因细胞系在制备截短的重组褐藻胶裂解酶rT185N中的应用。
上述截短的重组褐藻胶裂解酶rT185N在降解褐藻胶、降解褐藻胶寡糖或制备不饱和寡糖中的应用。
有益效果
1、本发明通过利用PCR技术对全长褐藻胶裂解酶Aly-1的N端截掉185个氨基酸残基,获得了rT185N截短酶;rT185N的表达量可达1259±2.2mg/L发酵液,比酶活可达2895±10.3U/mg,比全长蛋白rAly-1的表达量调高了近2.6倍,实现了增产、节能、提高经济效益的目的。并且rT185N可通过镍柱分离实现该融合蛋白的一步纯化。
2、本发明所述的截短的重组褐藻胶裂解酶rT185N既能降解来自褐藻胶的古罗糖醛酸片段,也能降甘露糖醛酸片段,仍然是兼性的褐藻胶裂解酶;rT185N彻底降解褐藻胶后的主产物是等摩尔量的不饱和二糖与不饱和三糖,其中不饱和二糖产物均是ΔG,而不饱和三糖产物含有ΔG、ΔM等两种非还原性末端,且二者摩尔比接近5:8,表明含ΔM末端的三糖产物的含量提高了约17%;rT185N对不饱和四糖片段、饱和M四糖、饱和M五糖,以及荧光标记的饱和型聚M五糖(2AB-M5)、饱和型聚G四糖(2AB-G4)的降解率显著提高;
附图说明
图1、截短的重组褐藻胶裂解酶rT185N功能模块构成的BLASTp分析结果;
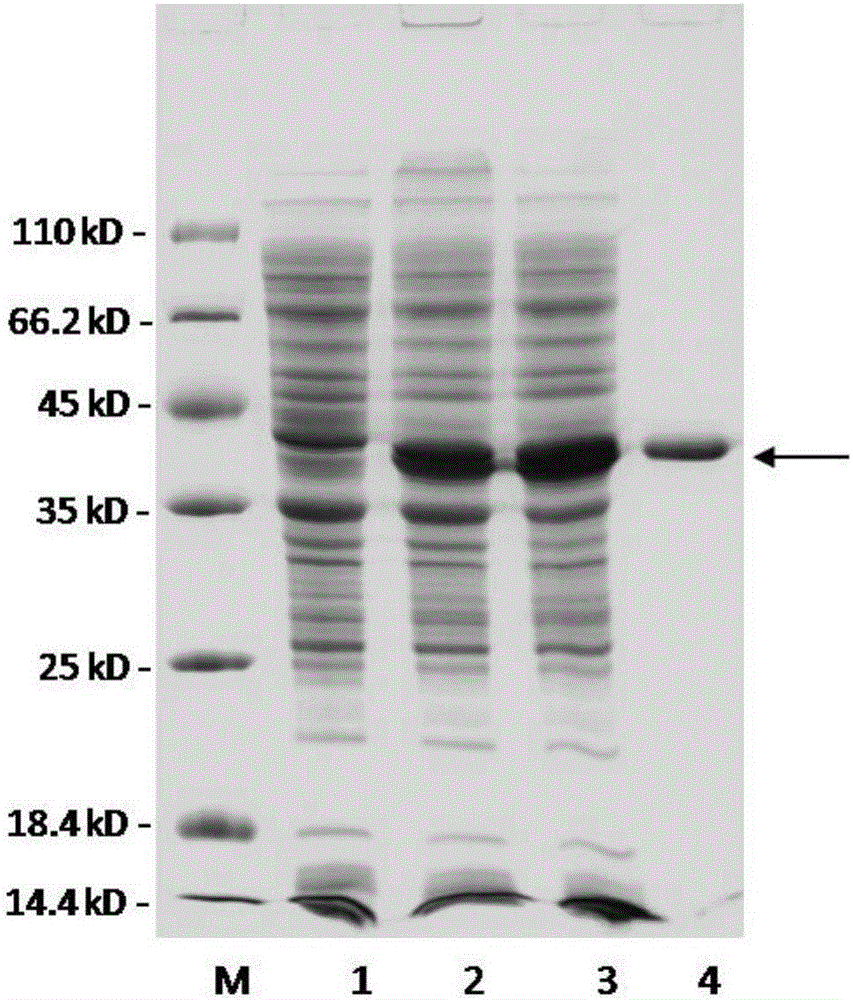
图2、截短的重组褐藻胶裂解酶rT185N表达及纯化情况的聚丙烯酰胺凝胶电泳图(SDS-PAGE);
图中:M、蛋白质分子量标准,条带自上至下大小为:116kD,66.2kD,45kD,35kD,25kD,18.4kD,14.4kD;泳道1、对照菌株破壁前菌体,上样量5μL;泳道2、重组菌破壁前菌体,上样量5μL;泳道3、重组菌破壁后上清,上样量5μL;泳道4、经镍柱纯化的rT185N,上样量5μL;
图3、温度对截短的重组褐藻胶裂解酶rT185N活性的影响曲线;
图4、pH值对截短的重组褐藻胶裂解酶rT185N活性的影响曲线;
图5、温度对截短的重组褐藻胶裂解酶rT185N稳定性的影响曲线;
图6、pH值对截短的重组褐藻胶裂解酶rT185N稳定性的影响曲线;
图7、金属离子及化学试剂对截短的重组褐藻胶裂解酶rT185N活性的影响柱状图;
图8、用重组褐藻胶裂解酶rAly-1和截短的重组褐藻胶裂解酶rT185N彻底降解褐藻胶后寡糖产物的分子凝胶色谱-HPLC分析比较图;
图中:(1)UDP2,不饱和二糖;(2)UDP3,不饱和三糖;(3)UDP4,不饱和四糖;
图9、用截短的重组褐藻胶裂解酶rT185N彻底降解褐藻胶后所制备的不饱和寡糖片段UDP2、UDP3的HPLC分析图;
图10-1、用截短的重组褐藻胶裂解酶rT185N彻底降解褐藻胶所制备不饱和寡糖片段UDP2的1H-NMR图;
图10-2、用截短的重组褐藻胶裂解酶rT185N彻底降解褐藻胶所制备不饱和寡糖片段UDP3的1H-NMR图;
图11、自重组褐藻胶裂解酶rAlgL-5不完全降解褐藻胶的产物中分离所得UDP2-UDP6HPLC分析图;
图12、用重组褐藻胶裂解酶rAly-1和截短的重组褐藻胶裂解酶rT185N彻底降解用rAlgL-5所制备寡糖UDP2-UDP6的HPLC分析比较图;
图13、用重组褐藻胶裂解酶rAly-1和截短的重组褐藻胶裂解酶rT185N彻底降解饱和聚M系列寡糖(M3-5)的HPLC分析比较图(紫外);
图14、用重组褐藻胶裂解酶rAly-1和截短的重组褐藻胶裂解酶rT185N彻底降解饱和聚G系列寡糖(G3-5)的HPLC分析比较图(紫外);
图15、用重组褐藻胶裂解酶rAly-1和截短的重组褐藻胶裂解酶rT185N彻底降解还原性末端被2-AB标记的饱和聚M系列寡糖(M3、M4、M5)的HPLC分析比较图(荧光);
图16、用重组褐藻胶裂解酶rAly-1和截短的重组褐藻胶裂解酶rT185N彻底降解还原性末端被2-AB标记的饱和聚G系列寡糖(G3、G4、G5)的HPLC分析比较图(荧光);
图17、用截短的重组褐藻胶裂解酶rT185N降解还原性末端被2-AB标记的饱和聚G四糖(G4)过程的HPLC分析图(荧光);
图18、用截短的重组褐藻胶裂解酶rT185N降解还原性末端被2-AB标记的饱和聚G五糖(G5)过程的HPLC分析图(荧光);
具体实施方式
以下实施例的阐述,是为了全面公开本发明如何实施的一些常用技术,而不是为了限制本发明的应用范围。发明人已经尽最大努力确保实施例中个参数的准确性(例如量,温度,等等),但是一些实验误差和偏差也应该予以考虑。除非另有说明,本发明中分子量是指重均分子量,温度是摄氏度。
下述实施例中,如无特殊说明,均为常规方法。
生物材料来源
火色杆菌(Flammeovirga yaeyamensis)MY04购自于中国微生物菌种保藏管理委员会普通微生物中心,地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏日期2008年11月27日,保藏编号CGMCC NO.2777。
实施例1、火色杆菌(Flammeovirga yaeyamensis)MY04菌株基因组DNA的提取
将火色杆菌(Flammeovirga yaeyamensis)MY04接种至液体培养基YT04中,在28℃、200rpm的条件下,振荡培养至600nm吸光值(OD600)为1.2;取培养菌液10mL,在12,000×g(g,地球引力常数)条件下离心15min,收集菌体沉淀;用10mL的溶菌酶缓冲液(10mM Tris-HCl,pH 8.0)悬浮菌体,在12,000rmp条件下离心15min,收集菌体沉淀。
上述液体培养基YT04,每升组分如下:
胰蛋白胨10g、酵母提取物5.0g、氯化钠30g,用水溶解并定容至1L,pH 7.2。
向上述菌体沉淀中,每管加入溶菌酶缓冲液(购自上海生工生物工程有限公司)6.0mL,得到约7.0mL的菌液,分别加入浓度为20mg/mL的溶菌酶溶液各280μL,使溶菌酶终浓度为800μg/mL;置于冰水浴中1.0h,然后转移至37℃水浴中,温浴2h,至反应体系粘稠;加入浓度为100mg/mL的十六烷基磺酸钠溶液0.41mL、100mg/mL的蛋白酶K溶液30μL,在52℃温浴1.0h;加入Tris-平衡过的酚/氯仿/异戊醇(体积比25:24:1)溶液7.5mL,轻轻颠倒混匀;在10,000×g、4℃条件下离心10min,收集上清,并加入1.0mL的NaAc-HAc(pH 5.2,3.0M)缓冲液,以及8.5mL的无水乙醇,充分混匀;用枪头挑出丝状DNA,转移至1.5mL的离心管中,以70%乙醇(贮于-20℃),洗涤2次,微离心后弃掉上清;在10,000×g、4℃条件下离心2min,彻底弃掉上清;将DNA沉淀于无菌工作台中风吹干燥,然后用无菌去离子水在4℃过夜溶解DNA样品,制得基因组DNA。
实施例2、火色杆菌(Flammeovirga yaeyamensis)MY04菌株基因组的扫描及其序列分析。
采用焦磷酸测序技术进行实施例1制得的基因组DNA的扫描测序,由上海美吉生物公司完成。用NCBI(National Center for Biotechnology Information,http://www.ncbi.nlm.nih.gov/)网站的在线软件对DNA测序结果进行分析。所用到的NCBI网站的分析软件是Open Reading Frame Finder(ORF Finder,http://www.ncbi.nlm.nih.gov/gorf/gorf.html)和Basic Local Alignment Search Tool(BLAST,http://blast.ncbi.nlm.nih.gov/Blast.cgi)。
用上述生物学软件分析的结果显示,火色杆菌(Flammeovirga yaeyamensis)MY04菌株基因组DNA上携带一个褐藻胶裂解酶的编码基因aly-1,用BLASTp软件在线分析,结果显示,推测Aly-1的蛋白质C-端含有在褐藻胶裂解酶超级家族2中保守的假定催化结构域,利用分子PCR技术截短表达Aly-1蛋白质C-端含有的假定催化结构域,命名为rT185N(如图1所示)。其核苷酸序列如SEQ ID NO.1所示。其氨基酸序列如SEQ ID NO.2所示。用生物学软件BioEdit 7.0.5.3进行分析,显示蛋白质rT185N的理论分子量约为30.0kD。用信号肽在线预测软件SignalP 4.1Server(http://www.cbs.dtu.dk/services/SignalP/)在线分析,该蛋白质无分泌型信号肽。
实施例3、基因aly-1在大肠杆菌BL21(DE3)菌株中的重组表达
以实施例1制得的基因组DNA为模板,进行PCR扩增。引物序列如下:
正向引物Aly1-F:5’-cgcGGATCCAACAATAAAGTAGAGGACGAG-3’(BamH I);
反向引物Aly1-R:5’-ccgCTCGAGTATAAGTTTCTTTTAATTCTATAG-3’(Xho I);
正向引物Aly1-F中下划线标注的是限制性内切酶BamH I位点,反向引物Aly1-R下划线标注的是限制性内切酶Xho I位点。所用高保真DNA聚合酶PrimeSTAR HS DNA Polymerase购自中国大连宝生物公司,所用PCR反应试剂按照该公司提供的产品说明进行操作。
PCR反应条件:95℃预变性4min;94℃变性40s,60℃退火30s,72℃延伸75s,35个循环;72℃延伸10min;4℃稳定10min。
将PCR产物用限制性内切酶BamH I和Xho I进行双酶切,通过琼脂糖凝胶电泳回收酶切后的PCR产物。将购于美国Invitrogen公司的产品pET-30a(+)质粒DNA,用BamH I和Xho I双酶切,进行琼脂糖凝胶电泳并回收酶切后的产物片段。限制性内切酶BamH I和Xho I均购于中国大连宝生物公司,酶切所用到的酶与底物反应的体系、温度和时间,均按照该公司提供的产品说明操作。
将经过BamH I和Xho I双酶切的PCR产物,与同样经过双酶切的pET-30a(+)质粒载体,在DNA连接酶的催化下进行接;连接产物转化大肠杆菌DH5α菌株,涂布于含有50μg/mL卡那霉素的Luria-Bertani培养基固体平板上,37℃培养16h后,挑取单克隆;将单克隆接入含有50μg/mL卡那霉素的液体Luria-Bertani培养基中培养,提取质粒;将质粒用扩增引物进行PCR验证,结果得到大小为1.3kb的扩增产物,初步证明构建的重组质粒正确;接着将该重组质粒进行测序,结果表明,在pET-30a(+)的BamH I和Xho I酶切位点之间插入SEQ ID NO.1所示的基因aly-1,且插入方向正确,所以进一步证明构建的重组质粒正确,将该重组质粒命名为pE30a-Aly1。
将重组质粒pE30a-Aly1转化大肠杆菌菌株BL21(DE3)(购自美国Invitrogen公司),即BL21(DE3)/pE30a-Aly1,得到表达pE30a-Aly1的工程菌。
将质粒pET-30a(+)转化大肠杆菌菌株BL21(DE3),得到空载体对照BL21(DE3)/pET-30a(+)的工程菌。
以下操作将对上面的两种工程菌平行进行。
按照Invitrogen公司提供的操作步骤,使用终浓度为0.05mM异丙基硫代半乳糖苷(IPTG)进行工程菌的诱导表达。在8,000×g、4℃条件下离心15min,收集菌体,并用缓冲液A重悬菌体,冰水浴环境中超声破碎。在15,000×g、4℃条件下进一步离心30min,收集水溶性组分,并用Ni-琼脂糖凝胶对组褐藻胶裂解酶rAly-1进行纯化。用含有咪唑浓度为10、50、100、250、500mM的缓冲液A进行梯度洗脱,纯化条件按照凝胶的产品手册操作。用聚丙烯酰胺凝变性胶电泳检测重组褐藻胶裂解酶rAly-1的纯化情况。将纯化后的重组褐藻胶裂解酶rAly-1样品装入最小分子截留量为10kD的透析袋,在4℃环境中对缓冲液A进行透析。所说缓冲液A的成分是50mM Tris、150mM NaCl,pH 7.9,制得重组褐藻胶裂解酶rAly-1酶液。
实施例4、基因aly1-T185N在大肠杆菌BL21(DE3)菌株中的重组表达
按照实施例1制得的基因组DNA为模板,进行PCR扩增。引物序列如下:
正向引物Aly1-T185N-F:5’-cgcGGATCCTACAAAGAAGACGAAGTGCCAG-3’(BamH I);
反向引物Aly1-T185N-R:5’-ccgCTCGAGTATAAGTTTCTTTTAATTCTATAG-3’(Xho I);
正向引物Aly1-T185N-F中下划线标注的是限制性内切酶BamH I位点,反向引物Aly1-T185N-R下划线标注的是限制性内切酶Xho I位点。所用高保真DNA聚合酶PrimeSTAR HS DNA Polymerase(购自中国大连宝生物公司),所用PCR反应试剂按照产品说明进行操作。
PCR反应条件:95℃预变性4min;95℃变性40s,59℃退火40s,72℃延伸60s,35个循环;72℃延伸10min;4℃稳定10min。
将PCR产物用限制性内切酶BamH I和Xho I进行双酶切,通过琼脂糖凝胶电泳回收酶切后的PCR产物。将购于美国Invitrogen公司的产品pET-30a(+)质粒DNA,用BamH I和Xho I双酶切,进行琼脂糖凝胶电泳并回收酶切后的产物片段。限制性内切酶BamH I和Xho I均购于中国大连宝生物公司,酶切所用到的酶与底物反应的体系、温度和时间,均按照该公司提供的产品说明操作。
将经过BamH I和Xho I双酶切的PCR产物,与同样经过双酶切的pET-30a(+)质粒载体,在DNA连接酶的催化下进行连接;连接产物转化大肠杆菌DH5α菌株,涂布于含有50μg/mL卡那霉素的Luria-Bertani培养基固体平板上,37℃培养16h后,挑取单克隆;将单克隆接入含有50μg/mL卡那霉素的液体Luria-Bertani培养基中培养,提取质粒;将质粒用扩增引物进行PCR验证,结果得到大小为0.78kb的扩增产物,初步证明构建的重组质粒正确;接着将该重组质粒进行测序,结果表明,在pET-30a(+)的BamH I和Xho I酶切位点之间插入SEQ ID NO.1所示的基因aly1-T185N,且插入方向正确,所以进一步证明构建的重组质粒正确,将该重组质粒命名为pE30a-Aly1-T185N。
将重组质粒pE30a-Aly1-T185N转化大肠杆菌菌株BL21(DE3)(购自美国Invitrogen公司),即BL21(DE3)/pE30a-Aly1-T185N,得到表达pE30a-Aly1-T185N的工程菌。
将质粒pET-30a(+)转化大肠杆菌菌株BL21(DE3),得到空载体对照BL21(DE3)/pET-30a(+)的工程菌。
以下操作将对上面的两种工程菌平行进行。
按照Invitrogen公司提供的操作步骤,使用终浓度为0.05mM异丙基硫代半乳糖苷(IPTG)进行工程菌的诱导表达。在8,000×g、4℃条件下离心15min,收集菌体,并用缓冲液A重悬菌体,冰水浴环境中超声破碎。在15,000×g、4℃条件下进一步离心30min,收集水溶性组分,并用Ni-琼脂糖凝胶对重组褐藻胶裂解酶rT185N进行纯化。用含有咪唑浓度为10、50、250、500mM的缓冲液A进行梯度洗脱,纯化条件按照凝胶的产品手册操作。用聚丙烯酰胺凝变性胶电泳检测重组褐藻胶裂解酶rT185N的纯化情况。
结果如图2所示:经IPTG诱导表达后的BL21(DE3)/pE30a-Aly1-T185N菌体中,重组褐藻胶裂解酶rT185N的产量不低于1259±2.2mg/L菌体培养物,而空载体对照菌体中没有该条带的表达;纯化后的重组褐藻胶裂解酶rT185N在电泳胶上呈单一条带,且位置与预测的分子量相吻合;将纯化后的重组褐藻胶裂解酶rT185N样品装入最小分子截留量为3kD的透析袋,在4℃环境中对缓冲液A进行透析。所述缓冲液A的成分为:50mM Tris、150mM NaCl,pH 7.9,制得重组褐藻胶裂解酶rT185N酶液。
实施例5、DNS-还原糖法测定重组褐藻胶裂解酶rT185N的酶活
将用去离子水配置的质量浓度(g/mL)为0.1~1.2%的褐藻胶、浓度为10μg/mL的重组褐藻胶裂解酶rT185N酶液、150mmol/L的HAc-NaAc(pH 6.0)缓冲液以及水按1:1:1(体积比)的比例混合后40℃下反应4h。将反应产物在沸水浴中加热10min灭活酶,转入冰水浴中5min,在12,000×g、4℃条件下离心15min,收集上清;将一定体积的上清与等体积的DNS(3,5-对硝基二甲苯)反应液混匀,在沸水浴中加热10min,降至室温,在540nm测定吸收值。用分析纯葡萄糖醛酸钠内酯作标准品,同样方法操作,绘制葡萄糖醛酸内酯的摩尔浓度与OD540之间的量效关系曲线。用购于上海生工生物工程有限公司的蛋白质定量试剂盒测定重组褐藻胶裂解酶rT185N酶液中的蛋白质含量。按照国际标准定义计算酶的活力单位,即在标准条件下,每分钟内产生1μmol产物所需的酶量为1个IU。结果表明:重组rT185N能以褐藻胶为底物,酶解并产生还原糖产物,酶活为2895±10.3U/mg。
实施例6、重组酶rT185N最适温度的测定
用去离子水配制质量体积浓度(g/mL)为0.1-1.2%的褐藻胶底物,加热溶解后,置于0℃、10℃、20℃、30℃、40℃、50℃、60℃、70℃、80℃水浴环境中降温1h。向每900μL底物溶液中添加实施例4制得的重组褐藻胶裂解酶rT185N的稀释液100μL,重组褐藻胶裂解酶rT185N的稀释液浓度为10μg/mL,混匀后继续反应,隔时取样。每个温度条件下3个平行样品,以沸水浴灭活的重组酶制剂为对照组。用DNS-还原糖法测定各反应体系中新生成还原糖的浓度(OD540),并计算平均值,进行偏差分析。最大吸收值对应的反应温度为重组酶的最适温度,相对酶活(RA)定义为:各吸收值与最大吸收值的百分比。
结果如图3所示:以褐藻胶为底物测定酶活时,重组褐藻胶裂解酶rT185N在40℃反应时达到最大活力,这表明重组褐藻胶裂解酶rT185N的最适反应温度是40℃。同时,重组褐藻胶裂解酶rT185N在0℃展示了81%的相对酶活,这表明重组褐藻胶裂解酶rT185N具有适冷的酶学性质;在80℃也展示了69.2%以上的相对酶活,这表明重组褐藻胶裂解酶rT185N具有一定的适热酶学性质。
实施例7、重组褐藻胶裂解酶rT185N最适pH的测定
分别用浓度为50mM的NaAc-HAC缓冲液、50mM的NaH2PO4-Na2HPO4缓冲液、50mM的Tris-HCl缓冲液,分别与褐藻胶配制质量体积浓度(g/mL)为0.1-1.2%的褐藻胶底物,所对应的pH值分别为5、6,6、7、8,7、8、9、10三个区段,各pH值均在最适温度下调定。将底物溶解后,置于最适温度中孵育1h,然后向每900μL底物中添加实施例4制得的重组褐藻胶裂解酶rT185N的稀释液100μL,混匀后开始反应,隔时取样。每个pH条件下3个平行样品,以沸水浴灭活的重组酶制剂为对照组。用DNS-还原糖法测定各反应体系中新生成的还原糖浓度(OD540),并计算平均值和偏差。相对酶(RA)活定义为:各组平均吸收值与最大吸收值的百分比。最大吸收值对应的pH为重组酶的最适pH。
结果如图4所示:重组褐藻胶裂解酶rT185N的最适反应pH为6.0。在pH 5~10范围内,重组褐藻胶裂解酶rT185N相对酶活在65.6%以上,显示该酶具有广泛的pH反应活性。
实施例8、重组褐藻胶裂解酶rT185N的温度稳定性分析
将实施例4制得的重组褐藻胶裂解酶rT185N酶液在不同温度(0~70℃)下热处理0.5h、1h、2h后,分别与用蒸馏水配置的质量体积浓度(g/mL)为0.1~1.2%的褐藻胶,按1:9(体积比)的比例混合,然后在最适温度下测定残余酶活,以不经过热处理的酶液酶活定义为100%相对活力。结果如图5所示:重组褐藻胶裂解酶rT185N在低于50℃的温度下预处理2h后,仍然具有>87%的残余活性,表明该酶具有一定的热稳定性。
实施例9、重组褐藻胶裂解酶rT185N的pH稳定性分析
将实施例4制得的重组褐藻胶裂解酶rT185N的酶液,在最适温度((40℃)、不同的pH(pH5~10)环境中分别预孵育2h后,与质量体积浓度(g/mL)为0.1~1.2%的褐藻胶底物溶液按1:9(体积比)的比例混合,然后在最适温度下测定残余酶活,以不经过预处理的酶液酶活定义为100%相对活力。结果如图6所示,在pH5~10的范围内预处理2h,rT185N酶活仍保持40%以上。这表明重组褐藻胶裂解酶rT185N对pH值耐受范围较广。
实施例10、金属离子和化学试剂对重组褐藻胶裂解酶rT185N活性的影响
将用去离子水配置质量浓度(g/mL)的为0.1~1.2%褐藻胶底物、实施例4制得的重组褐藻胶裂解酶rT185N酶液、以及水按5:1:4(体积比)的比例混合后,接着向反应体系中添加不同的金属离子,添加的离子终浓度为1mM或10mM,然后在40℃反应4h,按前述的DNS-还原糖法测酶的活力。对照组为不加任何金属离子时rT185N的活性(设定为100%)。结果图7所示,在1mM或10mM浓度下:(1)Na+、K+、Li+等三种一价金属试剂对rT185N的活性表现为微弱抑制作用,但Ag+具有显著抑制作用;(2)1mM的Mg2+、10mM的Fe2+、Mn2+等二价金属例子对酶活具有促进作用,而其余二价、三价金属离子对酶活具有抑制作用;(3)甘油、β-巯基乙醇及DTT在10mM时对rT185N的活性有明显促进活性。
实施例11、重组褐藻胶裂解酶rAly-1和截短的重组褐藻胶裂解酶rT185N彻底降解褐藻胶的产物高效液相(HPLC)比较分析
用去离子水配制质量体积浓度(g/mL)为0.1~1.2%的褐藻胶底物,加热溶解后,置于40℃水浴环境中降温1h。向每100μL底物中分别添加实施例3制得重组酶rAly-1及实施例4制得的重组酶rT185N的稀释液10-100μL,不足200μL体积时,用无菌去离子水补足;混匀后继续反应24h。将反应产物在沸水浴中加热10min,转入冰水浴中5min。在12,000×g、4℃条件下离心15min,收集上清。
用浓度为0.20mol/L的NH4HCO3溶液,平衡Superdex Peptide 10/300GL(GE公司)分子凝胶色谱柱,流速0.40mL/min,至少2柱床。将上述褐藻胶酶解的样品,以自动进样器加载100μg/样品,其它条件不变,235nm检测。用HPLC操作软件,分析各寡糖组分的积分面积,计算相对摩尔浓度。
如图8所示,在上述条件下,褐藻胶底物被彻底降解后的寡糖产物具有235nm特征吸收。这初步表明rAly1和rT185N是褐藻胶裂解酶。同时表明,以褐藻胶为底物时,rT185N与rAly-1相比较产物基本一致,含量稍有差别。其中截短的重组褐藻胶裂解酶rT185N酶解褐藻胶反应的最终主产物是HPLC分析中出峰时间为40.5'和43.2'的两个寡糖产物,面积比稳定为面积比稳定为51:49,表明二者摩尔比约为51:49;而rAly-1酶解反应的最终主产物40.5'和43.2'的两个寡糖产物,面积比稳定为48:52,表明二者摩尔比约为48:52。
实施例12、重组褐藻胶裂解酶rT185N彻底降解褐藻胶的寡糖主产物的分子量鉴定
按照实施例11所述,将共200mg褐藻胶用重组褐藻胶裂解酶rT185N彻底酶解,样品分批上样、过Superdex Peptide 10/300GL分子凝胶色谱柱(GE公司),并按照出峰时间分别收集出峰时间为40.5'和43.2'的两个寡糖样品。将多次收集到的两个寡糖样品分别集中后,反复冷冻干燥以脱盐。用无菌去离子水溶解所得寡糖样品,进行一级质谱(MS)分析,确定各寡糖的相对分子量。还用重水(D2O)溶解所得的寡糖样品,反复冷冻干燥,以完成氢氘置换,并进行1H-NMR分析,最终确定各寡糖的化学结构及特征。
如图9所示,用重组褐藻胶裂解酶rT185N彻底降解褐藻胶后所制备的不饱和寡糖片段UDP2、UDP3进行HPLC分析,结果显示产物在235nm具有特征吸收,出峰时间分别为40.5'和43.2',纯度均大于99%。
在阴离子模式下进行的一级质谱分析的结果表明,这两个寡糖主产物的分子量分别是352、528。这表明,上述两个寡糖主产物分别是重组褐藻胶裂解酶rT185N彻底降解褐藻胶之后所产生的不饱和二糖(UDP2)及不饱和三糖(UDP3)。
综合图8、图9的结果,不饱和二糖是重组褐藻胶裂解酶rT185N降解褐藻胶之后聚合度最小的寡糖主产物。
进一步通过1H-NMR数据分析上述两种寡糖的结构特征:
(1)如图10-1所示,5.75ppm处的特征性化学位移值表明,重组褐藻胶裂解酶rT185N降解褐藻胶后的主产物不饱和二糖UDP2几乎全部是ΔG。
(2)如图10-2所示5.70、5.60ppm两处的化学位移值,表明主产物不饱和三糖UDP3的非还原性末端有两种类型:ΔG和ΔM;而且两处峰的面积积分之比为100:161,表明这两类不饱和三糖的摩尔比约为5:8。与rAly-1降解褐藻胶的主产物两类不饱和三糖的摩尔比约为5:4相比较,这表明含ΔM末端的三糖产物的含量提高了约17%。
实施例13、重组褐藻胶裂解酶rAlgL-5不完全降解褐藻胶的产物UDP2-UDP6的制备
按照专利申请(申请号201410469861.4,一种内切型褐藻胶裂解酶及其编码基因与应用)中实施例10所述,将共200mg褐藻胶用重组酶rAlgL-5进行不彻底酶解,产物分批上样、过分子凝胶柱Superdex Peptide 10/300GL(GE公司),并按照出峰时间分别收集单个寡糖片段。将这些寡糖样品多次收集、分别集中后,反复冷冻干燥以脱盐。
如图11所示,制备的寡糖片段UDP2-UDP6经HPLC检测分析,结果显示产物在235nm具有特征吸收,纯度均大于99%。
实施例14、重组褐藻胶裂解酶rAly-1和截短的重组褐藻胶裂解酶rT185N最小不饱和寡糖底物的比较分析
用去离子水和实施例13所制备的寡糖片段,包括:不饱和六糖(UDP6)、不饱和五糖(UDP5)、不饱和四糖(UDP4)、不饱和三糖(UDP3)及不饱和二糖(UDP2)。将这些寡糖样品分别配置底物溶液,与浓度为10μg/mL的重组褐藻胶裂解酶rAly1和rT185N酶液、150mmol/L的HAc-NaAc(pH 6.0)缓冲液以及水按1:1:1(体积比)的比例混合后,40℃反应24h。按照实施例11所述色谱操作条件,进行HPLC分析。结果如图12所示,本申请所述截短的重组褐藻胶裂解酶rT185N:
(1)降解不饱和六糖(UDP6)之后产生不饱和四糖、不饱和三糖和不饱和二糖;
(2)降解不饱和五糖(UDP5)之后产生等量的不饱和三糖和不饱和二糖;
(3)降解不饱和四糖(UDP4)之后产生两倍的不饱和二糖;
(4)与不饱和三糖或不饱和二糖反应前后无显著变化。
这充分表明,不饱和四糖片段是重组褐藻胶裂解酶rT185N的最小不饱和寡糖底物,且重组褐藻胶裂解酶rT185N以内切酶方式降解不饱和寡糖底物。
与rAly-1相比较显著不同的是,rT185N对不饱和四糖(UDP4)的降解率明显高于rAly-1,转化效率可到95%以上,而rAly-1仅为50%左右。
实施例15、重组褐藻胶裂解酶rAly-1和截短的重组褐藻胶裂解酶rT185N酶切模式的高效液相色谱(HPLC)比较分析
取约含30μg饱和聚M糖(M3、M4、M5)、聚G糖(G3、G4、G5)的溶液,150mmol/L的HAc-NaAc(pH 6.0)缓冲液、按照实施例3制得重组酶rAly-1及实施例4制得的重组褐藻胶裂解酶rT185N的稀释液,按照体积比1:1:1混匀,置于40℃水浴中反应24h。将反应体系置沸水浴中10min,转至冰水浴5min,在12,000×g、4℃条件下离心至少15min。收集上清,作为重组褐藻胶裂解酶rAly-1和rT185N的寡糖降解产物。以预先在沸水浴中灭活的重组褐藻胶裂解酶rAly-1和rT185N酶液,做阴性对照反应。
按照实施例11所述的色谱条件,将重组褐藻胶裂解酶rAly-1和rT185N酶解饱和聚M糖(M3、M4、M5)、聚G糖(G3、G4、G5)的样品,以自动进样器加载20μg/样品,其它条件不变,235nm检测。用HPLC操作软件,分析各寡糖组分的积分面积,计算相对摩尔浓度。参照分子量标准物,确定各寡糖的相对分子量。
如图13所示,rT185N与rAly-1相比较,二者相似的是:(1)降解饱和聚M五糖(M5)之后产生不饱和三糖(UM3)和不饱和二糖(UM2);(2)降解饱和聚M四糖(M4)之后产生不饱和三糖(UM3)和不饱和二糖(UM2);(3)二者与饱和聚M三糖(M3)反应前后无显著变化。
如图14所示,rT185N与rAly-1相比较,二者相似的是:(1)降解饱和聚G五糖(G5)之后产生不饱和三糖(UG3)和微量不饱和二糖(UG2);(2)降解饱和聚G四糖(G4)之后产生不饱和三糖(UG3)和微量不饱和二糖(UG2);(3)二者与饱和聚G三糖(G3)反应前后无显著变化。
对比图13与14表明,截短后的rT185N仍然为兼性的褐藻胶裂解酶;rT185N与rAly-1在降解饱和聚M五糖(M5)和饱和聚G五糖(G5)时,可以从还原性末端或非还原性末端分别生成二糖产物,且最终主产物都是不饱和三糖产物;二者在降解饱和聚M四糖(M4)和饱和聚G四糖(G4)时,显示出既可以以外切酶方式切割饱和四糖产生一分子饱和单糖和一分子的不饱和三糖,又可以以内切酶方式切割饱和四糖产生一分子饱和二糖和一分子的不饱和二糖。二者显著的区别是,截短后的rT185N对饱和M四糖、饱和M五糖的降解率显著提高,未见对饱和G四糖、饱和G五糖及更大寡糖底物的显著变化。
实施例16重组褐藻胶裂解酶rAly-1和截短的重组褐藻胶裂解酶rT185N酶切模式的荧光-高效液相色谱(HPLC)比较分析
取约含10μg饱和聚M糖(M3、M4、M5)、聚G糖(G3、G4、G5)的溶液,旋转蒸干。加入含过量邻氨基苯甲酰胺(2-AB)、硼腈化钠的二甲亚砜(DMSO)溶液,混匀后置60℃水浴中温育2h。旋转蒸干,加入500μL去离子水溶解样品,将样品与200μL氯仿共振荡,离心,收集上清。继续用氯仿反复抽提,不少于7次,得到还原性末端被荧光标记了的饱和聚M糖(2AB-M3、2AB-M4、2AB-M5)、荧光标记的饱和聚G糖(2AB-G3、2AB-G4、2AB-G5)。同样方法标记饱和寡糖的分子量标准物。
取上述2AB-M3、2AB-M4、2AB-M5、2AB-G3、2AB-G4、2AB-G5样品、150mmol/L的HAc-NaAc(pH 6.0)缓冲液、按照实施例3制得重组酶rAly-1及实施例4制得的重组褐藻胶裂解酶rT185N的稀释液,按照体积比1:1:1混匀,置于40℃水浴中反应24h。将反应体系置沸水浴中10min,转至冰水浴5min,在12,000×g、4℃条件下离心至少15min。收集上清,作为重组褐藻胶裂解酶rAly-1和rT185N的寡糖降解产物。以预先在沸水浴中灭活的重组褐藻胶裂解酶rAly-1和rT185N酶液,做阴性对照反应。
按照实施例11所述的色谱条件,将2AB-M3、2AB-M4、2AB-M5、2AB-G3、2AB-G4、2AB-G5及其酶解产物的标记样品,以自动进样器加载50-200ng/样品,其它条件不变,330nm激发,420nm检测。用HPLC操作软件,分析各寡糖组分的积分面积,计算相对摩尔浓度。参照分子量标准物,确定各寡糖的相对分子量。
如图15、16所示,rAly-1与rT185N相比较:
(1)用过量的重组褐藻胶裂解酶rAly-1和rT185N与2AB-M5反应后,仅少量被降解,且产生等摩尔量的2AB-UM3;
(2)二者与2AB-M4、2AB-M3反应前后无显著变化;
(3)rAly-1和rT185N可完全降解2AB-G5,并生成等摩尔量的2AB-UG3;
(4)rAly-1和rT185N与2AB-G3反应前后无显著变化。
二者显著的差别是,rT185N可完全降解2AB-G4,并生成等摩尔量的2AB-UG3,而rAly-1与2AB-G4反应前后无明显变化。
实施例13与15,以及实施例14与16,说明:
(1)2-AB对饱和寡糖末端标记,抑制了酶rT185N对寡糖的降解活性;
(2)与rAly-1相比:(a)截短体rT185N可以降解的寡糖底物尺寸明显小于rAly-1,(b)截短体rT185N对polyM的相对降解活性明显提高。
实施例17截短的重组褐藻胶裂解酶rT185N酶切聚G寡糖(G4、G5)过程的荧光-高效液相色谱(HPLC)比较分析
取按照实施例16中所制的2AB-G4、2AB-G5样品、150mmol/L的HAc-NaAc(pH 6.0)缓冲液、实施例4制得的重组褐藻胶裂解酶rT185N的稀释液,按照体积比1:1:1混匀,置于40℃水浴中反应,隔时取样。将反应体系置沸水浴中10min,转至冰水浴5min,在12,000×g、4℃条件下离心至少15min。收集上清,作为rT185N的寡糖降解产物。以预先在沸水浴中加热10min的rT185N酶液,做阴性对照反应。
按照实施例11所述的色谱条件,将2AB-G4、2AB-G5及其酶解产物的标记样品,以自动进样器加载50-200ng/样品,其它条件不变,330nm激发,420nm检测。用HPLC操作软件,分析各寡糖组分的积分面积,计算相对摩尔浓度。参照分子量标准物,确定各寡糖的相对分子量。
如图17所示,在上述条件下,2AB-G4被降解后,随着酶解反应时间的增加,2AB-UG3寡糖产物的含量逐渐增加,且相对含量最终趋于稳定。这表明截短的重组褐藻胶裂解酶rT185N是以外切酶方式切割2AB-G4,从非还原性末端切割一分子单糖产生一分子2AB-UG3。如图18所示,2AB-G5被降解后,随着酶解反应时间的增加,2AB-UG3寡糖产物的含量逐渐增加,且相对含量最终趋于稳定,且捕捉不到2AB-UG4的产生;随后把酶量降低到原来的百分之一重复实验,结果仍然捕捉不到2AB-UG4的产生。这说明截短的重组褐藻胶裂解酶rT185N是以内切酶方式切割2AB-G5,从非还原性末端切割一分子二糖产生一分子2AB-UG3。
说明书中涉及的参考文献
1.Hu J,Geng M,Li J,Xin X,Wang J,Tang M,Zhang J,Zhang X,Ding J.2004.Acidic oligosaccharide sugar chain,a marine-derived acidic oligosaccharide,inhibits the cytotoxicity and aggregation of amyloid beta protein.Journal of Pharmacological Science 95:248-255
2.Xu X,Bi D,Li C,Fang W,Zhou R,Li S,Chi L,Wan M,Shen L.2015.Morphological and proteomic analyses reveal that unsaturated guluronate oligosaccharide modulates multiple functional pathways in murine macrophage RAW264.7cells.Marine Drugs 13:1798-1818
3.Zhu B,Yin H.2015.Alginate lyase:review of major resources and classification,properties,structure-function analysis and application.Bioengineered 6:125-131
4.MacDonald LC,Berger BW.2014.A polysaccharide lyase from Stenotrophomonas maltophilia with a unique,pH-regulated substrate specificity.The Journal of Biological Chemistry 289:312-325
5.Lundqvist LCE,Jam M,Barbeyron T,Czjzek M,Sandstrom C.2012.Substrate specificity of the recombinant alginate lyase from the marine bacteria Pseudomonas alginovora.Carbohydrate Reasearch 352:44-50
6.Thomas F,Lundqvist LCE,Jam M,Jeudy A,Barbeyron T,Sandstrom C,Michel G,Czjzek M.2013.Comparative characterization of two marine alginate lyases from Zobellia galactanivorans reveals distinct models of action and exquisite adaption to their natural substrate.The Journal of Biological Chemistry 288:23021-23037
7.Han W,Gu J,Cheng Y,Liu H,Li Y,Li F.2016.Novel alginate lyase(Aly5)from a polysaccharide-degrading marine bacterium,Flammeovirga sp.strain MY04:effects of module truncation on biochemical characteristics,alginate degradation patterns,and oligosaccharide-yielding properties.Applied and Environmental Microbiology 82:364-374
8.Li S,Yang X,Bao M,Wu Y,Yu W,Han F.2015.Family 13 carbohydrate-binding module of alginate lyase from Agarivorans sp.L11 enhances its catalytic efficiency and thermostability,and alters its substrate preference and product distribution.FEMS Microbiology Letters 362:1-7
9.Li S,Wang L,Hao J,Xing M,Sun J,Sun M.2017.Purification and Characterization of a New Alginate Lyase from Marine Bacterium Vibrio sp.SY08.Mar Drugs 15:1-11
SEQUENCE LISTING
<110> 滕州市悟通香料有限责任公司
<120> 一种截短的重组褐藻胶裂解酶rAly1-T185N及其编码基因与应用
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 780
<212> DNA
<213> Flammeovirga yaeyamensis
<400> 1
tacaaagaag acgaagtgcc agatgccgat cagaaaccta cggatgttat cccatcatta 60
gtacaatgga aagtaactct tccagtagac gcagatggaa atgataacag atatgttact 120
gatccggagt tgagaaatag aaatccacta gaaatcaaag atggtgattt agtcgattac 180
gaatggtttc cttacttcca cgcaaaaaat aacgaagtat tatttaaagg acattgtgca 240
ggaacaacca ctagaggttc ttactaccca cgttgcgagt taagacaacg tgttggtggt 300
ggagacaatt attggagtgt tcaacagtat caatatttaa aaacggtatt aagagtaaca 360
cacttaccgg tggtcaagcc agaggtttcc atggtacaga tccacgggcc tcaggatgaa 420
ccactgagag tgcagtactc ggaaagtaca cgttcgtcga ccccttgggg attacacatc 480
gtttacaacg agaactttaa ggaacgaaca aatattgaat acaaaatggg agatcgttta 540
gaagtagaag tgattgttga taagggtgat attactgtta atatcagaaa cttagaaaat 600
ggacaacgtt acaacaaaac gtatacttct gtagatcaaa caggatattt taaagtgggt 660
tgttatacac aatccacaaa attcctctct caagtaaaac cagaatatga tcaagacgag 720
ccaaacgatg cttatgcaga ggtggcagtt caatctatag aattaaaaga aacttattaa 780
<210> 2
<211> 259
<212> PRT
<213> Flammeovirga yaeyamensis
<400> 2
Tyr Lys Glu Asp Glu Val Pro Asp Ala Asp Gln Lys Pro Thr Asp Val
1 5 10 15
Ile Pro Ser Leu Val Gln Trp Lys Val Thr Leu Pro Val Asp Ala Asp
20 25 30
Gly Asn Asp Asn Arg Tyr Val Thr Asp Pro Glu Leu Arg Asn Arg Asn
35 40 45
Pro Leu Glu Ile Lys Asp Gly Asp Leu Val Asp Tyr Glu Trp Phe Pro
50 55 60
Tyr Phe His Ala Lys Asn Asn Glu Val Leu Phe Lys Gly His Cys Ala
65 70 75 80
Gly Thr Thr Thr Arg Gly Ser Tyr Tyr Pro Arg Cys Glu Leu Arg Gln
85 90 95
Arg Val Gly Gly Gly Asp Asn Tyr Trp Ser Val Gln Gln Tyr Gln Tyr
100 105 110
Leu Lys Thr Val Leu Arg Val Thr His Leu Pro Val Val Lys Pro Glu
115 120 125
Val Ser Met Val Gln Ile His Gly Pro Gln Asp Glu Pro Leu Arg Val
130 135 140
Gln Tyr Ser Glu Ser Thr Arg Ser Ser Thr Pro Trp Gly Leu His Ile
145 150 155 160
Val Tyr Asn Glu Asn Phe Lys Glu Arg Thr Asn Ile Glu Tyr Lys Met
165 170 175
Gly Asp Arg Leu Glu Val Glu Val Ile Val Asp Lys Gly Asp Ile Thr
180 185 190
Val Asn Ile Arg Asn Leu Glu Asn Gly Gln Arg Tyr Asn Lys Thr Tyr
195 200 205
Thr Ser Val Asp Gln Thr Gly Tyr Phe Lys Val Gly Cys Tyr Thr Gln
210 215 220
Ser Thr Lys Phe Leu Ser Gln Val Lys Pro Glu Tyr Asp Gln Asp Glu
225 230 235 240
Pro Asn Asp Ala Tyr Ala Glu Val Ala Val Gln Ser Ile Glu Leu Lys
245 250 255
Glu Thr Tyr
- 还没有人留言评论。精彩留言会获得点赞!