一种双功能转糖基α‑N‑乙酰氨基半乳糖苷酶及其表达基因与应用的制作方法
本发明涉及一种双功能转糖基α-N-乙酰氨基半乳糖苷酶及其表达基因与应用,特别涉及利用一种同时具有内切酶和外切酶活性的双功能α-N-乙酰氨基半乳糖苷酶合成T抗原和Tn抗原以及相应糖肽的方法,属于基因工程技术领域。
技术背景
α-N-乙酰氨基半乳糖苷酶(α-N-Acetylgalactosaminidase,EC.3.2.1.49)是一类重要的糖苷水解酶,催化α-N-乙酰氨基半乳糖苷键的水解,广泛分布于细菌、真菌、植物和动物中,根据氨基酸序列同源性归属于糖苷酶家族GH27、GH36、GH109和GH129(http://www.cazy.org/)。其中,细菌来源的α-N-乙酰氨基半乳糖苷酶在GH36、GH109、GH129个家族中有分布,真核生物来源的主要属于GH27。该类酶既可以水解简单的α-N-乙酰氨基半乳糖苷,也可以作用于含α-N-乙酰氨基半乳糖苷键的大分子,如多糖、糖蛋白和糖脂。此外,某些α-N-乙酰氨基半乳糖苷酶不仅具有水解功能,在体外合适的反应条件下还具有转α-N-乙酰氨基半乳糖苷的活性,合成重要N-乙酰氨基半乳糖苷化合物,应用于基础研究、农业和医药等领域,但目前报道的酶转糖基产物产量很低。
α-N-乙酰氨基半乳糖苷化合物的合成具有重要意义,如T抗原(Galβ1-3GalNAc-α-Ser,Galβ1-3GalNAc-α-Thr)和Tn抗原(GalNAc-α-Ser,GalNAc-α-Thr)属于Mucin-type O-glycan,但目前糖苷酶法合成Tn抗原(GalNAc-α-Ser,GalNAc-α-Thr)的产率不超过10%;合成T抗原(Galβ1-3GalNAc-α-Ser,Galβ1-3GalNAc-α-Thr)的产率不超过17%;合成相应糖肽的产率不超过11%。未见一种酶同时具有内切酶和外切酶活性的双功能,能够合成T抗原和Tn抗原以及相应糖肽的报道。由于现有的合成方法均存在局限性,使得α-N-乙酰氨基半乳糖类糖缀合物的商品价格一直非常昂贵,需要寻找新的酶和经济有效的合成方法。
技术实现要素:
本发明针对现有技术的不足,提供一种双功能转糖基α-N-乙酰氨基半乳糖苷酶及其表达基因与应用。
发明概述
本发明的技术要点是发现了一种同时具有内切酶和外切酶活性的双功能转糖基α-N-乙酰氨基半乳糖苷酶,并利用该酶以对硝基苯-N-乙酰氨基-α-D-半乳糖或对硝基苯-N-乙酰氨基-α-D-半乳糖-β1,3-D-半乳糖为糖基供体,以丝氨酸、苏氨酸或短肽为受体,一步转糖基反应高效合成Tn抗原和T抗原以及相应糖肽。
发明详述
一种双功能转糖基α-N-乙酰氨基半乳糖苷酶,氨基酸序列如SEQ ID NO.2所示。
上述双功能转糖基α-N-乙酰氨基半乳糖苷酶的表达基因,核苷酸序列如SEQ ID NO.1所示。
上述双功能转糖基α-N-乙酰氨基半乳糖苷酶在制备Tn抗原、T抗原或糖肽中的应用。
上述应用,步骤如下:
将转糖基α-N-乙酰氨基半乳糖苷酶与糖基供体、糖基受体溶液混合,配制成pH 5.0~6.0的反应体系,反应体系中,糖基供体反应浓度为5~10mM,糖基受体反应浓度为200~300mM,在45~55℃条件下,反应10~120min,终止反应,纯化,制得Tn和T抗原以及相应糖肽;
所述糖基供体为对硝基苯-N-乙酰氨基-α-D-半乳糖或对硝基苯-N-乙酰氨基-α-D-半乳糖-β1,3-D-半乳糖;
所述糖基受体为丝氨酸、苏氨酸或短肽。
根据本发明优选的,所述转糖基α-N-乙酰氨基半乳糖苷酶的反应浓度为0.1~0.9U/ml。
根据本发明优选的,所述转糖基α-N-乙酰氨基半乳糖苷酶,制备方法如下:
(1)将核苷酸序列如SEQ ID NO.1所示的基因序列插入质粒pET-21b中,转化大肠杆菌BL21(DE3),制得重组大肠杆菌;
(2)将步骤(1)制得的重组大肠杆菌经扩大培养,再经过诱导培养后,收集细胞,细胞破碎、纯化,制得转糖基α-N-乙酰氨基半乳糖苷酶。
经检测,转糖基α-N-乙酰氨基半乳糖苷酶的氨基酸序列如SEQ ID NO.2所示。该转糖基α-N-乙酰氨基半乳糖苷酶单亚基分子量为79kDa,专一性水解α-N-乙酰氨基半乳糖苷键,同时具有内切酶和外切酶活性,最适pH为4.0~5.0,在pH5.0~9.5范围内稳定,适宜的反应温度为55~60℃,在低于50℃时稳定;Hg2+、Cu2+和Ag+能够使酶失活,Ca2+、Mg2+、Ni2+、Zn2+和Co2+对酶活有一定抑制作用。Fe2+和Mn2+对酶活有促进作用,其中Fe2+对酶活有显著促进作用,Fe3+、NH4+、K+、Na+和EDTA对酶活影响较小。
根据本发明进一步优选的,所述步骤(1)中,核苷酸序列如SEQ ID NO.1所示的基因序列以长双歧杆菌(Bifidobacteriumlongum)JCM1217的基因组DNA为模板,经PCR扩增获得,PCR引物核苷酸序列如下所示:
PCR体系如下,总体积100μL:
10×PCR buffer 10μL,2.5mmol/L dNTP 8μL、20μmol/L引物F2μL、20μmol/L引物R 2μL、100ng/μL模板1μL、5U/μLTaKaRaLATaq酶1μL,超纯水76μL。
PCR扩增程序如下:
95℃预变性5分钟;95℃变性30秒,55℃退火30秒,72℃延伸2分钟,反应30个循环;72℃延伸10分钟。
根据本发明进一步优选的,所述步骤(2)中,扩大培养条件为:37℃、150~180r/min培养至OD600为0.4~0.6。
根据本发明进一步优选的,所述步骤(2)中,扩大培养基为LB培养液,配制方法如下:
蛋白胨10g/L、酵母膏5g/L、NaCl7g/L、pH 7.0,121℃灭菌20分钟。
更优的,所述扩大培养基还包括浓度为40~60μg/mL的氨苄霉素。
根据本发明进一步优选的,所述步骤(2)中,诱导培养为在扩大培养后,向培养液中加入IPTG,使培养液中IPTG的浓度为0.1~0.5mM,在16~25℃、100r/min继续过夜培养。
根据本发明优选的,所述反应体系由浓度为50mM的磷酸钠缓冲液配制,pH为6.0。
根据本发明优选的,所述纯化采用HPLC进行纯化。
有益效果
本发明首次发现了一种具有内切酶和外切酶活性的双功能α-N-乙酰氨基半乳糖苷酶,采用该酶可以高效合成Tn抗原和T抗原以及相应糖肽,所采用的α-N-乙酰氨基半乳糖苷酶在以丝氨酸、苏氨酸或短肽(STAPPA)为受体底物的反应体系中合成GalNAc-α-Ser/Thr、Galβ1-3GalNAc-α-Ser/Thr和GalNAc/Galβ1-3GalNAc-α-STAPPA糖缀合物的反应过程中,产率显著高于现有已知相关酶,具有潜在的应用前景。
附图说明
图1为本发明制备的转糖基α-N-乙酰氨基半乳糖苷酶电泳图;
图中,M、分子量标准;1、诱导前含α-N-乙酰氨基半乳糖苷酶的重组菌的粗细胞酶液;2、诱导后含α-N-乙酰氨基半乳糖苷酶的重组菌的粗细胞酶液;3、纯化转糖基α-N-乙酰氨基半乳糖苷酶;
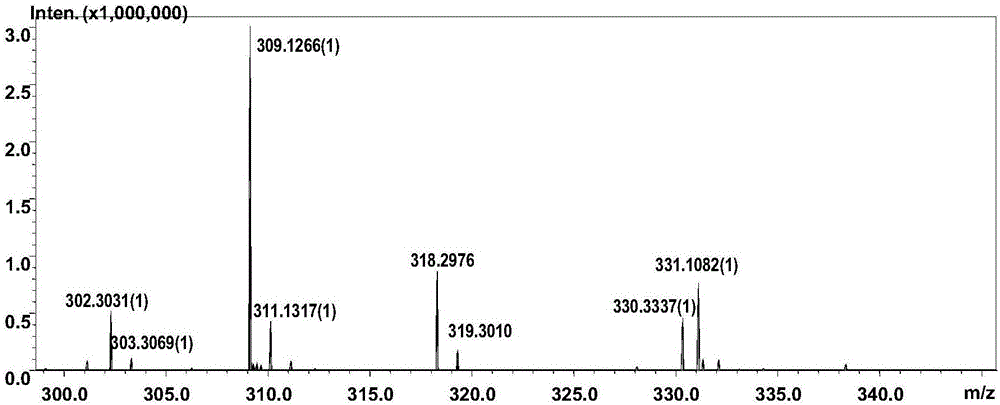
图2为α-N-乙酰氨基半乳糖苷酶以丝氨酸为受体、以对硝基苯-N-乙酰氨基-α-D-半乳糖为供体合成产物的质谱;
图3为α-N-乙酰氨基半乳糖苷酶以丝氨酸为受体、以对硝基苯-N-乙酰氨基-α-D-半乳糖为供体合成产物的核磁氢谱图;
图4为α-N-乙酰氨基半乳糖苷酶以丝氨酸为受体、以对硝基苯-N-乙酰氨基-α-D-半乳糖为供体合成产物的核磁碳谱图;
图5为α-N-乙酰氨基半乳糖苷酶以苏氨酸为受体、以对硝基苯-N-乙酰氨基-α-D-半乳糖为供体合成产物的质谱;
图6为α-N-乙酰氨基半乳糖苷酶以苏氨酸为受体、以对硝基苯-N-乙酰氨基-α-D-半乳糖为供体合成产物的核磁氢谱图;
图7为α-N-乙酰氨基半乳糖苷酶以苏氨酸为受体、以对硝基苯-N-乙酰氨基-α-D-半乳糖为供体合成产物的核磁碳谱图;
图8为α-N-乙酰氨基半乳糖苷酶以丝氨酸为受体、以对硝基苯-N-乙酰氨基-α-D-半乳糖-β1,3-D-半乳糖为供体合成产物的质谱;
图9为α-N-乙酰氨基半乳糖苷酶以丝氨酸为受体、以对硝基苯-N-乙酰氨基-α-D-半乳糖-β1,3-D-半乳糖为供体合成产物的核磁氢谱图;
图10为α-N-乙酰氨基半乳糖苷酶以丝氨酸为受体、以对硝基苯-N-乙酰氨基-α-D-半乳糖-β1,3-D-半乳糖为供体合成产物的核磁碳谱图;
图11为α-N-乙酰氨基半乳糖苷酶以苏氨酸为受体、以对硝基苯-N-乙酰氨基-α-D-半乳糖-β1,3-D-半乳糖为供体合成产物的质谱;
图12为α-N-乙酰氨基半乳糖苷酶以苏氨酸为受体、以对硝基苯-N-乙酰氨基-α-D-半乳糖-β1,3-D-半乳糖为供体合成产物的核磁氢谱图;
图13为α-N-乙酰氨基半乳糖苷酶以苏氨酸为受体、以对硝基苯-N-乙酰氨基-α-D-半乳糖-β1,3-D-半乳糖为供体合成产物的核磁碳谱图;
图14为α-N-乙酰氨基半乳糖苷酶以STAPPA为受体、以对硝基苯-N-乙酰氨基-α-D-半乳糖为供体合成产物的质谱;
图15为α-N-乙酰氨基半乳糖苷酶以STAPPA为受体、以对硝基苯-N-乙酰氨基-α-D-半乳糖-β1,3-D-半乳糖为供体合成产物的质谱。
具体实施方式
下面结合实施例对本发明的技术方案做进一步说明,但本发明所保护范围不限于此。
生物材料来源
长双歧杆菌(Bifidobacteriumlongum)JCM1217来源于日本微生物菌种保藏中心(Japan Collection of Microorganisms);
质粒pET-21b购自Novagen公司。
实施例1
利用双功能转糖基α-N-乙酰氨基半乳糖苷酶合成α-N-乙酰氨基半乳糖类糖缀合物,步骤如下:
1.α-N-乙酰氨基半乳糖苷酶的制备
根据长双歧杆菌(Bifidobacteriumlongum)JCM1217预测的α-N-乙酰氨基半乳糖苷酶基因序列(GenBank Accession No.BAJ66456.1)设计引物F和引物R:
以长双歧杆菌(Bifidobacteriumlongum)JCM1217的基因组为模板,PCR扩增α-N-乙酰氨基半乳糖苷酶基因片段,PCR体系如下(总体积100μL):
10×PCR buffer 10μL,2.5mmol/L dNTP 8μL、20μmol/L引物各2μL、100ng/μL模板1μL、5U/μLTaKaRaLA Taq酶1μL,超纯水76μL。
PCR扩增条件为:
95℃预变性5分钟;95℃变性30秒,65℃退火30秒,72℃延伸2分钟,反应30个循环;72℃延伸10分钟。
将纯化的PCR产物加入与NdeI和HindIII37℃双酶切3小时,16℃过夜连接到同样双酶切处理的质粒pET-21b载体上,构建重组质粒。采用CaCl2转化法转化宿主菌大肠杆菌DH5α,转化菌液涂布氨苄霉素LB平板,37℃过夜培养,挑取阳性生长菌菌落,提取质粒验证,测得核苷酸序列见SEQ ID No.1。
氨苄霉素LB平板组分如下:
氨苄霉素0.05g/L,胰蛋白胨10g/L,酵母提取物5g/L,NaCl 10g/L,琼脂10~15g/L,水配制,pH 7.0。
将获得的含有重组质粒的重组大肠杆菌BL21(DE3)接种于LB培养液,37℃,180r/min培养至OD600约0.8,加入终浓度0.1mM IPTG,16℃、100r/min过夜诱导,离心收集细胞,用pH7.0、50mmol/L磷酸钠缓冲溶液重新悬浮菌体,并置于冰水浴中,超声波破碎细胞壁20分钟,12000r/min离心30分钟,上清液通过镍亲和层析纯化获得电泳纯重组酶,SDS-PAGE显示重组酶单亚基分子量约为79kDa(如图1所示)。
LB培养液组分如下:
胰蛋白胨10g/L,酵母提取物5g/L,NaCl 10g/L,水配制,pH 7.0。
2.α-N-乙酰氨基半乳糖苷酶的酶学性质研究
研究了重组α-N-乙酰氨基半乳糖苷酶的酶学性质,该酶专一性水解α-N-乙酰氨基半乳糖苷键,同时具有内切酶和外切酶活性,水解对硝基苯-N-乙酰氨基-α-D-半乳糖和对硝基苯-N-乙酰氨基-α-D-半乳糖-β1,3-D-半乳糖。
在适当的温度范围(30~70℃)内,每5℃为一个梯度测定酶在该温度下的相对酶活。结果表明:酶适宜反应的温度为55~60℃,最适反应温度为55℃。将酶在上述温度梯度下保温30min后测定相对酶活。结果表明:酶在50℃以下比较稳定,55℃以上失活较快,65℃失去所有的酶活。
用不同pH的缓冲液配制酶反应体系,测定相对酶活,结果表明:酶适宜反应的pH范围为pH4.0~5.0,最适反应pH为4.0;酶在不同pH的缓冲液中4℃保存24小时,测定相对酶活,结果表明酶在pH 5.0~9.5范围内稳定。
以对硝基苯-N-乙酰氨基-α-D-半乳糖为底物,在酶活测定反应体系中分别加入终浓度为1mmol/L的各种金属离子,10mmol/L的EDTA,测定相对酶活。结果显示,Hg2+、Cu2+和Ag+能够使酶失活,Ca2+、Mg2+、Ni2+、Zn2+和Co2+对酶活有一定抑制作用。Fe2+和Mn2+对酶活有促进作用,其中Fe2+对酶活有显著促进作用,Fe3+、NH4+、K+、Na+和EDTA对酶活影响较小。
上述酶活测定方法为:50μL稀释一倍的纯酶与450μL、2mmol/L的糖苷底物溶液混合,于37℃反应10分钟,加1mL、0.5mol/L的Na2CO3溶液终止反应,测定OD405。
3.α-N-乙酰氨基半乳糖苷酶催化合成Tn抗原(GalNAc-α-Ser)
将重组α-N-乙酰氨基半乳糖苷酶在以对硝基苯-N-乙酰氨基-α-D-半乳糖为糖基供体,丝氨酸为糖基受体进行转糖基反应。研究了转糖基反应条件如糖基供体底物浓度(2~30mM)、糖基受体底物浓度(50~500mM)、pH(3.6~8.0)、反应温度(30~60℃)和时间(10~120min)对转糖基产物产率的影响,对硝基苯-N-乙酰氨基-α-D-半乳糖5mM、丝氨酸200mM时55℃反应60min产物产率达到最高。将反应产物煮沸10min终止反应,于12000r/min离心30min,取上清液进行薄层层析分析,结果显示反应产物为单一寡糖,高效液相色谱定量分析产物产量为74.3%。进一步对产物采用HPLC进行纯化,质谱和核磁共振分析鉴定其结构为GalNAc-α-Ser(图2、图3、图4)。
上述薄层层析条件如下:
薄层层析板点样,在展层剂(正丁醇:乙酸:水=2:1:1)中展开,雾喷显色剂(苯胺、二苯胺、磷酸),于86℃烘烤10分钟。
上述高效液相色谱分析所用设备及条件如下:
安捷伦(Agilent)1200型高压液相色谱仪;安捷伦G1314B紫外检测器;AcchromXAmide分析柱(4.6×250mm);流动相为乙腈/水(72:28,v/v);流速为1.0mL/min,柱温35℃;结果分析软件为Agilent Chemstation B.04.01版。反应液煮沸离心后上清用0.22μm的滤膜过滤后,进样分析。
4.α-N-乙酰氨基半乳糖苷酶催化合成Tn抗原(GalNAc-α-Thr)
将重组α-N-乙酰氨基半乳糖苷酶在以对硝基苯-N-乙酰氨基-α-D-半乳糖为糖基供体,苏氨酸为糖基受体进行转糖基反应。研究了转糖基反应条件如糖基供体底物浓度(2~30mM)、糖基受体底物浓度(50~500mM)、pH(3.6~8.0)、反应温度(30~60℃)和时间(10~120min)对转糖基产物产率的影响,对硝基苯-N-乙酰氨基-α-D-半乳糖5mM、苏氨酸250mM时55℃反应60min产物产率达到最高。将反应产物煮沸10min终止反应,于12000r/min离心30min,取上清液进行薄层层析分析,结果显示反应产物为单一寡糖,高效液相色谱定量分析产物产量为35.3%。进一步对产物采用HPLC进行纯化,质谱和核磁共振分析鉴定其结构为GalNAc-α-Thr(图5、图6、图7)。
薄层层析条件及高效液相色谱分析所用设备及条件同3。
5.α-N-乙酰氨基半乳糖苷酶催化合成T抗原(Galβ1-3GalNAc-α-Ser)
将重组α-N-乙酰氨基半乳糖苷酶在以对硝基苯-N-乙酰氨基-α-D-半乳糖-β1,3-D-半乳糖为糖基供体,丝氨酸为糖基受体进行转糖基反应。酶在对硝基苯-N-乙酰氨基-α-D-半乳糖-β1,3-D-半乳糖5mM、丝氨酸200mM时,55℃反应20minGalβ1-3GalNAc-α-Ser产物产率达到最高。将反应产物煮沸10min终止反应,于12000r/min离心30min,取上清液进行薄层层析分析,结果显示反应产物为单一寡糖,高效液相色谱定量分析产物产量为73.7%,进一步对产物采用HPLC进行纯化,质谱和核磁共振分析鉴定其结构分别为Galβ1-3GalNAc-α-Ser(图8、图9、图10)。
薄层层析条件及高效液相色谱分析所用设备及条件同3。
6.α-N-乙酰氨基半乳糖苷酶催化合成T抗原(Galβ1-3GalNAc-α-Thr)
将重组α-N-乙酰氨基半乳糖苷酶在以对硝基苯-N-乙酰氨基-α-D-半乳糖-β1,3-D-半乳糖为糖基供体,苏氨酸为糖基受体进行转糖基反应。酶在对硝基苯-N-乙酰氨基-α-D-半乳糖-β1,3-D-半乳糖5mM、苏氨酸250mM时,55℃反应20min Galβ1-3GalNAc-α-Thr产物产率达到最高。将反应产物煮沸10min终止反应,于12000r/min离心30min,取上清液进行薄层层析分析,结果显示反应产物为单一寡糖,高效液相色谱定量分析产物产量为58.8%,进一步对产物采用HPLC进行纯化,质谱和核磁共振分析鉴定其结构分别为Galβ1-3GalNAc-α-Thr(图11、图12、图13)。
薄层层析条件及高效液相色谱分析所用设备及条件同3。
7.α-N-乙酰氨基半乳糖苷酶催化合成糖肽(GalNAc-α-STAPPA)
将重组α-N-乙酰氨基半乳糖苷酶在以对硝基苯-N-乙酰氨基-α-D-半乳糖为糖基供体,STAPPA为糖基受体进行转糖基反应。酶在对硝基苯-N-乙酰氨基-α-D-半乳糖10mM、STAPPA200mM时,55℃反应60min,将反应产物煮沸10min终止反应,于12000r/min离心30min,高效液相色谱定量分析产物产量为10.7%,进一步对产物进行纯化,质谱分析其分子量与GalNAc-α-STAPPA一致(图14)。
上述高效液相色谱分析所用设备及条件如下:
安捷伦(Agilent)1200型高压液相色谱仪;安捷伦G1314B紫外检测器;Agilent TC-C18分析柱(4.6×150mm);流动相采用15min内梯度进行,0%~30%的乙腈,流动相体系中含有0.1%的TFA;流速为1.0mL/min,柱温35℃;结果分析软件为Agilent Chemstation B.04.01版。反应液煮沸离心后上清用0.22μm的滤膜过滤后,进样分析。
8.α-N-乙酰氨基半乳糖苷酶催化合成糖肽(Galβ1-3GalNAc-α-STAPPA)
将重组α-N-乙酰氨基半乳糖苷酶在以对硝基苯-N-乙酰氨基-α-D-半乳糖-β1,3-D-半乳糖为糖基供体,STAPPA为糖基受体进行转糖基反应。酶在对硝基苯-N-乙酰氨基-α-D-半乳糖-β1,3-D-半乳糖10mM、STAPPA 200mM时,55℃反应20min,将反应产物煮沸10min终止反应,于12000r/min离心30min,高效液相色谱定量分析产物产量为11%,进一步对产物进行纯化,质谱分析其分子量与Galβ1-3GalNAc-α-STAPPA一致(图15)。
高效液相色谱分析所用设备及条件同7。
SEQUENCE LISTING
<110> 山东大学
<120> 一种双功能转糖基α-N-乙酰氨基半乳糖苷酶及其表达基因与应用
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 1896
<212> DNA
<213> Bifidobacterium longum
<400> 1
atggaattca ccgtatccgg cactaccgtg cgattcgatg aacgaacaat gcagttcgct 60
tttacgcgcg acggtgccga atggaatacc tgcgctgatt tcaagccgac cctgcaatgc 120
gcgcaaggca ccttcgcgtt cgcggatgcc acttccatca cccatgagca gcgtgaaacc 180
ggcacgggaa ccggcattcg cagcatcttc accggctttg ggcacagcgc atactccttt 240
gaaacctatg tatgggtgga gcgtgcctca ggcgatgtgc tcttcgaatg gattccgctc 300
aatgagcaag gcctgaacat caccaatgtg acgtggcccg cagccatgga cttcgattgc 360
gccgacgacc atgacacgac actcatcacc catgagcaag gtgtgatgat ccccaacaca 420
tggcctaccg ccgtgagcac caaagacatc gccttcgacg gccgcttcga aacggctggc 480
ggttacatgc cgtggttcgc gcagctccgc gcagacggac acgggtatat cgccatctgc 540
gaaactccat ggaatgccgg ttacggcatc gaccatccca gcaatggccc gtacacccat 600
atcaatactt ggtttgagcc aagcctcggc acaatgaatt atcgccgcgt ggtacgctac 660
cagttcctcg accacgccga tcacacggcg gtgtgcaagg cctatcgttc gtacgtcaac 720
gaacgaggtc gcctgcgtac gctcgccgaa aaggcggcgc gcaatccctc cgtgcgtgac 780
ctgattggtc gctcgtgggt gcacatcggc atcaaaacca aagtgcagcc cgactcgtac 840
tactacgata aggaccaccc cgagaaaaac gagtcgctgg tcaccttcgc acagcgcgaa 900
aagcaaatgc gaacactgca cggcatgggt gcaggccgac tgtacatgca cttggatggt 960
tgggcacagc ccggatacga caacgcacac cccgactatc tgccggcctg tcaggaggca 1020
ggcggctggg aaggcatgaa gtcgctggtc gacgcctgcc atgagcaagg cgatattttc 1080
ggcacgcatg accagtaccg cgattactac ttcaccgcgc aaacctttga tgccaacaat 1140
gcgattcggc tggcagacgg tacgatgccc gaacacgcac gctgggcggg cggccgccag 1200
acctacctgt gcgccgagct cgcaccggac tacgtgcgcc gcaatttcac ccagattgcc 1260
gcgcatggca tcaaactcga ctgtgcatac ttggatgtct tcacctgcaa cgaaggcgac 1320
gaatgctcga accccgaaca ccgcatgacc cgccgcgaat gctttgaccg ccgcgccgaa 1380
tgcttcgaat atctgctctc gcacggcatc ctctcctcgt ccgaagaggt atcggactgg 1440
gcagtgccaa gcctgatatt ctgccattac gcgccatacg acttccagat gcgctcaccc 1500
aacgagccgc gccaaggtgt accggtgccg ctgtataacc tcgtctacca tgattgcgtt 1560
atcgagccgt ggatgatgga gcgtgtggtg gacggcgacg attacatgct gtacgccttg 1620
ctcaacggcg gagctccata cctgattcgc gatgccgcat acatcggcgt tgacggcgac 1680
atggacgacg aacagcgcgc tcgcacggaa aacgacatcg aacgctgcca tacggtcgct 1740
gcattccatg agcgggtcgg catgcaggaa ctggttcgtc acgagttcgt ggatgatgat 1800
ccgctggtgc agcgttcggt attcgcggac ggcactgcgg tcacttgcga cttccatacg 1860
caaacctatc gcatcaccga ctgcccgcat cactga 1896
<210> 2
<211> 631
<212> PRT
<213> Bifidobacteriumlongum
<400> 2
Met Glu Phe Thr Val Ser Gly Thr Thr Val Arg Phe Asp Glu Arg Thr
1 5 10 15
Met Gln Phe Ala Phe Thr Arg Asp Gly Ala Glu Trp Asn Thr Cys Ala
20 25 30
Asp Phe Lys Pro Thr Leu Gln Cys Ala Gln Gly Thr Phe Ala Phe Ala
35 40 45
Asp Ala Thr Ser Ile Thr His Glu Gln Arg Glu Thr Gly Thr Gly Thr
50 55 60
Gly Ile Arg Ser Ile Phe Thr Gly Phe Gly His Ser Ala Tyr Ser Phe
65 70 75 80
Glu Thr Tyr Val Trp Val Glu Arg Ala Ser Gly Asp Val Leu Phe Glu
85 90 95
Trp Ile Pro Leu Asn Glu Gln Gly Leu Asn Ile Thr Asn Val Thr Trp
100 105 110
Pro Ala Ala Met Asp Phe Asp Cys Ala Asp Asp His Asp Thr Thr Leu
115 120 125
Ile Thr His Glu Gln Gly Val Met Ile Pro Asn Thr Trp Pro Thr Ala
130 135 140
Val Ser Thr Lys Asp Ile Ala Phe Asp Gly Arg Phe Glu Thr Ala Gly
145 150 155 160
Gly Tyr Met Pro Trp Phe Ala Gln Leu Arg Ala Asp Gly His Gly Tyr
165 170 175
Ile Ala Ile Cys Glu Thr Pro Trp Asn Ala Gly Tyr Gly Ile Asp His
180 185 190
Pro Ser Asn Gly Pro Tyr Thr His Ile Asn Thr Trp Phe Glu Pro Ser
195 200 205
Leu Gly Thr Met Asn Tyr Arg Arg Val Val Arg Tyr Gln Phe Leu Asp
210 215 220
His Ala Asp His Thr Ala Val Cys Lys Ala Tyr Arg Ser Tyr Val Asn
225 230 235 240
Glu Arg Gly Arg Leu Arg Thr Leu Ala Glu Lys Ala Ala Arg Asn Pro
245 250 255
Ser Val Arg Asp Leu Ile Gly Arg Ser Trp Val His Ile Gly Ile Lys
260 265 270
Thr Lys Val Gln Pro Asp Ser Tyr Tyr Tyr Asp Lys Asp His Pro Glu
275 280 285
Lys Asn Glu Ser Leu Val Thr Phe Ala Gln Arg Glu Lys Gln Met Arg
290 295 300
Thr Leu His Gly Met Gly Ala Gly Arg Leu Tyr Met His Leu Asp Gly
305 310 315 320
Trp Ala Gln Pro Gly Tyr Asp Asn Ala His Pro Asp Tyr Leu Pro Ala
325 330 335
Cys Gln Glu Ala Gly Gly Trp Glu Gly Met Lys Ser Leu Val Asp Ala
340 345 350
Cys His Glu Gln Gly Asp Ile Phe Gly Thr His Asp Gln Tyr Arg Asp
355 360 365
Tyr Tyr Phe Thr Ala Gln Thr Phe Asp Ala Asn Asn Ala Ile Arg Leu
370 375 380
Ala Asp Gly Thr Met Pro Glu His Ala Arg Trp Ala Gly Gly Arg Gln
385 390 395 400
Thr Tyr Leu Cys Ala Glu Leu Ala Pro Asp Tyr Val Arg Arg Asn Phe
405 410 415
Thr Gln Ile Ala Ala His Gly Ile Lys Leu Asp Cys Ala Tyr Leu Asp
420 425 430
Val Phe Thr Cys Asn Glu Gly Asp Glu Cys Ser Asn Pro Glu His Arg
435 440 445
Met Thr Arg Arg Glu Cys Phe Asp Arg Arg Ala Glu Cys Phe Glu Tyr
450 455 460
Leu Leu Ser His Gly Ile Leu Ser Ser Ser Glu Glu Val Ser Asp Trp
465 470 475 480
Ala Val Pro Ser Leu Ile Phe Cys His Tyr Ala Pro Tyr Asp Phe Gln
485 490 495
Met Arg Ser Pro Asn Glu Pro Arg Gln Gly Val Pro Val Pro Leu Tyr
500 505 510
Asn Leu Val Tyr His Asp Cys Val Ile Glu Pro Trp Met Met Glu Arg
515 520 525
Val Val Asp Gly Asp Asp Tyr Met Leu Tyr Ala Leu Leu Asn Gly Gly
530 535 540
Ala Pro Tyr Leu Ile Arg Asp Ala Ala Tyr Ile Gly Val Asp Gly Asp
545 550 555 560
Met Asp Asp Glu Gln Arg Ala Arg Thr Glu Asn Asp Ile Glu Arg Cys
565 570 575
His Thr Val Ala Ala Phe His Glu Arg Val Gly Met Gln Glu Leu Val
580 585 590
Arg His Glu Phe Val Asp Asp Asp Pro Leu Val Gln Arg Ser Val Phe
595 600 605
Ala Asp Gly Thr Ala Val Thr Cys Asp Phe His Thr Gln Thr Tyr Arg
610 615 620
Ile Thr Asp Cys Pro His His
625 630
<210> 3
<211> 35
<212> DNA
<213> 人工合成
<400> 3
cgcgcatatg atggaattca ccgtatccgg cacta 35
<210> 4
<211> 32
<212> DNA
<213> 人工合成
<400> 4
atataagctt gtgatgcggg cagtcggtga tg 32
- 还没有人留言评论。精彩留言会获得点赞!