趋化因子家族基因SNP位点的应用及检测引物与试剂盒的制作方法
本发明涉及生物技术领域,具体涉及趋化因子家族基因snp位点的应用及检测引物与试剂盒。
背景技术:
我国是世界上食管癌发病率和死亡率最高的国家,据《中国卫生统计年鉴》报道,近40年来食管癌的死亡率稳居恶性肿瘤死因谱的前五位。食管癌预后极差,中晚期食管癌患者5年生存率仅10%左右。目前认为,影响食管癌预后的主要因素是肿瘤tnm分期和治疗方式,然而具有相同临床特征的食管癌患者,即使处于相同的临床分期、接受相同的治疗方案,其病情进展和预后却可能存在较大差异,提示除临床特征外,个体遗传易感因素亦可能是影响患者预后的重要因素。因此,寻找包括单核苷酸多态性(singlenucleotidepolymorphism,snp)在内的遗传分子标志,研究遗传变异与食管癌预后的关联,对于提高食管癌临床预后的预测价值,乃至建立我国食管癌个体化预后评价模型具有重要意义。
恶性肿瘤的不良预后主要与肿瘤的转移有关,而肿瘤转移是一个具有高度组织性和器官选择性的复杂过程,不同组织来源的肿瘤细胞迁移、侵袭到特定部位的分子机制尚未明确。新近,在肿瘤特异性转移的研究中出现了新的概念:“归巢”理论(thehomingtheory),该理论认为,肿瘤细胞转移到特定器官是由于不同器官通过趋化作用捕获或吸引特定类型肿瘤细胞而使肿瘤细胞“归巢”的结果。近年来,趋化因子受体--配体信号轴的研究,为“归巢”理论提供了有利的证据。
趋化因子是一种具有趋化活性的小分子细胞因子(相对分子量为8-14kd),这类细胞因子都含有4个保守的半胱氨酸,分为cxc、cc、cx3c、c共4个亚族。趋化因子受体是一类介导趋化因子行使功能的gtp蛋白耦联的跨膜受体(gprotein-coupledreceptors,gpcr),通常表达于免疫细胞、内皮细胞等细胞膜上。趋化因子受体根据其结合的配体不同也分为4个亚族:cxc趋化因子受体(cxcr)、cc趋化因子受体(ccr)、cx3c趋化因子受体(cx3cr)和c趋化因子受体(xcr)。趋化因子主要通过与其特定的g蛋白耦联受体结合,参与包括造血细胞的生成、白细胞的迁移与归巢、胚胎的发育等许多正常生命活动,同时也参与炎性疾病、病毒感染、移植排斥、恶性肿瘤等众多病理过程。
研究发现,肿瘤相关趋化因子不仅可促进肿瘤细胞增殖、抑制其凋亡,还可参与肿瘤细胞迁移、调节肿瘤血管生成、趋化淋巴细胞浸润肿瘤组织及参与肿瘤细胞器官选择性转移等过程。例如,cc和cxc家族中的关键因子ccl2、ccl5、ccl8、ccl20、ccl22、cxcl1、cxcl6、cxcl9和cxcl12等参与调节肿瘤血管的生成,并且可促进包括乳腺癌、前列腺癌、恶性黑色素瘤及肺癌等多种肿瘤细胞的侵袭和组织特异性转移。此外,已有多项研究发现,cxc(α)和cc(β)等趋化因子的表达失调可影响包括食管癌在内的多种肿瘤的发生、进展及预后。例如,cxcl12和其受体cxcr4的高表达与食管癌的侵袭、转移有关;经术前放化疗治疗后,cxcr4的持续表达与食管癌早期复发和预后不良有关。可见,肿瘤相关趋化因子在肿瘤的恶性进展中发挥重要作用,那么位于肿瘤相关趋化因子家族基因序列中的功能性遗传变异,亦可能导致相关基因的表达异常及功能改变,进而与肿瘤的恶性进展有关。因此,研究趋化因子家族的功能性遗传变异与食管癌预后的关联,筛选出具有预后意义的遗传易感标志,将对食管癌的合理临床决策、个体化治疗及预后评估具有重要的参考价值。
技术实现要素:
有鉴于此,本发明的目的在于提供趋化因子家族基因snp位点的应用及扩增引物与试剂盒,研究趋化因子家族的功能性遗传变异与食管癌预后的关联,为食管癌患者的个体化预后评估提供参考依据。
为实现本发明的目的,本发明采用如下技术方案。
本发明采用临床随访研究设计,收集食管癌病例标本及临床随访资料。生物信息学方法筛选趋化因子家族基因的潜在功能性多态位点。采用多重高温连接酶检测反应(imldr)基因分型技术和小测序技术(snapshot)对筛选出的趋化因子家族基因多态位点进行单核苷酸多态性分析。excel软件建立数据库,采用spss15.0软件进行统计分析,计数资料采用卡方检验。生存资料的单因素分析采用kaplan-meier法,log-rank检验进行生存曲线的比较;多因素分析采用cox风险比例模型。分析趋化因子家族入选基因位点的潜在功能性遗传变异及其组合对食管癌患者死亡时间及远处转移等预后的影响。采用组织芯片分析方法,检测具有预后意义的snp位点所对应的趋化因子在食管癌组织及癌旁正常组织的表达水平以及预后意义。
通过生物信息学分析,筛选出趋化因子家族中13个基因(ccl16,ccl19,ccl23,ccl25,ccl26,ccr6,cx3cl1,cxcl10,cxcl12,cxcl16,cxcl2,cxcl9,cxcr6)的16个snp位点(ccl16rs2063979,ccl19rs2227302,ccl23rs1003645,ccl25rs1129763,ccl26rs2302009,ccr6rs3093005,cx3cl1rs2239352,cxcl2rs9131,cxcl9rs3733236,cxcl10rs3921,cxcl12rs1029153,cxcl12rs1801157,cxcl12rs2522,cxcl16rs1050998,cxcl16rs1051009,cxcr6rs936939)。
16个snp位点的基因型检测的成功率均高于90%,相关位点的最小等位基因频率(minorallelefrequency,maf;分别包括本试验数据及hapmap-hcb数据库中国人群数据)均大于0.05。哈迪温伯格平衡检验(hardy-weinbergequilibrium,hwe)均大于0.05。
单因素分析显示:女性患者中位生存期高于男性患者(67.61月vs58.41月,log-rankp=0.008);未分化、低分化、中分化、高分化级患者的中位生存期依次升高(mst未分化=20.5月、mst低分化=53.74月、mst中分化=63.66月、mst高分化=108.05月,log-rankp=0.01);临床早期食管癌患者的中位生存时间明显高于中晚期食管癌患者(132.19月vs84.11月,log-rankp<0.001);肿瘤最长径≤5cm者和>5cm者相比,肿瘤直径小者预后较好(63.68月vs42.18月,log-rankp<0.001)。
针对16个位点与食管癌术后患者的生存时间进行了不同遗传模型下的关联分析(包括显性模型、隐性模型、加性模型、共显性模型),结果发现,5个snps(ccl23rs1003645,ccl26rs2302009,cx3cl1rs2239352,cxcl9rs3733236和cxcl12rs1801157)的不同基因型携带者其生存时间可能存在差异(显性模型log-rankp<0.05的有ccl23rs1003645、ccl26rs2302009、cxcl9rs3733236;隐性模型log-rankp<0.05的有cx3cl1rs2239352;加性模型log-rankp<0.05的有ccl26rs2302009、cx3cl1rs2239352;共显性模型log-rankp<0.05的有ccl26rs2302009、cx3cl1rs2239352、cxcl9rs3733236、cxcl12rs1801157)。
多因素cox回归分析发现,有3个snps与食管癌术后患者的预后存在显著关联。在校正年龄、性别、病理类型、解剖学部位、病理分级、病理分型、tnm分期和肿瘤最长径因素后,ccl26rs2302009的杂合突变基因型a/c(a/cvsa/a:校正hr=1.571,95%ci=1.149-2.148;加性模型:校正hr=1.249,95%ci=1.07-1.459;显性模型:校正hr=1.249,95%ci=1.07-1.459)、cx3cl1rs2239352的纯合突变基因型t/t(t/tvsc/c:校正hr=6.726,95%ci=2.065-21.906)、cxcl9rs3733236的杂合突变基因型g/a(g/avsg/g:校正hr=1.44,95%ci=1.013-2.047)可以显著增加患者的死亡风险。对上述三个位点的危险基因型(ccl26rs2302009a/c、cx3cl1rs2239352t/t和cxcl9rs3733236g/a)进行联合分析表明,随着携带危险基因型个数的增加,患者死亡的风险在逐渐升高,呈现剂量-反应关系(ptrend<0.01)。与携带个数“0-1”的危险基因型的个体相比,携带个数“2”的危险基因型的个体死亡风险上升了303.7%(2vs0-1:校正hr=4.037,95%ci=2.276-7.161)。表明在全变量模型中,趋化因子家族中ccl26rs2302009、cx3cl1rs2239352和cxcl9rs3733236的遗传变异与食管癌患者的预后有关联。
因此本发明提供了趋化因子家族的ccl26基因的snp位点、cx3cl1基因的snp位点和cxcl9基因的snp位点中至少一种在制备食管癌患者术后的预后的标志物中的应用。
其中,所述ccl26基因的snp位点为ccl26rs2302009,cx3cl1基因的snp位点为cx3cl1rs2239352,cxcl9基因的snp位点为cxcl9rs3733236。
进一步通过对ccl26rs2302009单核苷酸多态性的检测,得出ccl26rs2302009的杂合突变基因型a/c可能是食管癌术后患者预后的独立预测因子。且通过分层分析得出ccl26rs2302009a/c的危险效应在≤60岁患者、女性患者、鳞癌患者、肿瘤位于食管中1/3、病理低分化类型患者、肿瘤类型为糜烂性患者、tnm分期为ⅲ期的患者、肿瘤大小(最长径)≤5cm的患者中更为显著。
因此,进一步提供了趋化因子家族的ccl26基因的snp位点ccl26rs2302009在制备食管癌患者术后的预后的标志物中的应用。
本发明还提供了一种检测食管癌患者术后的预后的方法,根据趋化因子家族的ccl26基因的snp位点、cx3cl1基因的snp位点和cxcl9基因的snp位点的基因型评估食管癌患者术后的预后;所述ccl26基因的snp位点为ccl26rs2302009,cx3cl1基因的snp位点为cx3cl1rs2239352,cxcl9基因的snp位点为cxcl9rs3733236。
进一步的,所述基因snp位点的基因型的检测方法为:提取食管癌患者dna样品,进行多重pcr反应,纯化多重pcr产物,进行连接反应,然后测序分析。
ccl26rs2302009的杂合突变基因型a/c、cx3cl1rs2239352的纯合突变基因型t/t、cxcl9rs3733236的杂合突变基因型g/a可以显著增加患者的死亡风险。且随着携带危险基因型个数的增加,患者死亡的风险在逐渐升高,呈现剂量-反应关系(ptrend<0.01)。与携带个数“0-1”的危险基因型的个体相比,携带个数“2”的危险基因型的个体死亡风险上升了303.7%。
本发明还提供了ccl26基因snp位点ccl26rs2302009的扩增引物对,所述扩增引物对的核苷酸序列如seqidno:1-2所示。
其中,rs2302009f:tctgggaggaaacaccctctcc(seqidno:1);
rs2302009r:ccaaggaaaaaatgggtgcaaaa(seqidno:2)。
本发明还提供了cx3cl1基因snp位点cx3cl1rs2239352的扩增引物对,所述扩增引物对的核苷酸序列如seqidno:3-4所示。
其中,rs2239352f:tgttctctgccctccaagacct(seqidno:3);
rs2239352r:gccaaaaaagggaacccctgac(seqidno:4)。
本发明还提供了cxcl9基因snp位点cxcl9rs3733236的扩增引物对,所述扩增引物对的核苷酸序列如seqidno:5-6所示。
其中,rs3733236f:gaaagcacttctgtggggtgttg(seqidno:5);
rs3733236r:ccgctcaggctgaccactttat(seqidno:6)。
本发明还提供了一种评估食管癌患者术后的预后情况的试剂盒,包括:
(1)所述扩增ccl26基因snp位点ccl26rs2302009的扩增引物对;和/或
(2)所述扩增cx3cl1基因snp位点cx3cl1rs2239352的扩增引物对;和/或
(3)所述扩增cxcl9基因snp位点cxcl9rs3733236的扩增引物对。
进一步的,所述评估食管癌患者术后的预后情况的试剂盒还包括扩增反应常用的酶和试剂。
本发明利用食管癌组织芯片检测cx3cl1的表达水平,结果发现cx3cl1在食管癌组织中的表达水平明显高于癌旁正常组织(p=0.001)。因此本发明还提供了cx3cl1在制备食管癌标志物中的应用。
本发明还提供了一种食管癌辅助判断的试剂盒,包括cx3cl1的引物。
进一步的,在一些实施方案中,所述cx3cl1的引物序列如:
(a)seqidno.7和seqidno.8所示;或
(b)seqidno.9和seqidno.10所示。
其中seqidno.7:ctgggcgtccttatcactcc;
和seqidno.8:ctcctgccatctttcgaggg。
seqidno.9:caccacggtgtgacgaaatg;
和seqidno.10:atctgcttctcgaaggtgcc。
本发明所述食管癌辅助诊断的试剂盒还包括pcr反应常用的酶和试剂。
由上述技术方案可知,本发明提供了一种食管癌患者术后的预后标志物以及用于评估食管癌患者术后的预后情况的试剂盒。趋化因子家族的ccl26基因的snp位点、cx3cl1基因的snp位点和cxcl9基因的snp位点中至少一种的遗传变异与食管癌患者的预后有关联,可以作为食管癌患者术后的预后的标志物,用于辅助评估食管癌患者术后预后情况。本发明所述辅助判断食管癌患者术后的预后情况的试剂盒可以快速、灵敏、特异的用于临床辅助对食管癌的个体化预后进行评估,为临床医生快速评价治疗效果奠定基础。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
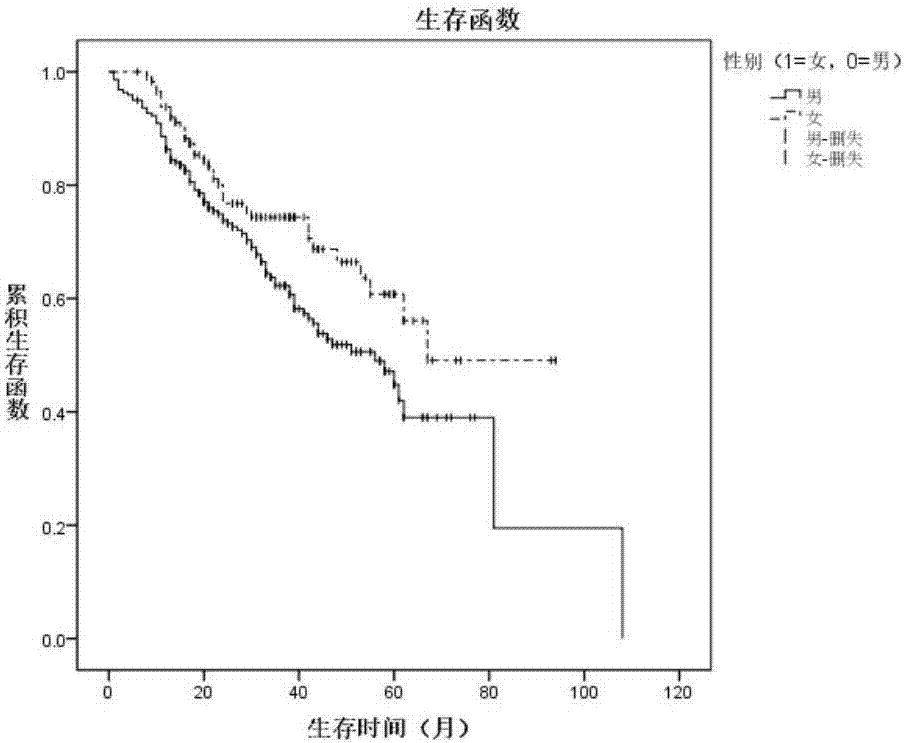
图1示不同性别间生存曲线比较;
图2示不同病理分级间生存曲线比较;
图3示不同病理分型间生存曲线比较;
图4示不同分期的病理分型间生存曲线比较;
图5示不同肿瘤最长径分组间生存曲线比较;
图6示ccl26rs2302009不同基因型对食管癌预后影响的生存曲线;
图7示携带不同数目危险基因型对食管癌预后影响的生存曲线;
图8示年龄≤60岁时ccl26rs2302009分层分析生存曲线;
图9示女性时ccl26rs2302009分层分析生存曲线;
图10示鳞癌时ccl26rs2302009分层分析生存曲线;
图11示肿瘤位于食管中1/3处时ccl26rs2302009分层分析生存曲线;
图12示病理低分化时ccl26rs2302009分层分析生存曲线;
图13示病理类型糜烂型时ccl26rs2302009分层分析生存曲线;
图14示tnm-ⅲ期时ccl26rs2302009分层分析生存曲线;
图15示肿瘤最长径≤5cm时ccl26rs2302009分层分析生存曲线;
图16示cx3cl1在食管癌及癌旁组织中的免疫组化染色情况;其中图a为cx3cl1在癌旁组织中的免疫组化染色图,图b为cx3cl1在食管癌组织中的免疫组化染色图;
图17示食管癌患者总体生存曲线;
图18示食管癌不同性别间生存曲线比较;
图19示食管癌不同病理分型间生存曲线比较;
图20示食管癌不同tnm分期间生存曲线比较;
图21示食管癌不同肿瘤最长径分组间生存曲线比较。
具体实施方式
下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1、一般特征描述
在我国食管癌高发区(河北磁县)选择2004年1月至2014年7月间确诊的729例食管癌病例为研究对象,收集所有病例标本及临床资料。从2005年5月开始对术后患者进行随访,2015年8月随访终止。所有病例均经病理组织学明确诊断。患者无其他肿瘤病史,入院前未接受过化疗或放疗。所有研究对象食管癌组织标本的取材均事先向患者及/或家属详细解释,征得患者及/或家属的同意后签署《知情同意书》。收集患者的临床资料,内容包括姓名、性别、出生日期、住址、联系电话、肿瘤解剖学部位、肿瘤形态、病理分级、病理分型、tnm分期、肿瘤最长径、手术时间等。临床资料使用excel软件录入后供分析使用。出院后第一年每半年随访一次,以后每一年随访一次。随访内容包括后继治疗(是否接受放化疗、放化疗时间)、复发转移(是否复发或转移、复发转移时间)以及死亡情况(是否死亡、死亡原因、死亡日期)等。
随访时间截止至2015年08月01日,共有676例患者成功完成随访,其中53例患者因为无正确的联系方式、联系方式改变或拒绝访问而失访,成功随访率为92.7%。成功随访者与失访者一般情况的比较见表1。随访者与失访者在年龄、性别、解剖学部位、组织类型、病理分级、tnm分期、肿瘤最长径之间无显著性统计学差异。随访者与失访者在病理分型上的差异有统计学意义(p=0.03),病理分型分组,食管癌早期与食管癌中晚期之间的差异有统计学意义(p=0.022)。
表1成功随访者与失访者一般情况的比较
a其他类型包括腺样囊性癌、粘液表皮样癌、肉瘤、小细胞癌以及未分化癌
b方差不齐情况下的satterthwaite近似t检验
实施例2、单因素分析
对所有随访病例进行单因素分析。
表2食管癌患者生存资料的单因素分析
a其他类型包括腺样囊性癌、粘液表皮样癌、肉瘤、小细胞癌以及未分化癌
b其他类型包括食管未特指
如表2所示,食管癌手术后患者共得到预期结局事件(死亡)241例(35.7%),全组患者中位生存期(mediumsurvivaltime,mst)为65.3个月。年龄分组(≤60岁,>60岁)、病理类型(鳞癌,腺癌,其他)、解剖学部位(食管近端1/3,食管近端1/3、食管中1/3,食管中1/3,食管中1/3、食管远端1/3,食管远端1/3,其他b)、tnm分期(0期,ⅰ期,ⅱ期,ⅲ期,ⅳ期)相应组别间的生存时间均无统计学意义(log-rankp>0.05)。
女性患者中位生存期高于男性患者(67.61月vs58.41月,log-rankp=0.008);未分化、低分化、中分化、高分化级患者的中位生存期依次升高(mst未分化=20.5月、mst低分化=53.74月、mst中分化=63.66月、mst高分化=108.05月,log-rankp=0.01);临床早期食管癌患者的中位生存时间明显高于中晚期食管癌患者(132.19月vs84.11月,log-rankp<0.001);肿瘤最长径≤5cm者和>5cm者相比,肿瘤直径小者预后较好(63.68月vs42.18月,log-rankp<0.001)。具体生存曲线的比较情况见图1-5。
采用生物信息学方法筛选趋化因子家族基因的潜在功能性多态位点。候选基因包括趋化因子家族中的因子及其受体(共77个)的所有基因。使用hapmap数据库(www.hapmap.org)进行多态性位点的选择,选点原则包括:
(1)位于5′非翻译区(utrs),外显子区,3′非翻译区等潜在功能性区域。
(2)在中国人群中的最小等位基因频率(minorallelefrequency,maf)≥0.05。
(3)如果多个位点间存在高连锁不平衡(linkagedisequilibrium,ld)(r2≥0.80),仅选择其中一个位点作为代表。
(4)再通过ncbidbsnps数据库(http://www.ncbi.nlm.nih.gov/snp/)进行复检。
通过生物信息学分析,筛选出趋化因子家族中13个基因(ccl16,ccl19,ccl23,ccl25,ccl26,ccr6,cx3cl1,cxcl10,cxcl12,cxcl16,cxcl2,cxcl9,cxcr6)的16个snp位点(ccl16rs2063979,ccl19rs2227302,ccl23rs1003645,ccl25rs1129763,ccl26rs2302009,ccr6rs3093005,cx3cl1rs2239352,cxcl2rs9131,cxcl9rs3733236,cxcl10rs3921,cxcl12rs1029153,cxcl12rs1801157,cxcl12rs2522,cxcl16rs1050998,cxcl16rs1051009,cxcr6rs936939)。在进行基因型检测的17个snps中,有1个位点rs3136667因结果认为该位点在ncbi中为c/g/a的三态,同时处在缺失位点rs199900344中,并且两侧为g,故无法设计延伸引物而被剔除。
16个snp位点的基因型检测的成功率均高于90%,相关位点的最小等位基因频率(minorallelefrequency,maf;分别包括本试验数据及hapmap-hcb数据库中国人群数据)均大于0.05。哈迪温伯格平衡检验(hardy-weinbergequilibrium,hwe)均大于0.05。所处基因、位置等基本信息亦见于表3。
针对16个位点与食管癌术后患者的生存时间进行了不同遗传模型下的关联分析(包括显性模型、隐性模型、加性模型、共显性模型),结果发现,5个snps(ccl23rs1003645,ccl26rs2302009,cx3cl1rs2239352,cxcl9rs3733236和cxcl12rs1801157)的不同基因型携带者其生存时间可能存在差异(显性模型log-rankp<0.05的有ccl23rs1003645、ccl26rs2302009、cxcl9rs3733236;隐性模型log-rankp<0.05的有cx3cl1rs2239352;加性模型log-rankp<0.05的有ccl26rs2302009、cx3cl1rs2239352;共显性模型log-rankp<0.05的有ccl26rs2302009、cx3cl1rs2239352、cxcl9rs3733236、cxcl12rs1801157)。
表3所有候选基因位点的位置及基因型检测信息
实施例3、多因素分析
对上述5个snps与食管癌术后患者的预后进一步进行了多因素回归分析。
多因素cox回归分析表明,有3个snps与食管癌术后患者的预后存在显著关联(表4)。在校正年龄、性别、病理类型、解剖学部位、病理分级、病理分型、tnm分期和肿瘤最长径因素后,ccl26rs2302009的杂合突变基因型a/c(a/cvsa/a:校正hr=1.571,95%ci=1.149-2.148;加性模型:校正hr=1.249,95%ci=1.07-1.459;显性模型:校正hr=1.249,95%ci=1.07-1.459)、cx3cl1rs2239352的纯合突变基因型t/t(t/tvsc/c:校正hr=6.726,95%ci=2.065-21.906)、cxcl9rs3733236的杂合突变基因型g/a(g/avsg/g:校正hr=1.44,95%ci=1.013-2.047)可以显著增加患者的死亡风险。
表4位点不同基因型与食管癌术后患者预后死亡风险的关联分析
a校正因素包括年龄、性别、病理类型、解剖学部位、病理分级、病理分型、tnm分期和肿瘤最长径。b危险基因型包括ccl26rs2302009a/c,cx3cl1rs2239352t/t和cxcl9rs3733236g/a
对上述三个位点的危险基因型(ccl26rs2302009a/c,cx3cl1rs2239352t/t和cxcl9rs3733236g/a)进行联合分析表明,随着携带危险基因型个数的增加,患者死亡的风险在逐渐升高,呈现显著的剂量-反应关系(ptrend<0.01)。生存曲线如图6所示,此外,与携带个数“0-1”的危险基因型的个体相比,携带个数“2”的危险基因型的个体死亡风险上升了303.7%(2vs0-1:校正hr=4.037,95%ci=2.276-7.161)。
为进一步阐明食管癌术后患者的预后相关的独立预测因子,对于年龄、性别、病理类型、解剖学部位、病理分级、病理分型、tnm分期和肿瘤最长径以及3个snps的单独效应进行了逐步回归分析。结果见表5,ccl26rs2302009c/a(p=0.006,校正hr=1.537,95%ci=1.133-2.085)、病理分级(p=0.011)、病理分型(p=3.27×10-4)、肿瘤最长径分组(p=0.003)进入最终的回归模型,逐步回归分析发现,仅ccl26rs2302009的杂合突变基因型a/c(p=0.006,校正hr=1.537,95%ci=1.133-2.085)是食管癌术后患者预后的独立预测因子。ccl26rs2302009不同基因型的生存曲线如图7所示。
表5位点效应和其他临床因素的逐步回归分析
实施例4、分层分析
进一步以年龄、性别、病理类型、解剖学部位、病理分级、病理分型、tnm分期、肿瘤最长径为分层变量进行了分层分析。结果如表6所示,ccl26rs2302009a/c的危险效应在≤60岁患者(校正hr=1.639,95%ci=1.133-2.371)、女性患者(校正hr=2.329,95%ci=1.403-3.865)、鳞癌患者(校正hr=1.387,95%ci=1.018-1.89)、肿瘤位于食管中1/3(校正hr=1.583,95%ci=1.102-2.276)、病理低分化类型患者(校正hr=2.025,95%ci=1.169-3.507)、肿瘤类型为糜烂性患者(校正hr=4.649,95%ci=1.713-12.617)、tnm分期为ⅲ期的患者(校正hr=1.907,95%ci=1.123-3.238)、肿瘤大小(最长径)≤5cm的患者(校正hr=1.518,95%ci=1.083-2.128)中更为显著。分层分析的生存曲线如图8-15所示。
表6ccl26rs2302009与食管癌手术患者预后的分层分析
实施例5、组织芯片分析
1、癌和癌旁表达情况的比较
采用组织芯片研究具有预后意义的snp位点所对应的趋化因子,检测其在食管癌组织及癌旁正常组织的表达水平以及预后意义。食管癌组织芯片购于上海芯超生物科技有限公司,阵列编号cgtno.:heso-squ180sur-04,芯片批号lotno.:xt15-012,包括100例食管癌及80例癌旁食管组织的食管癌180点组织芯片标本。用免疫组化方法检测了100例食管癌患者和80例癌旁正常组织中cx3cl1的表达,观察cx3cl1在细胞质和/或细胞核中的阳性染色。结果如表7所示,cx3cl1在食管癌组织中的表达明显高于癌旁组织(p=0.001)。食管癌组织中,cx3cl1低表达例数为2/100例(2%),cx3cl1高表达例数为98/100(98%),具体表达情况见图16。
表7cx3cl1在食管癌及癌旁组织中的差异表达
2、cx3cl1表达与临床资料的关系
进一步分析cx3cl1表达与临床资料的关系,结果见表8
表8cx3cl1的表达和食管癌患者临床病理资料的相关性
3、cx3cl1表达与预后的关系
采用kaplan-meier法分析cx3cl1表达与总生存期之间的关系,并采用log-rank检验进行生存曲线的比较。结果显示,所有的食管癌患者的中位生存时间为19个月。总体生存曲线如图17所示。
如表9所示,对所有随访食管癌患者进行单因素分析及生存曲线的比较。年龄分组(≤60岁,>60岁)、解剖学部位(食管近端1/3,食管中1/3,食管中1/3、食管远端1/3,食管远端1/3,食管)、病理分级(高分化,中分化,低分化)、免疫组化评分(cx3cl1低表达,cx3cl1高表达)相应组别间的生存时间均无统计学意义(log-rankp>0.05)。
表9食管癌患者的基本信息及临床特征
男性74例(74%),女性26例(26%),女性预后明显优于男性(log-rankp=0.024,hr=0.542,95%ci=0.313-0.938)。根据癌组织的病理分型,食管癌患者的中位生存时间长短排列如下:蕈伞型>斑块型>髓质型>溃疡型(mst分别为70,55,26.25和15.38),随着tnm分期逐渐升高,食管癌患者的生存时间显著缩短(ⅰ期-ⅲ期患者的mst从73月降低至75月)(log-rankp=1.6×10-4)。此外,肿瘤最长径≤5cm者和>5cm者的中位生存时间分别为27个月和14个月,与直径大者相比,直径小者预后情况明显好(log-rankp=0.005)。具体生存曲线情况见图18-21。
为了排除年龄、性别等因素的影响,识别影响食管癌生存的独立预后因素,采用多因素cox回归分析。tnm分期(hr=2.357,95.0%ci=1.385-4.011,p=0.002)、肿瘤最长径(hr=1.776,95.0%ci=1.072-2.943,p=0.026)显著影响患者预后的总体生存期(表10)。其他因素,包括年龄、性别、解剖学部位、病理分级,病理分型,包括免疫组化评分都未能发现会对患者预后产生影响(p>0.05)。
表10多因素cox回归分析影响患者预后的各种独立因素
实施例6、检测食管癌患者术后具有预后意义的snp位点的方法
1、实验操作步骤:
1)dna样本取1μl1%agarose电泳对其样本进行质量检查以及浓度估计,然后根据估计的浓度将样本稀释到工作浓度5-10ng/μl。
2)多重pcr反应:
a)pcr引物
rs1003645f:ggcaacttgtgtcccttcacctt
rs1003645r:tttctgtgccaaccccagtgat
rs1029153f:ttgccttctgccatgaagctc
rs1029153r:aacaaggaagtcaaagcaaggaaac
rs1050998f:cgcagtgtgaatggtggtttca
rs1050998r:tgtggcccaccagaagcattta
rs1051009f:ccatgttgtcaggggtcagtctc
rs1051009r:cctttccagatctgccggttc
rs1129763f:tgaagctcctggatgctcgaaat
rs1129763r:ggggttcaggcaggtgtcagta
rs1801157f:atgagggctgggtctcactctg
rs1801157r:tcacccccttctccatccacat
rs2063979f:tgtggagaagcccctgaaaaaa
rs2063979r:gctttgcaggacagggaaagaa
rs2227302f:atctgggggtggagcagcttta
rs2227302r:accgaggaccagaaggaaggac
rs2239352f:tgttctctgccctccaagacct
rs2239352r:gccaaaaaagggaacccctgac
rs2302009f:tctgggaggaaacaccctctcc
rs2302009r:ccaaggaaaaaatgggtgcaaaa
rs2522f:gggcaaaagtattcgtaagactgaatg
rs2522r:ttggagtgttccccttccactg
rs3093005f:tttccctgggagctgttctctg
rs3093005r:aaaccccaacttcattacgattcatt
rs3733236f:gaaagcacttctgtggggtgttg
rs3733236r:ccgctcaggctgaccactttat
rs3921f:caggagtagtagcagctgatttggtga
rs3921r:ggggagcaaaatcgatgcagt
rs9131f:catacatttccctgccgtcacat
rs9131r:gccactgtgatagaggctgagga
rs936939f:ggcactttggtccctggaaaga
rs936939r:cagaatctctgccagcaaagtcaa
b)pcr条件(2×gc-i)
pcr反应体系(20μl):1×gc-ibuffer(takara.),3.0mmmg2+,0.3mmdntp,1uhotstartaqpolymerase(qiageninc.),1μl样本dna和1μl多重pcr引物。其中rs1801157f/r和rs2227302f/r引物的浓度为2μm,其余引物的浓度为1μm。
pcr循环程序:
3)多重pcr产物纯化
在10μlpcr产物中加入5usap酶和2uexonucleasei酶,37℃温浴1小时,然后75℃灭活15分钟。
4)连接反应
a)连接引物
rs1801157rp:ggtctgcctcttctgggaggttttttt
rs2227302fp:tcaggtctggtgcagaggagctttttt
rs1050998fp:ttggggggctggtaggaagtttttttttt
rs1129763rp:tgttgtggyggagctttgcattttttttt
rs3093005fp:agcggagttccagcaaacaatttttttttt
rs2239352rp:tgaaggagaaggtcttggagggtttttttttt
rs1003645fp:gcaaacctgaacttgcttatcactgttttttttt
rs1051009rp:ttgtgagggtaaactgtggcttattctttttttt
rs9131fp:actggccattttcttggattcctttttttttttt
rs936939fp:agtcaggactcaaagtcagcgacatttttttttt
rs1029153fp:tcactataatttacttcctacttcctacatgttaca
rs2522rp:gggtttttgttttgtttttcattcagtttttttttt
rs3921fp:attggtcaccttttagtgtaactgcaattttttttt
rs3733236fp:gagttgactcagataaatcagagcatatgattttttt
rs2302009fp:aattcagctgagtcacaattgtttcgtttttttttttt
rs1801157rc:ttccgcgttcggactgatatctccatccacatgggagacg
rs2063979rp:catgcaataaataaaactcccttatttgactttttttttt
rs2227302fa:tgttcgtgggccggattagtccaggccctgtcctggcaga
rs1050998fg:ttccgcgttcggactgatatccccctctgaggcctgagtag
rs1129763rt:tgttcgtgggccggattagtgcccaccttggaaggtctcca
rs1801157rt:tacggttattcgggctcctgtctccatccacatgggagaca
rs2239352rt:tgttcgtgggccggattagttgtctgcggtggggacaacga
rs2302009fc:ttccgcgttcggactgatatgtccaagcgtcctcggatcac
rs1050998fa:tacggttattcgggctcctgtccccctctgaggcctgagcaa
rs2227302fg:tctctcgggtcaattcgtccttccaggccctgtcctggcagg
rs2302009fa:tacggttattcgggctcctgtgtccaagcgtcctcggatcaa
rs9131fc:ttccgcgttcggactgatattccctgccgtcacattgatgtc
rs936939fa:tgttcgtgggccggattagtcagcatcggagacactgctgca
rs1129763rc:tctctcgggtcaattcgtccttgcccaccttggaaggtcttcg
rs2239352rc:tctctcgggtcaattcgtcctttgtctgcggtggggacaatgg
rs3093005fc:ttccgcgttcggactgatattcacagctgtgctctgagtgacc
rs9131ft:tacggttattcgggctcctgttccctgccgtcacattgatgtt
rs3093005ft:tacggttattcgggctcctgttcacagctgtgctctgagtgact
rs936939fc:tctctcgggtcaattcgtccttcagcatcggagacactgctacc
rs1003645ft:tgttcgtgggccggattagtgtgtgtccagcttcagcattctgat
rs3733236fa:tgttcgtgggccggattagtgggtgttggggacaagatgagacaa
rs2522rg:ttccgcgttcggactgatatcacttttgacaaaggcaagcactagc
rs1003645fc:tctctcgggtcaattcgtccttgtgtgtccagcttcagcattctgac
rs2522ra:tacggttattcgggctcctgtcacttttgacaaaggcaagcactggt
rs3733236fg:tctctcgggtcaattcgtccttgggtgttggggacaagatgagacag
rs2063979rc:ttccgcgttcggactgatatggggtaaactcttagtccaaaaccctag
rs2063979rt:tacggttattcgggctcctgtggggtaaactcttagtccaaaaccccaa
rs3921fg:ttccgcgttcggactgatatgagtagtagcagctgatttggtgaccttg
rs3921fc:tacggttattcgggctcctgtgagtagtagcagctgatttggtgaccttc
rs1051009ra:tgttcgtgggccggattagttgactctaatacctgagccaagaatggacgt
rs1051009rg:tctctcgggtcaattcgtcctttgactctaatacctgagccaagaatggatgc
rs1029153fa:tgttcgtgggccggattagttattaaattcaagaacagttacaattcaagattcca
rs1029153fg:tctctcgggtcaattcgtcctttattaaattcaagaacagttacaattcaagatttcg
(注:引物中y,r,k,m代表兼并碱基,分别为c/t,g/a,g/t,a/c)
b)连接反应
反应体系:10×连接缓冲液1μl、高温连接酶0.25μl、5’连接引物混合液(1μm)0.4μl,3’连接引物混合液(2μm)0.4ul、纯化后多重pcr产物2μl、ddh2o6μl混匀。
连接程序:
3)连接产物上abi3730xl测序仪
取0.5μl稀释后的连接产物,与0.5μlliz500sizestandard,9μlhi-di混匀,95℃变性5分钟后上abi3730xl测序仪。
4)abi3730xl测序仪上收集的原始数据用genemapper4.1(appliedbiosystems,usa)来分析。
2、检测结果见表11
表11snp检测结果
注:“—”示没有分型成功
统计表11结果,见表12。
表12snp位点检测结果统计
sequencelisting
<110>广东医科大学
<120>趋化因子家族基因snp位点的应用及检测引物与试剂盒
<130>mp1616409
<160>10
<170>patentinversion3.3
<210>1
<211>22
<212>dna
<213>人工序列
<400>1
tctgggaggaaacaccctctcc22
<210>2
<211>23
<212>dna
<213>人工序列
<400>2
ccaaggaaaaaatgggtgcaaaa23
<210>3
<211>22
<212>dna
<213>人工序列
<400>3
tgttctctgccctccaagacct22
<210>4
<211>22
<212>dna
<213>人工序列
<400>4
gccaaaaaagggaacccctgac22
<210>5
<211>23
<212>dna
<213>人工序列
<400>5
gaaagcacttctgtggggtgttg23
<210>6
<211>22
<212>dna
<213>人工序列
<400>6
ccgctcaggctgaccactttat22
<210>7
<211>20
<212>dna
<213>人工序列
<400>7
ctgggcgtccttatcactcc20
<210>8
<211>20
<212>dna
<213>人工序列
<400>8
ctcctgccatctttcgaggg20
<210>9
<211>20
<212>dna
<213>人工序列
<400>9
caccacggtgtgacgaaatg20
<210>10
<211>20
<212>dna
<213>人工序列
<400>10
atctgcttctcgaaggtgcc20
- 还没有人留言评论。精彩留言会获得点赞!