一种基于萤光素校正的细胞碱性磷酸酶活性检测方法在药物筛选中的应用与流程
本发明属于生物医药领域,涉及一种检测细胞中碱性磷酸酶活力的方法,尤其涉及一种基于萤光素校正的细胞碱性磷酸酶活性检测方法在药物筛选中的应用。
背景技术:
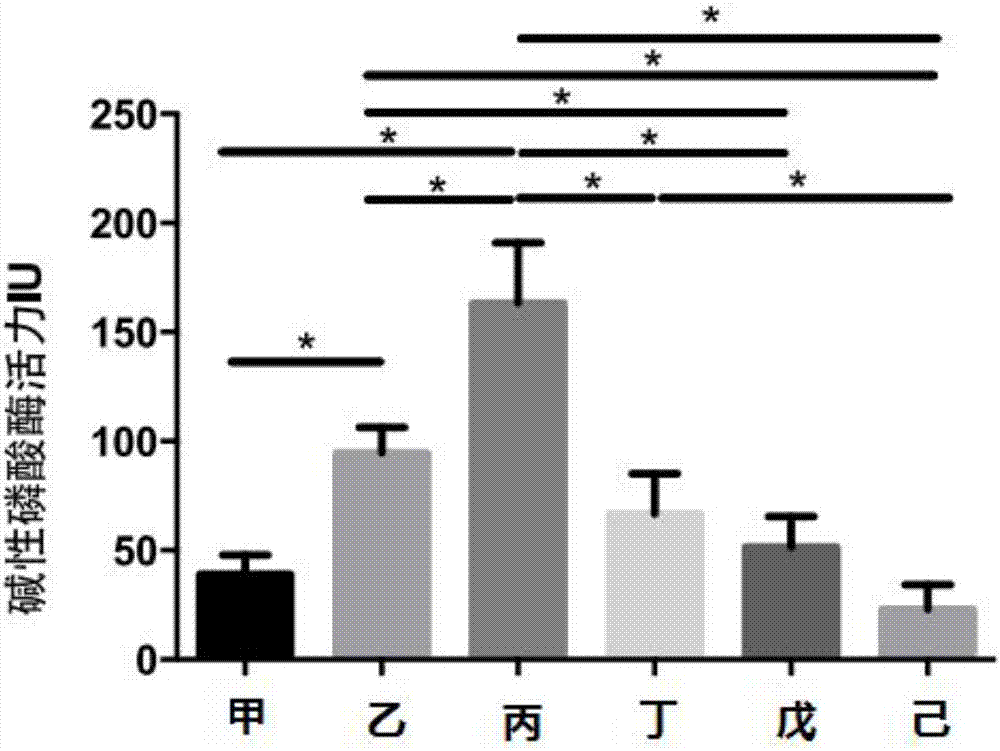
:骨质疏松即骨质疏松症,是多种原因引起的一组骨病,骨组织有正常的钙化,钙盐与基质呈正常比例,以单位体积内骨组织量减少为特点的代谢性骨病变。骨的生成与吸收是一个动态平衡,由成骨细胞介导的骨生成和破骨细胞接到的骨吸收两个过程动态的调控。当骨吸收速度超过骨形成时,会出现骨量减少,发生骨质疏松症。碱性磷酸酶的活性常作为骨代谢的标志物,由于碱性磷酸酶的功能与成骨过程密切相关,故而碱性磷酸酶活性属于特征性的骨形成代谢指标。利用碱性磷酸酶可以在碱性环境中催化底物产生显色或荧光反应,从而可以量化检测不同样本中碱性磷酸酶的活性。现有技术主要通过改进显色底物从而提高碱性磷酸酶活力检测的灵敏度。如公布号为cn1322255的碱性磷酸酶检测方法用450nm左右的检测波长进行测定并提出了消减血红蛋白干扰的方法。又如公布号为cn103645185a的方法,将酶促金属化和纳米金诱导银沉积相结合,提高了检测碱性磷酸酶的灵敏度。而公布号为cn104109176a的专利申请,则将荧光探针应用于碱性磷酸酶活性的荧光检测,其精确度和灵敏度都有很大的提高。但是在药物实验中比如药物筛选实验中,不同浓度药物溶剂或者助剂对细胞生长进行干预的情况下,往往导致药物干预后细胞发生部分的失活、凋亡或者死亡,导致每个样本的细胞数量改变,进而每个样本的碱性磷酸酶活性变化不能准确表现药物对单位细胞中碱性磷酸酶活性的影响。常规细胞活力检测方法为显色反应(如mtt法或cck8法),但是由于碱性磷酸酶的活力检测通常依赖于显色反应进行标定,这些常规的方法不适合细胞中碱性磷酸酶活性检测,会干扰实验的准确性。而现有技术对碱性磷酸酶活性检测,均未考虑药物或药物溶剂的毒性度细胞本身的影响,这些方法尚不适用于药物筛选。技术实现要素:所要解决的问题:针对以上问题,本发明提供能够同时检测细胞碱性磷酸酶活力并且量化细胞活力的检测方法,有效避免药物实验不同浓度药物溶剂或者助剂对细胞产生的影响,增加药物试验的可靠性,且本方法成本低,效率高。技术方案一种基于萤光素校正的细胞碱性磷酸酶活性检测方法在药物筛选中的应用,包括以下步骤:a、对培养的细胞进行基因工程修饰,导入非分泌型萤光素酶报告基因;b、转染细胞细胞后冷冻保存备用或移入容器中;c、加入药物干预d、吸弃培养液并洗涤,加入细胞裂解液裂解细胞,得到细胞裂解液;e、检测:取部分细胞裂解液加入含有萤光素酶发光底物的溶液得到样品,检测样品得到发光度值rlu;另取部分细胞裂解物或直接向发光检测后的样品中,加入碱性磷酸酶显色底物溶液,以空白裂解液校正检测产物吸光度;以分解产物为标准品溶液计算的标准曲线,标定样品分解产物产生量,为a;上述检测步骤均以空白裂解液位参比样品;f、根据得到的rlu与a比值,计算最终萤光素校正的细胞碱性磷酸酶活性q值,公式为q=a/rlu。常见的碱性磷酸显色底物中含有对硝基苯磷酸酯(p-nitrophenylphosphate,p-npp),其分解产物为对硝基酚(p-nitrophenol,p-np)。更进一步的,所述的非分泌萤光素酶报告基因为海肾萤光素酶报告基因、萤火虫萤光素酶报告基因、细菌萤光素酶基因;所述的a步骤处理细胞为成骨细胞系、原代成骨细胞。更进一步的,所述的非分泌萤光素酶报告基因为海肾萤光素酶报告基因;所述的成骨细胞为成骨细胞系mc3t3-e1或ros17/2.8细胞。更进一步的,所述的a步骤中,萤光素酶报告基因载体为细菌质粒,所述的载体启动子为cmv、sv40。更进一步的,所述的b步骤中,设有转染后再培养扩增细胞步骤。更进一步的,b步骤中所述的容器为加样板。更进一步的,步骤e中所述的发光底物为腔肠素、甲虫荧光素或还原型黄素单核苷酸;其中,所述的因为海肾萤光素酶报告基因对应发光底物为腔肠素(coelenterazine);所述的萤火虫萤光素酶报告基因对应发光底物为甲虫荧光素(luciferin);所述细菌萤光素酶基因的对应发光底物为还原型黄素单核苷酸(fmnh2)以上报告基因与发光底物在非分泌型萤光素酶为唯一对应关系。所述的碱性磷酸酶显色底物溶液为含有对硝基苯磷酸酯(p-nitrophenylphosphate,p-npp)的溶液;所述的分解产物为对硝基酚(p-nitrophenol,p-np);所述的e中使用细胞裂解液为np40(壬基酚聚氧乙烯醚)、triton(曲拉通)x-100、tween(吐温)-20、digitonin(洋地黄皂苷)或sapponin(皂素)等表面活性剂水溶液。更进一步的,所述的的细胞裂解液组成为:1%曲拉通x-100,1mm乙二胺四乙酸,5mm氯化镁,5%甘油,25mmtris-hcl缓冲液ph7.4,溶剂为超纯水;所述的海肾萤光素酶发光底物溶液组成为:所述的海肾萤光素酶发光底物溶液组成为:腔肠素2.5um,氯化钠1.1m,磷酸二氢钾0.22m,ph5.0,溶剂为超纯水;所述的萤火虫萤光素酶发光底物溶液组成为:25mm双甘氨肽,15mm磷酸二氢钾(ph8.0),4mm乙二醇二乙醚二胺四乙酸(egta),2mm三磷酸腺苷(atp),1mm二硫代苏糖醇,15mm硫酸镁,0.1mm辅酶a,75um甲虫荧光素。溶剂为超纯水。更进一步的,所述的检测碱性磷酸酶活性吸光度检测条件400-415nm检测吸光度,所述的检测条件为405nm;所述的检测萤光素酶吸光度检测条件为加入萤光素酶发光底物溶液,彻底混匀后10分钟内检测,检测时间为10秒;优选的条件为在21℃条件下逐孔加入,流速200ul/s,旋转震荡5s,旋转半径6mm,频率250rpmm,间隔5s,随后对该孔检测发光度10s。更进一步的,该方法可以应用于抗骨质疏松药物筛选实验。更进一步的,所述的碱性磷酸酶显色底物溶液组成为,10mmp-npp,10mmdea,0.5mm氯化镁(mgcl2),ph10.0,更进一步的,所述的alp检测缓冲液组成为:10mmdea,0.5mmmgcl2,ph10.0检测前将适量p-npp溶解于检测缓冲液中,配制成浓度为10mm的检测底物溶液,充分溶解和混匀,冰上放置。更进一步的,所述的分解产物pnp标准品溶液制备方法为:利用alp检测缓冲液稀释pnp为20µm、40µm、80µm、120µm、160µm、200µm对硝基酚储存液为0.5mm的pnp,按需要以检测缓冲液倍比稀释。所述的非分泌型萤光素酶报告基因为质粒,所述的表达海肾萤光素酶或萤火虫萤光素酶或细菌萤光素酶的质粒序列设计是公知的,且可在addgene等网站查到质粒设计并获得相关质粒,promega和origene等商业公司均可提供这些携带报告基因的质粒。a步骤之后的得到的转染后的细胞可以冷冻保存备用或移入容器中。有益效果本专利提供的技术方案通过结合萤光素酶报告基因手段达到量化细胞活力量化的目的,从而指示药物干预中细胞碱性磷酸酶活力和细胞活力两个维度的信息,并最终形成参数化指标反映不同药物对单个细胞碱性磷酸酶活力的影响。由于萤光素发光法检测的细胞数量具有宽广的线性范围,经过校正的碱性磷酸酶活性具有更加的可比性,可以更好的反映药物本身对碱性磷酸酶活性的影响,成功解决了高通量药物筛选中药物溶剂或助剂干扰碱性磷酸酶活性检测的问题,填补了技术上的空白。本方法不需要使用细胞内脱氢酶检测试剂,成本低且准确率高,快捷方便。这种快捷的检测方法更加适用于药物筛选中大量有效成分的高通量检测,且可以校正由于溶剂的细胞毒性对碱性磷酸酶活性测定带来的影响。当萤光素酶在细胞中通过事先转入的基因持续表达时,萤光素酶的活性呈时间和细胞数量相关的线性关系。萤光素酶检测的灵敏度高,底物成本低,反应速度快,可以在全自动酶标仪中自动完成,操作简单。碱性磷酸酶活性检测采用荧光显色反应,萤光素酶活力通过化学发光法测定,不影响碱性磷酸酶活力检测的显色反应,因此,两种检测的同时运用,可以综合考察药物对碱性磷酸酶活力和细胞活力的影响。在大规模药物筛选中,碱性磷酸酶活力检测往往采用细胞裂解液进行测定,这就对萤光素酶的选用提出了限制。为了与碱性磷酸酶检测综合应用,需要选用非分泌型萤光素酶如海肾萤光素酶和萤火虫萤光素酶等,防止丢弃培养液时损失信号。虽然同时需要检测碱性磷酸酶活性,但本方法既可以分为两步法检测,适应没有多功能酶标仪的实验室或检验科室,兼容性好;又可以利用全自动酶标仪连续在单一孔板中进行测定,无需更换孔板,更加方便快捷。细胞裂解液,裂解细胞效果彻底,但提取的蛋白活性可以保持。既可以支持碱性磷酸酶检测又可以支持各种萤光素酶检测。两步法加50ul细胞裂解液后取25ul做萤光素酶发光检测,另取25ul做碱性磷酸酶显色检测。全自动酶标仪法加25ul细胞裂解液后先检测萤光素酶发光,后直接加入碱性磷酸酶显色底物溶液进行检测。萤光素酶发光底物溶液,在不同细胞数量下具有宽广的线性范围。发光效果稳定,并兼容后续碱性磷酸酶检测。碱性磷酸酶显色底物溶液,利用ph改变彻底灭活萤光素酶,显色稳定。附图说明图1为实施例1中萤光素酶检测结果。图2为实施例1中未校正碱性磷酸酶检测结果。图3为实施例1中碱性磷酸酶校正检测结果。图4为实施例2中单独制备工具细胞结果。图5为实施例3中通过萤光素酶发光法校正细胞数量绘制的线性回归图。图6为实施例3中通过乳酸脱氢酶检测法(cck8试剂)校正细胞数量绘制的线性回归图。图7为实施例3根据萤光素酶活力计算出校正细胞活力后的各样本碱性磷酸酶活性q1。图8为实施例3中乳酸脱氢酶活力(cck8法)计算出校正细胞活力后的各样本碱性磷酸酶活性q2。具体实施方式实施例1:筛选一个复方中的有效抗骨质疏松成分(直接导入荧光素酶质粒)一、96孔板法制备表达萤火虫萤光素酶的成骨工具细胞1.取96孔培养板,转染前一日向每孔中加入4*104个mc3t3-e1成骨细胞进行培养,37℃、5%co2培养过夜。2.转染液制备:在聚苯乙烯管中制备以下两液(为转染1个孔细胞所用的量,以此类推)。a液:用不含血清培养基稀释萤光素酶过表达载体质粒(promega公司提供)加入量为0.2ug/50ul无血清培养基。注:pgl4.74[hrluc/tk]质粒载体编码海肾萤光素基因,并且通过sv40启动子进行高效表达,该质粒已经广泛用于哺乳动物细胞筛选应用。b液:用不含血清培养基稀释脂质体转染试剂fugenehd(promega公司提供),使用量为0.6ul/50ul无血清培养基。轻轻混合a液、b液,室温中置15分钟。3.转染:以ab复合物替换原有培养基,摇匀,置37℃温箱中6-24h,吸除无血清转染液,换入正常培养基继续培养。二、加药培养:已知一种中药复方,从中提取出6种有效成分,分别为甲乙丙丁戊己,由于极性不同,最终细胞培养液中须加入一定量有机溶剂。先将各有效成分干燥纯品分别溶解于溶剂后,再以培养基进行稀释,成为含有各药物的培养液以供进一步细胞实验使用。如:取一定量甲成分先溶解于无水dmso中,经超声震荡充分溶解后,以培养液稀释为1%后可以供细胞实验使用。以下有机溶剂含量均为体积比。药物组甲乙丙丁戊己含溶剂1%dmso0.1%dmso0.1%dmf1%甲醇0.1%dmso1%dmso所述的dmso为二甲基亚砜。dmf为二甲基甲酰胺。1.吸弃96孔板原有培养液,分别加入含有各药物的培养液继续培养,每种药物4个重复孔。2.本筛选方案用药物刺激5天,每天更换新鲜含药培养基。3.以不含钙镁离子的pbs缓冲液洗涤细胞。4.吸去pbs缓冲液。5.制备细胞裂解液裂解细胞:细胞裂解液组成为1%曲拉x-100,1mm乙二胺四乙酸,5mm氯化镁,5%甘油,25mmtris-hcl缓冲液ph7.4,溶剂为超纯水。6.96孔培养板中每个孔加50ul细胞裂解液(全自动酶标仪法则加25ul),室温下摇床中低速裂解30分钟((全自动酶标仪法则程序摇动孵育30分钟)。三、细胞碱性磷酸酶活性和萤光素酶活性的综合检测:取25ul细胞裂解物加入含有腔肠素(coelenterazine)的萤光素酶发光底物溶液,萤光素酶发光底物溶液配方为:腔肠素2.5um,氯化钠1.1m,磷酸二氢钾0.22m,ph5.0,溶剂为超纯水。coelenterazine平时以250um乙醇溶液避光保存,新鲜配制的显色底物溶液可在冰上放置6小时。现配现用。萤光素酶检测条件为在21℃条件下逐孔加入含有腔肠素的萤光素酶发光底物溶液,流速200ul/s,旋转震荡5s,旋转半径6mm,频率250rpmm,间隔5s,随后对该孔检测发光度10s。(萤光素酶检测结果见图1)另取25ul裂解物或直接向发光检测后的样品中,加入含有对硝基苯磷酸酯(p-nitrophenylphosphate,p-npp)的碱性磷酸酶显色底物溶液(10mmp-npp,10mmdea,0.5mmmgcl2,ph10.0),检测前将适量p-npp溶解于检测缓冲液(10mmdea,0.5mmmgcl2,ph10.0)中,配制成浓度为10mm的检测底物溶液,充分溶解和混匀,配置后冰上放置,现配现用。96孔培养板中每个孔加100ul碱性磷酸酶显色底物溶液,检测分解后410nm检测吸光度(以空白裂解液校正)。并以分解产物对硝基酚(p-nitrophenol,p-np)标准品溶液计算的标准曲线,标定样品p-np产生量,为a;(碱性磷酸酶单独检测结果见图2,*示差异具有统计学意义,p<0.05)数值计算:以裂解缓冲液调零,测得样品裂解物发光度值rlu;根据p-np标准曲线得出样品裂解液中碱性磷酸酶分解p-npp产生p-np的量a。通过计算公式q=a/rlu最终计算出校正细胞活力后的各样本碱性磷酸酶活性q。本实施例需给出具体数据和曲线图。(碱性磷酸酶校正检测结果见图3,*示差异具有统计学意义,p<0.05)从以上结果可以开出,若单独检测碱性磷酸酶活力,a/d药物之间,b/d药物之间,d/e药物之间均不体现出统计学意义,原因可能是d组试剂添加毒性较大的甲醇对细胞活力有影响所致。在校正了甲醇对细胞活力的影响之后,较好的体现出d组试剂实际可以促进碱性磷酸酶活力。而a/b药物之间,b/e药物之间,b/f药物之间,c/d药物之间在单独检测碱性磷酸酶活力时呈现假阳性,在通过荧光素酶校正之后有效地抑制了假阳性的发生。实施例2:筛选一个复方中的有效抗骨质疏松成分(独立制备工具细胞)除了直接利用96孔板进行转染和检测外,还可以利用单独进行细胞的制备和储存,以备筛选时利用。一、制备表达萤火虫萤光素酶的mc3t3-e1成骨细胞:1.取6孔培养板,转染前一日向每孔中加入4x105个mc3t3-e1成骨细胞进行培养,37℃、5%co2培养至40%-60%汇合。转染当天更换以2ml新鲜培养基。2.转染液制备:在聚苯乙烯管中制备以下两液(为转染1个孔细胞所用的量,以此类推)。a液:用不含血清培养基稀释含有萤火虫萤光素酶过表达载体质粒pgl4.51使浓度为4ug/250ul。b液:用不含血清培养基稀释lipofectamine2000脂质体试剂,浓度为10ul/250ul。轻轻混合a液、b液,室温中置15分钟。注:pgl4.51为promega公司提供的[luc2/cmv/neo]质粒。该质粒含有萤火虫荧光素酶基因,并由cmv启动子进行启动,该质粒还包含一个新霉素抗性基因,有助于高效的筛选出稳定表达pgl4.51的mc3t3发光工具细胞.转染:把a/b复合物缓缓加入培养基中,摇匀,置37℃温箱中6-24h,吸除无血清转染液,换入正常培养基继续培养。3.吸弃原有培养液,加入含有0.4mg/mlg410的培养液继续培养。4.每2天换新鲜培养液,直至细胞汇合度约90%-100%。5.以5毫升不含钙镁离子的pbs缓冲液洗涤细胞。6.吸去pbs缓冲液。7.以1毫升0.25%胰蛋白酶消化解离细胞(5分钟,37°c),随后以5ml含有血清的完全培养液终止消化。8.通过反复吹打将细胞分散,将细胞悬液转入离心管。9.以400g加速度离心5分钟。10.吸去原有培养液,将细胞以适量完全培养液(g418浓度降低为含有0.2mg/ml维持剂量)重悬。11.计数细胞后,以1×106每10cm2分装入培养瓶。12.每2-4天重复这一步骤以扩增细胞(保持约80%密度生长)13.随机取4份各50000个细胞进行裂解(方法同实施例1步骤5-6)并使用萤火虫萤光素酶活力验证。萤火虫萤光素酶发光底物溶液组成为:25mm双甘氨肽,15mm磷酸二氢钾(ph8.0),4mm乙二醇二乙醚二胺四乙酸(egta),2mm三磷酸腺苷(atp),1mm二硫代苏糖醇,15mm硫酸镁,0.1mm辅酶a,75um甲虫荧光素。溶剂为超纯水。配置时需最后加入三磷酸腺苷与甲虫荧光素,配置后冰上放置,现配现用。萤火虫萤光素酶检测条件为在21℃条件下逐孔加入含有甲虫荧光素的萤光素酶发光底物溶液,流速200ul/s,旋转震荡5s,旋转半径6mm,频率250rpmm,间隔5s,随后对该孔检测发光度10s。14.检测标准为:细胞在连续7天的含0.2mg/mlg418药物培养基中持续增殖,倍增时间小于72h;50000个细胞萤火虫萤光素酶活力不小于400000lum;细胞形貌保持成骨细胞的双角梭型且表达骨形成反应相关蛋白如胶原蛋白1,骨桥蛋白等。此时即为稳定表达pgl4.51的mc3t3发光工具细胞,可以按需予以冻存。15.使用该细胞做成骨活性药物筛选前,取冻存或培养的发光工具细胞按10000个细胞每孔接种于96孔板。以后步骤同实施例1中第二、三部分。筛选纯化细胞的方法可以增加工具细胞萤光素酶活力(图4),但对于检测碱性磷酸酶没有影响。独立制备工具细胞可更方便的随时检测药物成骨效能。实施例3萤光素校正的细胞碱性磷酸酶活性检测方法与既往方法的比较1.初步细胞数量检测能力的比较:将实施例2中的细胞按不同数量:0、800、4000、20000、100000每孔接种于96孔板中,分别通过萤光素酶发光法与乳酸脱氢酶检测法(cck8试剂)校正细胞数量。并借此分别绘制线性回归图,如图5。萤光素酶发光法检测方法同前文,而cck8法乳酸脱氢酶检测为一般技术,为本领域技术人员所公知。简述如下:在96孔板中接种细胞(培养液100μl/孔)。向每孔加入10μl的cck-8溶液并在培养箱内孵育2小时。用酶标仪测定在450nm处的吸光度。从图5、图6可见萤光素酶发光法检测细胞活力的线性范围宽广,细胞定量具有较高灵敏度和可靠性。然而常用的细胞活力定量方法—乳酸脱氢酶cck8测定法的线性范围较小,可检测的细胞数量范围更窄。2.碱性磷酸酶校正效果的比较:利用实施例2中方法对待测药物的碱性磷酸酶活力进行检测,并根据p-np标准曲线得出样品裂解液中碱性磷酸酶分解p-npp产生p-np的量a。根据乳酸脱氢酶活力(cck8法)计算出校正细胞活力后的各样本碱性磷酸酶活性q2。另根据萤光素酶活力计算出校正细胞活力后的各样本碱性磷酸酶活性q1。结果见图8。从图8可见由于cck8检测灵敏度较低,线性范围较窄,得出的q2数据质量较差难以反映两种药物之间的差异。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1