一种山药多糖提取方法与流程
本发明属于从天然原料中提取功能性生物大分子物质以生产功能性保健食品领域,具体涉及一种山药多糖提取方法。
背景技术:
山药(薯蓣属),大约有600余种品种,其中约有50余种在全球范围作为农作物商业种植,在潮湿的热带地区为约6000万人每日贡献200卡路里的能量。自古以来,山药就被认为具有药食同源的性质,中国第一部药学著作《神农本草经》就曾对山药的各种药效予以介绍。山药在预防和治疗糖尿病方面有很好的效果,对消化系统病症有明显的改善、在增强免疫功能、抗衰老等方面也具有积极的作用。大量研究表明,山药多糖是山药的主要活性成分之一,在体内,体外都存在生物活性,包括抗氧化性,降血糖,抗肿瘤和提高免疫力等。在食品加工方面,山药多糖也有很好的应用前景。
现有的提取方法大多将山药干燥成粉,采用水浸提、超声波破壁技术、微波破壁技术、或使用酶类使植物组织细胞破裂,使多糖易于溶出,之后采取乙醇沉淀的方法。采用热水浸提的方法成本低,耗时长,提取率不高;超声辅助提取时间短,效率高,但超声波有可能使可溶性多糖发生降解,超声波设备价格高,生产成本高;微波辅助提取高效、加热均匀,适用于对热稳定的产物,但是耗电量大、容易破坏多糖结构、有时会造成提取物分离困难,设备上适用于粉状、颗粒状等物料,对原料的状态有局限;酶解法能够有效去除细胞壁,但由于在温和条件下进行容易发生杂菌污染,且酶的价格高,过量的酶会引入蛋白质。
技术实现要素:
针对现有技术存在的问题,本发明提供一种利用超滤浓缩从鲜山药中提取山药多糖的方法。
本发明采用的技术方案为:
一种山药多糖提取方法,包括如下步骤:
1)以鲜山药为原料,经去皮,切块;
2)加入提取液,进行打浆,获得山药匀浆;
3)对山药匀浆进行离心,得山药匀浆离心上清液;
4)将山药匀浆离心上清液过滤除去淀粉,得滤液;
5)调节滤液ph,进行磁力搅拌,获得悬浮液;
6)将悬浮液离心,沉淀山药蛋白;
7)取上清液调节超滤ph、超滤温度和超滤压强进行超滤;
8)将截留的部分经过真空冷冻干燥后,得到山药多糖。
所述一种山药多糖提取方法,步骤2)提取液为ph=8.5的1%亚硫酸氢钠溶液;提取液的料液比为提取原料质量(g):提取液体积(ml)=1:2。
所述一种山药多糖提取方法,步骤3)的离心条件是将山药匀浆在6000转、4℃离心20min。
所述一种山药多糖提取方法,步骤5)调节滤液ph=3.5,磁力搅拌1h,获得悬浮液。
所述一种山药多糖提取方法,步骤6)的离心条件是将悬浮液在6000转、4℃离心20min,沉淀山药蛋白。
所述一种山药多糖提取方法,步骤7)上清液调节超滤ph=6-8,调节超滤温度20-40℃,调节超滤压强为0.03-0.05mpa,采用分子截留量为10000的超滤膜进行超滤。
所述一种山药多糖提取方法,调节超滤ph=6,调节超滤温度20℃,调节超滤压强为0.03mpa。
本发明具有以下有益效果:
本发明操作简单,易于实现,本发明利用了超滤浓缩法提取山药多糖,山药多糖提取率较高,高达88.69%,比传统的醇沉法(恒温浓缩)增加了10.77%,纯度提高了5.33%,因此,本方法的山药多糖提取率显著优于传统的醇沉法;本方法还利用响应面法优化提取条件、以提高产品的提取率,简化提取工艺。此外,还对所得山药多糖进行了成分测定、红外图谱分析、扫描电镜分析与抗氧化活性测定,更系统的评价了所得山药多糖的特点与功能。
附图说明
图1为本发明方法中超滤ph值对山药多糖提取率影响。
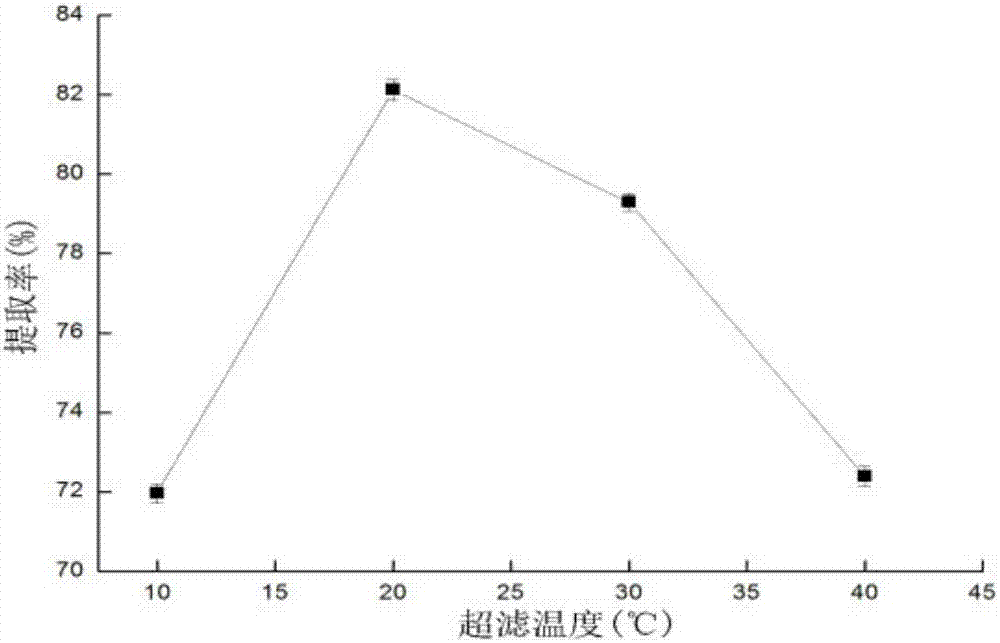
图2为本发明方法中超滤温度对山药多糖提取率影响。
图3为本发明方法中超滤压强对山药多糖提取率影响。
图4(a)为本发明超滤ph值与超滤温度对山药多糖提取率影响的响应面二维图。
图4(b)为本发明超滤ph值与超滤温度对山药多糖提取率影响的响应面三维图。
图4(c)为本发明超滤ph值与超滤压强对山药多糖提取率影响的响应面二维图。
图4(d)为本发明超滤ph值与超滤压强对山药多糖提取率影响的响应面三维图。
图4(e)为本发明超滤温度与超滤压强对山药多糖提取率影响的响应面二维图。
图4(f)为本发明超滤温度与超滤压强对山药多糖提取率影响的响应面三维图。
图5为本发明方法提取山药多糖的红外谱图。
图6(a)为本发明方法提取山药多糖100um扫描电镜图。
图6(b)为本发明方法提取山药多糖10um扫描电镜图。
图7为不同浓度的本发明方法提取山药多糖和抗坏血酸对羟基自由基清除率。
图8为不同浓度的本发明方法提取山药多糖和抗坏血酸对超氧阴离子清除率。
图9为不同浓度的本发明方法提取山药多糖和抗坏血酸对dpph自由基清除率。
具体实施方式
下面结合具体实施例对本发明做进一步说明,但不受实施例的限制。
实施例1:超滤提取山药多糖适宜工作条件的确定
1.操作流程
1)准确称取完整新鲜的山药500g,去皮,切块。
2)按料液(g/ml)比1:2的比例加入ph=8.5的1%亚硫酸氢钠溶液1000ml,进行打浆,获得山药匀浆。
3)将山药匀浆在6000转、4℃下离心20min。
4)将上清液过滤,除去淀粉。
5)取滤液调节ph=3.5,磁力搅拌1h,获得悬浮液。
6)将悬浮液在6000转、4℃下离心20min,沉淀山药蛋白。
7)将离心后的上清液调节超滤ph至一定值,调节超滤压强至一定值,调节超滤温度至一定值,采用分子截留量为10000的超滤膜进行超滤。
8)将截留的部分经过真空冷冻干燥后,即可得到山药多糖粉。
2.单因素试验设计
分别考察步骤7)影响超滤辅助提取过程的主要因素,即超滤ph、超滤温度、超滤压强,为探索适宜的工艺参数依次做单因素实验。
(1)超滤ph对提取率的影响:
超滤时,控制其它因素一定,温度25℃,压力0.04mpa。超滤ph试验设定值:5.0、6.0、7.0、8.0。
(2)超滤温度对提取率的影响:
超滤时,控制其它因素一定,ph为7.0,压力0.04mpa。超滤温度试验设定值:10℃、20℃、30℃、40℃。
(3)超滤压强对提取率的影响:
超滤时,控制其它因素一定,ph为7.0,超滤温度为25℃,超滤压强试验设定值:0.03mpa、0.04mpa、0.05mpa。
结果如图1、2、3所示,单因素试验结果表明,超滤ph值(a)、超滤温度(b)和超滤压强(c)3个变量对多糖提取率的影响较大,且其较佳值分别为超滤ph=6.0、超滤温度=20℃和超滤压强=0.03mpa。利用design-expert8.0.6软件,选取超滤ph值(a)、超滤温度(b)和超滤压强(c)3个自变量,转换为box-behnken代码为x1=(a-6)/10;x1=(b-20)/10;x3=(c-0.03)/10,以山药多糖的提取率(y)为响应值,进行响应面设计。响应面试验的因素和水平如下表(表1)。
表1box-behnken试验设计因素水平
实施例2:超滤提取山药多糖响应面优化及分析
试验采用design-expert8.0.6软件进行响应面设计及结果分析。
(1)试验设计结果
表2box-behnken试验设计结果
(2)回归模型方差分析
表3响应面试验回归模型方差分析
为了检查变量,超滤ph值(a)、超滤温度(b)、超滤压强(c),对于提取率的影响,利用box-behnken试验设计,试验结果如表3所示。通过应用多元回归分析实验数据,预测反应y(多糖的提取率)获得以下方程:
r1=39.788-2.22a+2.75b-1.44c-1.08ab+1.37ac+1.41bc-3.47a2+0.24b2-1.67c2
响应面方差分析的二次模型在表3中提供。高的回归模型f值(42.30)和低假定值(p<0.0001)表明,模型是非常显著的。失拟项f值(0.81)表示,相对于纯误差不显著。与此同时,多糖产量统计数据表明,p值(0.5518)不显著。r2(0.9981)表明模型的高准确性,并表示此模型可以解释大部分的因变量的变化。因此,综合看来,模型成立,可以对山药多糖的提取工艺进行优化分析,同时回归方程能够较准确的预测山药多糖提取率随着各单因素的变化规律。
(3)各因素交互作用分析
各因素的交互作用使指两个因素在不同水平上呈现出的差异,超滤ph(a)、超滤温度(b)及超滤压强(c)各有三个个水平,每个因素的每个水平在不同单因素上的效应都具有区别,这表示因素之间存在交互作用。采用降维分析法,探讨交互式操作变量对反应的影响,确定最优水平的每个变量的最大响应。三维响应面和二维轮廓响应面图提供了回归方程的图形分析,如图4所示。
从图4(a)和(b)可知,当超滤温度一定时,随着超滤ph的增加,提取率逐渐减少,超滤ph一定时,随着超滤温度的升高提取率先升高后下降,从等高线的图形和疏密程度可知,超滤ph值和超滤温度的交互作用明显。从图4(c)和(d)可知,当ph一定时,随着超滤ph的增加,提取率先升高后降低,超滤压强一定时,提取率也先升高后降低,从等高线的形状和疏密程度可知,超滤ph和超滤压强之间的交互作用较显著。从图4(e)和(f)可知,当超滤温度一定时,随着超滤压强的增加,提取率逐渐减少,当超滤压强一定时,随着超滤温度的增加,提取率先增加后降低。从等高线的形状和疏密程度可知,超滤温度和超滤压强之间的交互作用较显著。
响应面优化后,得到提取山药多糖的最佳工艺参数为超滤ph=6.5、超滤温度为20℃、超滤压强为0.03mpa。在此条件下,所得山药多糖纯度为43.84%,提取率为88.69%(以鲜山药计)。
实施例3:山药多糖成分的测定
利用国标方法测得山药多糖样品构成如表4所示。多糖含量43.84%,蛋白质含量18.52%,粗脂肪含量2.52%,粗纤维含量1.28%,水分含量9.62%,灰分含量4.28%。
表4多糖成分组成表
实施例4:山药多糖红外谱图分析
多糖化学结构的变化采用傅立叶变换红外光谱定性分析。样本磨成细粉与kbr混合,光谱被记录在400和4000cm-1之间的波数范围。(ft/ir3000,jusco,japan)。
山药多糖的红外谱图如图5所示,通过对山药多糖与其它多糖的红外谱图分析对比,山药多糖显示出一般类多糖的特征吸收峰。在指纹区,在3440cm-1处能发现明显的吸光度,这种现象可以归结为氢氧键的拉伸所致。在2928cm-1处展现出吸收峰是碳氢键拉伸振动的显著标志。另一个特征峰值出现在1638cm-1处,可以推测其成因是由为碳氧双键的不对称运动所致。而1410cm-1处的吸收峰则是因碳氧单键伸缩振动产生的。在2950cm-1处显示出的峰是碳氢键的振动吸收峰。1150cm-1处的吸收峰是脂肪醚的碳氧单键伸缩振动产生的吸收峰,相近的1080cm-1处吸收峰,是环内醚的碳氧单键伸缩振动产生的吸收峰,这两个吸收峰的出现表明多糖中有醚键的存在。
实施例5:山药多糖扫描电镜分析
采用zesisevo10扫描电子显微镜(carlzeissag,germany)检测山药多糖的形态学特征。测试之前,样品被固定到带有导电银胶的金属托盘,然后撒上一层黄金粉,放大倍数为100um和10um。
图6(a,b)显示山药多糖具有外形不规则的特点,表面凹凸不平,是带有孔洞的褶皱结构。这说明多糖分子间存在排斥力,分子间吸引力较弱。形状不规则和褶皱结构均为非晶粉末的表面的典型特征。因此,我们得出的结论,山药多糖属于非晶粉末。此外,提取和纯化的方法或产品的准备也会影响多糖的形状,结构或表面。
实施例6:山药多糖抗氧化性质的测定
(1)羟基自由基清除率
羟基自由基被认为是最有害的活性氧自由基,它们会影响细胞中的生物大分子活性。因此,清除羟基自由基对生命系统的保护非常重要。山药多糖和抗坏血酸的羟基自由基清除效果如图7所示。图7表明羟基自由基的清除效果随着浓度的增大而增大。山药多糖的浓度范围从0.01到5mg/ml时,羟基自由基的清除率从7.63%急剧增加到91.25%。抗坏血酸和山药多糖的ec50值分别为0.09mg/ml和0.95mg/ml。当山药多糖的浓度达到5mg/ml时,羟基自由基的清除率超过90%而抗坏血酸在浓度为0.5mg/ml时清除效果就达到98%。据报道,山药多糖通过捐赠自身羟基的氢键,与氢氧自由基结合进而达到清除的效果。根据实验结果,有理由认为山药多糖在清除羟基自由基中起着重要的作用。
(2)超氧阴离子清除率
过度生产超氧化物阴离子自由基被认为是细胞内活性氧积累的开始,会导致氧化还原状态失衡,还会导致相关得有害生理后果。因此,清除超氧化物阴离子自由基是非常重要的。不同浓度的山药多糖和抗坏血酸的清除效果如图8所示。超氧阴离子清除率随着山药多糖的浓度的增加而增加。山药多糖的浓度范围从0.01到5mg/ml,超氧阴离子清除率从4.28%上升到30.75%。然而,抗坏血酸在浓度为1.0mg/ml时的清除效果高达94.68%。比较表明,抗坏血酸比山药多糖对于清除超氧化物自由基的影响更大。据报道,清除超氧化物阴离子的机制可能o-h键的离解能有关,也就是说,大量吸附于山药多糖的吸电子基团可能导致o-h键离解变弱。这可能是由于葡萄糖醛酸或半乳糖醛酸中存在的酮或醛导致的。
(3)dpph自由基清除率
清除dpph自由基是一种广泛使用的评估化合物自由基清除能力性质的模型方法。不同样品在不同浓度下清除dpph自由基的测量结果如图9所示。从图9可以看出,dpph自由基清除效果随着样品浓度的增加而增加。样品浓度抑制百分比达到50%定义为ec50。因此,抗氧化活性与ec50值是负相关,这表明当ec50值越低,测试样本的抗氧化活性就会越高。通过对比二者的对于dpph自由基抑制率,发现抗坏血酸在浓度为0.02mg/ml时的抑制效果就达到了顶峰(98.89%),而山药多糖在浓度为5.0mg/ml时才到达最佳效果(62.74%)。此外,dpph自由基清除的效果受很多因素的影响。据报道,当dpph自由基遇到如抗氧化剂等物质时,自由基清除效果和吸光度值将会降低。
- 还没有人留言评论。精彩留言会获得点赞!