单色多重定量PCR的制作方法
本申请为分案申请,其原申请的申请日为2009年12月22日,申请号为200980157269.8,名称为“单色多重定量pcr”。
相关专利申请的交叉引用
本申请要求于2008年12月22日提交的第61/139,890号美国临时申请的优先权,其全文以引用方式并入本文。
关于联邦政府资助的研究的声明
本文公开的部分研究和发明是由美国政府支持在第5r21ag030034号美国国家卫生研究院基金的资助下完成的。美国政府具有本发明的某些权利。
本发明公开的内容涉及在使用单一检测标记的单个反应中测定与第二靶核酸序列相比的第一靶核酸序列的相对拷贝数和绝对拷贝数的方法以及可用于实施所述方法的试剂盒。
背景技术:
实时定量聚合酶链式反应(qpcr)测定每个反应孔的ct值,即反应孔的增强的荧光(与产物形成成比例)穿过设定阈值的部分循环数,所述设定阈值是基线荧光之上的几个标准差(higuchi,r.,fockler,c.,dollinger,g.andwatson,r.(1993)kineticpcranalysis:real-timemonitoringofdnaamplificationreactions.biotechnology(ny),11,1026-1030)。ct值对输入靶dna的量的对数作图是线性的,使得可通过与在同一板上扩增参照dna样本的系列稀释物得到的标准曲线比较得到未知物的相对定量。
对于许多qpcr应用,研究者希望将来自靶序列的信号(t)标准化为来自参照序列的信号(r)。早期研究用在嵌入任何双链dna中时会发荧光的染料例如溴化乙锭或sybrgreeni测量不同(单重)反应中的t和r,并且这种方法仍在使用。最近的研究已经使用针对每种被定量的dna序列的具有不同的激发/发射光谱的不同荧光染料,在多色多重qpcr中测量了同一个反应容器中的t和r(wittwer,c.t.,herrmann,m.g.,gundry,c.n.和elenitoba-johnson,k.s.(2001)real-timemultiplexpcrassays.methods,25,430-442)。通过多重qpcr测量t/r比值使必须进行的不同pcr反应的数量减少一半。而且,由于t和r信号两者均是在每个反应管中收集的,对重复反应吸取的给定dna样本的量的变化不再会产生t/r比值的变化,而在单重qpcr中在不同反应孔中测量t和r时会产生所述变化。
多色多重qpcr的主要缺点在于荧光探针成本较高,以及配备来读取两种或更多种荧光颜色的专用qpcr机器成本高。在多重pcr的传统方法中(不论该pcr是否是定量的),确定以下引物组和引物浓度有时也过度耗时,所述引物组和引物浓度会防止由一个引物对引起的高拷贝数模板的早期扩增抑制由第二个引物对引起的不同的低拷贝数模板的晚期扩增。
技术实现要素:
本发明提供在使用单一检测标记的单个反应中测定两个或更多个靶核酸序列的拷贝数的方法。还公开了测定端粒序列的拷贝数的方法。这些数据可用于将已测量的端粒长度和对应于在某个群体中观察到的端粒长度的死亡风险或疾病发生可能性相结合。
本文公开了通过使用单一检测标记的在单个反应孔、均一体系中的单色多重定量pcr(mmqpcr)测定相比于第二靶核酸拷贝数的第一靶核酸拷贝数的方法和组合物。
所公开的方法和组合物的其他优点一部分将在下述的说明书中阐明,并且一部分可从说明书中得以理解,或者通过所公开的方法和组合物的实施得以获悉。所公开的方法和组合物的优点借助于在所附权利要求中特别指出的要素及组合可得以实现和获得。应理解的是,前述的概括描述和下述的详细描述均仅是示例性和说明性的,而不是对所主张的本发明的限制。
附图说明
已纳入并构成本说明书的一部分的附图,展示了所公开方法和组合物的几个实施方案,并且与说明书一起用于解释所公开的方法和组合物的原理。
图1示出在循环1中telg引物与天然端粒序列杂交并且引发dna合成。telc引物与天然端粒序列杂交,但由于其3’端错配,不能引发dna合成。当如所示和以未示出的构型彼此杂交时,telg和telc有多个错配(包括在它们的3’端碱基处),于是引物二聚体形成被抑制。telg和telc的3’端可以比对为完全互补的三个bp的重叠,但其稳定性不足以有效形成引物二聚体。在循环2中,telc可沿着在循环1中合成的telg引物延伸产物杂交,但由于其他构型会在telc的3’端碱基产生错配,因此仅当以所示出的构型杂交时,才可以引发dna合成。在所述telg延伸产物中,上横线标记telg引物自身的序列,斜体碱基标记在pcr的循环1中新合成的序列。在引物5’端的大写的非模板化序列会阻止所述端粒pcr产物的3’端在所述端粒pcr产物的其他拷贝中间处引发dna合成。
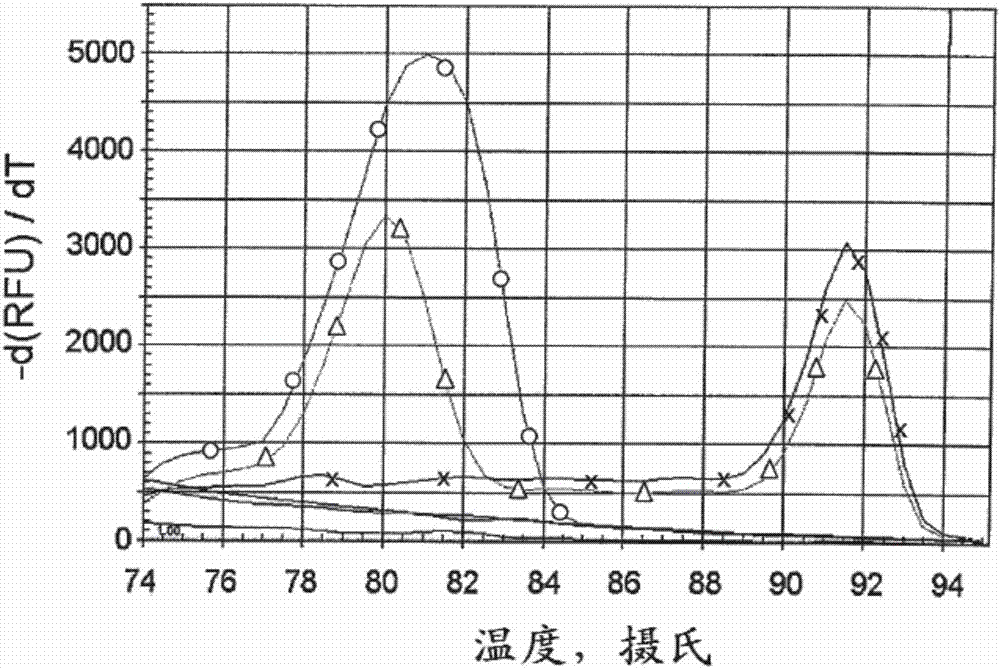
图2示出仅用端粒引物(圆形),仅用白蛋白引物(“x”),或同时用上述两个引物组(三角形)对150ng人基因组dna扩增25个循环之后的解链曲线(材料和方法部分给出的热循环谱(thermalprofile))。无模板对照的解链曲线用黑色表示,没有符号。在最终88℃孵育后,将反应冷却到72℃,从72℃至95℃以0.5℃步进采集信号,每步进30秒停留时间。端粒和白蛋白扩增子的解链温度相差大约11℃。
图3示出之前显示具有长端粒(圆形)、中等长度端粒(“x”)或短端粒(三角形)的20ng三种参照人dna样本中的每一种的单色多重定量pcr(mmqpcr)。无模板对照扩增曲线以黑方块示出。上图:半对数图;下图:线性图。
图4示出用于测定相对t/s比值的标准曲线。通过三倍系列稀释制备跨度为81倍范围的五种浓度的标准人基因组dna样本(每孔150ng,50ng,16.7ng,5.55ng和1.85ng),并且加至96孔pcr板中,一式两份。从每个反应孔中收集靶和参照荧光信号。圆形代表在88℃采集的单拷贝基因白蛋白的数据;三角形代表在74℃采集的端粒重复序列的数据。在本研究的每个板中,使用相同的标准dna来建立标准曲线反应。
图5示出在来自95位个体的全血dna样本中,通过单色多重定量pcr用白蛋白作为单拷贝基因测定的相对t/s比值与通过southern印迹分析测定的平均末端限制性片段(trf)长度之间的相关性。每个t/s比值均是三次测量的平均值;每个平均trf长度均是两次测量的平均值。使用microsoftexcel测定线性回归方程和相关系数。
图6示出在mmqpcr测定的独立运行中相对t/s比值的重现性。在次日重新测定在图4中所测定的相同95个dna样本,注意,具体myiqpcr仪和每个dna样本占有的反应孔位置与前一天是不同的。使用microsoftexcel测定线性回归方程和相关系数。
图7示出用白蛋白作为单拷贝基因获得的t/s比值与用β-珠蛋白作为单拷贝基因获得的t/s比值的之间的相关性。用β-珠蛋白引物代替白蛋白引物,在两次不同运行中,在相同的95个dna样本中测量相对t/s比值,一式三份。对于每个样本,将用白蛋白作为单拷贝基因的两次不同运行的平均t/s(x轴)对用β球蛋白作为单拷贝基因的两次运行的平均t/s(y轴)作图。使用microsoftexcel测定线性回归方程式和相关系数。
具体实施方式
本发明包括用于测定一种或多种靶核酸的拷贝数的方法和体系。通过参考下面对具体的实施方案的详细说明以及包括在其中的实施例,并参考附图及其前面和下面的描述,可以更容易理解所公开的方法和组合物。
所公开的组合物和方法可以用于靶核酸的实时检测。实时检测是可以在扩增反应或操作过程中进行或在之后立即进行的检测。通常,此类检测可通过在扩增期间的一个或多个离散时间点、在扩增的全部过程中或扩增的一个或多个部分期间连续地、或者结合离散时间点和连续检测来检测扩增产物而实现。通过利用体现或产生可被检测到的可检测信号而不干扰扩增反应或操作的标记或基团,可以有助于实时检测。荧光标记是可用于实时检测的标记的一个实例。获得实时检测的特别有用的方法是在扩增操作中使用检测标记。用适当设计的检测标记,当扩增进行时可以产生包括荧光信号的检测信号。在多数此类情况下,所述检测信号与扩增产物的量和/或靶序列或靶分子的量成比例。
本文公开了用于测定第一靶核酸和第二靶核酸的拷贝数的方法。靶核酸可以从样本获得或如本文他处所述人工合成。
本文引用(无论前文或下文)的所有专利、专利申请和出版物均由此通过引用方式全文并入本文,以便更充分地描述所属领域技术人员已知的本文描述和主张的发明之日前的现有技术。
应当理解,本发明不限于具体的合成方法,或具体重组生物技术方法(除非另有说明外),或具体的试剂(除非另有说明外),或具体的药物载体,或具体的药物制剂或治疗方案,因为这些当然可以变化。
定义和术语
本文使用的术语仅为描述具体实施方案的目的,而不意图限定。
当在说明书和所附权利要求中使用时,除非上下文中清楚地指明,否则单数形式“a”、“an”和“该”可以包括复数指代对象。因此,例如,“acompound”的表述包括化合物的混合物,“apharmaceuticalcarrier”的表述包括两个或更多个此类载体的混合物等等。除非上下文中清楚地指明,否则“acomponent”的表述可以包括单一或多个组分或组分的混合物。
范围在本文中可表示为从“大约”一个具体值和/或至“大约”另一个具体值。本文中使用的术语“大约”意思是近似地、在……左右、粗略地或大概。当术语“大约”结合数值范围使用时,其通过将边界扩大至所示数值之上和之下修饰该范围。通常,本文中的术语“大约”用于修饰在所示值之上和之下偏差20%的数值。当表示此类范围时,另一个实施方案包括从所述一个具体值和/或至所述另一具体值。同样地,当通过使用先行词“大约”以近似值表示数值时,应当理解,该具体值形成另一个实施方案。还应当理解,每个范围的端点在另一个端点有关时和独立于另一个端点时均是有意义的。
本文中使用的单词“或者/或”是指具体列表中的任何一个成员并且包括该列表的成员的任意组合。
所谓“样本”意指动物、来自动物的组织和器官、细胞(在受试者体内、从受试者直接采集或者维持在培养物中或来自培养的细胞系的细胞);细胞裂解物(或裂解物部分)或细胞提取物;或包含一种或多种来自细胞或细胞材料的分子(例如多肽或核酸)的溶液,其如本文所述进行测定。样本也可以是任何含有细胞或细胞组分的体液或排泄物(例如,但不限于,血液、尿液、粪便、唾液、泪液、胆汁)。
本文使用的词组“核酸”是指天然或合成的寡核苷酸或多核苷酸,无论dna、rna或dna-rna杂合体、单链或双链、正义或反义,所述核酸能通过watson-crick碱基配对与互补核酸杂交。本发明的核苷酸也可以包括核苷酸类似物(例如,brdu)以及非磷酸二酯核苷间键(例如,肽核酸(pna)或硫酯键(thiodiesterlinkage))。具体地,核酸可以包括但不限于dna、rna、cdna、gdna、ssdna、dsdna或其任意组合。
所谓的“特异性结合”表示组合物识别其同族靶标并与其发生物理相互作用。例如,引物可以特异性结合其靶核酸。例如,第一引物组的引物可以特异性结合第一靶核酸序列,不明显识别其他靶标或靶核酸序列并且不与它们发生相互作用。
所谓的“探针”、“引物”或寡核苷酸表示能与含有互补序列的第二dna或rna分子(“靶标”)碱基配对的确定序列的单链dna或rna分子。产生的杂合体的稳定性取决于发生的碱基配对的程度。碱基配对的程度受例如探针与靶分子之间的互补程度以及杂交条件的严格度的参数的影响。杂交严格度受到例如温度、盐浓度和有机分子如甲酰胺的浓度的参数的影响,并且其通过本领域技术人员已知的方法确定。对靶核酸(例如,基因和/或mrna)特异的探针或引物与其会杂交的靶标的区域具有至少80%-90%序列互补性、至少91%-95%序列互补性、至少96%-99%序列互补性、或至少100%序列互补性。可以通过本领域技术人员公知的方法可检测地标记(放射性或非放射性地)探针、引物和寡核苷酸。探针、引物和寡核苷酸用于涉及核酸杂交的方法,例如:本文所述的单色多重定量pcr(mmqpcr)以及核酸测序、反转录和/或通过聚合酶链式反应的核酸扩增、单链构象多态性(sscp)分析,限制性片段多态性(rflp)分析、southern杂交、northern杂交、原位杂交、电泳迁移率测定(emsa)。
所谓的“引物组”用来表示至少两个引物,其中每个引物都包含与同一靶序列的相对链互补的序列。在一个引物组中,两个引物中的至少一个必须是“正向引物”,两个引物中的至少一个必须是“反向引物”。“正向引物”是与靶核酸的有义链互补的引物,其中“反向引物”是与靶核酸的有义链的互补链(也被称为靶核酸的反义链)互补的引物。引物组可以是能在pcr反应中使用的一对引物。
所谓的“扩增子”用来表示作为天然或人工扩增事件的产物形成的dna片段。例如,它们可以通过本文所述的方法、聚合酶链式反应(pcr)、连接酶链式反应(lcr)以及通过天然基因复制形成。
所谓的“特异性杂交”表示在高严格度条件下,探针、引物或寡核苷酸识别大体上互补的核酸(例如,靶核酸)并与其发生物理相互作用(即,碱基配对),并且与其他核酸基本上不发生碱基配对。
所谓的“高严格度条件”表示可进行与下述杂交相当的杂交的条件:使用至少40个核苷酸长度的dna探针,在含有0.5mnahpo4、ph7.2、7%sds、1mmedta和1%bsa(fractionv)的缓冲液中,于65℃的温度下,或在含有48%甲酰胺、4.8×ssc、0.2mtris-cl、ph7.6、1×denhardt溶液、10%硫酸葡聚糖和0.1%sds的缓冲液中,于42℃的温度下杂交。高严格度杂交例如pcr、northern、southern或原位杂交、dna测序等的其他条件是分子生物学领域技术人员公知的(参见例如,f.ausubeletal.,currentprotocolsinmolecularbiology,johnwiley&sons,newyork,ny,1998)。
材料
公开的是可用于所公开的方法和组合物的、可结合所公开的方法和组合物而使用的、可用于制备所公开的方法和组合物的或者是所公开的方法和组合物的产物的材料、组合物以及组分。本文公开了这些材料和其它材料,并且应当理解,当公开这些材料的组合、子集、相互作用、群组等时,尽管可能未明确公开这些化合物的每个不同的单独和共同的组合和排列的具体表述,但是每一个均在本文被明确涵盖并描述。因此,如果公开了一类分子a、b和c以及一类分子d、e和f,并且公开了组合分子a-d的实例,那么即使没有单独列举每个组合分子,每个组合分子也单独地和共同地被涵盖。因此,在这个实例中,从a、b和c;和d、e和f;以及实例组合a-d的公开中,组合a-e、a-f、b-d、b-e、b-f、c-d、c-e和c-f中的每一个均被具体涵盖并且应当认为被公开。同样地,这些组合的任何子集或组合也被具体涵盖并公开。因此,例如,从a、b和c;和d、e和f;以及实例组合a-d的公开中,a-e、b-f和c-e的子群被明确涵盖并且应当认为被公开。这个概念适用于本公开内容的所有方面,包括但不限于制备和使用所公开组合物的方法中的步骤。因此,如果有多个可以进行的其他步骤,那么应当理解,这些其他步骤中的每一步均可用所公开方法的任何具体实施方案或实施方案的组合进行,并且每个此类组合被具体涵盖且应认为被公开。
a.靶样本
靶样本可以由任何具有或被怀疑具有靶分子的来源得到。靶样本可包含例如靶分子(如核酸)。靶样本可以是靶核酸的来源。靶样本可以包括天然的靶核酸、化学合成的靶核酸或者两者。靶样本可以是,例如来自一个或多个细胞、组织或体液(例如血液、尿液、精液、淋巴液、脑脊髓液或羊水)或其他生物样本(例如组织培养细胞、口腔拭物、漱口水、粪便、组织切片、穿刺活检以及诸如骨或木乃伊化组织的考古样本)的样本。有用的靶样本的类型包括血液样本、尿液样本、精液样本、淋巴液样本、脑脊髓液标本、羊水样本、活检样本、针吸活检样本、癌样本、肿瘤样本、组织样本、细胞样本、细胞裂解物样本、粗制细胞裂解物样本、法医样本、考古学样本、感染样本、医院内感染样本、生产样本、药物制剂样本、生物分子生产样本、蛋白制剂样本、脂质制剂样本和/或碳水化合物制剂样本。
1.靶核酸
核酸样本可以由任何具有或被怀疑具有靶核酸的来源得到。核酸样本是核酸分子和核酸序列(如靶核酸)的来源。核酸样本可以包含rna或dna或者两者。靶核酸也可以是cdna。另外,mrna可以被反转录以形成cdna,然后该cdna可以用作靶核酸用于本文中描述的方法中。
“靶核酸”或“靶序列”意指在双链或单链核酸上的核酸序列。所谓的“核酸”或“寡核苷酸”或本文中的语法同等形式意指共价连接在一起的至少两个核苷酸。本发明中的核酸通常包含磷酸二酯键,尽管在某些情况下包括可以具有替代骨架的核酸类似物,包括,例如,磷酰胺(beaucage,s.l等人,tetrahedron49:1925-63(1993),以及其中的参考文献;letsinger,r.l等人,j.org.chem.35:3800-03(1970);sprinzl,m等人,eur.j.biochem.81:579-89(1977);letsinger,r.l等人,nucleicacidsres.14:3487-99(1986);sawai等人,chem.lett.805(1984);letsinger,r.l等人,j.am.chem.soc.110:4470(1988);以及pauwels等人,chemicascripta26:141-49(1986))、硫代磷酸酯(mag,m等人,nucleicacidsres.19:1437-41(1991);和第5644048号美国专利)、二硫代磷酸酯(briu等人,j.amchem.soc.111:2321(1989))、o-甲基亚磷酰胺(o-methylphophoroamidite)键(参见eckstein,oligonucleotidesandanalogues:apracticalapproach,oxforduniversitypress,1991),以及肽核酸骨架和键(egholm,m.,am.chem.soc.114:1895-97(1992);meier等人,chem.int.ed.engl.31:1008(1992);egholm,m.,nature365:566-68(1993);carlsson,c等人,nature380:207(1996),所有以上文献均通过引用并入)。其他的核酸类似物包括具有以下骨架的那些核酸类似物:带正电(positive)骨架(dempcy,r.o等人,proc.natl.acad.sci.usa92:6097-101(1995))、非离子骨架(第5386023;5637684;5602240;5216141和4469863号美国专利;kiedrowshi等人,angew.chem.intl.ed.english30:423(1991);letsinger,r.l.等人,j.am.chem.soc.110:4470(1988);letsinger,r.l等人,nucleoside&nucleotide13:1597(1994);第2和3章,ascsymposiumseries580,"carbohydratemodificationsinantisenseresearch",编者y.s.sanghui和p.dancook;mesmaeker等人,bioorganic&medicinalchem.lett.4:395(1994);jeffs等人,j.biomolecularnmr34:17(1994))以及非核糖骨架(包括在第5235033和5034506号美国专利以及ascsymposiumseries580第6和7章,编者y.s.sanghui和p.dancook“carbohydratemodificationsinantisenseresearch(反义核酸研究中碳水化合物的修饰)”中描述的那些)。包含一个或多个碳环糖的核酸也包括在核酸的定义中(参见jenkins等人,chem.soc.rev.169-176(1995));所有参考文献以引用的方式明确地并入本文。
试图测定、鉴定、检测的任何核酸序列或试图确定其拷贝数的任何核酸序列均可以用作靶核酸序列。在本文描述的方法中,可以有多于一种靶核酸序列。如果存在两种靶核酸序列,它们将被分别称为第一和第二靶核酸序列。如果存在三种靶核酸序列,它们将被分别称为第一、第二和第三靶核酸序列,由此类推。本发明方法中描述的靶核酸可以有相同、相似或不同的拷贝数。例如,第一靶核酸是多拷贝数的核酸序列,而第二靶核酸是单拷贝基因。例如,第一靶核酸可以是端粒重复序列、mtdna、rdna或alu重复dna。例如,第一靶核酸可以是从高拷贝数mrna反转录的cdna,而第二靶核酸可以是从低拷贝数mrna反转录的cdna。
单拷贝基因是每个单倍体基因组有单个拷贝的基因。因此单拷贝基因在每一细胞中有两个拷贝。单拷贝基因包括但不限于白蛋白基因或β-珠蛋白基因。
端粒是在真核生物的线性染色体的末端发现的特化结构。端粒通常由短的串联重复序列组成,带有对该生物体特有的端粒酶特异的重复序列单元。多种生物体的端粒重复序列是已知的。对于脊椎动物、植物、某些类型的霉菌以及一些原生动物而言,该序列是完全的重复序列。例如,人重复序列单元是(ttaggg)n(seqidno:1)。在其他生物体中,所述重复序列是不规则的,例如酿酒酵母菌(sacharomycescerevisiae)的重复序列,其中该序列是可变的g1-3t/c1-3a。在一些真核生物体中,端粒不含短的串联重复序列,但具有用作端粒的序列元件。例如,在黑腹果蝇(drosophilamelanogaster)中,端粒是逆转录转座子het-a和tart复合物,而在冈比亚疟蚊(anophelesgambiae)中,端粒是一系列复杂串联重复序列。对于本发明的目的,不同结构的端粒被涵盖在本发明的范围内。
除所述重复序列之外,一些端粒的3'端包含单链区,对于人类其定位于富含g的链。该单链由(ttaggg)n(seqidno:1)重复序列组成,其中n通常为大约9-35,但n可以更多或或少。如上所述的3'单链区的长度也可与死亡风险有关。
通常,dna复制机制以5’至3'方向作用,并且通过使用在链合成后分解的短rna引物,后随链的合成不连续地发生。由于对先前被rna引物占有的区域的完整合成不能获得线性dna的3'端序列,因此线性染色体的3'端区不被复制。该“末端复制问题”通过端粒酶—一种端粒特异性核糖核蛋白反转录酶——的作用得以解决。端粒酶具有用作延伸端粒的3'端的模板的不可或缺的rna组分。通过端粒酶活性引起的反复延伸导致从端粒酶结合的rna模板复制的端粒重复序列的产生。在由端粒酶引起的延伸后,由dna聚合酶引起的后随链合成完成双链端粒结构的形成。
在正常的人体细胞中,端粒酶不表达或者低水平表达。因此,每次细胞分裂端粒缩短50-200bp,直到该细胞达到复制性衰老,在复制衰老时细胞失去增殖能力。细胞复制的有限能力通常被称为hayflick限制,并且可以为细胞提供一种对细胞分裂进行计数和调节细胞发育的计数机制,即有丝分裂钟。相应地,在缺乏端粒酶活性的细胞中端粒酶的活化,例如通过由组成型逆转录病毒启动子表达端粒酶或内源性聚合酶的活化,使细胞可保持增殖能力并且导致细胞无限增殖。
有趣地,这些无限增殖化细胞具有短的稳定的端粒,同时最短的端粒得以延长。这个现象表明,端粒酶防止短端粒进一步缩短并且延长已经降到某一临界长度下的端粒。因此,当端粒在某个长度时,端粒酶活性的存在似乎不是必要的,但是当长度降到临界极限下时,端粒酶活性对维持端粒完整性变得至关重要。
已经很好地证实,端粒的长度和完整性对染色体的正确分离以及细胞生长是重要的。例如,多种类型的癌症的发生与端粒保持的活化有关,而细胞衰老与端粒完整性的丧失有关。通过抑制端粒酶活性诱导的端粒的缩短可以导致增殖性衰老以及细胞凋亡(zhang,x等人,genesdev.2388-99(1999))。而且,小鼠中端粒酶rna的基因敲除产生具有发育缺陷、老化相关的病理学以及增加的癌症易感性的动物(rudolph,k.l.等人,cell96:701-12(1999);herrera,e.等人,emboj.18:2950-60(1999))。相似地,在由编码端粒酶rna组分的基因的突变引起的先天性角化不良(dkc)的常染色体显性紊乱中,患者表现出加速的端粒缩短并且在16岁的中值年龄时死亡(最大大约50岁),通常由于仅次于骨髓衰竭的严重感染。dkc患者的临床表现进一步表明老化加速,包括过早白发和脱发;皮肤色素沉淀异常;伤口愈合差;严重感染的高风险;以及恶性肿瘤发生率增高、骨质疏松和肺纤维化。另外,在正常老年个体的血液dna中测量的最短的平均端粒长度与在dkc患者血液中测量的最长的平均端粒长度部分重叠。
鉴于端粒在细胞生长和细胞衰老中起的作用,期望得到基于端粒长度预测老化相关疾病的发生率和死亡风险方法。本文所述的方法(包括mmqpcr方法)将提供用于鉴定具有发生具体的老化相关疾病例如癌症和高血压的增长的风险的个体的依据,以便可以对高危组的个体给予早期药物干预。
在本文所述的方法中,可以测定细胞中的单条染色体的端粒的拷贝数。一方面,测量单个细胞的端粒的平均拷贝数或平均端粒拷贝数。在另一个具体实施方案中,测量细胞群体的端粒的平均拷贝数或平均端粒拷贝数。端粒拷贝数的变化是端粒拷贝数的增加或减少,尤其是平均端粒拷贝数的增加或减少。该变化可以与具体的时间点相关,即将生物体在时间t1的端粒拷贝数与在稍晚的时间t2的端粒长度比较。也可以将端粒拷贝数的变化或差异与具体细胞群体或生物群体的平均端粒拷贝数对照比较。在一些方面,也可以将端粒拷贝数的变化或差异与未患病的群体的平均端粒拷贝数对照比较。在某些实施方案中,对不同时期存在的群体来测量端粒拷贝数的变化。
尽管,可以测定所有真核生物的端粒拷贝数,然而在一个方面,测定的是脊椎动物的端粒拷贝数,所述脊椎动物包括但不限于两栖动物,鸟类和哺乳动物例如啮齿类动物、有蹄类动物和灵长类动物尤其是人类。也可以测定寿命具有理想特质或寿命与疾病的易感性相关的生物体的端粒拷贝数。另一方面,为了评价与这些生物体中改变的端粒完整性相关的死亡风险或疾病的易感性,可以测定克隆生物体的端粒。
端粒核酸序列(例如上述端粒核酸序列)可以用作靶序列。端粒核酸序列或任何其他靶核酸可以是任何长度,应理解越长的序列特异性越高。在一些实施方案中,可能希望将样本核酸分裂或裂解成100-10,000个碱基对的片段。在一个方面,可以使用大致上500个碱基对的片段。可以用许多本领域技术人员公知的方法进行分裂或裂解,这些方法包括机械、化学和酶促方法。因此,可以用超声、french压力、剪切或用核酸酶(例如dnase、限制性内切酶、rnase等)或化学裂解剂(例如,酸/哌啶、肼/哌啶、铁-edta复合物、1,10-菲咯啉-铜复合物等)对核酸进行处理。
2.聚合酶
在本文所述的方法中,需要扩增酶。例如,在使引物与靶核酸接触之后,可以用扩增酶处理反应。扩增酶通常是聚合酶,例如dna聚合酶。本领域中公知多种合适的聚合酶,包括但不限于taqdna聚合酶、klentaq、tfl聚合酶、dynazyme等。通常,所有聚合酶均适用于本发明。在一方面,由于使用具有强3'至5’核酸外切酶活性的聚合酶倾向于除去错配3'端核苷酸,但在一些应用中需要所述错配3'端核苷酸阻止或延缓引物二聚体扩增,在另一些应用中需要所述错配3'端核苷酸进行等位基因特异扩增,因此聚合酶是缺少3'至5’核酸外切酶活性的热稳定聚合酶或被改造为具有减弱或无功能性的3'至5’核酸外切酶活性的聚合酶(例如,pfu(exo-),vent(exo-),pyra(exo-)等等)。可用来最佳地延伸杂交的引物的聚合酶混合物也可适用。在另一方面,对本发明有用的聚合酶被制成仅在适合扩增的温度下变得有活性。
在扩增温度下失去活性的聚合酶抑制抗体的存在或将聚合酶隔离为使其不可用直到达到扩增温度时的形式都是合适的。这些聚合酶制剂使得可在单个反应容器中混合所有组分而防止引发非靶核酸序列。
此外,本领域技术人员应当理解,多种试剂可以被添加到反应中以增加聚合酶的持续合成能力,稳定聚合酶从而避免失活,减少引物的非特异性杂交或增加复制效率。此类添加剂包括但不限于二甲基亚砜、甲酰胺、乙酰胺、甘油、聚乙二醇或蛋白制剂例如大肠杆菌单链dna结合蛋白、t4基因32蛋白、牛血清白蛋白、明胶等。在另一个方面,本领域技术人员可以使用多种核苷酸类似物进行具体类型序列的扩增,例如富含gc的序列或重复序列。这些类似物包括但不限于c7-dgtp、羟甲基-dutp、ditp、7-deaza-dgtp等。
3.引物
所谓的“引物”、“引物核酸”、“寡核苷酸引物”、“寡核苷酸探针”或本文使用的语法等同形式表示会与靶核酸的某一部分杂交的核酸。将本发明的引物或探针设计成基本上与靶序列互补以便发生所述靶序列和本发明引物的杂交。
在一些方面,可以将引物设计成以除了一个构型之外的所有构型阻止引物引发靶核酸延伸。例如,可以将引物组中的引物之一设计成通过在引物的3'端制造错配碱基而阻止引物引发靶核酸延伸。通过设计和利用此类引物,所述引物仍然能与其互补序列杂交;然而,其将仅以单一构型引发dna合成,因此,可预测扩增子大小并且因此可预测扩增子的tm。
例如,本文公开了这样的引物和引物组,其中,第一引物组的一个引物包含至少一个与该引物的3'端相邻的核苷酸,其中,所述核苷酸与靶核酸是错配的、不互补的,但与引物组中另一个引物的3'端的核苷酸互补。
本文还公开了这样的引物和引物组,其中,第一引物组的一个引物包含至少一个与该引物的3'端相邻的核苷酸,其中,所述核苷酸与靶核酸是错配的、不互补的,但与引物组中另一个引物的3'端的核苷酸互补,其中所述引物组的含有错配的引物的延伸产物可以与所述引物组中的另一个引物杂交,使得所述另一个引物可引发沿所述延伸产物的dna合成。
为了确保被阻止引物将仅以单一、特异性构型引发,可以对包括被阻止引物的引物组进行设计以使所述引物组的引物在被阻止引物中存在的错配碱基的区域上以完全互补方式重叠。可以进行此类设计以便阻止引物二聚体形成并且使两个引物彼此引发的能力最小化。当靶核酸序列是包含多个重复序列的序列例如在端粒中发现的重复序列(端粒序列)时,可以利用此类设计。本文他处描述了此类方法的实例,包括下文的实施例。
如本文所述,用于直接扩增端粒重复序列的引物可以包含与靶核酸的第一单链杂交的第一引物,以及与靶核酸的第二单链杂交的第二引物,其中第一链和第二链是大体上互补的。当引物与它们各自的链杂交时,引物能通过聚合酶进行引物延伸。就是说,与靶核酸杂交的引物具有与靶核酸上的核苷酸残基互补的3'端核苷酸残基,从而引物可通过聚合酶延伸。选择的引物是与重复区域的重复单元互补的。例如,可以改变至少一个所述引物的至少一个核苷酸残基以与所述引物杂交的至少一个重复单元的核苷酸残基产生错配,其中,当引物彼此杂交时,所改变的核苷酸残基还与其他引物的3'端核酸残基产生错配。错配的包含会阻止或限制引物延伸以及引物-引物杂交。
用于直接扩增端粒重复序列的引物组可以包括这样的引物组,其中改变第一引物的至少一个核苷酸残基以在改变的残基与所述引物杂交的第一链的至少一个重复单元的核苷酸残基之间产生错配,其中当第一和第二引物彼此杂交时,所改变的核苷酸残基还与第二引物的3'端核苷酸残基产生错配。所改变的核苷酸残基可以是3'端核苷酸的一个或多个核苷酸残基,以使得当所改变的引物与靶核酸杂交时,聚合酶可进行有效的延伸。例如,所改变的核苷酸残基可以是3'端核苷酸的至少1个核苷酸残基,至少2个核苷酸残基,或至少3个核苷酸残基,以使得当所改变的引物与靶核酸杂交时,聚合酶可进行有效的延伸。
如在本文他处讨论的,可以将引物组的引物设计成具有相似的tm以限制不需要的扩增产物的产生并使得可在单个反应体积中扩增和检测数个靶核酸。另外,由于不同生物体的端粒具有不同的重复单元序列,因此扩增具体生物体的端粒将采用对每个不同生物体的重复单元特异的引物。人端粒序列在本文用于举例说明本发明用于直接扩增并定量串联重复的核酸序列的实施,但本发明不限于所公开的具体实施方案。
还公开了使所产生的扩增子的解链温度(tm)提高至本文所述的方法的其他扩增子的解链温度之上的引物。这些引物可以被称作包含“gc-钳”的引物。“gc-钳”通常是指在在引物3’端的最后5个碱基内g或c碱基的存在,由于g和c碱基更强的结合,这帮助促进在3'端的特异性结合。通常,在引物3'端的最后5个碱基应当避免多于3个g'或c'。然而,在本文所述的方法中,包含“gc-钳”的引物是包含5’标签序列(gc-钳)的引物,该5’标签赋予所产生的pcr产物(扩增子)比在没有gc-钳的情况下的解链温度更高的解链温度。包含“gc-钳”的引物的5’标签序列在引物序列的5’端上包含gc-钳,所述gc-钳与靶核酸序列的任何部分都不互补。“gc-钳”是可连接到引物的5’端以提高扩增子的解链温度的一连串g和c核苷酸。gc钳可以是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30个或更多个核苷酸长。gc钳也可以称为富含gc的区域或富含gc的标签。
在本文所述的方法中可以使用gc-钳来提高一个扩增子的tm。通过提高所述扩增子的tm,可在高到足以使其他扩增子彻底解链的温度下采集荧光信号,因此使得可在两个或多个不同的温度下,采集两个或多个不同扩增子的荧光信号。可对gc-钳引物进行设计以用于同一个扩增反应,以使不同引物上的gc-钳彼此是不相同的,以便防止能导致扩增反应停止的发夹形成或引物二聚体。
由于与靶核酸杂交的引物必须能够进行引物延伸,因此对第一引物和第二引物的改变必须是在重复单元的非互补核苷酸上。因此,在一方面,当第一引物和第二引物都包含改变的残基时,所述改变在与重复单元相邻的核苷酸位置处。另一方面,所述改变位于不与重复单元相邻的核苷酸位置处。通常,在相邻核苷酸位置处的错配提供所改变的核苷酸和3'端核苷酸之间最大数量的配对碱基或互补残基,这对有效地扩增短的重复序列(例如3-6个碱基对)是重要的。
引物与靶核酸的互补性不需要是完全的。因此,所谓的“互补”或“大体上互补”在本文表示探针与靶核酸足够互补以在正常反应条件下杂交。只要与完全互补的差异不足以完全阻止杂交,那么这种差异就是可允许的。然而,如果改变或突变的数量足以使在最低严格度杂交条件(如下文所定义的)下都不发生杂交,那么该序列就与靶序列不互补。
尽管引物通常是单链的,但是本文描述的核酸可以是单链或双链(如所指明的),或包含双链或单链序列的部分。核酸可以是dna、rna或杂合体,在所述杂合体中核酸包含脱氧核苷酸和核苷酸的任意组合以及碱基(包括尿嘧啶、腺嘌呤、胸腺嘧啶、胞嘧啶、鸟嘌呤、黄嘌呤、次黄嘌呤、异胞嘧啶、异鸟嘌呤、肌苷等)的任意组合。在此使用的术语“核苷”包括核苷酸,以及核苷、核苷酸类似物和修饰的核苷酸例如氨基修饰的核苷酸。此外,“核苷”包括非天然的类似物结构。因此,例如,各自包含碱基的肽核酸的各个单元在本文中称作核苷酸。
引物核酸的大小可以变化,如本领域技术人员会理解的,长度通常从5至500个核苷酸变化。例如,根据用途、所需的特异性以及扩增技术,可以使用10至100个核苷酸的引物,12至75个核苷酸的引物,以及15至50个核苷酸的引物。
对于任何引物对,引物彼此杂交的能力可以通过将第一引物的序列与第二引物的序列比对来进行检查。所述杂交体的稳定性,尤其热解链温度(tm),可以通过下述方法以及本领域中公知的方法来测定。这些方法包括但不限于,最近邻域热力学计算(breslauer,t.等人,proc.natl.acad.sci.usa83:8893-97(1986);wetmur,j.g.,crit.rev.biochem.mol.biol.26:227-59(1991);rychlik,w.等人,j.nihres.6:78(1994))、华莱士规则判断(suggs,s.v.等人,"useofsyntheticoligodeoxribonucleotidesfortheisolationofspecificcloneddnasequences",developmentalbiologyusingpurifiedgenes,d.b.brown编辑,第683-693页,academicpress,newyork(1981)),以及基于bolton和mccarthy的tm估算(参见baldino,f.j.等人,methodsenzymol.168:761-77(1989);sambrook,j.等人,molecularcloning:alaboratorymanual,第10章,coldspringharborlaboratorypress,coldspringharbor,n.y.(2001))。所有参考文献均通过引用明确地并入本文。当分析杂合体稳定性时,要考虑到多个参数的影响,所述参数包括但不限于离子强度、探针长度、g/c含量以及错配。这些因素的考虑对本领域技术人员来说是公知的(参见例如,sambrook,j.,同上)。
可以在本文所述的方法中使用的引物可以用于扩增多种靶核酸。单一引物组,例如一个引物对,可以用于扩增单一靶核酸。在另一个实施方案中,多个引物组可以用于扩增多个靶核酸。扩增可以对每个独特引物组分别进行或使用引物组的组合在单一反应容器中进行(在本领域中通常称为多重化)。当在单一反应容器中使用多个引物组时,对引物进行设计以限制不需要的产物形成以及限制每个引物组的引物之间的干扰。
一般的pcr扩增反应可以根据本领域中公知的方法进行,如上所述(参见,例如第4683195和4683202号美国专利)。引物延伸步骤的时间和温度将取决于聚合酶、被扩增的靶核酸的长度以及用于扩增的引物序列。充分扩增靶核酸所需的反复步骤的数量将取决于每个循环的扩增效率和靶核酸的起始拷贝数。如本领域公知的,这些参数可由技术人员进行调整以实现需要的扩增水平。本领域技术人员应当理解,本发明不受在扩增过程中应用的时间、温度、缓冲条件以及扩增循环的变化的限制。
在使引物与靶核酸杂交中以及在所公开的扩增反应中,测定通常在严格条件下进行,该严格条件允许在靶核酸存在的情况下形成杂合体。本领域技术人员可以改变温度、盐浓度、ph、有机溶剂、离液剂或其他变量的参数,以控制杂交严格度并且使引物与非特异性靶标的杂交最小化(即,通过使用“热启动”pcr或“降落”pcr)。
4.检测标记
为使用所公开的组合物和方法帮助测定靶核酸拷贝数,检测标记可以直接并入到扩增的核酸中或可以与检测分子偶联。如本文使用的,检测标记是可以与扩增的核酸直接或间接连接并且直接或间接引起可测量、可检测的信号的任何分子。在本文所述的方法中,可以使用单一检测标记。所谓的“单一检测标记”用来表示单一类型的检测标记。例如,单一检测标记可以是本文所述的任何检测标记,然而在每个均一体系中仅可使用一种检测标记。例如,单一检测标记可以是sybrgreeni(invitrogen)、异硫氰基荧光素(fitc)、5,6-羧甲基荧光素或德克萨斯红(texasred),但不是所有这些的组合。因此,sybrgreeni(invitrogen)、异硫氰基荧光素(fitc)、5,6-羧甲基荧光素或德克萨斯红各自为单一检测标记,例如sybrgreeni(invitrogen)是单一检测标记,异硫氰基荧光素(fitc)是单一检测标记,5,6-羧甲基荧光素是单一检测标记,以及德克萨斯红是单一检测标记。
下面的实施例中提供另一个实例,其中sybrgreen是用于测定两种不同靶标的拷贝数的“单一检测标记”。另外,单一检测标记也可以被称作单一、单色的检测标记。“单一、单色的检测标记”是仅具有一种颜色的单一检测标记。例如,单一、单色的检测标记可以是发射可以被检测的单一颜色的检测标记。
许多用于并入到核酸中或与核酸探针偶联的此类标记对本领域技术人员来说是已知的。适用于所公开的方法中的检测标记的实例是放射性同位素、磷光分子、酶、抗体和配体以及包括荧光染料和荧光标记的荧光分子。荧光标记可用于扩增的实时检测。
例如,本文所述的方法可以使用在pcr反应中优先结合双链核酸扩增产物的荧光染料,由此提供对产物合成的连续监测(参见higuchi,r.等人,biotechnology11:1026-1030(1993);morrison,t.b.等人,biotechniques24:954-962(1998))。
合适的荧光标记的实例包括但不限于,sybrgreeni(invitrogen公司)、异硫氰酸荧光素(fitc)、5,6-羧甲基荧光素、德克萨斯红、nbd(硝基苯-2-氧杂-1,3-二唑-4-基)、香豆素、丹磺酰氯、若丹明、氨基-甲基香豆素(amca)、曙红、赤藓红(erythrosin)、
5.仪器
适用于所公开的方法和组合物的仪器包括但不限于,abiprism7700,appliedbiosystemsdivision,perkinelmer,fosterscity,calif.,usa;lightcyclertm,rochemolecularbiochemicals,indianapolis,ind.,usa。
多种算法可以用于计算本文所述的样本中的靶核酸拷贝数(参见abiprism7700软件version1.7;lightcyclertm软件version3;通过引用并入)。测定拷贝数可以包括使用具有已知靶核酸拷贝数的标准样本以及由所述标准的对数和阈值循环(ct)产生标准曲线。通常,ct是pcr循环或部分pcr循环,其中由扩增产物产生的荧光是基线荧光之上的几个偏差(higuchi,r.等人,同上)。mmqpcr提供大约7至8个数量级的线性,这使得可在宽动力学范围内测量靶核酸的拷贝数。靶核酸的绝对拷贝数可以通过比较标准曲线的ct值和样本的ct值得到。
也可以通过比较性mmqpcr来测定靶核酸拷贝数。使用已知拷贝数或恒定拷贝数的核酸使得可定量样本中的靶核酸的拷贝数。标准物可以是单拷贝基因、已知拷贝数的核酸,或者当定量dna拷贝数时,可以是组成型表达的管家基因(参见johnson,m.r.anal.biochem.278:175-184(2000);boulay,j.-l.等人,biotechniques27:228-232(1999))。
方法
本文公开了用于测定第一靶核酸和第二靶核酸的拷贝数的方法,包括:a)将第一靶核酸与第一引物组并将第二靶核酸与第二引物组接触,并且加入单一检测标记以形成均一体系的反应混合物;b)通过聚合酶链式反应用第一引物组扩增第一靶核酸以形成具有第一解链温度(tm)的第一扩增子,以及通过聚合酶链式反应用第二引物组扩增第二靶核酸以形成具有第二tm的第二扩增子,其中所述第二tm比所述第一tm高;c)在聚合酶链式反应期间,在第一采集温度下测定所述检测标记的量,其中所述第一信号采集温度低于所述第一tm;d)升高反应混合物的温度至第二信号采集温度并且测定所述检测标记的量,其中所述第二信号采集温度高于所述第一tm且低于所述第二tm;e)重复步骤(b)至(d)至少一次;以及f)测定所述第一靶核酸和所述第二靶核酸的相对拷贝数。
聚合酶链式反应(pcr)是扩增靶核酸序列的一个或多个拷贝(也就是增加靶核酸序列的拷贝数)的技术。扩增可以跨越几个数量级,产生数千到数十亿具体dna序列的拷贝。聚合酶链式反应依靠热循环,由反复加热和冷却反应以实现dna解链和核酸的酶复制的循环组成。随着pcr的进行,产生的dna本身用作扩增模板,启动该dna模板得以指数扩增的链式反应。
pcr通常由一系列称为循环的重复温度变化组成;每个循环通常由2-3个离散的温度步骤组成。pcr可以以具有3或4个步骤(每个步骤处在不同温度下)的循环进行。循环通常始于称为保温(hold)的单个高温(>90℃)步骤,应用该步骤是为了使双链靶核酸序列完全解链(即产生单链),接着重复一组温度变化(其间发生靶核酸的扩增),然后进行最后的终保温以进行最终产物延伸或短暂保存。使用的温度和所用温度在每个循环的应用的时长取决于多个参数。这些参数包括用于dna合成的酶(如dna聚合酶)、反应中二价离子和dntp的浓度、引物的解链温度和扩增产物的解链温度。
pcr至少包括变性步骤、退火步骤和延长步骤。延长步骤也可以称为延伸步骤。在pcr中,变性、退火、延伸步骤按顺序发生至少一次(又名单个“循环”),但通常重复最多达40个循环。当使用的dna聚合酶需要热活化时,在pcr的循环阶段之前先进行额外的步骤,称为启动(initialization)步骤。每一步都有与其相关的各自温度。与每个步骤相关的温度分别被称为启动温度、变性温度、退火温度、延伸或延长温度。
启动步骤可以包括将反应加热到90、91、92、93、94、95、96、97或98℃的启动温度,所述温度可以保持1、2、3、4、5、6、7、8、9、10、11、12、13、14或15分钟。只有当用于pcr的dna聚合酶需要热活化时,通常才需要启动步骤。例如,如果正在使用耐高温的聚合酶,可以使用初始温度为98℃的启动步骤。
变性步骤通常是在pcr重复循环中的第一个步骤,并且包括将反应加热至90、91、92、93、94、95、96、97或98℃的变性温度,保持15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34或35秒。变性步骤通过破坏互补碱基之间的氢键使dna模板解链,产生单链dna。
退火步骤通常是pcr重复循环中的第二步,并且包括将温度降低至45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69或70℃的退火温度,保持1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44或45秒以使引物组的引物退火,从而与靶核酸杂交。退火温度可以比所使用的引物的tm低约0、1、2、3、4、5、6、7、8、9或10℃。当引物序列与模板序列极大程度地匹配时,会形成稳定的dna-dna氢键。聚合酶结合引物-模板杂合体,并且开始dna合成。
延长/延伸步骤是核酸聚合酶通过以5’到3'方向加入与靶核酸互补的dntp并且使dntp的5’-磷酸基团与新生(延伸的)靶核酸链的末端3'-羟基缩合,从而合成与靶核酸链互补的新核酸链的步骤。延伸时间既取决于所使用的核酸聚合酶,而且取决于要扩增的靶核酸的长度。作为经验法则,在最佳温度下,核酸聚合酶每分钟聚合一千个碱基。在最佳条件下,即如果在每个延伸步骤中均没有限制(由于有限的底物或试剂),那么靶核酸量会增加一倍,从而导致特定靶核酸的指数(几何)扩增。在这个步骤的延伸温度取决于所使用的核酸聚合酶。例如,taq聚合酶具有在75-80℃的最佳活性温度,并且对于此酶,通常使用72℃的温度。
pcr还可以包括最终延伸步骤。在最后一次pcr循环之后,最终延伸可以在68、69、70、71、72、73、74或75℃的最终延伸温度进行1、2、3、4、5、6、7、8、9、10、11、12、13、14或15分钟,以确保任何剩余的单链dna均被完全复制以产生双链dna产物。
pcr还可以包含信号采集步骤,其中可以测定检测标记的量。信号采集步骤可以在扩增靶序列期间进行。在某些方面,信号采集步骤在变性步骤、退火步骤和延伸步骤之后。信号采集步骤可以在信号采集温度下进行。信号采集温度可以为任意温度,并且信号采集可以在pcr中进行一次或多次。当如本文所述测定两个或多个靶核酸的拷贝数时,信号采集温度对每个扩增子的检测标记的检测应是不同的。例如,应当选择两个或多个用于信号采集的温度,以致第一信号采集温度低于第一扩增子的tm,并且第二信号采集温度高于所述第一tm且低于第二扩增子的tm。两个或多个信号采集温度之间的差可以是3、4、5、6、7、8、9或10℃。信号采集步骤可以在采集温度下进行1、2、3、4、5、6、7、8、9、10、11、12、13、14或15秒。
pcr还可包括最终保温步骤。最终保温步骤可以在4、5、6、7、8、9、10、11、12、13、14或15℃的最终保温温度保持无限期的时间。最终保温步骤可以用于反应物的短期保存。
聚合酶链式反应还可包括连续阶段的循环。每个连续阶段的循环可以包括一个或多个上述的pcr步骤。每个连续阶段的循环也可以称为pcr“循环”。对于每个pcr循环,每个连续阶段的循环可以在相同或不同的温度下进行。对于一个或多个pcr循环,可以运行退火温度改变的pcr。例如,pcr可运行共40个循环,其中第一阶段的循环的退火温度相同,然后第二阶段的循环的退火温度升高,并且第三阶段的循环的退火温度降低。
“均一体系”是靶核酸的扩增和检测在同一反应中发生的体系。均一体系是在扩增靶序列期间中产生可检测信号的体系。所谓的“扩增期间”表示在一个pcr循环之后但在后续的pcr循环之前。所谓的“扩增期间”还指在pcr期间,但在最终保温步骤之前。
相对拷贝数可以通过本文他处所述的方法来进行。例如,本文所述的方法可用于在一组反应孔中测量实验dna样本中的端粒(t)重复序列的量和在不同孔中测量单拷贝基因(s)的量(相比于参考dna),产生与平均端粒长度成比例的相对t/s比值。在一个方面,可在s信号上升到高于基线之前,在早期的循环中收集t信号,并且可在使端粒产物完全解链、使其信号处于基线的温度下收集s信号。也可将t/s比值的相关性与通过southern杂交测量的末端限制性片段(trf)的长度相关,以确定拷贝数。
本文还公开了用于测定第一靶核酸和第二靶核酸的拷贝数的方法,其中第一靶核酸序列的拷贝数比第二靶核酸序列的拷贝数多,所述方法包括:a)将第一靶核酸与第一引物组并将第二靶核酸与第二引物组接触,并且加入单一检测标记以形成均一体系的反应混合物,b)通过聚合酶链式反应用第一引物组扩增第一靶核酸以形成具有第一解链温度(tm)的第一扩增子,以及通过聚合酶链式反应用第二引物组扩增第二靶核酸以形成具有第二tm的第二扩增子,其中所述第二tm比所述第一tm高;c)在聚合酶链式反应期间,在第一采集温度下测定所述检测标记的量,其中所述第一信号采集温度低于所述第一tm;d)升高反应混合物的温度至第二信号采集温度并且测定所述检测标记的量,其中所述第二信号采集温度高于所述第一tm并且低于所述第二tm;e)重复步骤(b)至(d)至少一次;以及f)测定所述第一靶核酸和所述第二靶核酸的相对拷贝数。
本文还公开了用于测定第一靶核酸和第二靶核酸的拷贝数的方法,所述方法包括:a)将第一靶核酸与第一引物组并将第二靶核酸与第二引物组接触,并且加入单一检测标记以形成均一体系的反应混合物,b)通过聚合酶链式反应用第一引物组扩增第一靶核酸以形成具有第一解链温度(tm)的第一扩增子,以及通过聚合酶链式反应用第二引物组扩增第二靶核酸以形成具有第二tm的第二扩增子,其中所述第二tm比所述第一tm高;c)在聚合酶链式反应期间,在第一采集温度下测定所述检测标记的量,其中所述第一信号采集温度低于所述第一tm;d)升高反应混合物的温度至第二信号采集温度并且测定所述检测标记的量,其中所述第二信号采集温度高于所述第一tm且低于所述第二tm;e)重复步骤(b)至(d),直到在所述第二信号采集温度下测出所述检测标记;以及f)测定所述第一靶核酸和所述第二靶核酸的相对拷贝数。
本文还公开了用于测定第一靶核酸和第二靶核酸的拷贝数的方法,所述方法包括:a)将第一靶核酸与第一引物组并将第二靶核酸与第二引物组接触,并且加入单一检测标记以形成均一体系的反应混合物,b)通过聚合酶链式反应用第一引物组扩增第一靶核酸以形成具有第一解链温度(tm)的第一扩增子,并且通过聚合酶链式反应用第二引物组扩增第二靶核酸以形成具有第二tm的第二扩增子,其中所述第二tm比所述第一tm高;c)在聚合酶链式反应期间,在第一采集温度下测定所述检测标记的量,其中所述第一信号采集温度低于所述第一tm;d)升高反应混合物的温度至第二信号采集温度并且测定所述检测标记的量,其中所述第二信号采集温度高于所述第一tm且低于所述第二tm,其中在每个所述扩增步骤期间,在所述第一信号采集温度和所述第二信号采集温度下检测所述检测标记的量;e)重复步骤(b)至(d)至少一次;以及f)测定所述第一靶核酸和所述第二靶核酸的相对拷贝数。
本文还公开了用于测定第一靶核酸和第二靶核酸的拷贝数的方法,所述方法包括:a)将第一靶核酸与第一引物组并将第二靶核酸与第二引物组接触,并且加入单一检测标记以形成均一体系的反应混合物,b)通过聚合酶链式反应用第一引物组扩增第一靶核酸以形成具有第一解链温度(tm)的第一扩增子,并且通过聚合酶链式反应用第二引物组扩增第二靶核酸以形成具有第二tm的第二扩增子,其中所述第二tm高于所述第一tm;c)在聚合酶链式反应期间,在第一采集温度下测定所述检测标记的量,其中所述第一信号采集温度低于所述第一tm;d)升高反应混合物的温度至第二信号采集温度并且测定所述检测标记的量,其中所述第二信号采集温度高于所述第一tm且低于所述第二tm,其中第一tm和第二tm之间的差为至少4摄氏度;e)重复步骤(b)至(d)至少一次;以及f)测定所述第一靶核酸和所述第二靶核酸的相对拷贝数。
本文还公开了用于测定第一靶核酸和第二靶核酸的拷贝数的方法,所述方法包括:a)将第一靶核酸与第一引物组并将第二靶核酸与第二引物组接触,并且加入单一检测标记以形成均一体系的反应混合物,其中第二引物组中的至少一个引物在该引物的5’端包含gc-钳;b)通过聚合酶链式反应用第一引物组扩增第一靶核酸从而形成具有第一解链温度(tm)的第一扩增子,并且通过聚合酶链式反应用第二引物组扩增第二靶核酸从而形成具有第二tm的第二扩增子,其中所述第二tm高于所述第一tm;c)在聚合酶链式反应期间,在第一采集温度下测定所述检测标记的量,其中所述第一信号采集温度低于所述第一tm;d)升高反应混合物的温度至第二信号采集温度并且测定所述检测标记的量,其中所述第二信号采集温度高于所述第一tm并且低于所述第二tm;e)重复步骤(b)至(d)至少一次;以及f)测定所述第一靶核酸和所述第二靶核酸的相对拷贝数。
本文还公开了用于测定第一靶核酸和第二靶核酸的拷贝数的方法,所述方法包括:a)将第一靶核酸与第一引物组并将第二靶核酸与第二引物组接触,并且加入单一检测标记以形成均一体系的反应混合物,其中所述第一引物组中的至少一个引物包含包括a和t核苷酸的5’序列;b)通过聚合酶链式反应用第一引物组扩增第一靶核酸以形成具有第一解链温度(tm)的第一扩增子,并且通过聚合酶链式反应用第二引物组扩增第二靶核酸以形成具有第二tm的第二扩增子,其中所述第二tm高于所述第一tm;c)在聚合酶链式反应期间,在第一采集温度下测定所述检测标记的量,其中所述第一信号采集温度低于所述第一tm;d)升高反应混合物的温度至第二信号采集温度并且测定所述检测标记的量,其中所述第二信号采集温度高于所述第一tm并且低于所述第二tm;e)重复步骤(b)至(d)至少一次;以及f)测定所述第一靶核酸和所述第二靶核酸的相对拷贝数。
本文还公开了用于测定第一靶核酸和第二靶核酸的拷贝数的方法,所述方法包括:a)将第一靶核酸与第一引物组并将第二靶核酸与第二引物组接触,并且加入单一检测标记以形成均一体系的反应混合物,其中第一引物组的引物的3’端是彼此互补的,并且其中第一引物组的一个引物是包含至少一个与该引物的3’端相邻的错配核苷酸的错配引物,其中所述核苷酸与靶核酸是不互补的,但是与第一引物组中的另一个引物的3’端核苷酸是互补的;b)通过聚合酶链式反应用第一引物组扩增第一靶核酸以形成具有第一解链温度(tm)的第一扩增子,并且通过聚合酶链式反应用第二引物组扩增第二靶核酸以形成具有第二tm的第二扩增子,其中所述第二tm高于所述第一tm;c)在聚合酶链式反应期间,在第一采集温度下测定所述检测标记的量,其中所述第一信号采集温度低于所述第一tm;d)升高反应混合物的温度至第二信号采集温度并且测定所述检测标记的量,其中所述第二信号采集温度高于所述第一tm并且低于所述第二tm;e)重复步骤(b)至(d)至少一次;以及f)测定所述第一靶核酸和所述第二靶核酸的相对拷贝数。
本文还公开了用于测定第一靶核酸和第二靶核酸的拷贝数的方法,所述方法包括:a)将第一靶核酸与第一引物组并将第二靶核酸与第二引物组接触,并且加入单一检测标记以形成均一体系的反应混合物,其中第一引物组的一个引物被阻止引发第一靶核酸;b)通过聚合酶链式反应用第一引物组扩增第一靶核酸以形成具有第一解链温度(tm)的第一扩增子,并且通过聚合酶链式反应用第二引物组扩增第二靶核酸以形成具有第二tm的第二扩增子,其中所述第二tm高于所述第一tm;c)在聚合酶链式反应期间,在第一采集温度下测定所述检测标记的量,其中所述第一信号采集温度低于所述第一tm;d)升高反应混合物的温度至第二信号采集温度并且测定所述检测标记的量,其中所述第二信号采集温度高于所述第一tm并且低于所述第二tm;e)重复步骤(b)至(d)至少一次;以及f)测定所述第一靶核酸和所述第二靶核酸的相对拷贝数。
本文还公开了用于测定第一靶核酸和第二靶核酸的拷贝数的方法,所述方法包括:a)将第一靶核酸与第一引物组并将第二靶核酸与第二引物组接触,并且加入单一检测标记以形成均一体系的反应混合物,其中该检测标记是嵌入染料;b)通过聚合酶链式反应用第一引物组扩增第一靶核酸以形成具有第一解链温度(tm)的第一扩增子,并且通过聚合酶链式反应用第二引物组扩增第二靶核酸以形成具有第二tm的第二扩增子,其中所述第二tm高于所述第一tm;c)在聚合酶链式反应期间,在第一采集温度下测定所述检测标记的量,其中所述第一信号采集温度低于所述第一tm;d)升高反应混合物的温度至第二信号采集温度并且测定所述检测标记的量,其中所述第二信号采集温度高于所述第一tm并且低于所述第二tm;e)重复步骤(b)至(d)至少一次;以及f)测定所述第一靶核酸和所述第二靶核酸的相对拷贝数。
在本文所述的方法的某些方面,第一靶核酸和第二靶核酸的拷贝数度量第一核酸相比于第二核酸的相对量。
在某些方面,可以使用sybrgreeni作为唯一荧光染料并使用仅装备用于单色检测的qpcr仪,通过阻止早期扩增模板的扩增干扰后期扩增模板的扩增的策略,以多重qpcr准确定量靶序列和参照序列。在某些方面,为通过mmqpcr定量一组dna样本中的两个模板,两个条件必须得到满足。首先,必须找到这样的pcr条件,从而,对于所述组中的每个dna样本,当达到早期扩增产物的循环阈值时,后期扩增产物的扩增信号仍处于基线。第二,后期扩增产物必须具有比早期扩增产物更高的解链温度,以便可以在低至足以保持后期扩增产物为双链、但高至足以使早期扩增产物完全解链、使其荧光信号处于基线的温度下监测后期扩增产物的荧光。通过设计引物以使两种pcr产物均较小,以及向后期扩增产物的引物加入富含gc的5’标签(如gc-钳),可以确保后期扩增产物具有更高的解链温度。
本文所述的方法可用于定量生物样本中两种不同模板的水平,其中每种模板在拷贝数上有差异,但第一种模板和第二种模板的拷贝数的范围没有重叠。例如,细胞具有远多于单拷贝核基因的拷贝的端粒重复序列拷贝;同样的情况适用于mtdna拷贝与单拷贝基因、rdna拷贝与单拷贝基因、aludna拷贝与单拷贝基因等。同样地,在对mrna水平的多重逆转录qpcr(rt-qpcr)的研究中,其目的往往是定量两种不同的mrna种类的水平,每种在拷贝数上不同,但具有不重叠的拷贝数范围。对于这些其中的每一个模板对,当较低丰度模板的扩增信号处于基线时,可以收集较高丰度模板的ct值;并且较低丰度模板的ct值可以在使其富含gc的产物处于双链而使高丰度模板的产物完全解链且其信号被消除的高温下收集。通过在整个pcr循环中收集在两个不同温度下的荧光信号并单独分析这些信号,可用单一,单色检测标记独立地定量所述两个模板中的每一个模板。
迄今为止,由于累积的荧光信号来自全部两个扩增子,因此人们认为无法用单一重dna嵌入染料在多重定量聚合酶链式反应中测定两种不同dna序列的相对拷贝数。本文所述的方法提出这样的策略,即使得两个扩增子的信号可被单独地收集。当第二扩增子的信号仍在基线处时,在早期循环中收集第一扩增子的循环阈值(ct)。在远高于第一扩增子的解链温度(tm)、使第一扩增子成为单链并使其信号处于基线的温度下收集第二扩增子的循环阈值(ct)。对引物进行设计以使两个扩增子均较小,并且第二扩增子富含gc,从而提高其tm。作为拷贝数范围没有重叠的高和低丰度的种类在生物样本中存在的模板对是用于此方法的天然靶标。即使具有相似拷贝数的两个模板也可以通过应用延迟一个扩增子的扩增的引物和热循环设计加以区分。本文所述的方法可以用来测定人dna样本中的相对端粒长度。
相似拷贝数方法
本文还公开了测定第一靶核酸和第二靶核酸的拷贝数的方法,其中第一靶核酸序列的拷贝数与第二靶核酸序列的拷贝数相似,所述方法包括:a)将第一靶核酸与第一引物组并将第二靶核酸与第二引物组接触,并且加入单一检测标记以形成均一体系的反应混合物,b)通过聚合酶链式反应用第一引物组扩增第一靶核酸以形成具有第一解链温度(tm)的第一扩增子,并且通过聚合酶链式反应用第二引物组扩增第二靶核酸以形成具有第二tm的第二扩增子,其中所述第二tm高于所述第一tm;c)在聚合酶链式反应期间,在第一采集温度下测定所述检测标记的量,其中所述第一信号采集温度低于所述第一tm;d)升高反应混合物的温度至第二信号采集温度并且测定所述检测标记的量,其中所述第二信号采集温度高于所述第一tm并且低于所述第二tm;e)重复步骤(b)至(d)至少一次;以及f)测定所述第一靶核酸和所述第二靶核酸的相对拷贝数。
当第一靶核酸序列的拷贝数与第二靶核酸序列的拷贝数相似时,pcr的循环数或pcr的各个步骤可以改变或变化。例如,当第一靶核酸序列的拷贝数与第二靶核酸序列的拷贝数相似时,该方法的聚合酶链式反应可以进一步包括至少三个连续的阶段,其中第一阶段的聚合酶链式反应包括其中聚合酶链式反应的退火温度高于第二阶段的退火温度的聚合酶链式反应循环,其中第二阶段的聚合酶链式反应包括其中聚合酶链式反应的退火温度低于第一阶段的退火温度的聚合酶链式反应循环,其中第三阶段的聚合酶链式反应包括其中聚合酶链式反应的退火温度低于第一阶段的退火温度且高于第二阶段的退火温度的聚合酶链式反应。
在某些方面,当应用连续阶段的聚合酶链式反应时,在第一阶段的聚合酶链式反应期间仅形成第二扩增子。在某些方面,当应用连续阶段的聚合酶链式反应时,在第二阶段的聚合酶链式反应期间仅形成第一扩增子。在某些方面,当应用连续阶段的聚合酶链式反应时,在第三阶段的聚合酶链式反应期间形成第一和第二扩增子。在某些方面,当应用连续阶段的聚合酶链式反应时,在第一阶段的聚合酶链式反应期间仅形成第二扩增子,并且在第二阶段的聚合酶链式反应期间仅形成第一扩增子,并且在第三阶段的聚合酶链式反应期间形成第一和第二扩增子。
pcr的引物组成和各个温度也可以根据靶标、引物的tm以及所使用或产生的扩增子和聚合酶而进行改变。
在某些方面,为了通过mmqpcr定量两个相似丰度的模板,将模板之一的扩增延迟几个循环。例如,可将一个引物对设计成在68℃退火,而另一引物对在50℃退火。在初始15分钟的热启动dna聚合酶的活化以及基因组dna样本的变性之后,在94℃和68℃之间循环至少四个循环将在第一模板的扩增中提供4个(或更多个)循环的热启动,而第二模板不被引发。接着,在94℃和50℃之间循环两个循环将继续扩增第一模板,并且启动第二模板的扩增。注意,第二模板的引物可以具有富含gc的5’标签(如gc-钳),以赋予它们的pcr产物高解链温度。由于在94℃和50℃之间循环两个循环足够合成与这些引物的全长互补的序列,从而得出,一旦这两个循环完成,则退火温度可再次提高,并且程序中剩余的循环可以有与下面方案中的第三阶段(参见材料和方法部分)相似的热循环谱,在此期间,在每个循环中在两个不同温度下收集荧光信号。
在另一个方面,提供了将一个模板的扩增延迟几个循环的第二种方法,以使两个引物对均可启动产物形成;然后以高至足以使低熔点扩增子解链但不足以使高熔点扩增子解链的变性温度进行四个或更多个循环;最后转变为与剩余循环的第三阶段(参见材料和方法部分)相似的热循环谱。以降低的变性温度进行循环的阶段使得仍可对原始模板进行线性扩增,所述扩增原本是要延迟的。此问题的解决方案是使用这样的两个引物对,即具有较低的初始退火温度(例如50℃)的,但5’标签(如gc-钳)赋予pcr扩增子较高的后续退火温度。通过在94℃至50℃之间循环两个循环,足以产生初始pcr产物,之后将退火温度升高到足以防止对原始dna模板的任何进一步引发。
在一个方面,所述第一靶核酸在第一核酸中并且所述第二靶核酸在第二核酸中。在这方面,第一靶核酸和第二靶核酸的拷贝数量度所述第一核酸相比于所述第二核酸的相对量。在另一方面,第一靶核酸在第一核酸中并且第二靶核酸在第二核酸中。第一靶核酸的拷贝数量度在第一核酸中的第一靶核酸的非串联重复序列,其中所述非串联重复序列是通过所述第一引物对独立扩增的。
还公开了用于通过多重定量pcr测定相比于第二靶核酸拷贝数的第一靶核酸拷贝数的方法。第一靶核酸包含串联重复序列并且所述第一靶核酸序列的拷贝数比所述第二靶核酸序列的拷贝数多。该方法包括:(1)将包含第一靶核酸和第二靶核酸的样本与第一引物组、第二引物组和嵌入染料接触,其中第一引物组能pcr扩增第一靶核酸以形成具有第一解链温度(tm)的第一扩增子,其中第一引物对的第一引物在非3’端处包含错配核苷酸,当所述第一引物与所述第一靶核酸的第一链杂交时,所述错配核苷酸与所述第一链中的核苷酸不进行碱基配对,并且其中所述第一引物对的第二引物具有3’核苷酸,当所述第二引物与所述第一链的pcr转录物杂交时,所述3’核苷酸与所述第一核酸的第二链的核苷酸不进行碱基配对,但是与所述pcr转录物中的所述错配核苷酸进行碱基配对,由此通过重复的pcr循环产生的第一扩增子具有确定的大小以及所述第一tm,并且其中所述第二引物组能扩增所述第二靶核酸以形成具有第二tm的第二扩增子,其中所述第二tm高于所述第一tm;(2)通过包括用于测量第一和第二扩增子中的染料嵌入的第一和第二信号采集温度的温度谱对样本进行pcr循环,其中第一信号采集温度低于第一tm并且所述第二信号采集温度高于第一tm且低于第二tm;(3)重复pcr循环步骤;以及(4)在至少两个不同的pcr循环中在第一和所述第二信号采集温度下测量染料嵌入所致的嵌入信号,从而确定第一靶核酸和第二靶核酸的相对拷贝数。
还公开了用于通过多重定量pcr测定相比于第二靶核酸拷贝数的第一靶核酸拷贝数的方法,其中第一靶核酸序列的拷贝数与第二靶核酸序列的拷贝数相似。该方法包括:(1)将包含第一靶核酸和第二靶核酸的样本与第一引物组、第二引物组和嵌入染料接触,其中第一引物组能扩增第一靶核酸以形成具有第一解链温度(tm)的第一扩增子,并且其中第一引物对和第一靶核酸之间的杂交复合体具有第一引物tm,并且其中第二引物组能扩增第二靶核酸以形成具有第二tm的第二扩增子,并且其中所述第二引物对和所述第二靶核酸的杂交复合体具有第二引物tm,其中所述第二tm高于所述第一tm并且其中所述第一引物tm高于所述第二引物tm;(2)使所述样本经过预定数目的pcr循环,其中在所述预定的pcr循环中引物退火温度高于所述第二引物tm以阻止所述第二靶核酸的扩增;(3)通过其中引物退火温度等于或低于所述第二引物tm的温度谱对所述样本进行pcr循环,借此pcr扩增所述第一靶核酸和所述第二靶核酸,并且其中所述温度谱包括用于测量所述第一和第二扩增子中所述染料的嵌入的第一和第二信号采集温度,其中所述第一信号采集温度低于所述第一tm,并且所述第二信号采集温度高于所述第一tm且低于所述第二tm;(4)重复所述pcr循环步骤;以及(5)在至少两个不同的pcr循环中在所述第一和所述第二信号采集温度下测量由所述染料的嵌入产生的嵌入信号,其中从所述嵌入信号和所述预定的pcr循环数确定所述第一和所述第二靶核酸的相对拷贝数。
还公开了用于通过多重定量pcr测定相比于第二靶核酸拷贝数的第一靶核酸拷贝数的方法,其中第一靶核酸序列的拷贝数与第二靶核酸序列的拷贝数相似。该方法包括:(1)将包含第一靶核酸和第二靶核酸的样本与第一引物组、第二引物组和嵌入染料接触,其中所述第一引物组能扩增所述第一靶核酸序列以形成具有第一解链温度(tm)的第一扩增子,并且其中所述第一引物对与所述第一靶核酸之间的杂交复合体具有第一引物tm,并且所述第二引物组能扩增所述第二靶核酸以形成具有第二tm的第二扩增子,并且其中所述第二引物对与所述第二靶核酸之间的杂交复合体具有第二引物tm,其中所述第二tm高于所述第一tm且其中所述第一引物tm高于所述第二引物tm;(2)使所述样本经过第一预定数目的pcr循环,其中在所述预定的pcr循环中引物的退火温度等于或低于所述第一引物tm,从而扩增所述第一靶核酸和所述第二靶核酸;(3)使所述样本经过第二预定数目的pcr循环,其中变性温度低于所述第二tm,从而阻止所述第二靶核酸的进一步扩增;(4)通过其中引物退火温度等于或低于所述第二引物tm的温度谱对所述样本进行pcr循环,借此pcr扩增所述第一靶核酸和所述第二靶核酸,并且其中所述温度谱包括用于测量所述第一和第二扩增子中所述染料的嵌入的第一和第二信号采集温度,其中所述第一信号采集温度低于所述第一tm并且所述第二信号采集温度高于所述第一tm且低于所述第二tm;(5)重复所述pcr循环步骤;以及(6)在至少两个不同的pcr循环中在所述第一和所述第二信号采集温度下测量由所述染料的嵌入产生的嵌入信号,其中从所述嵌入信号和所述第二预定数目的pcr循环确定所述第一靶核酸和所述第二靶核酸的相对拷贝数。
在本文所述的方法的某些方面中,第二样本可以用作测定拷贝数的参照。该方法还包括至少一个参照样本、所述第一引物对和所述第二引物对以及所述嵌入染料,所述参照样本包含含有已知拷贝数的所述第一靶核酸和所述第二靶核酸的参照核酸;其中所述第二样本经过与所述第一样本相同的pcr条件并且其中将所述第二样本在所述第一和所述第二信号采集温度下的嵌入信号与在所述第一样本中在所述第一和所述第二信号采集温度下的嵌入信号相比,从而提供所述第一靶核酸和所述第二靶核酸的绝对拷贝数的指示。
在某些方面,该方法包括:(1)在存在嵌入双链dna中后会发荧光的任何单一检测标记的情况下,使包含所述第一靶核酸的样本与第一引物组并将所述第二靶核酸与第二引物组接触,其中所述第一引物组能扩增所述第一靶核酸以形成具有第一解链温度(tm)的第一扩增子,并且所述第二引物组能扩增所述第二靶核酸以形成具有第二tm的第二扩增子,其中所述第二tm充分高于所述第一tm,从而确保在所述第二扩增子还没有开始解链的温度下使所述第一扩增子完全解链;(2)通过包括用于测量所述第一和第二扩增子的所述染料嵌入的第一和第二信号采集温度的温度谱对所述样本进行重复pcr循环,其中所述第一信号采集温度充分低于所述第一扩增子还没有开始解链的所述第一tm,并且所述第二信号采集温度充分高于所述第一扩增子完全解链的所述第一tm并且充分低于所述第二扩增子还没有开始解链的第二tm;以及(3)在使所述第一信号可穿过所述第二信号仍在基线处的循环数的检测阈值的一组条件下,在至少两个不同的pcr循环中在所述第一和所述第二信号采集温度下测量所述染料的嵌入信号,从而确定所述第一靶核酸和所述第二靶核酸的相对拷贝数。
试剂盒
上文所述的材料以及其他材料都可以以任何适当组合的形式包装在一起作为用于实施或帮助实施所公开的方法的试剂盒。对在给定的试剂盒中的试剂盒组分进行设计并使其适于一起用于所公开的方法是有用的。例如,公开了用于测定一个或多个靶核酸的拷贝数的试剂盒,该试剂盒包括一种或多种试剂组合物以及一种或多种组分或试剂以测定一个或多个靶核酸的拷贝数。例如,所述试剂盒可以包括一种或多种试剂组合物以及一个或多个引物组、检测标记、核酸聚合酶或组合。另一种形式的试剂盒可以包含多种试剂组合物。所述试剂盒也可以包含例如,核苷酸、缓冲液、连接酶、开环探针、缺口寡核苷酸(gapoligonucleotide)或组合。
公开了可以用于此类方法的试剂盒。所述试剂盒可以至少包括用于扩增第一靶核酸和第二靶核酸的第一和第二pcr引物对。此类组分可以在适合用于pcr扩增仪的第一容器中。在一些方面,将测试样本加入到该容器中,并且根据所公开的方法进行pcr扩增。所述试剂盒还可以包括用于进行pcr的一种或多种或所有组分,包括三磷酸脱氧核苷酸(deoxynucleotidetriphosphate),热稳定dna聚合酶和检测标记。
在一个方面,所述试剂盒可以包含同样适用于pcr仪的第二容器,所述第二容器包含第二样本(包含含有已知拷贝数的第一靶核酸和所述第二靶核酸的参照核酸)并任选地包含进行pcr所需的其他组分(包括第一和第二引物对和嵌入染料)。所述第二容器经受与第一容器样本同样的pcr条件。第二容器提供已知拷贝数的第一靶核酸和第二靶核酸的参照嵌入信号,从而有助于确定测试样本中第一靶核酸和所述第二靶核酸的绝对拷贝数。包含具有不同拷贝数的第一和第二靶核酸的参照核酸的其他容器也可以包括在试剂盒中。此类容器提供其他的嵌入信号,所述信号提供在绝对拷贝数比值的范围内不同的参照点。当一个检测样本中的第一和第二靶核酸的拷贝数可以在一个宽范围内变化时,此类其他容器是特别有用的。
还公开了包括适合用于pcr仪的第一容器的试剂盒,其中所述第一容器包含含有已知拷贝数的第一靶核酸和第二靶核酸的参照核酸。所述试剂盒还可以包含至少一个其他容器,所述其他容器包含相比于所述第一容器的参照核酸具有不同拷贝数的第一和第二靶核酸的第二参照核酸。所述容器任选地含有嵌入染料以及pcr需要的其他组分。此类试剂盒可用于标准化一种或多种不同参照核酸的由pcr仪产生的的嵌入信号。
系统
公开了可用于实施或帮助实施所公开的方法的系统。还公开了用于生产试剂组合物的系统。系统通常包含制造品例如结构、机器、设备等以及组合物、化合物、材料等等的组合。被公开的或从公开的内容明显可知的此类组合被涵盖。例如,被公开并且被涵盖的是包含固体支持物和试剂组合物的系统。
数据结构和电脑控制
公开了用于所公开的方法或由所公开的方法产生或从所公开的方法产生的数据结构。数据结构通常是在组合物或媒介中收集、组织、存储和/或具体表现的任何形式的数据、信息和/或对象。以电子形式(例如在ram中或在磁盘储存器上)存储的目标指纹是一种类型的数据结构。
所公开的方法或其任何部分或其制剂因此可以通过计算机控制来控制、管理或辅助。此类计算机控制可以通过计算机控制的过程或方法来完成,可使用和/或产生数据结构,并且可以使用计算机程序。此类计算机控制、计算机控制的过程、数据结构以及计算机程序被涵盖,并且应当理解为在本文中被公开。
实施例
实施例1
研究对象
通过标准步骤直接从血液样本中提取基因组dna,并且在4℃以大约100ng/μl的浓度长期贮存于te-4(10mmtris-hcl,0.1mmedta,ph值7.5)中。在临开始qpcr运行之前,将dna储液稀释到纯水中。来自95个犹他州个体(47名女性和48名男性,年龄范围为5-94岁)的样本是在我们先前的描述通过单重定量pcr测量端粒长度的文章中分析的样本(cawthon,r.m.(2002)telomeremeasurementbysingleplexquantitativepcr.nucleicacidsres,30,e47)。
单色多重定量pcr(mmqpcr)
通过将15μl主混合物(mastermix)的小份加入到与bio-rad公司myiq单色实时pcr检测系统兼容的96孔板的每个反应孔中建立pcr反应,然后加入10μl的各个实验dna样本(含有约20ng稀释于纯水中的dna),使得每个反应终体积为25微升。通过系列稀释制备了跨度为81倍dna浓度范围的五种浓度的参照dna样本(“标准dna”),并将其在这项研究中在每个96孔板中进行一式两份的分析;这些反应提供了用于生成用于相对定量的标准曲线的数据。所有实验dna样本均进行一式三份的测定。
pcr中试剂的最终浓度分别0.75×sybrsybrgreeni(invitrogen),10mmtris–hclph8.3,50mmkcl,3mmmgcl2,0.2mm各dntp,1mmdtt和1m甜菜碱(u.s.biochemicals)。每个25μl反应加入0.625uamplitaqgolddna聚合酶(appliedbiosystems,inc.)。对于多重qpcr,在主要混合物中,端粒引物对telg和telc(各自最终浓度为900nm)与白蛋白引物对albu和albd(各自最终浓度为900nm)或与β-珠蛋白引物对hbgu和hbgd(各自最终浓度为500nm)结合。所有引物序列和其设计依据在结果部分给出。
热循环谱是:第1阶段:95℃15分钟;第2阶段:94℃15秒、49℃15秒,2个循环;以及第3阶段:94℃15秒、62℃10秒、74℃15秒(信号采集)、84℃10秒、88℃15秒(信号采集),32个循环。在74℃的读数提供扩增端粒模板的ct值;在88℃的读数提供扩增单拷贝基因模板的ct值。
热循环和原始数据收集完成之后,myiq软件(bio-radiq52.0标准版光学系统软件)用于产生每个板的两条标准曲线,一条是端粒信号的标准曲线,另一条是scg信号的标准曲线。实验dna样本的t/s比值为t除以s,t为与实验样本的端粒模板的拷贝数匹配的标准dna以ng计的量,s为与实验样本的scg拷贝数匹配的标准dna以ng计的量。由于每个实验样本均进行一式三份的测定,因此每个样本获得三个t/s结果;在给定运行中样品的最终报告结果为所述三个t/s值的平均值。平均t/s被预期与每个细胞的平均端粒长度成正比。t/s>1.0的样本的平均端粒长度比标准dna的平均端粒长度长;t/s<1.0的样本的平均端粒长度比标准dna的平均端粒长度短。
测定平均末端限制性片段(trf)长度
如前人所述测定平均trf长度,一式两份(cawthon,r.m.(2002)nucleicacidsres,30,e47)。简言之,用haeiii限制性内切核酸酶消化dna,并且将所消化的样本与dna大小标准物混合,然后进行琼脂糖凝胶电泳并进行印迹到尼龙膜上的southern印迹。在将印迹与放射性端粒寡核苷酸探针(ttaggg)7(seqidno:1)杂交并且获取端粒拖影图像后,剥离印迹,并且将印迹与对dna大小标准物特异的放射性探针杂交。然后将大小标准物图像和端粒拖尾图像叠加以定位端粒拖尾内大小间隔的位置。然后以σ(odi)/σ(odi/li)计算平均trf长度。其中odi是间隔i的背景之上的总放射性,li是以碱基对计的i的平均长度。
结果
从端粒串联六聚体重复序列扩增固定长度的产物的引物
因为引物的结合位点的数目随着平均端粒长度的增加而增加,因此可以通过使用与端粒六聚体重复序列杂交的引物进行定量pcr来测量相对平均端粒长度。我们的用于通过singleplexqpcr(1)测量端粒长度的原始tel1和tel2引物都能在沿着端粒dna的串联重复序列的多个位点处引发。因此,它们产生一系列大小不同的产物,它们中的一些在高到足以与scg扩增子的解链曲线有重叠的温度解链。因此,当tel1和tel2是端粒引物时,在没有任何来自双链端粒pcr产物的干扰信号(如成功的mmqpcr需要的)的情况下,在高温下不可能获得来自scg双链扩增子的sybrgreeni荧光信号的“干净(clean)”读数。
为了解决这个问题,设计了一对端粒引物,telg,acactaaggtttgggtttgggtttgggtttgggttagtgtseqidno:2)和telc,tgttaggtatccctatccctatccctatccctatccctaacaseqidno:3),其产生短的、固定长度的产物(图1)。只有telg能够沿天然端粒dna序列引发dna的合成。telc引物在其3'端的错配碱基阻止telc引物引发天然端粒dna。然而,telc能沿telg引物延伸产物的各种片段杂交,并且正是这些杂交中的一个构型可引发dna合成,由此实现单一、固定长度的产物的产生。这是通过在telg的从3'端的第三个碱基处引入核苷酸变化来实现,以致telg和telc引物的最后三个碱基完全互补地重叠。这种重叠不足以使天然telg和telc引物有效地彼此引发,因此在进行端粒长度定量的循环的范围内,引物二聚体的形成是不可检测的。然而,当telg延伸产物与telc杂交时,这三个碱基的重叠是telc3’端可以有效引发dna合成的唯一位点。参见例如第2003/0162266号美国专利公开。因此,所得的pcr产物是固定长度的,并且比用于产生该产物的两个引物的总长度短三个碱基。这种产物的锐解链曲线(图2的绿色曲线)与特定的、固定长度的产物形成一致,并且6%凝胶中的琼脂糖凝胶电泳仅显示预期的79bp产物(数据未示出)。图2也证明端粒pcr产物的解链曲线与白蛋白pcr产物的解链曲线(图2的蓝色曲线)很好地分离,使得可在使端粒pcr产物完全解链的温度下读取来自白蛋白的sybrgreeni信号。
对单拷贝基因(白蛋白和β-珠蛋白)的引物设计
设计引物以便scg扩增子与端粒扩增子相比在高得多的温度下解链。然后可在这样的温度下采集来自scg扩增子的荧光信号,即所述温度高至足以使端粒扩增子完全解链,从而消除其对信号的贡献,但低到足以保持scg扩增子为双链并且因此能结合sybrgreeni。
用于扩增scg白蛋白的引物是albu:cggcggcgggcggcgcgggctgggcggaaatgctgcacagaatccttgseqidno:4);和albd:gcccggcccgccgcgcccgtcccgccggaaaagcatggtcgcctgttseqidno:5)。预期的产物大小是98bp。用于扩增scgβ-珠蛋白的引物是hbgu:gcggcggcgggcggcgcgggctgggcggcttcatccacgttcaccttgseqidno:6);以及hbgd:gcccggcccgccgcgcccgtcccgccggaggagaagtctgccgttseqidno:7)。预期的产物大小是106bp。大写碱基是赋予所生成的pcr产物非常高的解链温度的非模板化5’标签序列。请注意,白蛋白引物的5’标签序列与β-珠蛋白引物的5’标签序列相同。还要注意,在每个引物组中的两个富含gc的5’标签序列彼此差异很大;如果它们是相同的,那么可能在pcr过程中出现停止扩增的发夹结构。
当通过变性梯度凝胶电泳法(denaturinggradientgelelectrophoresis)(2)筛选基因的点突变时,为提高pcr产物的一端的解链温度而在pcr引物的5’端添加gc-钳的是惯用做法。通过将5’gc钳附接至用于扩增scg的两种引物并且保持靶向的基因组序列较短,会产生具有非常高的解链温度的pcr产物。图2表明双gc钳的白蛋白pcr产物的tm高于91℃。6%凝胶肿的琼脂糖凝胶电泳仅显示预期大小的产物。对于双gc钳的β-珠蛋白pcr产物,也获得相似的结果(数据未显示)。
5’gc-钳也保证用于扩增scg的两个引物对其扩增子的tm均比端粒pcr产物的tm高。这种设计的好处在下面讨论(参见温度变化谱和循环设计部分)。使用oligoanalyzer程序(www.idtdna.com)的分析表明,所有四个scg引物(albu、albd、hbgu和hbgd)在本研究使用的缓冲液组合物中的tm均大于84℃。
热循环谱和循环设计
在热循环方案的第一阶段,amplitaqgolddna聚合酶被热激活,并且基因组dna样本被变性。在第二阶段,由于在那些引物中存在有意引入的防止引物二聚体pcr产物(1)的形成和扩增的突变,因此需要较低温度的两个循环以有效退火并且延伸端粒引物。
在第三阶段,重复循环始于变性、退火和伴有在传统qpcr中常见的信号采集的延伸步骤。之后进行两个非常规的步骤:在84℃孵育10秒和在88℃孵育15秒(伴有第二次信号采集)。由于scg引物的高退火温度(高于84℃)和taqdna聚合酶在84℃仍保持强活性的能力(4),加热至84℃使早期扩增端粒产物解链,释放出dna聚合酶(其结合双链,但不结合单链dna;参考文献3)来针对scgpcr产物,其中进行dna合成。
在传统的多重pcr中,由于早期产物与dna聚合酶的上述结合,高浓度的早期扩增产物往往抑制较低丰度模板的后续扩增。通常建议的解决方案是限制较高丰度的靶序列的引物浓度,以便形成更少的产物,使得足够的dna聚合酶未被结合,自由地继续复制较低丰度的模板。但降低引物浓度通常导致降低的pcr效率,甚至完全不扩增靶序列。降低的效率也造成重复之间ct值的更大变化。mmqpcr中在84℃的孵育步骤消除了限制用于更高丰度模板的引物浓度的需要,从即使是高浓度的相应pcr产物中释放聚合酶,以便可以有效率地合成第二产物。
第二信号采集步骤的进一步加热到88℃确保端粒pcr产物完全解链,并且不能干扰从积累的scg扩增子中采集上升的sybrgreeni信号。
mmqpcr方法在端粒长度的自然范围内的有效性
图3显示在两个不同温度(74℃和88℃)收集的之前显示具有高、中或低平均端粒长度(大约三倍范围的端粒长度)的三个参照人基因组dna样本的扩增曲线。基于图2中所示的解链曲线,在74℃的读数应当同时检测端粒和白蛋白pcr产物,并且在88℃的读数应当仅检测白蛋白pcr产物。然而,由于在每个dna样本中,白蛋白模板的拷贝数远低于端粒模板的拷贝数,因此全部在相应的白蛋白信号仍在基线处时收集的74℃的ct值仅是端粒扩增的度量(已经证实,在没有端粒引物的反应中,无论在74℃还是在88℃收集的单拷贝基因信号均在基本上相同的循环数上升到基线之上)。即使具有最短的端粒(大约1,670bp)的样本,并因此最右移的扩增曲线(蓝色曲线),也在白蛋白基因的扩增信号仍在基线处时的循环数处穿过阈值。在来自5-94岁受试者的95个全血dna模板的本研究中,当收集对应的端粒信号的ct时,每个样本的scg扩增信号处于基线。
端粒和单拷贝基因的独立标准曲线
图4显示对标准dna确定的两条独立的标准曲线(一条是端粒重复序列的标准曲线,另一条是scg白蛋白的标准曲线),所述曲线通过在循环方案的第3阶段的每个循环中在两个不同温度(对于端粒信号为74℃,对于白蛋白信号为88℃)下采集的sybrgreeni荧光信号而确定。在本研究中,对于每个不同的pcr反应板,均使用相同的dna样本生成两条标准曲线。在dna浓度对循环阈值的半对数图中,两个曲线在81倍dna浓度范围内均是线性的。端粒和白蛋白扩增的pcr效率均大于90%,并且近似相等。对于每个dna浓度的这一具体的标准dna样本,在循环中白蛋白的ct均比端粒重复序列的ct出现晚大约6个循环。
在图3中,将基本相等量的dna加入反应中(基于od260uv分光光度计读数),以致在74℃观察到的ct值的差异仅反应端粒长度的差异(没有来自输入dna的量的变化的影响)。(在一般实施中,没有必要精确地匹配实验样本的输入dna,因为将t信号标准化至s信号的程序解决了这个问题。宽范围的输入dna量是可接受的,只要t和s信号两个都在t和s标准曲线的范围内;参见图4)。由于在88℃下仅收集到单拷贝基因(白蛋白基因)信号,因此预期在88℃采集的三个扩增曲线几乎完全重叠。下图显示,当白蛋白信号仍在基线处时,可以在74℃收集端粒信号的循环阈值。(已经确认,在没有端粒引物的反应中,无论在74℃还是在88℃,单拷贝基因信号均在基本相同的循环数时升高至基线之上。还已经确认,在没有单拷贝基因基因的反应中,在88℃读数时,端粒扩增信号在整个pcr运行中是完全平坦的并且为零,如基于图2所示的解链曲线图形会预见的)。由于bio-radmyiq软件可以一次仅显示一个温度的扩增曲线,因此74℃和88℃读数的显示已经被叠加。
平均trf长度和相对t/s比值之间的相关性
为了检验mmqpcr方法对端粒长度测量的有效性,将通过mmqpcr一式三份地测量的来自95个5-94岁个体的全血dna样本中的相对端粒长度(平均t/s比值)与通过常规southern杂交的方法(1)测量的这些相同dna样本的平均末端限制性片段(trf)长度进行了比较。图5显示了通过这些非常不同的技术测量的相对端粒长度的强相关性(r2=0.844)。这种相关性高于以前所报告(1)的通过单重qpcr在这些相同样本中测量的t/s比值与它们的平均trf长度的相关性(r2=0.677)。
t/s比值测量的重现性
为了研究通过mmqpcr的t/s测量的测定内重现性,对在mmqpcr测定的单次运行中一式三份地测定的95个dna样本中的每个样本,使用白蛋白作为scg测定t/s变异系数(标准偏差除以平均值)。变异系数的测定内几何平均数为5.22%。为了检验测定内重现性,在另一天在相同95个dna样本中重复t/s测量(还是一式三份),注意,具体myiqpcr仪和每个dna样本占有的反应孔位置在所述两次独立运行的测试中是不同的。图6显示通过第一次运行和第二次运行确定的平均t/s比值之间的强相关性(r2=0.91)。如所预期的,通过这些数据的线性回归线的斜率接近一致,并且y轴截距接近0。确定了两次独立运行的95对平均t/s值各自的变异系数。所述变异系数的测定内几何平均数为3.13%。
t/s比值与所使用的单拷贝基因无关
为了测试使用β-珠蛋白代替白蛋白作为scg是否可能改变表观相对端粒长度,在用β-珠蛋白引物替换白蛋白引物的两次独立运行中,重复测量95个dna样本的t/s值(一式三份)。图7将以白蛋白作为scg的两次运行的平均t/s值(x轴)对以β-珠蛋白作为scg的两次运行的平均t/s值(y轴)作图。用白蛋白获得的t/s值与用β-珠蛋白获得的t/s值高度相关(r2=0.934)。
通过描述的单色多重定量pcr方法在95个dna样本中测得的相对端粒长度(t/s比值)与通过southern印迹测得的相对末端限制性片段长度具有非常高的相关性。通过原始单重qpcr测定在这些相同的样本中测量的t/s比值与trf长度不高度相关。这些结果表明,通过mmqpcr测量的端粒长度比通过单重qpcr测量的端粒长度更准确。此外,通过mmqpcr获得的t/s结果在独立运行的测定中具有高度重现性。端粒qpcr测定的多重化使得可增加通量并降低端粒长度的流行病学研究的成本。此外,转换为多重测定带来的必须合成或购买昂贵的定制多色荧光探针的通常的额外费用通过采用这种方法也得以避免。
可以容易地调整mmqpcr用于以非常不同的拷贝数天然存在的多对dna模板的研究,例如mtdna拷贝对单拷贝基因,rdna拷贝对单拷贝基因以及aludna拷贝对单拷贝基因。类似地,具有非常不同的拷贝数的rna种类对在反转录成cdna后也可以通过这种方法定量。对于大多数靶标对,可以遵循引物设计的标准原则,唯一额外的指导原则是更高丰度的模板的引物可以产生较短的产物(40-80bp)以使其tm适当地低(<83℃),以及更低丰度的模板的引物可以包含这里所示的5’gc-钳(或类似物)并且产生短的产物以使其tm足够地高(>90℃)。此外,在mmqpcr中,消除了常规多重qpcr中不得不限制用于扩增更高丰度模板的引物的浓度的麻烦和伴随的困难。在此,telg和telc端粒引物的设计特点用于使用与那些重复序列杂交的引物扩增短的串联重复序列。除了用mmqpcr测量端粒长度之外,还用该方法测量mtdna与ndna的比值,并运作良好。通过应用延迟一个扩增子的扩增的引物和热循环谱设计,甚至可以用该方法研究具有相似拷贝数的模板对。
实施例2相似丰度的两个靶标的mmqpcr
如果两个靶核酸具有相似的丰度,则可以采用mmqpcr。为了这样做,可以人为地延迟一个靶标的扩增,同时允许另一个靶继续扩增。例如,当第一靶核酸和第二个靶核酸在丰度方面相似时,使用实施例1中描述的组合物和方法来测定第一靶核酸的拷贝数和第二个核酸的拷贝数。要做到这点,可使用上述的相同的组合物和方法,但提供的pcr循环参数不同。热循环谱可以是:第一阶段:95℃15分钟;第2阶段:94℃15秒、49℃15秒,2个循环;第三阶段:88℃15秒、62℃10秒、74℃15秒,2至6个循环;第四阶段:94℃15秒、62℃10秒、74℃15秒(伴有信号采集)、84℃10秒、88℃15秒(伴有信号采集),32个循环。
上述第三阶段会使得端粒产物可指数扩增,因为其在88℃完全解链。然而,单拷贝基因产物在88℃是完全双链化的,所以单拷贝基因引物在此第3阶段循环期间不能结合并扩增单拷贝基因产物。
除非另有规定,本文使用的所有技术和科学术语与所公开的发明和组合物所属领域的技术人员通常的理解具有相同的涵义。尽管类似或等同于本文所述的任何方法和材料都可以用于实施或测试本发明的方法和组合物,但是特别有用的方法、设备和材料如所述。本文引用的出版物和所引用的材料通过引用方式明确地并入。本文任何内容都不视为承认本发明由于先前发明而不享有此公开内容。
本领域技术人员只是使用常规实验,会认识到或能确定本文所述的方法和组合物的具体实施方案的许多等同形式。此类等同形式意图被下述权利要求所涵盖。
序列表
<110>犹他大学研究基金会
<120>单色多重定量pcr
<130>21101.0199p1
<150>61/139,890
<151>2008-12-22
<160>7
<170>fastseqforwindowsversion4.0
<210>1
<211>6
<212>dna
<213>人工序列
<220>
<223>人工序列的描述:标注=
合成构建体
<400>1
ttaggg6
<210>2
<211>40
<212>dna
<213>人工序列
<220>
<223>人工序列的描述:标注=
合成构建体
<400>2
acactaaggtttgggtttgggtttgggtttgggttagtgt40
<210>3
<211>42
<212>dna
<213>人工序列
<220>
<223>人工序列的描述:标注=
合成构建体
<400>3
tgttaggtatccctatccctatccctatccctatccctaaca42
<210>4
<211>48
<212>dna
<213>人工序列
<220>
<223>人工序列的描述:标注=
合成构建体
<400>4
cggcggcgggcggcgcgggctgggcggaaatgctgcacagaatccttg48
<210>5
<211>47
<212>dna
<213>人工序列
<220>
<223>人工序列的描述:标注=
合成构建体
<400>5
gcccggcccgccgcgcccgtcccgccggaaaagcatggtcgcctgtt47
<210>6
<211>47
<212>dna
<213>人工序列
<220>
<223>人工序列的描述:标注=
合成构建体
<400>6
cggcggcgggcggcgcgggctgggcggcttcatccacgttcaccttg47
<210>7
<211>45
<212>dna
<213>人工序列
<220>
<223>人工序列的描述:标注=
合成构建体
<400>7
gcccggcccgccgcgcccgtcccgccggaggagaagtctgccgtt45
- 还没有人留言评论。精彩留言会获得点赞!
- 重石油级分的hplc分离和定量的制作方法
- 改变PCR产物Tm值达到多重荧光PCR的方法和用途的制作方法
- Mgb探针多重荧光定量pcr检测大肠杆菌o157的方法
- 食品中三种致病菌的多重荧光定量pcr同时快速检测方法
- 单色多重定量pcr的制作方法
- 人冠状病毒oc43、229e、nl63、hku1和sars一管多重荧光pcr检测方法及其引物、探针和试剂盒的制作方法
- 一种病原体核酸及耐药性基因检测试剂盒及其应用的制作方法
- 鸭甲型肝炎病毒检测与基因a型和c型鉴别的多重荧光定量pcr方法及试剂盒的制作方法
- 一种耐万古霉素肠球菌的多重荧光定量pcr检测试剂盒及其检测方法
- 一种胃液中幽门螺杆菌多重实时荧光定量pcr检测试剂盒及检测方法