一种取代类苯甲酸化合物的无金属催化氧化合成新方法与流程
本发明涉及一种化合物的合成方法,具体涉及一种取代类苯甲酸化合物的无金属催化氧化合成新方法,属于化学技术领域。
背景技术:
取代类苯甲酸是一种可重点开发的有机合成中间体,可用于有机化工原料和多种农药的生产,也是染料、农药和医药的合成中间体。是防腐剂及香料的原料,还可用于可以用于液晶材料,具有价值高、市场前景好的优点。
苯甲酸类化合物传统的合成方法需要通过高锰酸钾或重铬酸盐的氧化多步合成得到。该工艺体系中重铬酸盐毒性巨大,对环境污染严重,收率偏低。目前国内外报道通常采用以下几种合成方法:
1)醇类化合物在碱性条件下通过过渡金属催化剂氧化为羧酸盐:
该合成方法对反应条件和底物的化学结构都具有极高的敏感度,需要底物在碱性条件下才能反应。而且过渡金属催化剂制备困难,成本很高。反应后处理也比较麻烦,产率也并不高。
(2)有机锌试剂在dmf中加入氯化锂和co2(1atm)氧化成羧酸:
该合成方法中原料有机锌试剂制备比较困难,且在反应中含有两种金属离子,反应时间也较长,后处理比较繁琐。
(3)磺酰基酮类化合物通过硝酸铈铵氧化为羧酸类化合物:
该合成方法使用了硝酸铈铵作为氧化剂,铈属于稀土元素,反应过程成中需使用1当量的氧化剂,成本很高,后处理的溶液对水体有害,污染较大,而且磺酰基酮类化合物的制备也比较繁琐,不适合工业生产。
(4)硝基苄基类化合物利用醋酸锌催化氧化为羧酸:
该合成方法相比之前条件比较温和,但仍然使用了过渡金属作为催化剂,还需要加入四丁基碘化铵作为相转移催化剂,在80℃下反应24h。而且反应原料硝基类化合物具有较大的毒性,前期制备过程比较复杂,成本较高。
(5)苯乙炔类化合物利用三氮唑类衍生物作为配体和溴化镍催化氧化:
该合成方法条件复杂。反应不仅用到过渡金属,而且三氮唑类化合物的配体合成成本也很高,需使用碳酸铯。反应需要入o2(1atm),在120℃下反应两天。虽然产率较高,但在很大程度上增加了反应操作的难度,同时仍然不能解决重金属的使用问题,限制了此方法在工业上大规模生产的需求。
可见,目前合成苯甲酸类化合物时,操作相对复杂,反应条件苛刻,步骤繁琐,并且通常会使用重金属过渡金属作为催化剂,后处理困难,对环境有危害。
技术实现要素:
为解决现有技术的不足,本发明的目的在于提供一种对环境友好、操作更简单的无金属催化氧化合成取代类苯甲酸类化合物的绿色合成方法。
为了实现上述目标,本发明采用如下的技术方案:
苯甲酸类化合物的合成方法,其特征在于,以wittig试剂和双氧水为原料,在有机溶剂中反应,反应温度为室温或者50℃加热,反应式如下:
式中,ar为芳香环类取代基,x为不饱和酯类取代基或芳香环类取代基
前述的合成方法(patha),其特征在于,前述ar芳香环类取代基为2,4-dif-c6h4、3,4-dif-c6h4、2-napth,不需要加入x类取代基wittig试剂,wittig试剂和双氧水的投料比为1mol∶6mol~9mol。
前述的合成方法(pathb),其特征在于,x类取代基wittig试剂x取代基为ch-ch=chcoome、3,4-dif-c6h4、4-br-c6h4。前述ar芳香环类取代基为4-meo-c6h4、4-cl-c6h4、4-br-c6h4、4-c6h5-c6h4,需要加入x类取代基wittig试剂。前述两种wittig试剂的投料比为1mol∶1mol。前述两种wittig试剂和双氧水的投料比为1mol∶1.5~1.8mol。此类苯甲酸类化合物的合成与ar和x类取代基的性质有关。x类取代基wittig试剂在反应后可通过重结晶回收再利用。
前述的合成方法,其特征在于,前述有机溶剂为四氢呋喃、dmso、甲醇或dmf。
前述的合成方法,其特征在于,反应温度为室温或者50℃加热。
本发明的有益之处在于:
(1)操作简单,底物适用范围广,产率较高,对环境友好;
(2)wittig试剂制备简便,原料便宜,未参与反应的wittig试剂还可以通过重结晶回收再利用;
(3)wittig试剂与双氧水的反应条件温和,后处理简便,绿色环保,适合工业放大。
(4)副产物三苯基氧膦也可回收,是重要的化工原料,可作用在有机合成中间体,医药中间体,催化剂和萃取剂。
附图说明
图1是产物4a的1hnmr图;
图2是产物4a的13cnmr图;
图3是产物4b的1hnmr图;
图4是产物4b的13cnmr图;
图5是产物4c的1hnmr图;
图6是产物4c的13cnmr图;
图7是产物4d的1hnmr图;
图8是产物4d的13cnmr图;
图8是产物4d的13cnmr图;
图9是产物4e的1hnmr图;
图10是产物4e的13cnmr图;
图11是产物4f的13cnmr图;
图12是产物4f的13cnmr图;
图13是产物4g的13cnmr图;
图14是产物4g的13cnmr图;
具体实施方式
以下结合附图和具体实施例对本发明作具体的介绍。
本发明的取代类苯甲酸化合物的合成方法为:
以wittig试剂和双氧水为原料,二者投料比为1mol∶1.5mol~9mol,在有机溶剂中反应,反应温度为室温或者50℃加热。
反应式如下:
式中,ar为芳香环类取代基,x不饱和酯类取代基或芳香环类取代基
实施例1:2,4-二氟苯甲酸的合成(4a)
在干燥的100ml圆底烧瓶中加入wittig试剂2,4-二氟苯基甲酰基亚甲基三苯基膦1.1572g(2.78mmol),加入thf30ml,2ml(18mmol)30%双氧水,50℃下氮气保护反应。18h后,原料wittig试剂几乎反应完全。反应结束后,旋蒸除去大部分溶剂,加入二氯甲烷和水各10ml,分液萃取。有机相加入无水硫酸钠干燥,浓缩。粗产物经分离得白色固体,404mg,产率为92%。
产物4a的1hnmr如图1所示。1hnmr(400mhz,dmso)δ13.29(1h,s),7.98-7.92(1h,m),7.36-7.30(1h,m),7.17(td,j1=2.4hz,j2=8.4hz)。
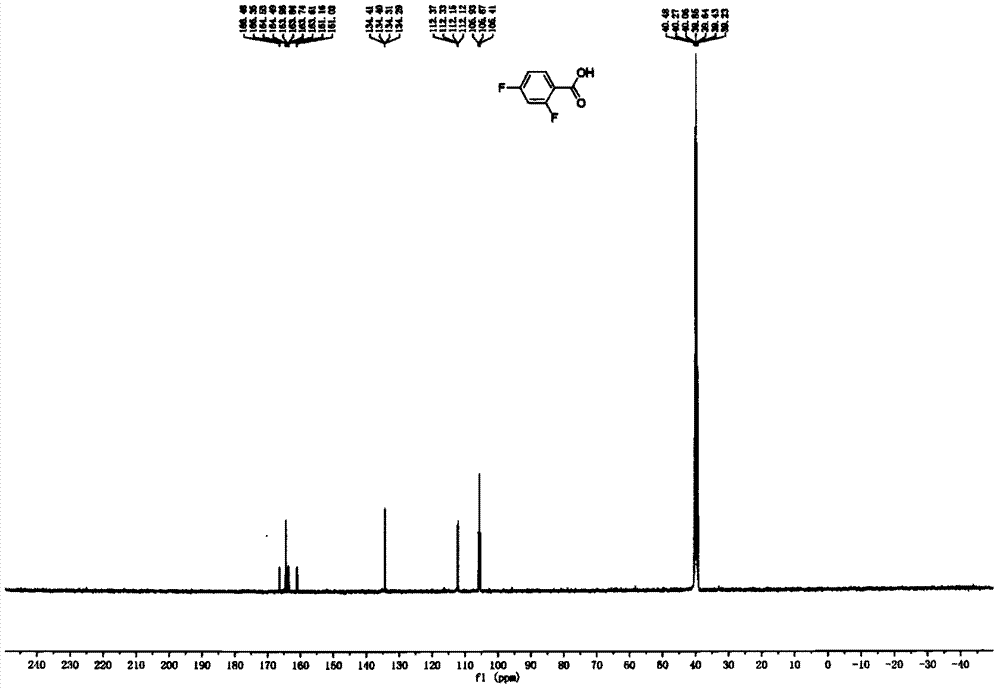
产物4a的13cnmr如图2所示。所示13cnmr(101mhz,dmso)δ166.42(d,j=13hz),164.51(d,j=4hz),163.79(q,j=35hz),161.10(d,j=13hz),134.41,134.31,134.29(dd,j1=2hz,j2=10hz),112.37,112.33,112.15,112.12(dd,j1=4hz,j2=22hz),105.67(t,j=26hz)。
实施例2:3,4-二氟苯甲酸的合成(4b)
在干燥的100ml圆底烧瓶中加入wittig试剂3,4-二氟苯基甲酰基亚甲基三苯基膦416mg(1mmol),加入thf30ml,1ml(9mmol)30%过氧化氢溶液,50℃氮气保护下反应。12h后,原料wittig试剂几乎反应完全。反应结束后,旋蒸除去大部分溶剂,加入二氯甲烷和水各10ml,分液萃取。有机相加入无水硫酸钠干燥,浓缩。粗产物经分离得淡黄色固体,134mg,产物为85%。
产物4b的1hnmr如图3所示。1hnmr(400mhz,dmso)δ7.88-7.82(1h,m),7.80-7.75(1h,m),7.56-7.49(1h,m)。
产物4b的13cnmr如图4所示。13cnmr(101mhz,dmso)δ165.99,154.26(d,j=12hz),151.75(d,j=12hz),151.00(d,j=13hz),148.54(d,j=13hz),128.97(t,j=3hz),127.43(q,j=11hz),118.97(d,j=19hz),118.41(d,j=18hz)。
实施例3:对甲氧基苯甲酸的合成(4c)
在干燥的100ml圆底烧瓶中加入wittig试剂对甲氧基苯基甲酰基亚甲基三苯基膦1.2916g(3.28mmol)和wittig试剂ph3p=ch-ch=chcoome1.465g(3.18mmol),加入thf30ml,后加入1ml(9mmol)30%h2o2,氮气保护下50℃搅拌反应。24h后,原料wittig试剂几乎反应完全。浓缩除去大部分溶剂,加入二氯甲烷10ml和水10ml,萃取,再用二氯甲烷萃取10ml*3,合并有机相,无水硫酸钠干燥。粗产物经分离得白色固体,364mg,产率为73%。
产物4c的1hnmr如图5所示。1hnmr(400mhz,dmso):δ12.65(1h,s),7.91(2h,dd,j1=2hz,j2=7.2hz),7.03(2h,dd,j1=2hz,j2=7.2hz),3.83(3h,s)。
产物4c的13cnmr如图6所示。13cnmr(400mhz,dmso):δ166.14,161.96,130.47,122.07,112.93,54.56。
实施例4:对氯苯甲酸的合成(4d)
在干燥的100ml圆底烧瓶中加入wittig试剂3,4-二氟苯基甲酰基亚甲基三苯基膦1.0184g(2.5mmol)和wittig试剂对氯苯基甲酰基亚甲基三苯基膦1.0365g(2.5mmol),再加入四氢呋喃30ml。向溶液中加入h2o2(30%水溶液)1ml(9mmol)。在氮气保护下,室温下搅拌反应,tlc跟踪反应,24h后停止。反应结束后,旋蒸除去大部分溶剂,加入二氯甲烷和水各10ml,分液萃取。有机相加入无水硫酸钠干燥,浓缩。粗产物经分离得黄色固体,363mg,产率为93%。
产物4d的1hnmr如图7所示。1hnmr(400mhz,dmso):δ13.16(1h,s),7.90(2h,d,j=4.4hz),7.53(2h,d,j=8.4hz)。
产物4d的13cnmr如图8所示。13cnmr(101mhz,dmso):δ166.99,138.32,131.63,130.13,129.21。
实施例5:对溴苯甲酸的合成(4e)
在干燥的100ml圆底烧瓶中加入wittig试剂3,4-二氟苯基甲酰基亚甲基三苯基膦1.2084g(2.9mmol)和wittig试剂对溴苯基甲酰基亚甲基三苯基膦1.2801g(2.8mmol),再加入四氢呋喃30ml。向溶液中加入h2o2(30%水溶液)1ml(9mmol)。在氮气保护下,50℃搅拌反应,tlc跟踪反应,12h后停止。反应结束后,旋蒸除去大部分溶剂,加入二氯甲烷和水各10ml,分液萃取。有机相加入无水硫酸钠干燥,浓缩。粗产物经分离得黄色固体,485mg,产率为86%。
产物4e的1hnmr如图9所示。1hnmr(400mhz,dmso):δ13.14(1h,s),7.83-7.80(2h,m),7.68-66(2h,m)。
产物4e的13cnmr如图10所示。13cnmr(101mhz,dmso):δ167.13,132.24,131.82,130.52,127.41。
实施例6:4-联苯甲酸的合成(4f)
在干燥的100ml圆底烧瓶中加入wittig试剂联苯基甲酰基亚甲基三苯基膦1.2478g(2.7mmol)和wittig试剂对溴苯基甲酰基亚甲基三苯基膦1.3335g(2.9mmol),再加入四氢呋喃30ml。向溶液中加入h2o2(30%水溶液)1ml(9mmol)。在氮气保护下,50℃搅拌反应,tlc跟踪反应,24h后停止。反应结束后,旋蒸除去大部分溶剂,加入二氯甲烷和水各10ml,分液萃取。有机相加入无水硫酸钠干燥,浓缩。粗产物经分离得白色固体,493mg,产率为94%。
产物4f的1hnmr如图11所示。1hnmr(400mhz,dmso):δ12.98(1h,s),7.99(2h,dd,j1=1.6hz,j2=8.4hz),7.76(2h,dd,j1=1.6hz,j2=8.4hz),7.70(2h,t,j=8.8hz),7.46(2h,t,j=14.8hz),7.38(1h,m).
产物4f的13cnmr如图12所示。13cnmr(101mhz):δ167.66,144.84,139.55,130.48,130.14,129.61,128.82,127.49,127.34。
实施例7:2-萘甲酸的合成(4g)
在干燥的100ml圆底烧瓶中加入wittig试剂萘基甲酰基亚甲基三苯基膦430mg(1mmol),再加入四氢呋喃30ml。向溶液中加入和h2o2(30%水溶液)1ml(9mmol)。在氮气保护下,50℃搅拌反应,tlc跟踪反应,12h后停止。反应结束后,旋蒸除去大部分溶剂,加入二氯甲烷和水各10ml,分液萃取。有机相加入无水硫酸钠干燥,浓缩。粗产物经分离得淡橙色固体,155mg,产率为90%。
产物4g的1hnmr如图13所示。1hnmr(400mhz,dmso)δ13.07(1h,s),8.62(1h,s),8.13(1h,d,j=8hz),8.03-7.98(3h,m),7.67(1h,td,j1=1.5hz,j2=5.6hz),7.61(1h,td,j1=1.5hz,j2=6.8hz)。
产物4g的13cnmr如图14所示。13cnmr(101mhz,dmso)δ167.90,135.40,132.62,130.98,129.75,128.80,128.63,128.53,128.12,127.28,125.62。
由此可见,本发明的合成方法操作简单,底物适用范围广,对环境友好,无需金属或者其他特殊催化氧化,后处理简便,此外,对合成苯甲酸类化合物具有普适性。
需要说明的是,上述实施例不以任何形式限制本发明,凡采用等同替换或等效变换的方式所获得的技术方案,均落在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!