一种受光或生长素诱导的启动子HLP3的制作方法
本发明属于植物生物工程育种和分子生物学技术领域,涉及一种植物的启动子,具体说,涉及拟南芥的一个受光或生长素诱导的启动子hlp3及其应用。
背景技术:
植物的生长发育过程离不开光的影响,光不但能提供能量,也作为一种外源信号提供了季节变化和位置信息。植物感受光信号,并将信号传递到下游,影响植物的光形态建成。植物光形态建成与外界环境相协调(温度、庇荫、生物及非生物胁迫),与自身生物钟相协调,使植物在改变的内外环境中更好地生存。而生长素作为植物体内一种至关重要的内源激素信号,其代谢和分布都直接关乎到植物的生长发育。在植物生长过程中,外界的光信号往往与内源的生长素信号协同作用于植物,例如植物的向光性生长就是光和生长素共同作用的结果。目前已有的研究了解到,光信号会影响植物生长素的合成与分布,生长素含量高低将直接关系到作物生长于发育。生长素能够整合各种环境信号,控制下游相关基因响应,影响作物器官大小,结实率等性状。可见,光和生长素是控制植物生长发育的两大关键要素。
既然光对植物的生长如此重要,那么光无论作为能源还是作为信号,在农业生产上都将对作物的产量构成影响。同样,生长素或者具有生长素活性的生长调节剂在目前也被广泛应用于农业生产中,用来调节瓜果蔬菜的生长与发育。从另一方面讲,如果能够通过作物改良,改变作物对光和生长素的感应,就有可能培育出更加高产稳产的新品种。随着分子生物学的迅速发展,转基因技术已为作物新品种的培育提供了新思路和新方法,具有方便快捷、目标定向、周期短等种种优势。目前在国内外商业化种植的转基因抗虫棉、抗虫玉米、抗除草剂大豆、抗病番木瓜等就是新一代育种技术的成功案例。这种技术依赖于发掘并克隆植物重要的抗逆功能基因和调控元件,进而进行作物的分子设计与遗传改良,以提高作物对不良环境的适应性,已经成为保证粮食安全的有效措施。
如果通过转基因技术改变作物对光和生长素的感应能力,光信号或生长素信号诱导型的启动子的发现和利用将变得尤为重要。然而,在目前作物遗传改良中能够被广泛使用的启动子非常有限,在单子叶植物主要使用来自玉米泛素(ubiquitin)基因的启动子和水稻肌动蛋白(actin)基因启动子,在双子叶植物主要使用来自花椰菜花叶病毒(camv)的35s启动子(yeetal.2012)。这些启动子都属于组成型启动子,也就是说在这些启动子的调控下,目标基因每时每刻都在表达。这种类型的启动子不会对光和生长素做出响应,也就无法保证作物对光和生长素做出适当的反应。因此,针对光和生长素的作物遗传改良来讲,光信号或生长素信号诱导型启动子的发现、克隆、功能分析和利用已成为当前一个重要的创新研究方向。将功能明确的光信号或生长素信号诱导型启动子成功应用到转基因作物育种中将是未来遗传育种的重要方向。
申请人在相关研究中从拟南芥克隆到一种光或者生长素诱导的启动子,命名为启动子hlp3。该启动子功能揭示它在粮食作物、瓜果蔬菜等遗传育种上的应用将具有重要价值。迄今为止,未见该启动子克隆和应用的相关报道。
技术实现要素:
针对目前的技术现状,本发明的目的是提供一种来源于拟南芥基因组的受光或生长素诱导的启动子及其应用。
本发明所述的拟南芥的一种受光或生长素诱导的启动子,命名为启动子hlp3;其特征在于:该启动子的核苷酸序列是下列核苷酸序列之一:
(1)序列表中seqidno:1所示的dna序列。
(2)与序列表中seqidno:1所示的dna序列具有90%以上同源性,且具有相同功能的dna序列。
(3)对上述(1)或(2)所示dna序列进行一个或多个碱基的取代、缺失和/或添加且具有相同启动子功能的dna。
进一步优选的实施方式是:所述启动子命名为启动子hlp3,其核苷酸序列是序列表中seqidno:1所示的dna序列。
上述启动子hlp3可以利用seqidno.2和seqidno.3所示的引物序列,通过pcr技术从拟南芥基因组dna中克隆获得。
鉴于本领域专业人员很容易通过定向优化或者点突变等方法对本发明专利中所述的启动子序列进行修饰或突变,那些经过人工修饰改造后具有与本发明所提供的启动子碱基序列同源性≧60%且仍具有启动子活性的核苷酸序列均为本发明中所述启动子序列衍生物,等同于本发明所述序列,属于本专利的保护范畴。
含有上述启动子的载体、转基因组织或细胞系、重组菌株和转基因植株等均属于本发明的保护范围。
本发明所述拟南芥的一个受光或生长素诱导的启动子在植物基因研究或基因工程育种中的应用。
其中,所述应用的方法是:所述启动子hlp3为光或生长素诱导型启动子,将其作为启动子分别与功能基因融合构建植物表达载体,并转入植物中,以实现在转基因植物体内的诱导型高表达。
其中,所述植物优选是农作物、经济林木、牧草或草坪草;所述植物体是指在植株器官、组织、细胞或整株水平。
进一步的,所述农作物优选是棉花、大豆、烟草、油菜、白菜、甘蓝、芥菜、玉米、小麦或水稻。
本发明利用seqidno.2和seqidno.3所示的引物序列,通过pcr技术从拟南芥基因组dna中克隆启动子hlp3,然后利用该启动子构建报告基因gus的植物表达载体,进行植物转基因操作,获得转基因植物。试验检测表明:本发明的启动子hlp3能够明显增强报告基因在不同光照强度或生长素处理条件下的表达水平(见附图)。
本发明的突出效果是:在当前作物育种中缺少理想的诱导型启动子的背景下,本发明为植物基因功能研究和基因工程育种提供了植物来源的诱导型强启动子,并可以将其广泛用于培育作物新品种,实现了明显增强功能基因在不同光照或生长素处理条件下的表达水平的目的,在农作物基因工程育种中具有重要的应用价值和很好的开发前景。
附图说明
图1.hlp3启动子pcr扩增产物的电泳图,其中:m为分子量marker,泳道1-4为启动子dna。
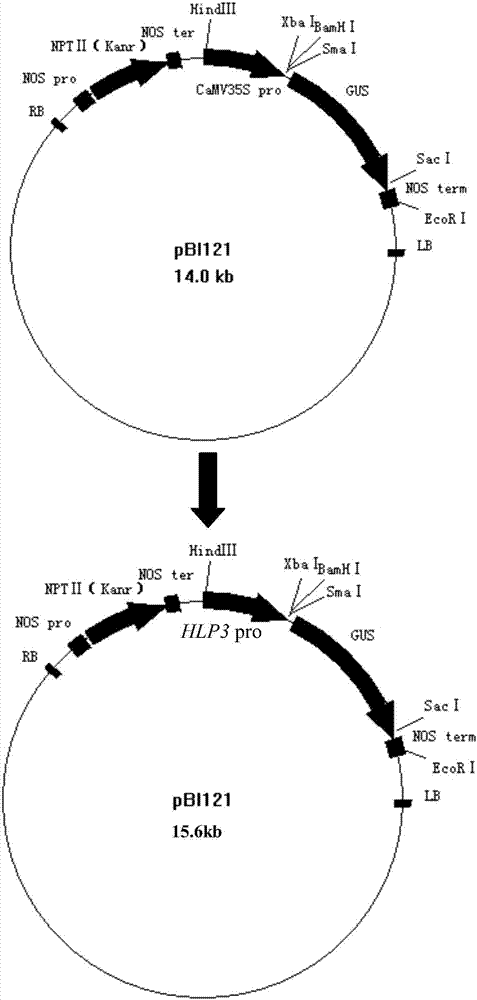
图2.hlp3启动子与gus报告基因连接示意图。用hlp3启动子替换pbi121载体中的camv35s启动子,即得到hlp3启动子连接gus报告基因的植物表达载体。
图3.hlp3-gus转基因拟南芥的下胚轴在照光后gus染色明显加深,表明hlp3是一个受光照强烈诱导的启动子。
图4.hlp3-gus转基因拟南芥在黑暗、光照不同时间后叶片中gus基因表达的水平变化。再次表明hlp3是一个受光照强烈诱导的启动子。
图5.hlp3-gus转基因拟南芥在生长素iaa或者iba处理前后,叶片中gus酶活的染色对比图。证明hlp3是一个生长素强烈诱导的启动子。
具体实施方式
下述将通过具体实施例子对本发明作进一步的说明,但本发明并不仅限于以下具体实施例子。下面实施例子中所描述的方法内容若无特殊说明,均为常规实验方法。
实施例1拟南芥hlp3启动子的获得
为了得到诱导型启动子,本发明人从拟南芥基因组克隆了100多个基因的启动子,逐一对这些启动子活性进行大规模筛选。发现hlp3启动子具有很强的受光或生长素诱导的活性。下面叙述它的具体克隆过程。
1)首先根据拟南芥tair数据库,选定hlp3基因的翻译起始密码子atg上游约1.6kb的调控序列作为hlp3启动子序列。
2)依据上述序列,利用primer5.0软件设计pcr扩增引物如下。
hlp3-f:5'aagcttaggattagttttgctatcggtta3';
hlp3-r:5'ggatcctttcttcttcttatctttttcttttc3'。
上游引物5'末端添加hindiii酶切位点,下游引物5'末端添加bamhi酶切位点,便于后续的启动子克隆。
3)采用ctab法提取拟南芥基因组dna,具体参见《分子克隆实验指南ⅲ》,以提取的dna为模板进行pcr扩增,反应体系如下所示:
pcr反应体系:10mmtris·cl,1.5mmmgcl2,50mmkcl,200μmdntpeach,0.8μm引物,0.8u高保真dnapolymerase,1μldna模板,无菌水补足25μl。
pcr反应程序:95℃预变性5min;95℃变性40s,55℃退火40s,72℃延伸1min30s,循环35次;72℃延伸5min。扩增产物进行琼脂糖凝胶电泳。
4)电泳结束后,利用天根公司生产的dna片段回收试剂盒(tiangenbiotechco,ltd)回收目的条带,凝胶回收具体步骤参见其说明书。回收的目的条带通过t-a连接直接连入中间载体pmd-t18。连接产物转化大肠杆菌感受态细胞dh5α。向转化的大肠杆菌管中加入约1mllb培养基37℃200rpm振荡培养1小时,4000rpm离心5min收菌,涂布在含有100μg/ml氨苄青霉素lb固体平板上过夜培养,挑单克隆在含有50mg/l氨苄青霉素的液体lb培养基中振荡培养6-8小时后提取质粒dna,经pcr鉴定插入片段的大小,然后送华大科技股份有限公司进行测序确认,以确保启动子的正确性。
实施例2拟南芥hlp3启动子的植物表达载体构建和农杆菌转化
目的是获得hlp3启动子驱动葡萄糖苷酸酶报告基因(gus)表达的载体,同时获得含有该载体的农杆菌,为后续的转化拟南芥做准备。
1)将hlp3启动子从pmd-t18中间载体上用hindiii和bamhi两种限制性内切酶切出,pbi121植物表达载体也用同样的两种酶切开(内切酶购自takara公司,具体酶切的条件和程序参见其说明书)。酶切产物经琼脂糖凝胶电泳后使用天根公司的凝胶回收试剂盒回收(参考说明书)。
2)将获得的酶切后的启动子片段与载体进行连接(使用thermo公司的t4dna连接酶,连接体系参照公司说明书)。连接反应体系轻轻混匀,置于22℃恒温水浴锅连接0.5h,随后将连接产物直接用于转化大肠杆菌。
3)大肠杆菌的转化。融化固体lb培养基,待冷却到50℃左右时加入kan抗生素至50mg/l,混匀后倒平板;-80℃冰箱中取出约50μl感受态大肠杆菌置于冰上,加入连接产物后轻轻混匀;冰浴30分钟,同时42℃热激90s,随后迅速冰浴2min;向管中加入800μl液体lb培养基(不含抗生素)混匀后放入摇床,37℃,200rpm,1h复苏;复苏结束后,5000rpm,离心3min,将上清吸至剩余约100μl左右,轻轻将菌悬浮;将其涂布于上述准备好的平板上,倒置平板,放入培养箱中37℃过夜培养;挑单克隆摇菌,提取质粒进行酶切鉴定和测序,确认大肠杆菌中含有构建正确的hlp3-gus表达载体。
4)农杆菌的转化。农杆菌gv3101具有侵染植物和转移基因的能力,故需要将构建的hlp3-gus表达载体转入农杆菌。取80μl农杆菌液接种到含50μg/ml利福平(rif)的lb培养基中,28℃培养一夜;取1ml菌液,加至50ml含50μg/mlrif的lb培养基中,28℃震荡培养,至od600=0.5;菌液冰浴30min,4℃,4500rpm,离心10min,收集菌体;将菌液重新悬于预冷的10ml0.15mol/l的cacl2中,4℃,4500rpm,离心10min,收集菌体;将菌液重新悬于冰浴的1ml20mmol/l的cacl2溶液中,用1.5ml的ep管进行分装,液氮速冻1min,储存于-70℃作为农杆菌感受态备用;从上述大肠杆菌中提取hlp3-gus表达载体,取100μl农杆菌感受态细胞在冰上化开,把表达载体10μl加入其中,轻轻混合均匀,冰上放置30分钟;液氮速冻1min,迅速移至37℃水浴5min,立即冰浴2-3min;加入lb培养基(未添加抗生素)1ml,28℃培养3h;7000rpm,离心1min,收集菌体,涂于含50μg/ml利福平、50μg/mlkan的lb平板上,28℃倒置暗培养3天。挑取农杆菌单菌落,用添加了50μg/mlkan的lb培养基扩增培养,从农杆菌中提取质粒,进行后续pcr验证,以确定hlp3-gus表达载体转入了农杆菌gv3101。
实施例3hlp3启动子转化拟南芥验证其受光或生长素强烈诱导
目的是将hlp3启动子-gus表达载体转入拟南芥,获得转基因植物,用于验证hlp3启动子是否能够被光或者生长素诱导。
1)利用浸花法(一种公开的通用方法),使含有植物表达载体的农杆菌gv3101浸染拟南芥花蕾。待其长出的角果成熟之后,收集t1代种子并在筛选培养基(ms培养基附加30mg/l卡那霉素)上进行筛选,将能够正常生长的绿色转化苗移栽至营养土中培养,分别收获其t2代种子再进行下一轮的卡那霉素筛选,挑选出绿苗:白苗为3:1的培养皿。将此培养皿上的绿苗移栽,单株收获种子(t3代)。对每一单株的种子部分用于卡那霉素平皿筛选,直到选出在筛选培养基上为全绿的株系,即为纯合转基因株系。
2)为了分析hlp3启动子对光信号或生长素的响应情况,对hlp3-gus转基因拟南芥进行了相应处理。具体做法如下:
光照处理:在黑暗中生长4days的hlp3-gus转基因幼苗,暴露在光下0h、12h和24h;分别取材进行gus染色或者进行qrt-pcr分析gus基因的表达水平。
iaa处理:将在ms固体培养基中培养两周的hlp3-gus转基因幼苗,用镊子小心夹取部分幼苗,移植到外源添加10μmiaa(或iba)的ms液体培养基中,对照组仅用ms液体培养基在常温下处理。在处理3h、6h、12h、24h后,分别取材进行gus染色。
3)gus染色的具体做法是:将植物材料放入离心管中,倒入冰预冷的90%丙酮没过植物材料,插到冰上放置30min。用现配的gus染色缓冲液(公知的配方)清洗材料,置于冰上20分钟,倒掉缓冲液再加入新的缓冲液重复洗一次,再倒掉染色缓冲液。倒入配好的染色液(染色缓冲液中加入终浓度为2mm的x-gluc),保证植物材料完全没入其中。根据染色情况在37℃温箱中染色6-12h。75%乙醇清洗材料,去除染色液,倒入无水乙醇浸泡材料直至完全脱色。实体解剖显微镜下观察并拍照。
上述gus表达和gus染色结果表明,hlp3启动子是一个受光或生长素强烈诱导的启动子(附图3,附图4,附图5)。该启动子的发现将会在在光和生长素调控生长的农作物遗传改良中显示出巨大的应用潜力。
序列表
<110>山东大学
<120>一种受光或生长素诱导的启动子hlp3
<141>2017-7-3
<160>3
<210>1
<211>1570
<212>dna
<213>拟南芥
<221>启动子hlp3的核苷酸序列
<222>(1)…(1570)
<400>1
aggattagttttgctatcggttataggattcctggtaaaaaaatgtcttattattttcta60
agcaatattaaagatgaggtaatgagtaaaaattattatttttctccagattctagatta120
gatgagccagtgacagagcttccacctttgaaagtgaaggatcttccggtaatggaaacg180
aatgagccggaggaactttaccgggtagttaacgacatggtggaaggagccaagtcttct240
tcaggagtcatatggaacacatttgaagatcttgaaagactatcacttatgaattgtagc300
agcaaattacaagttccatttttcccgatcggaccgtttcacaaatatagcgaagatcct360
acaccgaagacagagaacaaggaagataccgattggctcgacaagcaagacccacagtcg420
gtggtctatgcgagtttcggaagccttgcagctatagaagagaaggagtttctcgagatt480
gcttggggtctaagaaacagtgaacgaccgtttttgtgggtggttaggccggggtctgtc540
agggggaccgagtggctcgagtcattgcctttagggtttatggaaaacattggagataag600
ggaaaaatcgtgaaatgggcgaatcagttagaggtattggcgcatcctgccattggagcg660
ttttggacacattgtggatggaactcgacactagagagcatatgtgaaggtgttcctatg720
atatgtacgtcatgtttcacggaccagcatgtgaacgcgagatacatcgttgatgtatgg780
cgagtcgggatgttgttagagagaagtaagatggaaaagaaggagattgaaaaggtgcta840
agaagtgtaatgatggagaagggagatggattgagggaaaggagtttgaagttgaaagag900
agagctgatttttgcttaagtaaagatgggtcttcttccaagtatttagacaaacttgtg960
agtcatgtcctgtcttttgattcttatgcttttgcaagttaagaaaacttatgaatgagt1020
aacgtattctaagcactctccaaaagttccaaaaccattggatgttttgtttcttcaaat1080
aataatgttcttgagttaattgttttttttcagattaaagtcaaaatttattgaatttta1140
ttttacgaatttaccgtttcatattatttctaatatttacttaggatccaataaattttg1200
accataataggttgataatattatgttgaatctgaatataccaaataacatttatttatt1260
tttccctaatgttttaaagtaatgtgtggaacaaacgtgtgtaccaagcggcgacgaaag1320
ttgaatgtgtgatgggtacaacttaaatggcccatgatcctatcataggattcctatgta1380
aagtcgacagctttcctagctgcatgtgagaagaaaaataagattttagctaggatttgt1440
gacgatgctcgcggacagacagtgacttgagagagcctttgtttggccgaaagtgttcaa1500
caacaaatccaatatatccttgaagtctagatcccacataattagaaaagaaaaagataa1560
gaagaagaaa1570
<210>2
<211>29
<212>dna
<213>人工序列
<221>hlp3-f
<222>(1)…(29)
<400>2
aagcttaggattagttttgctatcggtta29
<210>3
<211>32
<212>dna
<213>人工序列
<221>hlp3-r
<222>(1)…(32)
<400>3
ggatcctttcttcttcttatctttttcttttc32
- 还没有人留言评论。精彩留言会获得点赞!
- 大豆低温诱导型启动子、包含该启动子的重组表达载体及应用的制作方法与工艺
- 受植物激素调控的启动子及其应用的制作方法与工艺
- 一种受盐诱导的特异性诱导型启动子DNA序列及应用的制作方法与工艺
- 受维甲酸调控的具有浓度依赖效应的重组启动子及其使用的制作方法与工艺
- 一种磷酸盐诱导启动子降低黑曲霉β‑葡萄糖苷酶表达酶活的方法与流程
- 一种疫霉诱导性人工合成启动子PMP1及其重组表达载体和应用的制作方法与工艺
- 一种植物盐/干旱诱导型启动子soyEQ及其应用的制作方法与工艺
- 新型的L-苏氨酸-诱导型启动子及其应用的制作方法与工艺
- 一种植物茉莉酸甲酯诱导表达启动子PosMeJ1及其应用的制作方法与工艺
- 一个逆境诱导启动子SlWRKY31P的克隆及应用的制造方法与工艺