一种记忆性T细胞的制备方法与流程
本发明属于生命科学与医学的交叉技术领域,具体的涉及一种人记忆性t细胞的制备方法,属于细胞免疫学领域。
背景技术:
随着对人类免疫系统的认识和肿瘤发生机制的深入研究,肿瘤免疫治疗在过去的几十年中得到了飞速的发展。其中,过继性细胞免疫治疗(adoptivecellimmunotherapy,aci)、嵌合抗原受体修饰的t细胞(car-t)和免疫检查点阻断剂是国内外研究的热点。免疫治疗已经获得了癌症研究领域最具革命性的进展,这种治疗方法不仅能够改善患者的免疫状态、够延长患者的生存时间,同时也能够为未来的研究指明方向。aci主要是指体外大量扩增有功能的杀伤细胞并将其输注给患者达到直接或间接杀伤肿瘤的作用。目前,临床应用的免疫细胞主要类型是细胞因子诱导的杀伤细胞(cik)、肿瘤浸润性t细胞(til)以及自然杀伤细胞(nk)等。
过继性细胞免疫治疗已经成为癌症治疗的重要手段之一,在临床试验中取得了显著的治疗效果。然而过继性细胞免疫治疗在实体瘤治疗中仍未取得突破性进展。究其原因,一方面由于肿瘤微环境的存在影响t细胞的活化和代谢;另一方面,由于体外扩增培养的t细胞大多处于终末分化状态,难以在患者体内发挥持续、长久的抗肿瘤效应。如何获得分化状态低、抗肿瘤能力强的t细胞是目前过继性细胞免疫治疗领域研究的热点。
免疫细胞在体外培养过程中需要添加不同的细胞因子刺激其增殖和分化。了解不同细胞因子的生物学特性和对t细胞分化影响的机制,能够为细胞免疫治疗提供更多记忆性前体细胞,延长其在患者体内杀伤肿瘤细胞的时间。il-7是一种非造血细胞来源的细胞因子,主要在适应性免疫中发挥作用。il-7促进t细胞在胸腺中的发育以及维持tn细胞和记忆性t细胞的生存和自稳态平衡。il-7与其受体il-7r结合后激活免疫细胞的jak3和stat5,上调抗凋亡基因如bcl2的表达。il-21通过诱导早期分化的表型对tcm细胞的维持和发育起到重要作用。同时,il-21诱导tscm细胞的产生,已经应用于临床输注的免疫细胞培养体系中。多种细胞因子的组合应用为act治疗提供更多年轻化且有活性的t细胞。wnt信号通路也是调控t细胞分化的一个关键性通路。forgetma等报道了wnt–β-连环蛋白通路可由tws119激活,通过抑制糖原合成酶-3β(glycogensythasekinase-3β,gsk-3β)的磷酸化,抑制cd8+t细胞向效应t细胞分化,促进记忆性cd8+t的产生。
技术实现要素:
本发明主要提供了一种tws119联合细胞因子il-7和il-21高效制备记忆性t细胞的方法,可以获得大量具有记忆特性同时分化状态低的t细胞用于肿瘤的治疗。其技术方案如下:
一种记忆性t细胞的制备方法,该方法包括以下步骤:
(1)采集人外周血,采用密度梯度离心法获得人外周血单个核细胞;
(2)将步骤(1)得到的人外周血单个核细胞采用磁分选仪分选cd8+t细胞;
(3)将步骤(2)分选的cd8+t细胞加入含有刺激剂cd3/cd28偶联磁珠、细胞因子il-7、il-21和tws119的培养基中培养,扩增至7天时即可获得具有大量tcm和tscm表型的cd8+t细胞。
优选的步骤(1)中获得人外周血单个核细胞具体的方法步骤如下:
a、在无菌条件下采集人外周血,先在1500rpm条件下离心10min,得血清;
b、将步骤a所得的血清转移至无菌的离心管中,56℃灭活25min,再到4000rpm条件下离心20min,用缓冲液1稀释沉淀的血细胞,得血细胞稀释液;
c、将步骤b所得血细胞稀释液缓慢的加至淋巴分离液上,在2500rpm条件下,离心25min,最后吸取白膜层,并用缓冲液1清洗,收集沉淀;
d、将步骤c所得沉淀,在1500rpm条件下离心10min,弃去上清液后,沉淀采用缓冲液2清洗,1500rpm件下离心10min,弃去上清液,即获得人外周血单个核细胞。
优选的缓冲液1为磷酸缓冲盐溶液,缓冲液2为磁珠分选缓冲液。
优选的,缓冲液1稀释沉淀的血细胞时,采用1/2-1/4血细胞体积量的pbs缓冲液稀释,所述淋巴分离液的体积量为血细胞稀释液体积量的1/2-1/4。
优选的,步骤(2)中磁分选仪分选cd8+t细胞方法为:按照每1×107个单个核细胞避光加入20μl人cd8磁珠和70μl磁珠分选缓冲液,进行磁分选cd8+t细胞。
优选的,步骤(3)中刺激剂cd3/cd28beads与cd8+t细胞个数比例为1:3(1个偶联磁珠刺激3个t细胞),细胞因子il-7的浓度为10-30ng/ml,il-15的浓度为10-30ng/ml,tws119的浓度为1-10μm。
优选的,步骤(3)中所述培养基为takaragt-551培养基,培养条件为37℃、5%co2环境。
优选的,步骤(3)中所述培养基中还包括5%体积量的自体血清,培养基中t细胞密度为1×106/ml—3×106/ml。
本发明提供了一种人记忆性t细胞优选为cd8+t细胞,该细胞由上述方法获得。
本发明提供了记忆性t细胞在制备治疗肿瘤、感染或其他免疫相关疾病的药物中的应用。
采用上述方法制备人记忆性cd8+t细胞,其具有以下优点:
在体外实验中,细胞因子il-7和il-21能够维持t细胞生长,降低t细胞的凋亡。tws119能够激活wnt信号通路促进tscm细胞的产生,并且维持tscm细胞表型。从外周血中获得cd8+t细胞,加入cd3/cd28偶联磁珠活化,并采用il-7、il-21和tws119降低t细胞凋亡,获得大量具有记忆特性同时分化状态低的t细胞,从而获得抗肿瘤活性高、体内存活时间长的t细胞用于临床过继性细胞免疫治疗。
本方法可使记忆性t细胞在体外培养中获得大量扩增,可以有效推动细胞免疫治疗的进一步发展,解决目前临床培养技术瓶颈,延长过继免疫细胞在患者体内存活时间,增强其持久高效的抗肿瘤能力,为细胞免疫治疗进一步开展大规模临床治疗打下坚实基础。
附图说明
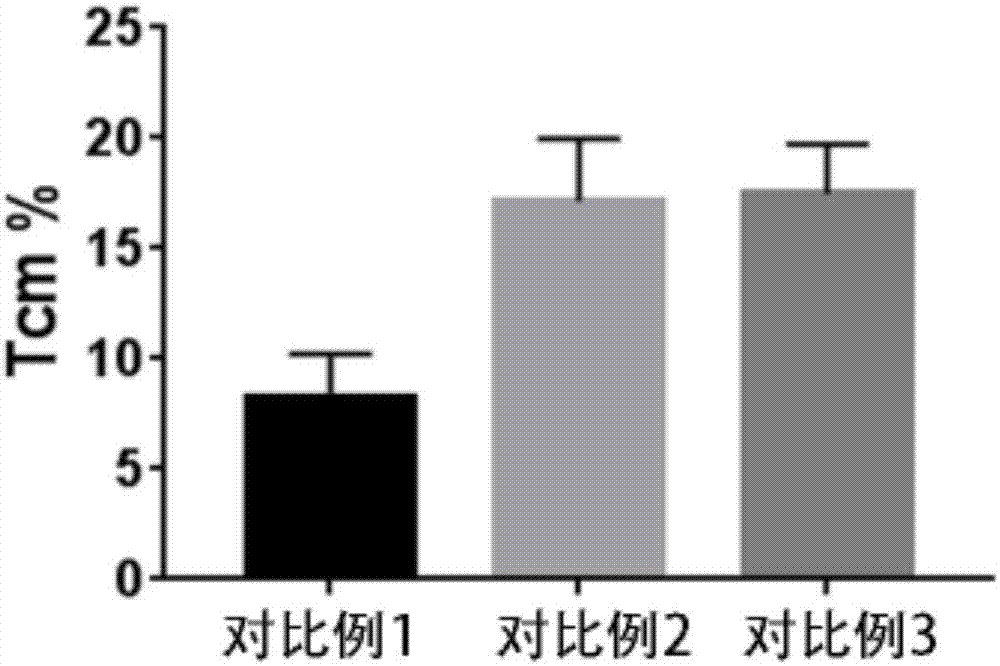
图1为对比例1、对比例2和对比例3制备的tcm细胞比例统计图;
图2为对比例与实施例1制备的tcm细胞比例统计图;
图3为对比例制备的tscm细胞比例的统计图;
图4为对比例与实施例1制备的tscm统计图;
图5为实施例1制备的t细胞与对比例制备的t细胞表面激活型表面标志物cd28的表达水平图;
图6为实施例1制备的t细胞与对比例制备的t细胞表面抗凋亡能力图。
具体实施方式
实施例1:t细胞的制备方法包括以下步骤
(1)无菌条件下采集外周血20ml采用密度梯度离心法获得人外周血单个核细胞pbmcs,具体步骤如下:a、在无菌条件下采集人外周血20ml,先1500rpm,10min离心,其升速和减速的加速度均为9m/s2,得血清;b、将步骤a所得的血清转移至无菌的50ml离心管中,56℃灭活25min,再4000rpm,20min离心血清,其升速和减速的加速度均为9m/s2,采用pbs缓冲液按照与血细胞体积1:3的比例稀释沉淀的血细胞,得血细胞稀释液;c、然后将步骤b所得血细胞稀释液缓慢的加至淋巴分离液上,所述淋巴分离液的体积量为血细胞稀释液体积量的1/3,在2500rpm条件下,离心25min,其升速和减速的加速度均为5m/s2,小心吸取白膜层,用pbs缓冲液清洗两遍,弃去上清后,收集沉淀;d、然后将步骤c所得沉淀,在1500rpm条件下离心10min,弃去上清液后,沉淀加入磁珠分选缓冲液洗一遍,1500rpm,10min离心,其升速和减速的加速度均为9m/s2,弃去上清液,即可获得外周血单个核细胞。
(2)将上述分离的pbmcs计数,按照每1×107个细胞避光加入20μl人cd8磁珠(20μlhumancd8microbeads)和70μl(automacsrunningbuffer)磁珠分选缓冲液,进行磁分选cd8+t细胞。
(3)将分选的cd8+t细胞置于含有刺激剂cd3/cd28偶联磁珠(其中cd3/cd28偶联磁珠与cd8+t细胞个数比例为1:3)、10ng/mlil-7、10ng/mlil-15和1μmtws119的gt551培养基中,同时加入5%自体血清,调整细胞密度为2×106/ml。在37℃,5%co2培养箱中培养。每隔2d观察细胞生长状态,半量换液并补加全量的细胞因子il-7和il-21。培养至第7d即可获得80%具有tcm和tscm表型的cd8+t细胞。
以上所用试剂中,所述淋巴细胞分离液选自天津市灏洋生物制品科技有限责任公司,gt-551培养基选自takara公司,il-7和il-15为德国美天旎公司生产,tws119购自selleck公司,cd3/cd28偶联磁珠为lifetechnology公司生产,人cd8磁珠购自德国美天旎公司。
实施例2:t细胞的制备方法包括以下步骤
(1)无菌条件下采集外周血20ml采用密度梯度离心法获得人外周血单个核细胞pbmcs,具体步骤如下:a、在无菌条件下采集人外周血20ml,先1500rpm,10min离心,其升速和减速的加速度均为9m/s2,得血清;b、将步骤a所得的血清转移至无菌的50ml离心管中,56℃灭活25min,再4000rpm,20min离心血清,其升速和减速的加速度均为9m/s2,采用pbs缓冲液按照与血细胞体积1:2的比例稀释沉淀的血细胞,得血细胞稀释液;c、然后将步骤b所得血细胞稀释液缓慢的加至淋巴分离液上,所述淋巴分离液的体积量为血细胞稀释液体积量的1/4,在2500rpm条件下,离心25min,其升速和减速的加速度均为5m/s2,小心吸取白膜层,用pbs缓冲液清洗两遍,弃去上清后,收集沉淀;d、然后将步骤c所得沉淀,在1500rpm条件下离心10min,弃去上清液后,沉淀加入磁珠分选缓冲液洗一遍,1500rpm,10min离心,其升速和减速的加速度均为9m/s2,弃去上清液,即可获得外周血单个核细胞。
(2)将上述分离的pbmcs计数,按照每1×107个细胞避光加入20μlhumancd8microbeads和70μlautomacsrunningbuffer,进行磁分选cd8+t细胞。
(3)将分选的cd8+t细胞亚群置于含有cd3/cd28偶联磁珠(其中1个磁珠刺激3个t细胞)、20ng/mlil-7、20ng/mlil-15和5μmtws119的gt551培养基中,同时加入5%自体血清,调整细胞密度为2×106/ml。在37℃,5%co2培养箱中培养,每隔2d观察细胞生长状态,半量换液并补加全量的细胞因子il-7和il-15。培养至第7d即可获得90%以上具有记忆表型的cd8+t细胞。
以上所用试剂中,所述淋巴细胞分离液选自天津市灏洋生物制品科技有限责任公司,gt-551培养基选自takara公司,il-7和il-15为德国美天旎公司生产,tws119购自selleck公司,cd3/cd28beads为lifetechnology公司生产,humancd8microbeads购自德国美天旎公司。
实施例3:t细胞的制备方法包括以下步骤
(1)无菌条件下采集外周血20ml采用密度梯度离心法获得人外周血单个核细胞pbmcs,具体步骤如下::a、在无菌条件下采集人外周血20ml,先1500rpm,10min离心,其升速和减速的加速度均为9m/s2,得血清;b、将步骤a所得的血清转移至无菌的50ml离心管中,56℃灭活25min,再4000rpm,20min离心血清,其升速和减速的加速度均为9m/s2,采用pbs缓冲液按照与血细胞体积1:4的比例稀释沉淀的血细胞,得血细胞稀释液;c、然后将步骤b所得血细胞稀释液缓慢的加至淋巴分离液上,所述淋巴分离液的体积量为血细胞稀释液体积量的1/2,在2500rpm条件下,离心25min,其升速和减速的加速度均为5m/s2,小心吸取白膜层,用pbs缓冲液清洗两遍,弃去上清后,收集沉淀;d、然后将步骤c所得沉淀,在1500rpm条件下离心10min,弃去上清液后,沉淀加入磁珠分选缓冲液洗一遍,1500rpm,10min离心,其升速和减速的加速度均为9m/s2,弃去上清液,即可获得外周血单个核细胞。
(2)将上述分离的pbmcs计数,按照每1×107个细胞避光加入20μlhumancd8microbeads和70μlautomacsrunningbuffer,进行磁分选cd8+t细胞。
(3)将分选的初始t细胞亚群置于含有刺激剂cd3/cd28偶联磁珠(其中1个磁珠刺激3个t细胞)、20ng/mlil-7、20ng/mlil-15和10μmtws119的gt551培养基中,同时加入5%自体血清、青霉素和链霉素,调整细胞密度为1×106/ml。在37℃,5%co2培养箱中培养。每隔两天观察细胞生长状态,半量换液并补加全量的细胞因子il-7和il-15。培养至第7d即可获得85%具有记忆表型的t细胞。
以上所用试剂中,所述淋巴细胞分离液选自天津市灏洋生物制品科技有限责任公司,gt-551培养基选自takara公司,il-7和il-15为德国美天旎公司生产,tws119购自selleck公司,cd3/cd28偶联磁珠为lifetechnology公司生产,人cd8磁珠购自德国美天旎公司。
对比例1
本实施例与实施例1的区别在于,不添加细胞因子il-7、il-15及小分子化合物tws119,其他培养条件一致。
对比例2
本实施例与实施例1的区别在于,不添加细胞因子il-7、il-15,其他培养条件一致。
对比例3
本实施例与实施例1的区别在于,不添加tws119,其他培养条件一致。
检测及结果
对记忆细胞的表型(tcm和tscm)、激活型标记物cd28以及il-7、il-15联合tws119对t细胞抗凋亡的增强进行检测,以实施例1中的试样为研究对象。具体操作步骤如下:
1.记忆性t细胞表型检测:收集培养至第7d细胞1×106个,重悬于200μl含1%fbs(胎牛血清)的pbs中,避光加入流式抗体:cd8-apc-cy7、cd45ra-apc、ccr7-percp和cd95-pe-cy7,4℃避光孵育15min,流式检测tcm和tscm的表型。采用diva软件分析培养获得的细胞表型结果显示tcm细胞比例达到40%,tscm比例达到65%,较外周血诱导培养获得的tcm细胞比例高30%以及tscm细胞比例高40%以上。
2.记忆性t细胞激活型标记物检测:收集培养至第7d细胞,,流式细胞术检测细胞的激活型表面标志物。收集1×106个细胞,重悬于200μl含1%fbs(胎牛血清)的pbs中,避光加入流式抗体:cd8-apc-cy7、cd28-apc,4℃避光孵育15min。采用diva软件分析培养获得的t细胞cd28的表达水平,结果显示t细胞cd28表达水平70%,较外周血诱导培养获得的t细胞cd28比例高40%以上。
3.流式检测检测实施例1制备的tcm和tscm细胞与对比例1、2和3制备的tcm和tscm细胞比例,结果如图1-4所示,其中图1为对比例1、对比例2和对比例3制备的tcm细胞比例统计图,图2为对比例与实施例1制备的tcm细胞比例统计图,图3为对比例制备的tscm细胞比例的统计图,图4为对比例与实施例1制备的tscm统计图。由结果可知,采用实施例1方法制备tcm和tscm细胞比例高,利于记忆性t细胞的诱导及活化。
4.流式检测实施例1制备的t细胞与对比例制备的t细胞表面激活型表面标志物cd28的表达水平。结果如图5所示,实施例制备t细胞cd28的表达水平均优于对比例1、2和3的cd28表达水平。结果表明了实施例1制备的t细胞更加有利于维持记忆性t细胞活性。
5.流式检测实施例1制备的t细胞与对比例制备的t细胞表面抗凋亡能力。结果如图6所示,实施例1制备t细胞中抗凋亡能力显著优于对比例1、2和3的t细胞抗凋亡能力。结果表明了实施例1制备的t细胞更加有利于维持记忆性t细胞表型和生存。
对于实施例2-3制备的记忆性t细胞,在做上述检测后其结果与实施例1的检测结果相似。
- 还没有人留言评论。精彩留言会获得点赞!