吡唑啉类氨肽酶N抑制剂及其制备方法和应用与流程
本发明涉及一种吡唑啉类氨肽酶n抑制剂及其制备方法和用途,属于有机化合物合成与医药应用技术领域。
背景技术:
氨肽酶n(apn,cd13)是一族ii型膜结合糖蛋白,分子量约为150kd,属于锌离子依赖性金属蛋白酶和氨肽酶m1家族的gluzincins亚族,以同源二聚体的形式存在于细胞膜,参与底物n端氨基酸的降解。研究证明,氨肽酶n在肿瘤发生、发展、侵袭转移、凋亡及肿瘤血管生成中发挥重要的作用。
(1)氨肽酶n在肿瘤细胞表面高水平表达。该酶可降解细胞外基质,从而促进肿瘤细胞侵袭与转移。细胞外基质在维持细胞连接的稳定性和细胞间信号传导中起着非常重要的作用。细胞外基质的降解还能通过促进存在于其中的生长因子的释放而促进肿瘤的生长增殖(biol.pharm.bull.,2004,27(6):772-776;int.j.cancer.,1993,54,137;cancerres.,1993,53(6):1450-1455)。(2)氨肽酶n能够刺激血管内皮细胞释放肿瘤微血管形成相关因子,促进肿瘤细胞血管生成。apn在新生血管内皮细胞和亚内皮细胞高表达,可方便内皮细胞入侵周围其他组织。这也是血管生成的基本内容,血管生成是肿瘤生长和转移的第一步。(3)氨肽酶n(cd13)是肿瘤干细胞的表面标志物,与肝癌干细胞的生存有着重大关系(jclininvest2010,120(9),3326-3339)。肿瘤干细胞是导致肿瘤化疗耐药、复发和转移的重要原因。(4)apn参与t淋巴细胞依赖的炎症反应。能够表达于抗原递呈细胞表面,降解免疫活性物质(如白介素-8);还降低了t细胞表面对其抗原的识别能力,同时削弱了巨噬细胞和nk细胞对肿瘤细胞的识别和杀伤能力,使机体免疫力下降。
乌苯美司是至今为止唯一一个上市的药物,具有β-氨基酸的类二肽结构,作为免疫增强剂用于白血病的治疗。其是从橄榄网状链霉菌(streptomycesolivorecticuli)的培养液中分离得到的,全合成代价昂贵,因而来源有限。现在已经报道的apn抑制剂,大多数为肽或肽的类似物,对体内酶的降解比较敏感,由于体内多种氨肽酶、羧基肽酶或者二肽肽酶的存在,选择性差,很难开发成具有临床应用价值的氨肽酶n抑制剂。另外,肽类抑制剂由于含有多个手性中心,合成难度大,大多来源于天然产物,来源的有限不利于深入的科学研究和将来的大规模生产。因此,开发有效的易合成的非肽类氨肽酶n抑制剂显得非常有必要。
技术实现要素:
针对现有技术的不足,本发明提供了一种吡唑啉类氨肽酶n抑制剂及其制备方法,本发明还提供该化合物的制药用途。
本发明的技术方案为:
一、吡唑啉类氨肽酶n抑制剂
吡唑啉类氨肽酶n抑制剂,以及其光学异构体、非对映异构体和消旋体混合物,其药学上可接受的盐,溶剂合物或前药,具有如下通式(i)或(ii)所示的结构:
其中:
r1是芳基,取代芳基,杂芳基,取代杂芳基,烷基;
r2是烷酰基,氨基甲酰基,芳基,取代芳基,杂芳基,取代杂芳基,烷基;
x是邻位、间位或对位的o原子,s原子;
n是1-6。
根据本发明优选的,r1是苯基,取代苯基;r2是烷酰基,氨基甲酰基,苯基,烷基;x是邻位、间位或对位的o原子;n是1或3。
根据本发明进一步优选的,上述化合物为下列之一:
二、吡唑啉类氨肽酶n抑制剂的制备方法
本发明的吡唑啉类氨肽酶n抑制剂的制备方法为如下之一:
(1)具有通式i结构的化合物的制备方法如下:
羟基苯乙酮1与各种醛在碱性条件下发生克莱森-施密特反应,生成α,β-不饱和酮中间体2,然后经环合生成中间体3,中间体3在碱性条件下与溴代脂肪酸甲酯反应生成中间体4,最后将甲酯转化为异羟肟酸得到目标化合物5;反应式1如下:
其中r1,r2,n的定义同通式i和ii所述;
上述反应式1中的试剂和条件:(a)r1cho,氢氧化钾,水,乙醇,25℃反应48小时;(b)r2为烷酰基时,各种烷基羧酸,水合肼,回流5小时;r2为氨基甲酰基时,盐酸氨基脲,氢氧化钠,乙醇,回流5小时;r2为芳基,取代芳基,杂芳基,取代杂芳基,烷基时,r2nhnh2,氢氧化钠,乙醇,回流5小时;(c)n=1,氢化钠,n’n-二甲基甲酰胺,25℃反应12小时;n=2、3、4、5或6,碳酸钾,n’n-二甲基甲酰胺,80℃反应40小时;(d)羟胺钾,无水甲醇,25℃反应0.5小时。
(2)具有通式ii结构的化合物的制备方法如下:
羟基苯甲醛6与各种酮在碱性条件下发生克莱森-施密特反应,生成α,β-不饱和酮中间体7,然后经环合生成中间体8,中间体8在碱性条件下与溴代脂肪酸甲酯反应生成中间体9,最后将甲酯转化为异羟肟酸得到目标化合物10;反应式2如下:
其中r1,r2,n的定义同通式i和ii所述;
上述反应式1中的试剂和条件:(a)r1coch3,氢氧化钾,水,乙醇,25℃反应48小时;(b)r2为烷酰基时,各种烷基羧酸,水合肼,回流5小时;r2为氨基甲酰基时,盐酸氨基脲,氢氧化钠,乙醇,回流5小时;r2为芳基,取代芳基,杂芳基,取代杂芳基,烷基时,r2nhnh2,氢氧化钠,乙醇,回流5小时;(c)n=1,氢化钠,n’n-二甲基甲酰胺,25℃反应12小时;n=2、3、4、5或6,碳酸钾,n’n-二甲基甲酰胺,80℃反应40小时;(d)羟胺钾,无水甲醇,25℃反应0.5小时。
根据本发明优选的,吡唑啉类氨肽酶n抑制剂的制备方法,具体步骤如下:
1.具有通式i结构的化合物的制备方法如下:
(1)化合物5a-5c,5f-5h和5k-5n的制备,以5a为例。
2-(2-(1-甲酰基-5-苯基-4,5-二氢-1h-吡唑-3-基)苯氧基)-n-羟基乙酰胺(5a)的制备方法,步骤如下:
1)(e)-1-(2-羟基苯基)-3-苯丙基-2-烯基-1-酮(2a)的制备
2-羟基苯乙酮1a1.36g和苯甲醛1.27g溶解在无水乙醇40ml中。0℃搅拌5分钟,加入5.04g氢氧化钾的10ml水溶液。25℃反应48小时。将反应液倒入冰水中,1n盐酸调ph至中性,生成黄色固体。滤过。乙醇重结晶,得到黄色固体1.14g,收率:51%。
化合物2b和2c的制备方法与化合物2a类似。
2)3-(2-羟基苯基)-5-苯基-4,5-二氢-1h-吡唑-1-甲醛(3a)的制备
化合物2a2.24g溶解在热甲酸20ml中。滴加80%水合肼2.5g。回流反应5小时。加入冰水。碳酸氢钠固体调ph至中性,生成固体。滤过。固体用乙酸乙酯洗一次,得到白色固体1.38g,收率:52%。
化合物3b,3c,3f,3g,3i和3j的制备方法与化合物3a类似。
3)甲基-2-(2-(1-甲酰基-5苯基-4,5-二氢-1h-吡唑-3-基)苯氧基)乙酸酯(4a)的制备
化合物3a2.66g溶于n’n-二甲基甲酰胺30ml,逐次加入60%氢化钠0.48g。25℃反应5分钟。加入溴乙酸甲酯1.66g,25℃反应12小时。将反应液倾入水中,乙酸乙酯萃取3次。合并有机相,饱和氯化钠洗3次,无水硫酸镁干燥。滤过。浓缩,得到粗品。柱层析,流动相:二氯甲烷/甲醇,得到白色固体1.79g,收率:53%。
化合物4b,4c,4f,4g,4k和4m的制备方法与化合物4a类似。
甲基-4-(2-(5-苯基-1-丙酰基-4,5-二氢-1h-吡唑-3-基)苯氧基)丁酸酯(4h)的制备
化合物3g2.94g溶于n’n-二甲基甲酰胺30ml,加入碳酸钾1.65g和4-溴丁酸甲酯1.97g。80℃反应40小时。将反应液倾入冰水中。乙酸乙酯萃取3次。饱和氯化钠洗,无水硫酸镁干燥。滤过,浓缩,得到粗品。柱层析,流动相:二氯甲烷/甲醇,得到白色固体2.12g,收率:54%。
化合物4l和4n的制备方法与化合物4h类似。
4)2-(2-(1-甲酰基-5-苯基-4,5-二氢-1h-吡唑-3-基)苯氧基)-n-羟基乙酰胺(5a)的制备
羟胺钾甲醇溶液的制备:氢氧化钾28g和盐酸羟胺23.35g分别溶于70ml和120ml的重蒸甲醇中,获得溶液a和溶液b。溶液a滴加到溶液b中,冰水浴下搅拌40分钟。滤过,得到新制的羟胺钾的甲醇溶液。化合物4a3.38g加入到新制的羟胺钾的甲醇溶液20ml中,25℃反应0.5小时。将反应液倾入水中,10%盐酸调ph至6,生成白色固体。滤过,得到白色固体1.46g,收率:43%。
化合物5b,5c,5f-5h和5k-5n的制备方法与化合物5a类似。
(2)5d,5e,5i,5j,5o和5p的制备,以5d为例。
3-(2-(2-羟基胺)-2-氧代乙氧基)苯基)-5-苯基-4,5-二氢-1h-吡唑-1-甲酰胺(5d)的制备方法,步骤如下:
1)3-(2-羟基苯基)-5-苯基-4,5-二氢-1h-吡唑-1-甲酰胺(3d)的制备
化合物2a2.24g,盐酸氨基脲1.34g,氢氧化钠1.80g,加入到无水乙醇100ml中。回流反应5小时。将反应液倾入水中,10%盐酸调ph至中性,生成白色固体。滤过。固体用乙酸乙酯洗一次,得到白色固体1.63g,收率:58%。
化合物3e,3h和3k的制备方法与化合物3d类似。
2)甲基-2-(2-(1-氨基甲酰基-5-苯基-4,5-二氢-1h-吡唑-3-基)苯氧基)乙酸酯(4d)的制备
化合物3d2.66g,溶于n’n-二甲基甲酰胺30ml,逐次加入60%氢化钠0.48g。25℃反应5分钟。加入溴乙酸甲酯1.66g,25℃反应12小时。将反应液倾入水中,乙酸乙酯萃取3次。合并有机相,饱和氯化钠洗3次,无水硫酸镁干燥。滤过。浓缩,得到粗品。柱层析,流动相:二氯甲烷/甲醇,得到白色固体1.91g,收率:54%。
化合物4e,4i和4o的制备方法与化合物4d类似。
甲基-4-(3-(1-氨基甲酰基-5-苯基-4,5-二氢-1h-吡唑-3-基)苯氧基)丁酸酯(4j)的制备
化合物3h2.81g溶于n’n-二甲基甲酰胺30ml,加入碳酸钾1.65g和4-溴丁酸甲酯1.97g。80℃反应40小时。将反应液倾入冰水中。乙酸乙酯萃取3次。饱和氯化钠洗3次,无水硫酸镁干燥。滤过,浓缩,得到粗品。柱层析,流动相:二氯甲烷/甲醇,得到白色固体2.25g,收率:59%。
化合物4p的制备方法与化合物4j类似。
3)3-(2-(2-羟基胺)-2-氧代乙氧基)苯基)-5-苯基-4,5-二氢-1h-吡唑-1-甲酰胺(5d)的制备
化合物4d3.53g加入到新制的羟胺钾的甲醇溶液20ml中,25℃反应0.5小时。将反应液倾入水中,10%盐酸调ph至6,生成白色固体。滤过,得到白色固体1.56g,收率:44%。
5e,5i,5j,5o和5p的制备方法与化合物5d类似。
2.具有通式ii结构的化合物的制备方法如下:
(1)化合物10a-10d、10g和10h的制备,以10b为例。
2-(2-(1-乙酰基-3-苯基-4,5-二氢-1h-吡唑-5-基)苯氧基)-n-羟基乙酰胺(10b)的制备方法,步骤如下:
1)(e)-3-(2-羟基苯基)-1-苯丙基-2-烯-1-酮(7a)的制备
2-羟基苯甲醛6a1.22g和苯乙酮1.44g溶解在无水乙醇40ml中。0℃搅拌5分钟,加入5.04g氢氧化钾的10ml水溶液。25℃反应48小时。将反应液倒入冰水中,1n盐酸调ph至中性,生成黄色固体。滤过。乙醇重结晶,得到黄色固体1.16g,收率:52%。
化合物7b的制备方法与化合物7a类似。
2)1-(5-(2-羟基苯基)-3-苯基-4,5-二氢-1h-吡唑-1-基)乙酮(8b)的制备
化合物7a2.24g溶解在热醋酸20ml中。滴加80%水合肼2.5g。回流反应5小时。加入冰水。碳酸氢钠固体调ph至中性,生成固体,滤过。固体用乙酸乙酯洗一次,得到白色固体1.51g,收率:54%。
化合物8a,8c,8d,8g和8h的制备方法与化合物8b类似。
3)甲基-2-(2-(1-乙酰基-3-苯基-4,5-二氢-1h-吡唑-5-基)苯氧基)乙酸酯(9b)的制备
化合物8b2.80g溶于n’n-二甲基甲酰胺30ml,逐次加入60%氢化钠0.48g。25℃反应5分钟。加入溴乙酸甲酯1.66g,25℃反应12小时。将反应液倾入水中,乙酸乙酯萃取3次。合并有机相,饱和氯化钠洗3次,无水硫酸镁干燥。滤过。浓缩,得到粗品。柱层析,流动相:二氯甲烷/甲醇,得到白色固体1.94g,收率:55%。
化合物9a,9c,9d,9g和9h的制备方法与化合物9b类似。
4)2-(2-(1-乙酰基-3-苯基-4,5-二氢-1h-吡唑-5-基)苯氧基)-n-羟基乙酰胺(10b)
化合物9b3.52g加入到20ml新制的羟胺钾的甲醇溶液中,25℃反应0.5小时。将反应液倾入水中,10%盐酸调ph至6,生成白色固体。滤过,得到白色固体1.66g,收率:47%。
化合物10a,10c,10d,10g和10h的制备方法与化合物10b类似。
(2)化合物10e和10f的制备,以10e为例。
5-(2-(2-(羟基胺)-2-氧代乙氧基)苯基)-3-苯基-4,5-二氢-1h-吡唑-1-甲酰胺(10e)的制备方法,步骤如下:
1)5-(2-羟基苯基)-3-苯基-4,5-二氢-1h-吡唑-1-甲酰胺(8e)的制备
化合物7a2.24g,盐酸氨基脲1.34g,氢氧化钠1.80g加入到无水乙醇100ml中。回流反应5小时。将反应液倾入水中,10%盐酸调ph至中性,生成白色固体。滤过。乙酸乙酯洗一次。得到白色固体1.61g,收率:57%。
化合物8f的制备方法与化合物8e类似。
2)甲基-2-(2-(1-氨基甲酰基-3-苯基-4,5-二氢-1h-吡唑-5-基)苯氧基)乙酸酯(9e)的制备
化合物8e2.66g溶于n’n-二甲基甲酰胺30ml中,逐次加入60%氢化钠0.48g。25℃反应5分钟。加入溴乙酸甲酯1.66g,25℃反应12小时。将反应液倾入水中,乙酸乙酯萃取3次。合并有机相,饱和氯化钠洗3次,无水硫酸镁干燥。滤过。浓缩,得到粗品。柱层析,流动相:二氯甲烷/甲醇,得到白色固体1.84g,收率:52%。
化合物9f的制备方法与化合物9e类似。
3)5-(2-(2-(羟基胺)-2-氧代乙氧基)苯基)-3-苯基-4,5-二氢-1h-吡唑-1-甲酰胺(10e)的制备
化合物9e3.53g加入到20ml新制的羟胺钾的甲醇溶液中,25℃反应0.5小时。将反应液倾入水中,10%盐酸调ph至6,生成白色固体。滤过,得到白色固体1.45g,收率:41%。
化合物10f的制备方法与化合物10e类似。
反应式1的目标化合物结构式如下:
反应式2的目标化合物结构式如下:
所述化合物的具体操作步骤在实施例中将加以详细说明。
本领域技术人员可以对上述步骤进行变动以提高收率,他们可根据本领域的基本知识确定合成路线,如选择反应物,溶剂和温度,可以通过使用各种常规保护基以避免副反应的发生从而提高效率。这些常规的保护方法可参见例如t.greene,protectinggroupsinorganicsynthesis。
三、吡唑啉类氨肽酶n抑制剂的用途
本发明还提供了吡唑啉类氨肽酶n抑制剂在制备预防或治疗与氨肽酶活性异常相关的疾病的药物中的应用;所述的与氨肽酶活性异常相关的疾病包括:各种血液瘤或实体瘤,炎症,多发性硬化症,各种组织溃疡或组织溃疡性病症,牙周病,大疱性表皮松懈症,疟疾。
此外,本发明还包括一种适于口服或胃肠外给药的药物组合物,包含通式i或ii所述的化合物和一种或多种药学上可接受载体或赋形剂。
发明详述
本文中所用的术语和定义含义如下:
“药学上可接受的盐”是指式(i)或(ii)化合物具有疗效且无毒的盐形式。本领域已知许多这样的盐。在任何酸性基团(如羧基)上形成的阳离子盐,或是在任何碱性基团(如氨基)上形成的阴离子盐。这些盐有许多是本领域已知的,如阳离子盐包括碱金属(如钠和钾)和碱土金属(如镁和钙)的盐以及有机盐(如胺盐)。还可通过使用相应的酸获得阴离子盐,这样的酸包括无机酸如硫酸、硝酸、磷酸、盐酸等;或者有机酸如乙酸、丙酸、羟基乙酸、2-羟基丙酸、2-氧代丙酸、草酸、丙二酸、琥珀酸、马来酸、富马酸、苹果酸、酒石酸、2-羟基-1,2,3-丙三酸、甲磺酸、乙磺酸、苯甲磺酸、4-甲基苯磺酸、环己基亚磺酸、2-羟基苯甲酸、4-氨基-2-羟基苯甲酸等。这些盐是熟练技术人员熟知的,熟练的技术人员可制备本领域知识所提供的任何盐。此外,熟练技术人员可根据溶解度、稳定性、容易制剂等取某种盐而舍另一种盐。这些盐的测定和最优化在熟练技术人员的经验范围内。
“溶剂合物”是溶质(如氨肽酶n抑制剂)和溶剂(如水)组合形成的配合物。参见j.honig等,thevannostrandchemist’sdictionary,p.650(1953)。本发明采用的药学上可接受的溶剂包括不干扰氨肽酶n抑制剂的生物活性的那些溶剂(例如水、乙醇、乙酸、n’n-二甲基甲酰胺、二甲基亚砜以及该领域技术人员所知的或容易确定的溶剂)。
本文所用的“光学异构体”、“对映体”、“非对映体”、“消旋体”等定义了本发明化合物或其生理上的衍生物所有可能的立体异构体的形式。除非另有指示,本发明化合物的化学命名包括所有可能的立体化学形式的混合物,所属混合物包含基本结构分子的所有非对映体和对映体,以及基本纯净的本发明化合物的单个异构体形式,即其中含有低于10%,优选低于5%,特别是低于2%,最优选低于1%的其它异构体。本发明化合物各种立体异构体形式均明显包含于本发明的范围内。
式(i)或(ii)化合物还可以其它被保护的形式或衍生物的形式存在,这些形式对本领域技术人员而言是显而易见的,均应该包含于本发明的范围内。
如上所述的取代基自身还可被一个或多个取代基取代。这样的取代基包括在c.hansch和a.leo,substituentconstantsforcorrelationanalysisinchemistryandbiology(1979)中列出的那些取代基。优选的取代基包括,例如烷基,烯基,烷氧基,羟基,氧基,硝基,氨基,氨基烷基(如氨甲基等),氰基,卤,羧基,羰基烷氧基(如羰基乙氧基等),硫基,芳基,环烷基,杂芳基,杂环烷基(如哌啶基,吗啉基,吡咯基等),亚氨基,羟烷基,芳基氧基,芳基烷基,及其结合。
附图说明
图1是抑制人脐静脉内皮细胞管状结构形成的代表性图片。
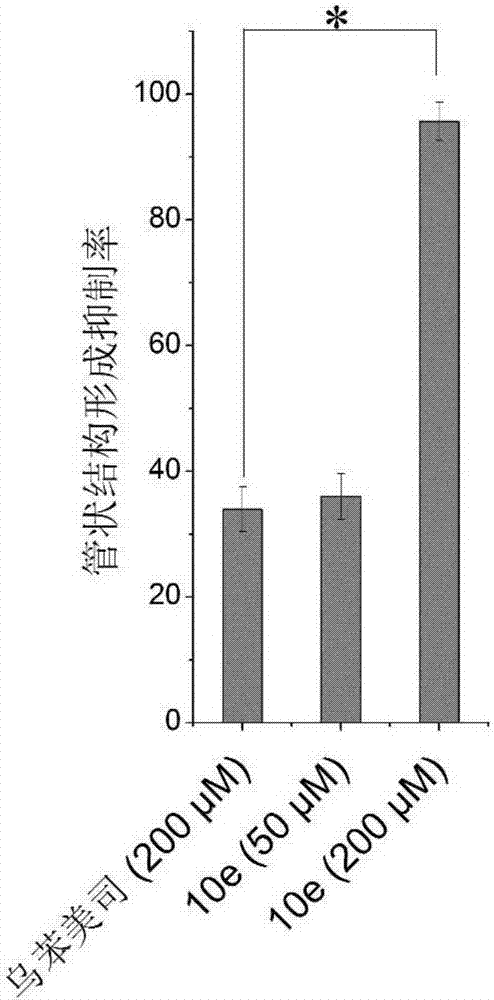
图2是抑制管状结构形成的抑制率柱形图;统计学分析,*p<0.05,10e(200μm)组对乌苯美司(200μm)组。
具体实施方式
下面结合实施例对本发明做进一步的说明,但不限于此。
实施例1.化合物5a-5c,5f-5h和5k-5n的制备,以5a为例。
2-(2-(1-甲酰基-5-苯基-4,5-二氢-1h-吡唑-3-基)苯氧基)-n-羟基乙酰胺(5a)的制备方法,步骤如下:
1)(e)-1-(2-羟基苯基)-3-苯丙基-2-烯基-1-酮(2a)的制备
2-羟基苯乙酮1a(1.36g,10mmol)和苯甲醛(1.27g,12mmol)溶解在无水乙醇(40ml)中。0℃搅拌5分钟,加入氢氧化钾(5.04g,90mmol)的水(10ml)溶液。25℃反应48小时。将反应液倒入冰水中,1n盐酸调ph至中性,生成黄色固体。滤过。乙醇重结晶,得到黄色固体1.14g。收率:51%,mp:88.5-90.3℃;1hnmr(400mhz,[d6]dmso):δ=12.49(s,1h),8.26(d,j=8.0hz,1h),8.05(d,j=16.0hz,1h),7.94-7.91(m,2h),7.85(d,j=16.0hz,1h),7.58(t,j=8.0hz,1h),7.51-7.47(m,3h),7.04-7.00(m,2h)。
化合物2b和2c的制备方法与化合物2a类似。
2)3-(2-羟基苯基)-5-苯基-4,5-二氢-1h-吡唑-1-甲醛(3a)的制备
化合物2a(2.24g,10mmol)溶解在热甲酸(20ml)中。滴加80%水合肼(2.5g,40mmol)。回流反应5小时。加入冰水。碳酸氢钠固体调ph至中性,生成固体。滤过。固体用乙酸乙酯洗一次,得到白色固体1.38g。收率:52%,mp:150.7-152.2℃;1hnmr(400mhz,[d6]dmso):δ=10.19(s,1h),8.95(s,1h),7.58(d,j=8.0hz,1h),7.38-7.32(m,3h),7.30-7.27(m,1h),7.26-7.24(m,2h),6.98(d,j=8.0hz,1h),6.92(t,j=8.0hz,1h),5.50(dd,j=8.0hz,4.0hz,1h),4.01(dd,j=16.0hz,8.0hz,1h),3.30(dd,j=16.0hz,4.0hz,1h);esi-ms:m/z[m+h]+267.3。
化合物3b,3c,3f,3g,3i和3j的制备方法与化合物3a类似。
3)甲基-2-(2-(1-甲酰基-5苯基-4,5-二氢-1h-吡唑-3-基)苯氧基)乙酸酯(4a)的制备
化合物3a(2.66g,10mmol)溶于n’n-二甲基甲酰胺(30ml)中,逐次加入60%氢化钠(0.48g,12mmol)。25℃反应5分钟。加入溴乙酸甲酯(1.66g,11mmol),25℃反应12小时。将反应液倾入水中,乙酸乙酯萃取3次。合并有机相,饱和氯化钠洗3次,无水硫酸镁干燥。滤过。浓缩,得到粗品。柱层析(流动相:二氯甲烷/甲醇),得到白色固体1.79g。收率:53%;mp:126.6-128.3℃;1hnmr(400mhz,[d6]dmso):δ=8.90(s,1h),7.89-7.87(m,1h),7.46-7.41(m,1h),7.38-7.33(m,2h),7.30-7.22(m,3h),7.09-7.05(m,2h),5.51(dd,j=8.0hz,4.0hz,1h),4.88(s,2h),4.04(dd,j=16.0hz,8.0hz,1h),3.64(s,3h),3.38(dd,j=16.0hz,4.0hz,1h);esi-ms:m/z[m+h]+339.3。
化合物4b,4c,4f,4g,4k和4m的制备方法与化合物4a类似。
甲基-4-(2-(5-苯基-1-丙酰基-4,5-二氢-1h-吡唑-3-基)苯氧基)丁酸酯(4h)的制备
化合物3g(2.94g,10mmol)溶于n’n-二甲基甲酰胺(30ml)中,加入碳酸钾(1.65g,12mmol)和4-溴丁酸甲酯(1.97g,11mmol)。80℃反应40小时。将反应液倾入冰水中。乙酸乙酯萃取3次。饱和氯化钠洗3次,无水硫酸镁干燥。滤过,浓缩,得到粗品。柱层析(流动相:二氯甲烷/甲醇),得到白色固体2.12g,收率:54%,mp:90.4-92.1℃。1hnmr(400mhz,dmso-d6):δ=7.37-7.35(m,2h),7.33-7.28(m,3h),7.27-7.23(m,1h),7.19-7.16(m,2h),7.05-7.02(m,1h),5.54(dd,j=8hz,4hz,1h),4.04(t,j=8hz,2h),3.83(dd,j=16hz,8hz,1h),3.61(s,3h),3.13(dd,j=16hz,4hz,1h),2.80-2.69(m,2h),2.50-2.47(m,2h),2.02-1.95(m,2h),1.07(t,j=8hz,3h)。
化合物4l和4n的制备方法与化合物4h类似。
4)2-(2-(1-甲酰基-5-苯基-4,5-二氢-1h-吡唑-3-基)苯氧基)-n-羟基乙酰胺(5a)的制备
羟胺钾甲醇溶液的制备:氢氧化钾(28g,509mmol)和盐酸羟胺(23.35g,343mmol)分别溶于70ml和120ml的重蒸甲醇中,获得溶液a和溶液b。溶液a滴加到溶液b中,冰水浴下搅拌40分钟。滤过,得到新制的羟胺钾的甲醇溶液。化合物4a(3.38g,10mmol)加入到新制的羟胺钾的甲醇溶液(20ml)中,25℃反应0.5小时。将反应液倾入水中,10%盐酸调ph至6,生成白色固体。滤过,得到白色固体1.46g,收率:43%,mp:196.5-198.4℃;1hnmr(400mhz,[d6]dmso):δ=10.85(s,1h),9.09(s,1h),8.90(s,1h),7.81(d,j=8.0hz,1h),7.48-7.44(m,1h),7.40-7.34(m,2h),7.30-7.23(m,3h),7.07(t,j=8.0hz,2h),5.49(dd,j=8.0hz,4.0hz,1h),4.62(d,j=16.0hz,1h),4.57(d,j=16.0hz,1h),4.04(dd,j=16.0hz,8.0hz,1h),3.31(dd,j=16.0hz,4.0hz,1h);13cnmr(100mhz,[d6]dmso):δ=164.5,159.9,156.7,155.8,141.8,132.4,129.7,129.2,127.9,126.2,121.9,120.2,113.8,66.8,58.5,45.5;hrms(ap-esi)m/z[m+h]+calcdforc18h18n3o4:340.1297,found:340.1296。
化合物5b,5c,5f-5h和5k-5n的制备方法与化合物5a类似。
实施例2.5d,5e,5i,5j,5o和5p的制备,以5d为例。
3-(2-(2-羟基胺)-2-氧代乙氧基)苯基)-5-苯基-4,5-二氢-1h-吡唑-1-甲酰胺(5d)的制备方法。步骤如下:
1)3-(2-羟基苯基)-5-苯基-4,5-二氢-1h-吡唑-1-甲酰胺(3d)的制备
化合物2a(2.24g,10mmol),盐酸氨基脲(1.34g,12mmol),氢氧化钠(1.80g,45mmol)加入到无水乙醇(100ml)中。回流反应5小时。将反应液倾入水中,10%盐酸调ph至中性,生成白色固体。滤过。固体用乙酸乙酯洗一次,得到白色固体1.63g。产率:58%,mp:220.2-221.7℃;1hnmr(400mhz,[d6]dmso):δ=9.77(s,1h),7.48(d,j=8.0hz,1h),7.36-7.27(m,3h),7.26-7.22(m,1h),7.21-7.18(m,2h),6.96(d,j=8.0hz,1h),6.89(t,j=8.0hz,1h),6.71(brs,2h),5.38(dd,j=8.0hz,4.0hz,1h),3.91(dd,j=16.0hz,8.0hz,1h),3.16(dd,j=16.0hz,4.0hz,1h);esi-ms:m/z[m+h]+282.3。
化合物3e,3h和3k的制备方法与化合物3d类似。
2)甲基-2-(2-(1-氨基甲酰基-5-苯基-4,5-二氢-1h-吡唑-3-基)苯氧基)乙酸酯(4d)的制备
化合物3d(2.66g,10mmol)溶于n’n-二甲基甲酰胺(30ml),逐次加入60%氢化钠(0.48g,12mmol)。25℃反应5分钟。加入溴乙酸甲酯(1.66g,11mmol),25℃反应12小时。将反应液倾入水中,乙酸乙酯萃取3次。合并有机相,饱和氯化钠洗3次,无水硫酸镁干燥。滤过。浓缩,得到粗品。柱层析(流动相:二氯甲烷/甲醇),得到白色固体1.91g。收率:54%;mp:220.6-222.3℃;1hnmr(400mhz,[d6]dmso):δ=7.98-7.95(m,h),7.39-7.31(m,3h),7.25-7.17(m,3h),7.05-7.02(m,2h),6.49(brs,2h),5.36(dd,j=8.0hz,4.0hz,1h),4.84(s,2h),3.93(dd,j=16.0hz,8.0hz,1h),3.65(s,3h),3.26(dd,j=16.0hz,4.0hz,1h);esi-ms:m/z[m+h]+354.4。
化合物4e,4i和4o的制备方法与化合物4d类似。
甲基-4-(3-(1-氨基甲酰基-5-苯基-4,5-二氢-1h-吡唑-3-基)苯氧基)丁酸酯(4j)的制备
化合物3h(2.81g,10mmol)溶于n’n-二甲基甲酰胺(30ml)中,加入碳酸钾(1.65g,12mmol)和4-溴丁酸甲酯(1.97g,11mmol)。80℃反应40小时。将反应液倾入冰水中。乙酸乙酯萃取3次。饱和氯化钠洗3次,无水硫酸镁干燥。滤过,浓缩,得到粗品。柱层析(流动相:二氯甲烷/甲醇),得到白色固体2.25g,收率:59%,mp:156.6-158.2℃;1hnmr(400mhz,dmso-d6):δ7.41-7.40(m,1h),7.34-7.28(m,4h),7.26-7.22(m,1h),7.19-7.16(m,2h),6.98-6.95(m,1h),6.56(brs,2h),5.41(dd,j=8hz,4hz,1h),4.04(t,j=8hz,2h),3.79(dd,j=16hz,8hz,1h),3.60(s,3h),3.06(dd,j=16hz,4hz,1h),2.50-2.47(m,2h),2.00-1.96(m,2h)。
化合物4p的制备方法与化合物4j类似。
3)3-(2-(2-羟基胺)-2-氧代乙氧基)苯基)-5-苯基-4,5-二氢-1h-吡唑-1-甲酰胺(5d)的制备
化合物4d(3.53g,10mmol)加入到新制的羟胺钾的甲醇溶液(20ml)中,25℃反应0.5小时。将反应液倾入水中,10%盐酸调ph至6,生成白色固体。滤过,得到白色固体1.56g,收率:44%,mp:142.5-144.1℃;1hnmr(400mhz,[d6]dmso):δ=10.78(s,1h),9.00(s,1h),7.97(d,j=8.0hz,1h),7.40-7.36(m,1h),7.34-7.30(m,2h),7.25-7.21(m,1h),7.20-7.17(m,2h),7.05-6.98(m,2h),6.46(brs,2h),5.34(dd,j=8.0hz,4.0hz,1h),4.52(d,j=16.0hz,1h),4.48(d,j=16.0hz,1h),3.94(dd,j=16.0hz,8.0hz,1h),3.20(dd,j=16.0hz,4.0hz,1h);13cnmr(100mhz,[d6]dmso):δ=164.6,156.7,155.5,150.3,144.2,131.4,129.3,128.9,127.3,125.9,121.7,121.3,113.7,66.5,60.1,46.0;hrms(ap-esi)m/z[m+h]+calcdforc18h19n4o4:355.1406,found:355.1408。
5e,5i,5j,5o和5p的制备方法与化合物5d类似。
实施例3.化合物10a-10d、10g和10h的制备,以10b为例。
2-(2-(1-乙酰基-3-苯基-4,5-二氢-1h-吡唑-5-基)苯氧基)-n-羟基乙酰胺(10b)的制备方法,步骤如下:
1)(e)-3-(2-羟基苯基)-1-苯丙基-2-烯-1-酮(7a)的制备
2-羟基苯甲醛6a(1.22g,10mmol)和苯乙酮(1.44g,12mmol)溶解在无水乙醇(40ml)中。0℃搅拌5分钟,加入氢氧化钾(5.04g,90mmol)的水(10ml)溶液。25℃反应48小时。将反应液倒入冰水中,1n盐酸调ph至中性,生成黄色固体。滤过。乙醇重结晶,得到黄色固体1.16g。产率:52%,mp:144.4-146.1℃;1hnmr(400mhz,[d6]dmso):δ=10.27(s,1h),8.10(d,j=8.0hz,2h),8.05(d,j=16.0hz,1h),7.88-7.86(m,1h),7.85(d,j=16.0hz,1h),7.67(t,j=8.0hz,1h),7.58(t,j=8.0hz,2h),7.28(t,j=8.0hz,1h),6.95(d,j=8.0hz,1h),6.88(t,j=8.0hz,1h);esi-ms:m/z[m-h]-223.4。
化合物7b的制备方法与化合物7a类似。
2)1-(5-(2-羟基苯基)-3-苯基-4,5-二氢-1h-吡唑-1-基)乙酮(8b)的制备
化合物7a(2.24g,10mmol)溶解在热醋酸(20ml)中。滴加80%水合肼(2.5g,40mmol)。回流反应5小时。加入冰水。碳酸氢钠固体调ph至中性,生成固体,滤过。固体用乙酸乙酯洗一次,得到白色固体1.51g。收率:54%,mp:246.5-248.3℃;1hnmr(400mhz,[d6]dmso):δ=9.70(s,1h),7.79-7.74(m,2h),7.47-7.43(m,3h),7.06(t,j=8.0hz,1h),6.83(d,j=8.0hz,2h),6.71(t,j=8.0hz,1h),5.64(dd,j=8.0hz,4.0hz,1h),3.81(dd,j=14.0hz,8.0hz,1h),3.00(dd,j=14.0hz,4.0hz,1h),2.33(s,3h);esi-ms:m/z[m+h]+281.3。
化合物8a,8c,8d,8g和8h的制备方法与化合物8b类似。
3)甲基-2-(2-(1-乙酰基-3-苯基-4,5-二氢-1h-吡唑-5-基)苯氧基)乙酸酯(9b)的制备
化合物8b(2.80g,10mmol)溶于n’n-二甲基甲酰胺(30ml)中,逐次加入60%氢化钠(0.48g,12mmol)。25℃反应5分钟。加入溴乙酸甲酯(1.66g,11mmol),25℃反应12小时。将反应液倾入水中,乙酸乙酯萃取3次。合并有机相,饱和氯化钠洗3次,无水硫酸镁干燥。滤过。浓缩,得到粗品。柱层析(流动相:二氯甲烷/甲醇),得到白色固体1.94g。收率:55%;mp:36.6-138.3℃;1hnmr(400mhz,[d6]dmso):δ=7.76-7.71(m,2h),7.48-7.43(m,3h),7.24-7.19(m,1h),6.98-6.96(m,1h),6.95-6.89(m,2h),5.73(dd,j=8.0hz,4.0hz,1h),4.88(s,2h),3.83(dd,j=16.0hz,8.0hz,1h),3.69(s,3h),3.10(dd,j=16.0hz,4.0hz,1h),2.35(s,3h);esi-ms:m/z[m+h]+353.5。
化合物9a,9c,9d,9g和9h的制备方法与化合物9b类似。
4)2-(2-(1-乙酰基-3-苯基-4,5-二氢-1h-吡唑-5-基)苯氧基)-n-羟基乙酰胺(10b)的制备
化合物9b(3.52g,10mmol)加入到新制的羟胺钾的甲醇溶液(20ml)中,25℃反应0.5小时。将反应液倾入水中,10%盐酸调ph至6,生成白色固体。滤过,得到白色固体1.66g,收率:47%,mp:180.2-182.1℃;1hnmr(300mhz,[d6]dmso):δ=10.74(s,1h),9.03(s,1h),7.78-7.75(m,2h),7.47-7.45(m,3h),7.26-7.20(m,1h),7.00-6.90(m,3h),5.86(dd,j=11.4hz,4.2hz,1h),4.63(d,j=14.1hz,1h),4.55(d,j=14.1hz,1h),3.82(dd,j=18.0hz,11.4hz,1h),3.19(dd,j=18.0hz,4.2hz,1h),2.36(s,3h);13cnmr(100mhz,[d6]dmso):δ=166.8,163.7,154.4,153.6,130.5,129.6,129.0,128.1,127.7,125.9,124.6,120.5,111.6,66.5,54.1,40.5,21.1;hrms(ap-esi)m/z[m+h]+calcdforc19h20n3o4:354.1454,found:354.1411。
化合物10a,10c,10d,10g和10h的制备方法与化合物10b类似。
实施例4.化合物10e和10f的制备,以10e为例。
5-(2-(2-(羟基胺)-2-氧代乙氧基)苯基)-3-苯基-4,5-二氢-1h-吡唑-1-甲酰胺(10e)的制备方法,步骤如下:
1)5-(2-羟基苯基)-3-苯基-4,5-二氢-1h-吡唑-1-甲酰胺(8e)的制备
化合物7a(2.24g,10mmol),盐酸氨基脲(1.34g,12mmol)和氢氧化钠(1.80g,45mmol)加入到无水乙醇(100ml)中。回流反应5小时。将反应液倾入水中,10%盐酸调ph至中性,生成白色固体。滤过。乙酸乙酯洗一次。得到白色固体1.61g。产率:57%,mp:234.1-235.8℃;1hnmr(400mhz,[d6]dmso):δ=9.65(s,1h),7.81-7.75(m,2h),7.45-7.31(m,3h),7.06(t,j=8.0hz,1h),6.85(d,j=8.0hz,2h),6.72(t,j=8.0hz,1h),6.51(brs,2h),5.55(dd,j=8.0hz,4.0hz,1h),3.77(dd,j=16.0hz,8.0hz,1h),2.97(dd,j=16.0hz,4.0hz,1h);esi-ms:m/z[m+h]+282.5。
化合物8f的制备方法与化合物8e类似。
2)甲基-2-(2-(1-氨基甲酰基-3-苯基-4,5-二氢-1h-吡唑-5-基)苯氧基)乙酸酯(9e)的制备
化合物8e(2.66g,10mmol)溶于n’n-二甲基甲酰胺(30ml)中,逐次加入60%氢化钠(0.48g,12mmol)。25℃反应5分钟。加入溴乙酸甲酯(1.66g,11mmol),25℃反应12小时。将反应液倾入水中,乙酸乙酯萃取3次。合并有机相,饱和氯化钠洗3次,无水硫酸镁干燥。滤过。浓缩,得到粗品。柱层析(流动相:二氯甲烷/甲醇),得到白色固体1.84g。收率:52%;mp:198.8-200.3℃;1hnmr(400mhz,[d6]dmso):δ=7.76-7.74(m,2h),7.44-7.40(m,3h),7.23-7.18(m,1h),6.97-6.90(m,3h),6.54(brs,2h),5.63(dd,j=8.0hz,4.0hz,1h),4.89(s,2h),3.78(dd,j=16.0hz,8.0hz,1h),3.71(s,3h),3.04(dd,j=16.0hz,4.0hz,1h);esi-ms:m/z[m+h]+354.4。
化合物9f的制备方法与化合物9e类似。
3)5-(2-(2-(羟基胺)-2-氧代乙氧基)苯基)-3-苯基-4,5-二氢-1h-吡唑-1-甲酰胺(10e)的制备
化合物9e(3.53g,10mmol)加入到新制的羟胺钾的甲醇溶液(20ml)中,25℃反应0.5小时。将反应液倾入水中,10%盐酸调ph至6,生成白色固体。滤过,得到白色固体1.45g,收率:41%,mp:192.6-194.2℃;1hnmr(400mhz,[d6]dmso):δ=10.75(s,1h),9.00(s,1h),7.79-7.73(m,2h),7.45-7.39(m,3h),7.24-7.19(m,1h),6.98-6.90(m,3h),6.56(brs,2h),5.77(dd,j=8.0hz,4.0hz,1h),4.63(d,j=16.0hz,1h),4.57(d,j=16.0hz,1h),3.79(dd,j=16.0hz,8.0hz,1h),3.11(dd,j=16.0hz,4.0hz,1h);13cnmr(100mhz,[d6]dmso):δ=164.8,155.4,154.5,151.9,132.0,131.6,130.1,129.0,128.6,126.8,125.8,121.6,112.4,66.6,54.9,41.7;hrms(ap-esi)m/z[m+h]+calcdforc18h19n4o4:355.1406,found:355.1398。
化合物10f的制备方法与化合物10e类似。
实施例5.体外抑制氨肽酶n的活性实验
1)实验材料:
氨肽酶n购自biocol公司,底物l-亮氨酰-p-硝基苯胺购自sigma公司。
缓冲液的配制,12.89gna2hpo4.12h2o和2.18gnah2po4.2h2o,溶解于1000ml容量瓶中,加新煮沸放冷的蒸馏水定容,得到ph为7.2的50mm磷酸盐缓冲溶液,室温放置备用。
底物溶解在二甲基亚砜中配成16mmol/ml的溶液,备用。
氨肽酶n溶解在缓冲液中,配成0.15iu/ml的溶液,冰箱4℃放置,备用。
2)实验方法:
表1.体外抑酶实验各种加入试剂配比
在96孔板中,按照上表中的量加入酶,底物,抑制剂和磷酸盐缓冲液。在37℃孵育0.5小时。于405nm处测定吸光度,按照如下公式计算抑制率:
根据化合物的浓度和抑制率,利用origin8.0软件拟合曲线,得到ic50值。
3)实验结果:
本发明所述通式(i)和(ii)结构中部分化合物和阳性药乌苯美司的氨肽酶n抑制活性如下表2所示:
表2.部分化合物的氨肽酶n抑制活性
[a]实验结果表示为平均值±标准差,来自三次独立的实验。
体外抑酶实验结果显示:大部分化合物在微摩尔或者亚微摩尔水平表现了氨肽酶n的抑制活性。化合物5a,5d,10a,10b,10c,10d,10e和10f氨肽酶n的抑制活性优于阳性药乌苯美司(bestatin)一至二个数量级。其中10e的活性最好。
实施例6.体外抑制肿瘤细胞增殖实验:
1)实验材料:
细胞株:
处于对数生长期的人淋巴癌u937细胞株,人白血病k562细胞株,人肝癌plc/prf/5、hepg2细胞株,人前列腺癌pc-3细胞株,人卵巢透明细胞癌es-2细胞株。
试剂:mtt溶于1×pbs配成5mg/ml的溶液,二甲基亚砜。
2)实验方法:
取对数生长期的细胞(100μl)铺于96孔板底部(悬浮细胞8,000细胞/孔,贴壁细胞4,000细胞/孔),待细胞贴壁伸展后(悬浮细胞直接加入抑制剂)加入不同浓度的抑制剂100μl,37℃,5%co2孵育48小时。然后加入20μlmtt溶液,继续孵育4小时。离心。加入200μl二甲基亚砜,混匀15分钟。570nm处测定吸光度。细胞增殖抑制率按照如下公式计算:
根据抑制剂的浓度和相应抑制率,利用origin8.0软件拟合曲线,得到ic50值。
3)实验结果:
本发明所述通式(i)和(ii)结构中部分化合物和阳性药乌苯美司的抑制多种肿瘤细胞株增殖的活性如下表3所示:
表3.部分化合物的抗肿瘤细胞增殖活性
[a]实验结果表示为平均值±标准差,来自三次独立的实验。
细胞增殖活性显示:化合物10b和10e对六种细胞株的抑制作用明显优于阳性药乌苯美司,具有抗肿瘤细胞增殖的作用。
实施例7.体外抗血管生成实验:
1)实验模型:体外人脐静脉内皮细胞管状结构形成
2)实验材料:原代分离的人脐静脉内皮细胞,基质胶(matrigel,购自bdbioscience公司),m199细胞培养基
3)实验方法:
50μl基质胶加入到96孔板中,37℃放置,待胶凝固后,加入50μl含人脐静脉内皮细胞(20,000个细胞/孔)和不同浓度抑制剂的m199培养基。37℃,5%co2孵育4小时。显微镜下观察和拍照,随机选取五个视野对管状结构分支点进行计数,计算平均值,与乌苯美司组进行比较。
4)实验结果:
实验结果见附图1和附图2。化合物10e在50μm时,抑制管状结构形成的作用与阳性药乌苯美司在200μm时相当;化合物10e在200μm时,几乎完全抑制管状结构的形成。化合物10e显示了体外抗血管生成的作用,具有进一步开发的价值。
- 还没有人留言评论。精彩留言会获得点赞!