MDCK细胞宿主残留蛋白的制备及其用途的制作方法
本发明属于疫苗制剂领域,具体而言,涉及一种MDCK细胞宿主残留蛋白的制备及其用途。
背景技术:
MDCK((Madin-Daby canine kidney cells),由Madin和Darby于1958年从美国Cocker Spaniel母曲架犬的肾脏组织分离培育建立,通常是以贴壁方式生长的上皮样细胞。由于其病毒感染效率高、增殖快,且不易变异,MDCK细胞系(MDCK Cell Lines)被公认为最适于甲、乙型流感病毒疫苗生产的3种细胞系之一。
残留在生物制品中的宿主细胞蛋白(host cell protein,HCP)属于异源蛋白,既包括宿主细胞的结构蛋白液也包括宿主细胞(传代细胞)分泌的促生长因子。HCP不仅有可能诱导机体产生抗HCP抗体,引起机体产生过敏反应,还有可能有“佐剂效应”而引起机体对蛋白质药物产生抗体,影响药物治疗效果。因此控制疫苗中HCP含量是保证疫苗质量的一项重要内容。1998年,WHO制定了《使用动物细胞生产生物制品规程》,其中对传代细胞的HCP 残留量提出了指导性要求,即将传代细胞HCP含量降低至可接受水平。目前,大部分疫苗只是通过控制疫苗的总蛋白含量进行间接控制。
韩国学者Kim HyunSu等首先报导了检测Vero细胞制备的乙型脑炎减毒活疫苗中HCP残留含量方法,日本学者Keishin Sugawara等使用酶联间接双抗体夹心法检测Veto细胞生产的乙型脑炎灭活疫苗中HCP含量,田博等报导建立间接酶联免疫法,但重复性差敏感度低,王辉等报导建立了酶联双抗体夹心法检测Vero细胞残留蛋白含量。
王辉等建立的酶联双抗体夹心法检测Vero细胞残留蛋白含量的方法是最接近本发明的技术方案。步骤主要包括:备Veto细胞蛋白抗原参考品,免疫家兔,提纯抗体作为包被抗体并以酶标记,建立酶联免疫检测系统。用Vero细胞蛋白抗原参考品绘制定量标准曲线,并对各项指标进行验证。
MDCK细胞作为细胞基质主要被用作流感疫苗的研制,但目前国际上尚无用MDCK制备的流感疫苗上市,更无特异性MDCK细胞宿主蛋白(HCP)的检测手段。市面上也没有出售用于检测MDCK细胞HCP残余量的试剂盒,主要原因是MDCK细胞工艺特异蛋白以及针对该蛋白的特异性抗体难以制备。本发明所要解决的问题在于提供检测MDCK细胞HCP的抗原标准品和抗体,同时建立起相应的检测方法,以备在疫苗生产和质控中检测MDCK细胞HCP残余量。
技术实现要素:
本发明首先涉及一种稳定培养的MDCK细胞的工艺特异蛋白(即为MDCK细胞宿主残留蛋白)的制备方法,所述方法包括如下步骤,
(1)收集稳定培养的MDCK细胞的培养液;
(2)对所述培养液进行微滤,收集滤出液;
(3)对所述的滤出液进行超滤浓缩,得浓缩液;
(4)对所述浓缩液进行分子筛凝胶层析纯化,得纯化液;
(5)对所述纯化液进行再次浓缩,得所述稳定培养的MDCK细胞的工艺特异蛋白溶液。
所述的稳定培养MDCK细胞的方法包括:
(1)以3×105个/cm2接种细胞至反应器中,进行培养;
(2)细胞经对数生长期逐渐进入平台期后,换成不含血清的新鲜培养基,继续培养;
(3)继续培养2~4天,优选为72h,此时细胞为稳定培养的MDCK细胞。
所述的对培养液进行微滤的方法为:选用0.8+0.65u、0.45+0.2u的两级5英寸柱式滤芯构成微滤系统,对细胞培养液上清进行微滤,收集滤出液。
所述的超滤浓缩的方法为:选择MWCO=100KD的膜包对滤出液进行超滤浓缩,步骤为:
(1)先以小于0.3MPa的透膜压力将微滤滤出液浓缩至原体积的1/10;
(2)以超滤液的8~10体积的pH7.4,0.01M的PBS充分透洗,
(3)将超滤液浓缩至原体积的1/60~1/80。
所述的分子筛凝胶层析纯化的方法为:采用Sepharose分子筛凝胶进行层析纯化,平衡缓冲液和洗脱缓冲液均选用0.01M,pH7.4的PBS,线性流速为50cm/h,目标洗脱峰为第一洗脱峰,收集280nm波长吸收峰≥20mAU部分洗脱液。
所述的再次浓缩的步骤为:将纯化液用MWCO=100KD的超滤离心管浓缩至原体积的1/2~ 1/3,再次浓缩方法与所述超滤浓缩方法相同。
本发明还涉及一种制备所述的工艺特异蛋白的检测抗体的方法,所述的方法包括如下步骤:
(1)使用所述蛋白皮下注射免疫动物,所述动物优选为家兔或豚鼠;所述蛋白用量为0.3~0.4mg/kg,免疫佐剂为弗氏佐剂,佐剂用量与蛋白溶液为1:1(v/v);
(2)免疫双向扩散测定血清效价达到≥1:32后,处死动物并取全血;
(3)分别选择效价较高的抗血清进行纯化,得到抗MDCK细胞蛋白IgG。
所述的抗血清纯化步骤为:
(1)辛酸-硫酸铵法粗提纯抗血清;
(2)用市售预装Protein-A亲和层析柱进行亲和层析,收集洗脱峰≥30mAU的洗脱液部分,合并洗脱液并用MWCO=10KD的超滤浓缩离心管浓缩洗脱液成原体积的1/10,同时更换缓冲体系为0.01M,pH7.4的PBS,得到抗MDCK细胞蛋白的IgG抗体。
本发明还涉及以所述检测抗体制备的检测所述工艺特异蛋白的检测试剂盒,优选的,所述的试剂盒为,基于双抗夹心法原理的ELISA检测试剂盒。
本发明还涉及由所述方法制备获得的稳定培养的MDCK细胞的工艺特异蛋白,所述蛋白的分子量范围为13KD、17KD、29KD~44.3KD、44.3KD~66.4KD以及97.2KD。
本发明还涉及所述的检测抗体或检测试剂盒在评价疫苗质量中的应用。
本发明还涉及所述的工艺特异蛋白工艺特异蛋白在评价疫苗质量中的应用。
本发明提供了MDCK细胞工艺蛋白及其制备方法,并以该蛋白作为免疫原建立MDCK细胞 HCP的检测方法和检测试验标准品。这种方法制备的MDCK细胞工艺蛋白应用范围更大,不仅可以用于H5N1型流感疫苗,还可以用于疫苗制备过程中的质量控制与分析,并且特异性强、灵敏度高、重复性好。
附图说明
图1、MDCK细胞工艺特异蛋白制备方法流程图。
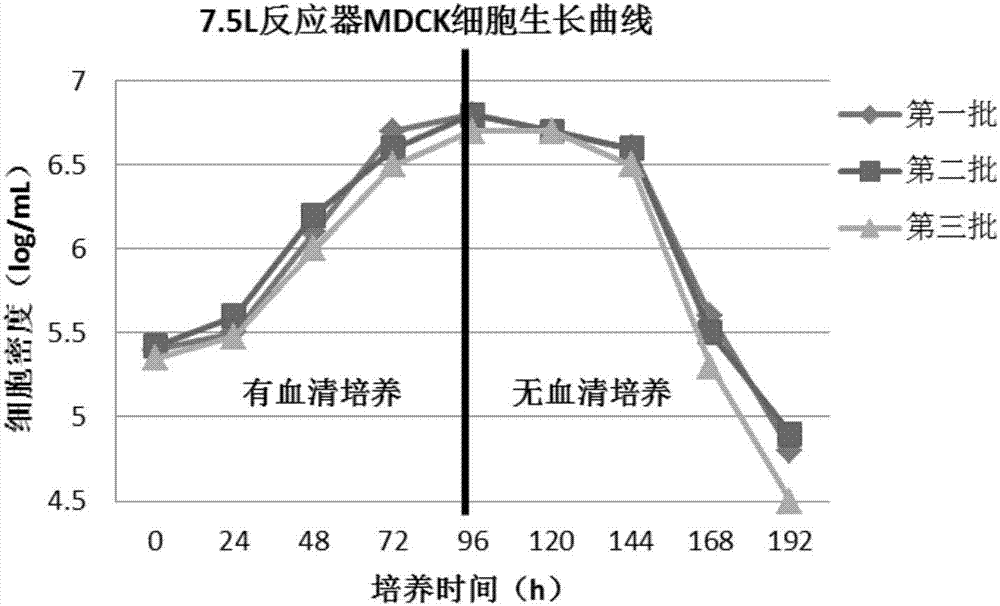
图2、7.5L反应器细胞培养结果。
图3、MDCK细胞蛋白Sepharose 4Fast Flow分子筛凝胶层析色谱图。
图4、MDCK细胞工艺特异蛋白标准品SDS-PAGE考染图(左)和银染图(右)。
图5、两种抗体纯化后的鉴定分析(左为考染图右为western blot图)。
图6、MDCK HCP抗体检测趋势线。
图7、抗体最佳检测线性范围。
图8、抗体特异性验证。
图9、疫苗HCP浓度的检测趋势线。
具体实施方式
主要材料:
MDCK细胞从ATCC(美国标准菌种保藏中心)引进:MDCK CCL-34,P55,Lot:59681577;
家兔和豚鼠由武汉生物制品研究所股份有限公司动物房提供;
酶标板购自美国Costar公司;
辣根过氧化物酶(HRP)购自阿拉丁公司。
主要仪器设备:
超滤器、超滤膜、超滤浓缩器购自赛多利斯公司;
色谱纯化仪色谱柱、纯化介质购自GE Healthcare公司。
实施例1,MDCK细胞工艺蛋白的制备方法:
1、7.5L反应器培养细胞:
取一支工作细胞库MDCK细胞复苏,经T瓶复苏传代放大至10L转瓶,培养到一定的细胞量,以3×105个/cm2接种细胞至反应器中,进行培养。细胞经短暂的调整很快进入对数生长期并维持到72h,从96h细胞逐渐进入平台期,细胞量维持在2×106个/cm2。培养96h后, PBS彻底清洗掉残留的血清,换成不含血清的新鲜培养基,继续培养。从生长曲线上看,细胞停止生长,并开始死亡,数量开始下降,4天(192h)后,细胞密度下降至约3×104/cm2,此时收获细胞培养上清液。整个培养过程中温度稳定,PH值在7.1~7.5之间波动、DO在36%~ 42%之间波动。图2为7.5L反应器中三次培养MDCK细胞的生长曲线图,从图中曲线的趋势可以看出,细胞培养批次间稳定。
2、收获上清:
模拟流感疫苗接毒工艺,待反应器中细胞生长稳定后,将培养液换成不含胎牛血清的培养液,连续灌流培养3~5天后,此时培养液中已经不含胎牛血清(含量可以忽略),收集细胞培养液。
3、MDCK细胞培养液的微滤:
根据步骤2所收获的细胞培养液上清的状态,选用0.8+0.65u、0.45+0.2u的两级5英寸柱式滤芯构成微滤系统,对细胞培养液上清进行微滤,收集滤出液(约6000ml)。
表1微滤前后总蛋白浓度的比较
4、超滤浓缩:
根据流感病毒疫苗制备工艺和相关文献报道,选择MWCO=100KD的膜包对步骤3所得滤出液进行超滤浓缩。本发明在超滤浓缩时,首先以小于0.3MPa的透膜压力将微滤滤出液浓缩至原体积的1/10,然后以超滤液的8~10体积的pH7.4,0.01M的PBS充分透洗,最后将超滤液浓缩至原体积的1/60~1/80。最大限度的保留了宿主蛋白成分,在浓缩的同时也起到了一定的纯化效果。下表是超滤浓缩前后总蛋白浓度的变化,从表中数据可以看出,超滤浓缩损失很大,蛋白回收率低,同时所收集的蛋白相对于通用的裂解蛋白工艺特异性更高。
表2超滤前后MDCK细胞蛋白量的比较
4、超滤浓缩液的层析纯化:
浓缩液采用Sepharose 4Fast Flow型分子筛凝胶进行层析纯化,纯化过程中,平衡缓冲液和洗脱缓冲液均选用0.01M,pH7.4的PBS,线性流速为50cm/h,根据流感疫苗的制备工艺,目标洗脱峰为第一洗脱峰,收集280nm波长吸收峰≥20mAU部分洗脱液,参见图3。
表3层析纯化前后MDCK细胞蛋白量的比较
5、再次浓缩:将收集液用30mL、MWCO=100KD的超滤离心管浓缩至20mL,即可获得工艺特异的MDCK细胞蛋白。
6、纯化后MDCK细胞工艺特异蛋白进行SDS-PAGE电泳,考马斯蓝染色、银染(图4)。
实验结果:SDS-PAGE凝胶电泳显示,MDCK HCP是典型的混合蛋白,在分子量范围为13KD、 17KD、29KD~44.3KD、44.3KD~66.4KD以及97.2KD处均有蛋白分子分布,能清晰分辨的条带有四十余条。制备的3批MDCK HCP虽然总蛋白浓度略有差异,但是蛋白组分高度一致,说明MDCK HCP参考品制备工艺稳定,具有重复性
实施例2,抗MDCK细胞蛋白多抗制备:
材料来源:
纯化的MDCK细胞工艺蛋白来源于实施例1。
实验动物:
家兔(普通级)和豚鼠(清洁级)均来自武汉生物制品研究所动物实验中心
其他仪器试剂:
Protein-A亲和层析柱,羊抗兔-HRP、羊抗豚鼠-HRP均购自武汉博士德公司,HRP酶购自阿拉丁公司,弗氏完全佐剂、弗氏不完全佐剂均购自Sigma公司。
1、免疫家兔:
免疫3只家兔,初次免疫每只家兔用0.6mg实例1制备的工艺特异的MDCK细胞蛋白,加入等体积弗氏完全佐剂,乳化充分后,背部皮下注射6~8点。2周后第二次免疫:0.6mg实例1制备的工艺特异的MDCK细胞蛋白加入等体积弗氏不完全佐剂,乳化充分后,背部皮下多点注射。第二次免疫2周后第三次免疫:1.2mg实例1制备的工艺特异的MDCK细胞蛋白,背部皮下多点注射。最后于第三次免疫10天后采用第三次免疫方法进行第四次免疫,一周后采血测定效价,免疫双向扩散测定血清效价达到≥1:32后,取家兔全血并处死动物。
表4免疫家兔血清效价
2、免疫豚鼠:
免疫5只豚鼠,初次免疫每只豚鼠用0.3mg实例1制备的工艺特异的MDCK细胞蛋白,加入等体积弗氏完全佐剂,乳化充分后,背部皮下注射6~8点。2周后第二次免疫:0.3mg实例1制备的工艺特异的MDCK细胞蛋白加入等体积弗氏不完全佐剂,乳化充分后,背部皮下多点注射。第二次免疫2周后第三次免疫:0.6mg实例1制备的工艺特异的MDCK细胞蛋白,背部皮下多点注射。最后于第三次免疫10天后采用第三次免疫方法进行第四次免疫,一周后采血测定效价,免疫双向扩散测定血清效价达到≥1:32后,取豚鼠全血并处死动物。
表5免疫豚鼠血清效价
3、抗血清纯化:
分别选择上述步骤中两种动物抗血清效价较高的抗血清进行纯化。抗血清经辛酸-硫酸铵法粗提纯后,用市售预装Protein-A亲和层析柱进行亲和层析(纯化方法参考GE公司预装Protein-A亲和层析柱使用说明书),收集洗脱峰≥30mAU的洗脱液部分,合并洗脱液并用MWCO=10KD的超滤浓缩离心管浓缩洗脱液成原体积的1/10,同时更换缓冲体系为0.01M,pH7.4 的PBS,得到抗MDCK细胞蛋白IgG。SDS-PAGE电泳,观察纯化前后抗体IgG的变化,并测定 280nm和260nm吸光度。计算蛋白含量:C(mg/ml)=1.55×OD(280nm)-0.76×OD(260nm)。
表6纯化后抗体含量
4、纯化后抗体效价检测:
采用间接ELISA法检测,用碳酸盐缓冲液(0.05M,pH9.6)将实施例1制备的工艺特异的MDCK细胞蛋白稀释至5ug/ml,100ul/孔包被,4℃过夜。次日弃去包被液,用PBST洗涤3 次,加入含1%BSA的PBST封闭液,150ul/孔,室温封闭2h,弃去封闭液,PBST洗涤5次。将步骤3中纯化好的抗MDCK细胞工艺特异蛋白IgG分别稀释至1mg/ml后再系列10倍稀释,每个稀释度一孔,100ul/孔,37℃孵育60分钟,PBST洗涤5次,拍干,每孔分别加入100ul 酶标二抗(羊抗兔-HRP,羊抗豚鼠-HRP)37℃孵育1h,PBST洗涤5次,拍干。各孔加入显色液A液、B液37℃孵育10分钟。2mol/L硫酸终止反应,在酶标仪上比色,计算抗体效价。
表7纯化后抗体效价
5、纯化后的家兔和豚鼠抗体进行SDS-PAGE鉴定和western blotting分析,结果如图5,结果表明,经纯化后,家兔和豚鼠抗体IgG的重链在55kd附近,抗体IgG的轻链在20kd附近。纯化后抗体与MDCK HCP的绝大部分蛋白成分均能特异性结合。但是,由于MDCK HCP分子量范围广泛,小分子量的抗原部分可能因为抗原位点的丢失而无法与相应抗体特异性结合,从而导致部分抗体的损失。
6、HRP酶标记抗体制备
选用经改良过的高碘酸钠法,分别选取步骤3中抗体效价最高的抗MDCK细胞工艺特异蛋白IgG(1#兔抗/3#兔抗、3#豚鼠抗/5#豚鼠抗)标记辣根过氧化物酶(HRP)。
表8HRP-抗MDCK细胞工艺特异蛋白IgG
实施例3:ELISA双抗体夹心法的建立
1、包被抗体工作浓度和HRP酶标抗体工作浓度的确定----方阵滴定法
(1)抗体稀释液将包被抗体稀释成四个浓度:10μg/mL、5μg/mL、2.5μg/mL、1.25μg/mL,每个稀释度包被3行酶标板,每孔100μL,37℃包被2h或者4℃包被过夜;
(2)封闭:弃去包被液,PBST洗板5次,拍干,每孔加入150μL含1%BSA的PBST,37℃封闭1h;
(3)弃去封闭液,PBST洗板3次,拍干;MDCK HCP用碳酸盐缓冲液稀释成七个浓度: 10μg/mL、5μg/mL、2.5μg/mL、1.25μg/mL、0.625μg/mL、0.312μg/mL、0.155μg/mL,以及一个阴性对照(碳酸盐缓冲液),每个浓度设置一列,每孔100μL,37℃孵育1h;
(4)弃去液体,PBST洗板3次,拍干;酶标抗体稀释成三个浓度:1:100、1:500、1: 1500,在每个包被抗体的浓度里,每个酶标抗体稀释度设置一行,每孔100μL,37℃孵育1h;
(5)弃去抗体稀释液,PBST洗板5次,拍干;每孔依次加入底物显色A液和B液各50μL, 37℃恒温反应10~15min;
(6)每孔加入50μL终止液终止反应,酶标仪读取450nm处的吸光值A450,记录结果并分析。
依据阳性A值大于1.0,阴性对照A值最小,P/N值较大的原则,经棋盘滴定,包被抗体的工作浓度为5μg/mL,酶标抗体工作浓度为1:500(见表9)
表9包被抗体和酶标抗体工作浓度的选择
2、MDCK HCP蛋白定量标准曲线线性范围和最低检出限的确定
根据已经确定的双抗体夹心ELISA法的包被抗体和酶标抗体的工作浓度,将MDCK HCP参考品稀释成12个浓度:20μg/mL、10μg/mL、5μg/mL、2.5μg/mL、1.25μg/mL、0.625μg/mL、 0.312μg/mL、0.155μg/mL、0.065μg/mL、0.032μg/mL、0.016μg/mL、0.008μg/mL,建立反应曲线,同时设置阴性对照(碳酸盐缓冲液),做10个复孔。选择线性相关系数R2在0.99以上且阳性A值较大的对应MDCK HCP参考品稀释范围为线性范围,以阴性对照A值(Aneg)的统计均值与2倍标准差之和作为检测界限,确定检测的灵敏度。
将MDCK HCP参考品对倍稀释为20μg/mL~0.008μg/mL,选择包被抗体和酶标抗体到工作浓度,进行检测。以HCP浓度为横坐标,A450值作为纵坐标,建立反应曲线(见图6)。结果发现,MDCK HCP在0.32~5μg/mL范围时,R2在0.99以上,线性相关性很好。当把范围扩大到0.32~10μg/mL后,R2就低于0.99。因此,可以将0.32~5μg/mL定为检测线性范围(见图 7)。
3、检测线性范围的确认
线性范围内,将MDCK HCP参考品对倍稀释成5μg/mL、2.5μg/mL、1.25μg/mL、0.625μg/mL、 0.312μg/mL,做反应曲线线性回归,重复4次,所得拟合的直线的线性相关系数R2为:0.9967、 0.9983、0.9971、0.9939,全部大于0.99,其均值为0.9965。
线性范围内,选取低(1.0μg/mL)、中(2.0μg/mL)和高(4.0μg/mL)三个浓度,以MDCK HCP参考品浓度作为纵坐标,A值作为横坐标,做出线性回归方程,分别对这三个浓度重复检测4次,从结果可以看出,低中高三个浓度的变异系数均小于5%,在线性检测范围内,该方法可以较准确的检测出样品的浓度。
表10.1参考品标准曲线
表10.2线性范围的确认
实施例4:建立的ELISA双抗体夹心法方法学验证
1、精密度----重复性验证
将MDCK HCP参考品稀释成低、中、高(1.0μg/mL、2.0μg/mL、4μg/mL)三个浓度,每个浓度在同一块酶标板内测定4孔,由标准曲线回归方程计算出每个浓度的检测值,分别计算每个浓度的均值、标准差、变异系数和回收率,结果(见表11)显示,三个浓度MDCK HCP 参考品检测值的CV分别为10.94%、4.37%、4.11%,回收率均在90%以上,说明本方法板内精密度和重复性良好。
表11板内精密度和重复性测定
另外,取三块酶标板,同一板内检测低、中、高三种MDCK HCP参考品三次,三块酶标板在三个不同时间段里完成,结果如下(见表12),可以看出低、中、高三个浓度在板间检测的变异系数为11.0%、5.6%、4.37%,均在可接受的范围内,同时,三个浓度的回收率也都在 90%以上,结果说明该方法具有良好的重复性。
表12板间精密度和重复性测定
2、特异性验证
本实验所建立的ELISA法主要用来检测MDCK细胞疫苗生产中的中间产品中宿主细胞蛋白含量,这些中间产品可能含有的除宿主蛋白(HCP)外的其他成分不应产生对本检测的干扰,这些成分主要有:胎牛血清、细胞培养液、BSA、胰酶、流感病毒蛋白、抗流感病毒蛋白-IgG。
因此,以PBST、胎牛血清、细胞培养液、1%BSA、流感病毒蛋白(1:4稀释,2.0ug/ml),抗流感病毒蛋白-IgG、0.25%胰酶、流感疫苗半成品作为样品,每个样品检测5次,计算A450值均值和标准差,判断该检测方法的特异性,结果见下表(表13和图8)。结果可以看到, 1、阴性受检品与阳性对照(抗原参考品)检测结果有显著性差异(P<0.05);2、阳性受检品(流感疫苗半成品)与阳性对照检测结果无显著性差异(P>0.05),结果说明课题建立的检测方法特异性良好,
表13特异性验证
3、适用性验证
按照MDCK细胞基质流感疫苗的制备工艺制备H5N1型流感病毒疫苗半成品4批,连续检测5次,MDCK细胞HCP含量结果如下表(见表14,图9),可以看出疫苗批间检测结果重复性良好,变异系数为6.78%,小于10%。疫苗批间检测结果置信区间为(1318.1±178.96)ng/mL,虽然批间检测结果稍有波动,但是本方法可以很好地适用于MDCK细胞基质流感疫苗的检测。
表14流感疫苗半成品MDCK细胞HCP含量
4、稳定性验证
将低、中、高(1.0μg/mL、2.0μg/mL、4μg/mL)三个浓度的MDCK HCP参考品置于37℃下一周,对三个浓度进行浓度检测,计算每个浓度检出值的平均值、标准差、变异系数和回收率,结果见表15。结果表明,经过37℃加速实验后,MDCK HCP参考品低、中、高三个参考品浓度的回收率与4℃条件下的受检浓度相比,均在±30%范围内,可以接受。因此,可以认为MDCK HCP参考品在4℃环境下保存一年时间是稳定的。
表15MDCK HCP参考品稳定性试验
最后需要说明的是,以上实施例仅帮助本领域技术人员理解本发明的实质,不用做对本发明保护范围的限定。
- 还没有人留言评论。精彩留言会获得点赞!