一种用于分析肠道微生物的引物组及其应用的制作方法
本发明属于分子生物学领域,涉及一种用于分析肠道微生物的引物组及其应用,具体涉及通过一轮pcr构建文库,分析分类肠道微生物的引物组,其组成的检测试剂盒及应用。
背景技术:
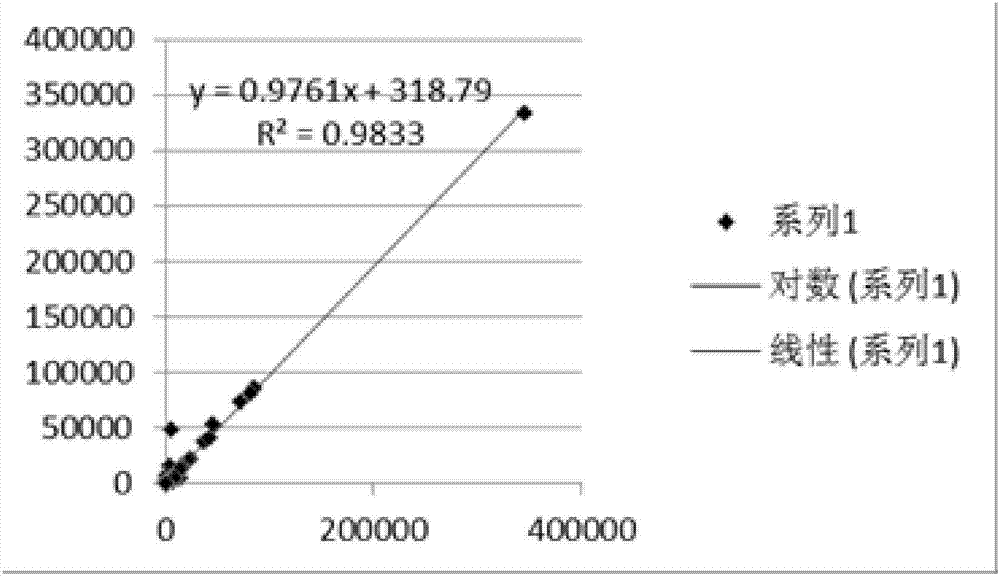
:人体肠道中共生着结构复杂、数量庞大的微生物群,这些微生物通过长期与人类协同进化,已成为维持人类健康不可忽视的重要“功能器官”。越来越多的研究证据表明,肠道菌群失调与肥胖、糖尿病、非酒精性脂肪肝、炎症性肠炎、消化道肿瘤等多种疾病的发生密切相关。因此探寻肠道菌群与疾病发生发展之间的关系对疾病的预防和治疗具有重要的意义。许多经典方法在肠道菌群研究方面一直沿用,如研究菌落特征、菌体形态、生理生化特征、代谢产物等指标,这些传统方法主要是建立在纯培养技术之上的,但是肠道中有很多微生物还无法实现纯培养;可以纯培养的微生物又存在耗时、费力且操作复杂等问题,而且很大程度上受培养条件的制约,这往往造成研究结果的不稳定性,导致不能全面、客观地反映肠道菌群的真实情况。分子生物学技术的快速发展为肠道菌群研究提供了全新的方法和思维,它克服了传统方法的限制,使得科研工作者可以从基因水平估计出种的丰度和均匀度,分清楚种的变异情况,从而客观地认识微生物天然的生态状况。该领域目前对肠道微生物的研究基本上基于16srrna测序或者宏基因测序进行分析。16srrna基因是对原核微生物进行系统分类研究最常用的分子标志物。16srrna位于原核细胞核糖体小亚基上,一般由10个保守区和9个高变区组成,保守区在细菌间差异不大,高变区随亲缘关系不同而存在差异。16srrna被认为是最适用于细菌系统发育和分类鉴定的指标。对16srrna高变区进行测序,可将菌群精确分类到属甚至种的级别。肠道微生物基因扩增子测序正是基于上述16srrna基因的特点,选择1-2个高变区,利用保守区设计通用引物进行pcr扩增,再对高变区进行测序分析和菌种鉴定,而因为16srrna的v3-v4区在细菌和古菌中的覆盖度均较高,所以被认为是16srrna测序最佳选择区域。基于上述问题,如何设计引物,获得肠道微生物高质量、较为完整的基因组dna显得尤为重要,尤其对目前16srrna测序技术进行改进,获得更好质量的测序分析数据是必要的,才能为精准获得更多肠道微生物生物学信息,并为临床预防与治疗提供指导打下基础。技术实现要素:针对现有技术的不足,本发明提供了一种分析肠道微生物的引物组及其应用,本发明引物组采用一步法扩增获得测序文库,其中包含了随机碱基,增加了文库序列的复杂度,简单、快捷、获得质量高的测序文库,以提高肠道微生物组基因组序列捕获效率。第一方面,本发明提供了一种用于分析肠道微生物的引物组,其包含:第一正向引物和第一反向引物;其中,所述第一正向引物从5’到3’端包括依次相连的五个部分:p5接头序列、第一标签序列、第一间隔序列、2bp的随机碱基序列和肠道微生物16srrnav3-v4区特异性正向引物;所述第一反向引物从5’到3’端包括依次相连的五个部分:p7接头序列、第二标签序列、第二间隔序列、2bp的随机碱基序列和肠道微生物16srrnav3-v4区特异性反向引物。本发明中,发明人发现,通过采用一步法扩增获得测序文库,所述引物组包含v3-v4位点特异性简并引物,提高了扩增片段覆盖率、检测特异性及灵敏度,结合数据分析,可获得更丰富的微生物组信息,所述引物组引入2bp的随机碱基,增加了文库序列的复杂度,降低了phix的比例,保证更多测序质量。根据本发明,所述第一正向引物的特异性正向引物的核酸如seqidno.1所示,所述第一反向引物的特异性反向引物的核酸序列如seqidno.2所示,所述seqidno.1-2所示的核酸序列如下:特异性正向引物(seqidno.1):cctacggrrbgcascagkvrvgaat;特异性反向引物(seqidno.2):ggactacnvgggtwtctaatcc;其中,特异性正向引物中的r选自a/g中的任意一个碱基,b选自t/c/g中的任意一个碱基,s选自c/g中的任意一个碱基,k选自t/g中的任意一个碱基,v选自a/c/g中的任意一个碱基;特异性反向引物中的n选自a\g\c\t中的任意一个碱基,v选自a/c/g中的任意一个碱基,w选自a/t中的任意一个碱基。本发明中,所述特异性正向引物通过r、b、s、k和v按不同的排列组合所形成的72种序列,所述特异性正向引物为同时含有这72种所述特异性正向引物的混合物;所述特异性反向引物通过n、v和w按不同的排列组合所形成的24种序列,所述特异性反向引物为同时含有这24种所述特异性反向引物的混合物。优选地,所述p5接头序列如seqidno.3所示,所述p7接头序列如seqidno.4所示,所述seqidno.3-4所示的核酸序列如下:p5接头序列(seqidno.3):aatgatacggcgaccaccgagatctacac;p7接头序列(seqidno.4):caagcagaagacggcatacgagat.根据本发明,所述第一标签序列为p5标签序列,其核酸序列如seqidno.5-14所示,所述核酸序列如下:序列接头名称seqidno.5ctctctats502seqidno.6tatcctcts503seqidno.7gtaaggags505seqidno.8actgcatas506seqidno.9aaggagtas507seqidno.10ctaagccts508seqidno.11cgtctaats510seqidno.12tctctccgs511seqidno.13tcgactags513seqidno.14ttctagcts515根据本发明,所述第二标签序列为p7标签序列,其核酸序列如seqidno.15-24所示,所述核酸序列如下:本发明中,所述引物组还通过引入双index(标签)的设计,可以更大程度地混合更多的样本。根据本发明,所述第一间隔序列如seqidno.25所示,所述第二间隔序列如seqidno.26所示,所述seqidno.25-26所示的核酸序列如下:第一间隔序列(seqidno.25):tatggtaatt;第二间隔序列(seqidno.26):agtcagccag;本发明中,所述引物组还包括间隔序列,所述间隔序列可以改善长引物扩增问增问题,减少二级结构等的产生。根据本发明,所述引物组包含2bp的随机碱基nn,所述n可以任意的选自a\t\g\c中的任意一个碱基,所述随机碱基增加了文库序列的复杂度,降低了phix的比例,保证更多测序质量。本发明中,所述第一正向引物通过p5接头+第一标签序列+第一间隔序列+nn+肠道微生物16srrnav3-v4区特异性正向引物的序列组合得到,具体为:aatgatacggcgaccaccgagatctacactct-[i5]-tatggtaattnncctacggrrbgcascagkvrvgaat,其中,i5为p5标签序列,n为a\t\g\c中的任意一个碱基,r选自a/g中的任意一个碱基,b选自t/c/g中的任意一个碱基,s选自c/g中的任意一个碱基,k选自t/g中的任意一个碱基,v选自a/c/g中的任意一个碱基;所述第二反向引物通过p7接头+第二标签序列+第二间隔序列+nn+肠道微生物16srrnav3-v4区特异性反向引物的序列组合得到,具体为:caagcagaagacggcatacgagat-[i7]-agtcagccagnnggactacnvgggtwtctaatcc,其中,i7为p7标签序列,n为a\t\g\c中的任意一个碱基,v选自a/c/g中的任意一个碱基,w选自a/t中的任意一个碱基。第二方面,本发明提供一种分析肠道微生物的试剂盒,其包括如第一方面所述的引物组合物。第三方面,本发明提供一种肠道微生物的分析方法,采用如第一方面所述的引物组合物,包括如下步骤:(1)样本基因组dna的提取;(2)扩增子文库的构建:采用如权利要求1或2所述的引物组,进行一轮pcr扩增,构建高通量测序文库;(3)数据分析。根据本发明,所述样本来源于粪便、土壤、尿液或口腔细胞中的任意一种或至少两种的组合,优选为来源于粪便。本发明,步骤(1)所述样本基因组dna的提取的方法为常规的dna提取方法,本领域技术人员可以根据需要进行选择,在此不作特殊限定。根据本发明,步骤(2)所述第一轮pcr的条件为:93-96℃预变性1-5min;93-96℃预变性20-40s,55-65℃20-40s,70-75℃20-40s,共进行25-35个循环;70-75℃延伸3-6min。优选地,步骤(2)所述第一轮pcr的条件为:95℃预变性3min;95℃预变性30s,62℃30s,72℃30s,共进行28个循环;72℃延伸5min。根据本发明,步骤(1)之后还包括纯化的步骤,优选采用磁珠进行纯化。根据本发明,所述磁珠与扩增产物的体积比为(0.4-0.7):1,例如可以是0.4:1、0.5:1、0.6:1或0.7:1,优选为0.5:1。根据本发明,步骤(3)所述数据分析为采用illuminamiseq测序仪进行测序分析。根据本发明,所述测序分析具体包括如下步骤:通过illuminamiseq测序仪测序得到按照标签区分的测序读长,利用读长的重叠关系组装得到高可变区v3-v4的全长序列,再对全长序列进行分类分析,得到所述微生物群体的分类。根据本发明,所述全长序列进行分类分析具体包括计算全长序列差异度,根据序列差异度执行操作分类学单元otu的分类,将全长序列分配到otu中,再将每一个otu分类中的全长序列比对到16srrna的v6数据库中,将比对结果根据众数原则对otu进行物种注释。优选地,将序列差异度在3%以内的全长序列分配到一个otu中。本发明中,将比对结果根据众数原则对otu进行物种注释是指如果一个otu中66%以上的比对结果均为同一个物种,则将该otu注释为该物种;如果未达到该比例,则将物种分类信息上移一个水平(例如从“种”上移到“属”,或从“属”继续上移到“科”)再进行统计,直到达到66%的比例标准为止。第四方面,本发明提供一种如第一方面所述的引物组、如第二方面所述的试剂盒或如第三方面所述的分析方法用于分析分类肠道微生物。第五方面,本发明提供一种如第三方面所述的分析方法用于免疫组学分析。第六方面,本发明提供一种如第一方面所述的引物组和/或如第二方面所述的试剂盒用于制备癌症的诊断试剂。优选地,所述癌症选自但不限于肠癌、腺癌或膀胱癌中的任意一种或至少两种的组合。与现有技术相比,本发明具有如下有益效果:(1)本发明中,通过采用一步法扩增获得测序文库,所述引物组可以更大程度地混合更多的样本,提高了扩增片段覆盖率、检测特异性及灵敏度,改善长引物扩增问题,减少二级结构等的产生,降低了pcr扩增偏好性,结合数据分析,可获得更丰富的微生物组信息,增加了文库序列的复杂度,降低了phix的比例,保证更多测序质量;(2)本发明提供的数据处理分析方法,实现更多微生物物种在分类学属、种上的鉴别及多样性分析,并得到相关微生物群体的相对丰度值;(3)本发明方法对肠道微生物进行测序及数据分析,实现了更多物种在分类学属甚至种上的鉴别,即获得更多肠道微生物生物学信息,对微生物的生物学信息提取准确可靠,可为免疫组学研究以及临床用药上提供一定指导意义。附图说明图1为本发明实施例中样本a数据分析后相关性分析的结果图;图2为本发明实施例中样本b数据分析后相关性分析的结果图;图3为本发明实施例中样本c数据分析后相关性分析的结果图;图4为本发明实施例中标准品中每个菌种含量柱状图,其中,bacillussubtilis为枯草芽孢杆菌,enterococcusfaecalis为粪肠球菌,escherichiacoli为大肠杆菌,lactobacillusfermentum为发酵乳杆菌,listeriamonocytogenes为单核细胞增多性李司忒氏菌,pseudomonasaeruginosa为绿浓杆菌,salmonellaenterica为肠道沙门式菌,staphylococcusaureus为金黄色葡萄球菌,propionibacteriumacnes为痤疮病酸杆菌;图5为本发明实施例中菌种的堆积图,其中,bacillussubtilis为枯草芽孢杆菌,enterococcusfaecalis为粪肠球菌,escherichiacoli为大肠杆菌,lactobacillusfermentum为发酵乳杆菌,listeriamonocytogenes为单核细胞增多性李司忒氏菌,pseudomonasaeruginosa为绿浓杆菌,salmonellaenterica为肠道沙门式菌,staphylococcusaureus为金黄色葡萄球菌,propionibacteriumacnes为痤疮病酸杆菌;图6为本发明实施例中样品的菌种含量柱状图,其中,bacillussubtilis为枯草芽孢杆菌,enterococcusfaecalis为粪肠球菌,escherichiacoli为大肠杆菌,lactobacillusfermentum为发酵乳杆菌,listeriamonocytogenes为单核细胞增多性李司忒氏菌,pseudomonasaeruginosa为绿浓杆菌,salmonellaenterica为肠道沙门式菌,staphylococcusaureus为金黄色葡萄球菌,propionibacteriumacnes为痤疮病酸杆菌。具体实施方式下面结合附图和实施例对本发明作进一步的详细说明。可以理解的是,此处所描述的具体实施例仅仅用于解释本发明,而非对本发明的限定。另外还需要说明的是,为了便于描述,附图中仅示出了与本发明相关的部分而非全部结构。材料与试剂:缓冲液a:0.5mtris-cl缓冲液(ph8.0),1.0mnacl;裂解液b:1mtris-cl缓冲液(ph8.0),0.2medta,10%sds,12%tween-40;悬浮液c:30mg/mlrnaasea;去除剂d:1.0mal2(so4)3,250g/lctab,1.5mnacl;结合液e:0.5mtris-cl缓冲液(ph8.0),5m异硫腈酸胍;漂洗液f:5mtris-cl缓冲液(ph8.0),25%(体积比)无水乙醇;洗脱液g:无菌去离子水。实施例1检测试剂盒的制备(1)引物组的制备所述引物组包括第一正向引物和第二反向引物,其核酸序列如下:第一正向引物:aatgatacggcgaccaccgagatctacactct-[i5]-tatggtaattnncctacggrrbgcascagkvrvgaat;其中,i5为p5标签序列,n为a\t\g\c中的任意一个碱基,r选自a/g中的任意一个碱基,b选自t/c/g中的任意一个碱基,s选自c/g中的任意一个碱基,k选自t/g中的任意一个碱基,v选自a/c/g中的任意一个碱基;第一反向引物:caagcagaagacggcatacgagat-[i7]-agtcagccagnnggactacnvgggtwtctaatcc;其中,i7为p7标签序列,n为a\t\g\c中的任意一个碱基,v选自a/c/g中的任意一个碱基,w选自a/t中的任意一个碱基。所述第一标签序列为p5标签序列,其核酸序列如seqidno.5-14所示,所述核酸序列如下:所述第二标签序列为p7标签序列,其核酸序列如seqidno.15-24所示,所述核酸序列如下:序列接头名称seqidno.15tcgccttan701seqidno.16ctagtacgn702seqidno.17ttctgcctn703seqidno.18gctcaggan704seqidno.19aggagtccn705seqidno.20catgcctan706seqidno.21gtagagagn707seqidno.22cagcctcgn710seqidno.23tgcctcttn711seqidno.24tcctctacn712(2)试剂盒的组装将所述引物组合物和检测探针与试剂盒相关的试剂进行组装,制备成所述检测试剂盒。实施例2样本dna的提取选取3个粪便样本:a、b、c,平均分成2份,标记为:a1/a2,b1/b2,c1/c2,a1、b1、c1三个样本用本专利说明的方法处理并获得数据,a2、b2、c2三个样本直接送去金唯智公司处理,具体的dna提取方法包括如下步骤:(1)取700~800μl缓冲液a和250mg玻璃珠至2ml离心管中;(2)在上述2ml离心管中加入200mg样本,涡旋混匀10-30s;(3)向样本中加入50μl裂解液b,涡旋振荡10min混匀样本,12,000rpm(~13,400×g),离心30s,转移上清液(400μl)至新的2ml离心管;(4)加入200μl悬浮液c,涡旋振荡10s,室温放置2min,12,000rpm(~13,400×g),离心60s,沉淀样本颗粒;(5)转移上清至新的2ml离心管,加入300μl去除剂d混匀,4℃放置5min;(6)12,000rpm(~13,400×g),离心60s,转移上清液至新的2ml离心管,加入1000μl结合液e颠倒混匀;(7)取上一步所得溶液600μl加入到一个吸附柱中(吸附柱放入收集管中),12,000rpm(~13,400×g),离心60s,倒掉废液,将吸附柱放入收集管中;(8)向吸附柱中,加入600μl漂洗液f,12,000rpm(~13,400×g),离心60s,倒掉废液,将吸附柱放入收集管中;(9)向吸附柱中,加入600μl75%无水乙醇,12,000rpm(~13,400×g),离心30s,倒掉废液,将吸附柱放入收集管中;(10)将吸附柱放回空收集管中,12,000rpm(~13,400×g),离心30s,尽量除去漂洗液,以免漂洗液中残留乙醇抑制下游反应;(11)取出吸附柱,放入一个干净的离心管中,在吸附膜的中间部位加200μl洗脱液g(洗脱液可事先在60~70℃水浴中预热),室温放置2min,12,000rpm(~13,400×g),离心60s,将得到的溶液重新加入离心吸附柱中,室温放置2min,12,000rpm(~13,400×g),离心3min;(12)使用琼脂糖凝胶电泳,检测基因组dna的完整性、浓度和污染情况;(13)使用分光光度计或qubit对样品进行精确定量,dna可以存放在0~10℃,如果要长时间存放,可以放置在-20℃。实施例3文库构建(1)在冰上配制以下反应液,除dna提取液和h2o以外,依照如下组份先按反应数+α的量配制扩增预混mix,取配制好的预混mix分装到pcr反应管中,引物序列如下:上游引物(seqidno.27):aatgatacggcgaccaccgagatctacactct-tatcctct-tatggtaattagcctacgggacgcagcagtcgggaat;下游引物(seqidno.28):caagcagaagacggcatacgagat-ttctgcct-agtcagccagtgggactacacgggtatctaatcc;具体反应体系如下:试剂使用量2×pcr混合液(mg2+,dntps)12.5μl上游引物(1μm)5μl下游引物(1μm)5μl样本dna5ng/μl(或者ddh2o)2.5μltotal25μl设置一组以水为样本的阴性对照。反应条件如下:(2)第一轮pcr产物的纯化使用agencourtampurexp(beckmancoulter公司)对第一轮pcr扩增产物进行纯化,具体步骤如下:1)4℃冰箱取出,室温放置25min,将agencourtampurexp磁珠充分打散,混匀;2)扩增产物与agencourtampurexp磁珠的结合,所述扩增产物与agencourtampurexp磁珠的体积比为2:1;3)充分混匀,室温孵育15min,瞬离,磁力架上静置5min,去除上清液;4)第一次清洗:反应管放置在磁力架上不动,加入200μl新配的80%的乙醇室温静置(>30s),去除80%的乙醇;5)第二次清洗:重复一次上述4)第一次清洗操作,轻轻离心,去除残留80%的乙醇;6)磁珠的干燥:室温干燥1min;7)洗脱:加入30μl的洗脱液,轻轻地上下吸打,充分混匀,室温孵育15min,瞬离,磁力架上静置5min,回收上清液;(3)片段大小确定;琼脂糖电泳确定扩增是否准确,扩增产物长度约600bp。对比例1两步法建库分析将a2、b2、c2三个样本直接送去金唯智公司处理,采用传统的两步法进行建库,并得到如下结果:扩增产物长度约600bp,将建好的文库用illumina公司的miseq测序进行测序,测序采用pe300测序。实施例4数据分析(1)对测序得到的原始数据进行质控:通过barcode和引物等信息筛选出高质量的数据,筛选标准如下:含有完整的序列;具有完整前引物序列;去除barcode、引物、接头,序列长度必须大于400bp,不含有模糊碱基;不能存在超过20个的单碱基重复,将得到的序列根据信息分别与各个样品相对应;(2)通过数据库比对工具进行比对,将序列聚类生成out;(3)将得到的otu表,按照a1/a2,b1/b2,c1/c2进行相关性分析,结果如图1-3所示。从图1可以看出,样本a,分成两份后,分别用实施例3方法和对比例1的方法建库测序,得到的数据分析后进行相关性分析发现,两种方法得到的out相关性达到0.9671;从图2可以看出,样本b,分成两份后,分别用实施例3方法和对比例1的方法建库测序,得到的数据分析后进行相关性分析发现,两种方法得到的out相关性达到0.9833;从图3可以看出,样本c,分成两份后,分别用实施例3方法和对比例1的方法建库测序,得到的数据分析后进行相关性分析发现,两种方法得到的out相关性达到0.9861。实施例5分析验证以美国zymo公司的微生物混合标准品“zymobiomicstmmicrobialcommunitystandard”为模板,用本专利所述的方法提取建库,测序获得dna序列信息,与标准品的含量进行比对,具体试验方法同实施例2-实施例4,结果如图4-6和表1所示。表1从图4-6可以看出,图4说明了,以美国zymo公司的微生物混合标准品“zymobiomicstmmicrobialcommunitystandard”为模板,用本申请所述的方法构建的3个文库(d1,d2,d3),测序分析对比后,标准品中8个细菌全部检测出,并且每个细菌的比例与标准品说明的比例基本一致;图5说明了,以美国zymo公司的微生物混合标准品“zymobiomicstmmicrobialcommunitystandard”为模板,用本申请所述的方法构建的3个文库(d1,d2,d3),测序分析对比后,3个文库都检测出了8种细菌,并且这八种细菌的种类和比例基本一致;图6说明了,以美国zymo公司的微生物混合标准品“zymobiomicstmmicrobialcommunitystandard”为模板,用本申请所述的方法构建的3个文库(d1,d2,d3),测序分析对比后,3个文库都检测出了8种细菌,并且这八种细菌的种类和比例基本一致;可见,本发明方法测得的样品与标准品的结果相近,本发明方法具有一致性。从表1可以看出,以美国zymo公司的微生物混合标准品“zymobiomicstmmicrobialcommunitystandard”为模板,用本专利所述的方法构建的3个文库(d1,d2,d3),测序分析对比后,标准品9个细菌中8种全部检测出,并且每个细菌的比例与标准品说明的比例基本一致,只有propionibacteriumacnes(痤疮病酸杆菌)由于在标准品中含量非常低,没有检出,可见,d1、d2和d3的结果与标准品相近,可见本申请方法检测准确。综上所述,本发明中,通过采用一步法扩增获得测序文库,所述引物组可以更大程度地混合更多的样本,提高了扩增片段覆盖率、检测特异性及灵敏度,改善长引物扩增问题,减少二级结构等的产生,降低了pcr扩增偏好性,结合数据分析,可获得更丰富的微生物组信息,增加了文库序列的复杂度,降低了phix的比例,保证更多测序质量。注意,上述仅为本发明的较佳实施例及所运用技术原理。本领域技术人员会理解,本发明不限于这里所述的特定实施例,对本领域技术人员来说能够进行各种明显的变化、重新调整和替代而不会脱离本发明的保护范围。因此,虽然通过以上实施例对本发明进行了较为详细的说明,但是本发明不仅仅限于以上实施例,在不脱离本发明构思的情况下,还可以包括更多其他等效实施例,而本发明的范围由所附的权利要求范围决定。序列表<110>苏州普瑞森基因科技有限公司<120>一种用于分析肠道微生物的引物组及其应用<130>2017<141>2017-12-29<160>28<170>siposequencelisting1.0<210>1<211>25<212>dna<213>人工合成序列()<400>1cctacggrrbgcascagkvrvgaat25<210>2<211>22<212>dna<213>人工合成序列()<220><221>misc_feature<222>(8)..(8)<223>nisa,c,g,ort<400>2ggactacnvgggtwtctaatcc22<210>3<211>29<212>dna<213>人工合成序列()<400>3aatgatacggcgaccaccgagatctacac29<210>4<211>24<212>dna<213>人工合成序列()<400>4caagcagaagacggcatacgagat24<210>5<211>8<212>dna<213>人工合成序列()<400>5ctctctat8<210>6<211>8<212>dna<213>人工合成序列()<400>6tatcctct8<210>7<211>8<212>dna<213>人工合成序列()<400>7gtaaggag8<210>8<211>8<212>dna<213>人工合成序列()<400>8actgcata8<210>9<211>8<212>dna<213>人工合成序列()<400>9aaggagta8<210>10<211>8<212>dna<213>人工合成序列()<400>10ctaagcct8<210>11<211>8<212>dna<213>人工合成序列()<400>11cgtctaat8<210>12<211>8<212>dna<213>人工合成序列()<400>12tctctccg8<210>13<211>8<212>dna<213>人工合成序列()<400>13tcgactag8<210>14<211>8<212>dna<213>人工合成序列()<400>14ttctagct8<210>15<211>8<212>dna<213>人工合成序列()<400>15tcgcctta8<210>16<211>8<212>dna<213>人工合成序列()<400>16ctagtacg8<210>17<211>8<212>dna<213>人工合成序列()<400>17ttctgcct8<210>18<211>8<212>dna<213>人工合成序列()<400>18gctcagga8<210>19<211>8<212>dna<213>人工合成序列()<400>19aggagtcc8<210>20<211>8<212>dna<213>人工合成序列()<400>20catgccta8<210>21<211>8<212>dna<213>人工合成序列()<400>21gtagagag8<210>22<211>8<212>dna<213>人工合成序列()<400>22cagcctcg8<210>23<211>8<212>dna<213>人工合成序列()<400>23tgcctctt8<210>24<211>8<212>dna<213>人工合成序列()<400>24tcctctac8<210>25<211>10<212>dna<213>人工合成序列()<400>25tatggtaatt10<210>26<211>10<212>dna<213>人工合成序列()<400>26agtcagccag10<210>27<211>77<212>dna<213>人工合成序列()<400>27aatgatacggcgaccaccgagatctacactcttatcctcttatggtaattagcctacggg60acgcagcagtcgggaat77<210>28<211>66<212>dna<213>人工合成序列()<400>28caagcagaagacggcatacgagatttctgcctagtcagccagtgggactacacgggtatc60taatcc66当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1