包含过氧蛋白的无血清培养基添加剂组合物及其用途的制作方法
本发明涉及包含过氧蛋白(peroxidasin)的用于无血清细胞培养的培养基添加剂组合物,以及使用所述培养基添加剂组合物进行无血清细胞培养的方法。
背景技术:
干细胞是具有能够分化为动物的内胚层细胞、中胚层细胞和外胚层细胞的多能性,或具有能够分化为组织中或在功能上紧密相关的细胞的多潜能性的细胞。干细胞包括胚胎干细胞、成体干细胞和诱导性多能干细胞等。
干细胞已经被应用于各种临床试验中,例如人间充质干细胞(成体干细胞之一,没有胚胎干细胞的一般问题如致癌作用或伦理问题)已经被用作细胞治疗剂,用于通过在体外培养再生心血管系统、神经系统和肌肉骨骼系统中的受损组织,或用于减少同源免疫应答或促进造血细胞移植的目的。
由于从组织获得的干细胞的数目非常少,因此有必要在体外稳定地培养干细胞并进行扩增,用于干细胞的各种临床应用。
此外,用于药物的激素、酶、细胞因子或治疗性抗体大多数为重组糖蛋白。由于糖蛋白在从原核生物生产时其功能活性丢失,因此在复杂的真核生物如动物细胞(例如,CHO细胞、BHK细胞、NS0细胞等)中生产糖蛋白。因此,在体外稳定地培养细胞的技术在大量培养动物细胞,用于生产生物药物如重组蛋白或基因治疗剂中也是必要的。
传统地,当在体外培养干细胞或动物细胞时,使用了包含非人动物来源的血清如胎牛血清的培养基。血清作为促进细胞生长或增殖的营养素源或作为生物活性物质源如激素被添加至培养基中。然而,血清使得培养基的价格增加,原因是:血清的高昂价格和由于血清组分的复杂性引起在蛋白质纯化方面的难题以及由于在每个生产工艺中的组分不同使得实验中产生的结果不同。此外,由于动物血清具有由各种病原体如微生物、病毒或朊病毒引起的相对高的感染风险并且可以引起不适当的免疫应答,因此已经指出动物血清的安全性问题。
因此,已经开发了在没有非人动物来源的血清的情况下培养细胞的技术。例如,在用于自体移植的细胞培养的情况下,可以通过使用得自同一患者的自体人血清来避免细胞污染,然而,存在的问题是血清生产需要大量的血液。此外,已经开发了不含血清的无血清培养基或包含较少血清的低血清培养基,然而存在以下问题:这样的培养基仅允许特异性细胞良好地生长;替代血清的细胞生长因子太昂贵;细胞生长和产物生产比含有血清的培养基更加不稳定。
此外,在用作细胞治疗剂的干细胞的情况下,从患者得到的干细胞在体外培养,并再注入到患者体内。因为必须保证这种用于人体的培养过程的安全性,因此可以替代动物血清的血清替代物的发现在商业上是非常有意义的。
另一方面,过氧蛋白首次在果蝇属(Drosophila)中被发现,暗示过氧蛋白在果蝇属血细胞中的基质形成和固结中发挥重要作用(Nelson,Fessler等人,1994)。果蝇属的过氧蛋白由1512个氨基酸残基组成并且已知形成三聚体。人的过氧蛋白分子由1479个氨基酸组成并携带数个含有富亮氨酸重复序列(LRR)、免疫球蛋白C2(IgC2)型结构域和血管性血友病因子C型(vWC)的ECM基序,以及过氧化物酶结构域。
然而,至今尚不知道促进细胞在不含血清的培养基中增殖和存活的过氧蛋白的功能。
技术实现要素:
技术问题
本发明提供了过氧蛋白作为培养基添加剂,不仅用于动物血清的替代物而且还促进细胞增殖和存活的用途。
一方面,提供了一种用于无血清细胞培养的培养基添加剂组合物,该培养基添加剂组合物包含过氧蛋白。
另一方面,提供了一种用于无血清细胞培养的培养基,该培养基包含上述培养基添加剂组合物。
其他方面,提供了一种无血清细胞培养的方法,该方法包括在上述培养基中培养细胞的步骤。
技术方案
为了实现上述目的,一方面,本发明涉及一种用于无血清细胞培养的培养基添加剂组合物,该培养基添加剂组合物包含过氧蛋白。
另一方面,本发明涉及一种用于无血清细胞培养的培养基,该培养基包含上述培养基添加剂组合物。
其他方面,本发明涉及一种无血清细胞培养的方法,该方法包括在上述培养基中培养细胞的步骤。
在下文中,将对本发明进行更详细的描述。
本文所用的术语“无血清培养”是指培养基完全不含或基本上不含来自人或非人动物的血清的细胞培养。本文所用的短语“基本上不含来自动物的血清”可以是指包含低于通常添加到培养基中的量的水平或基本上不影响细胞增殖或存活的量的来自动物的血清。例如,“基本上不含来自动物的血清”可以是指培养基中包含5%或更低、4%或更低、3%或更低、2%或更低、1%或更低、0.5%或更低,或0.1%或更低的来自动物的血清。
在本发明中,对用于无血清培养的基本培养基没有特别限制。例如,可以使用本领域中众所周知的用于动物细胞的基本培养基。在一种实施方式中,可以例示以下培养基:DMEM(达尔伯克改良伊格尔培养基(Dulbecco′s Modified Eagle′s Medium))、MEM(最小必需培养基)、IMDM(Iscove改良达尔伯克培养基(Iscove′s Modified Dulbecco′s Medium))、α-MEM(α-最小必需培养基)、M199(199培养基)、RPMI(洛斯维·帕克纪念研究所(Roswell Park Memorial Institute))1640、BME(基本伊格培养基)、GMEM(Glasgow最小必需培养基)、EGM2(内皮细胞生长培养基2)-MV、Ham′s F-12、Ham′s F-10、E199、MCDB、Leibovitz L-15或Williams E培养基(Williams Medium E),但不限于此。可以单独或组合使用基础培养基。
在本发明中,可以使用衍生自任何生物体的过氧蛋白,只要所述过氧蛋白在无血清培养中具有促进细胞增殖或存活的活性。优选地,可以使用衍生自人的过氧蛋白。过氧蛋白的序列信息通过公共数据库可得到。例如,人过氧蛋白基因的核苷酸序列用基因库登记号NM_012293.1可得到,人过氧蛋白的氨基酸序列用基因库登记号NP_036425.1可得到。
即使改变过氧蛋白的一些序列,只要过氧蛋白保持无血清培养中促进细胞增殖或存活,则该过氧蛋白仍包括在本发明中。与没有序列改变的参比蛋白质相比,序列变异可以包括:与参比蛋白质例如野生型蛋白质相比,表现出类似或同等生物活性的蛋白质的氨基酸的置换、缺失、添加和/或插入。在这方面,如本文所使用的“序列同源性”是指与野生型蛋白质或参比蛋白质的氨基酸序列或核苷酸序列的相似性。本发明可以包括与野生型蛋白质具有同等生物活性的蛋白质,同时该蛋白质与野生型过氧蛋白具有至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少98%或至少99%的相同氨基酸序列。同源蛋白质可以包括与靶蛋白相同的活性结构域。该同源性比较可以通过肉眼或容易买到的比较程序进行。市场上的计算机程序可以计算至少两(2)个序列之间的同源性百分比(%),并且可以计算相邻序列的同源性(%)。可以使用本领域中已知的方法来进行用于比较的序列比对方法,所述已知的方法例如包括GAP、BESTFIT、BLAST、FASTA和TFASTA。
本领域中已知不改变整体活性的蛋白质和肽的氨基酸置换。例如一般发生的置换可以为但不限于氨基酸残基Ala/Ser、Val/Ile、Asp/Glu、Thr/Ser、Ala/Gly、Ala/Thr、Ser/Asn、Ala/Val、Ser/Gly、Thr/Phe、Ala/Pro、Lys/Arg、Asp/Asn、Leu/Ile、Leu/Val、Ala/Glu或Asp/Gly之间的置换。
根据情况,可以在保持总体分子活性的范围内对过氧蛋白进行修饰,如磷酸化、硫酸化、丙烯酰化、糖基化、甲基化或法尼基化。此外,本发明可以包括对热或pH的结构稳定性或活性通过氨基酸序列的改变或修饰增加的蛋白变体。
在本发明中,可以通过各种方法获得过氧蛋白。例如,可以通过采用本领域中众所周知的方法从自然界中提取和纯化来获得过氧蛋白。供选择地,过氧蛋白可以作为经化学合成的合成蛋白或通过基因重组技术获得的重组蛋白来获得。在使用化学合成法合成蛋白的情况下,可以通过本领域中众所周知的多肽合成方法来获得过氧蛋白。在基因重组技术的情况下,可以通过以下步骤获得过氧蛋白:将编码过氧蛋白的核酸插入到适当的表达载体中,将所述载体引入宿主细胞,培养所述宿主细胞以表达靶蛋白,以及从所述宿主细胞中收集过氧蛋白。所述蛋白在选择的宿主细胞中表达之后,传统地可以采用常规生物化学分离技术来高纯度地分离蛋白质,例如用蛋白沉淀剂(盐析法)处理、离心、超声处理、超滤、透析或各种色谱技术,如分子筛色谱(凝胶过滤)、吸附色谱、离子交换色谱、亲和色谱以及它们的组合。编码过氧蛋白的基因可以分离、通过标准分子生物学技术如化学合成法或重组法合成或经商购获得。
在本发明中,培养基添加剂组合物或培养基组合物可以包括:含有过氧蛋白编码基因的重组载体、用上述载体转化的细胞、细胞的培养物或纯化的过氧蛋白。
重组载体可以可操作地连接到可以用于在宿主体内选择性表达的转录和翻译调节序列以增加插入基因的表达水平。重组载体是包括可操作地连接到基因插入物的关键调控元件的基因构建物,该基因构建物可以通过标准重组DNA技术制备。重组载体的种类没有特别限制,只要重组载体在各种宿主细胞内如在原核细胞和真核细胞内表达靶基因和生产靶蛋白中起作用。然而,能够大量生产类似于天然形式的外源蛋白的载体优选地具有高表达活性,并且包括显示较强活性的启动子。优选地,重组载体至少包括启动子、起始密码子、编码靶蛋白的基因、终止密码子和终止子。此外,重组载体可以包括编码信号肽的DNA、增强子序列、靶基因的5’和3’端的非翻译区(UTR)、选择性标记区域或复制子。
将重组载体引入细胞的方法可以为但不限于本领域中已知的常规方法,例如磷酸钙法、氯化钙/氯化铷法、电穿孔、电注射、热激和化学处理法如PEG、基因枪、逆转录病毒感染、显微注射、DEAE-右旋糖酐和阳离子脂质体。
原核细胞或真核细胞可以用作引入重组载体并表达过氧蛋白的细胞。可以使用具有高效率地引入DNA并且引入的DNA具有高表达效率的细胞。为了适合地进行细胞生长和大量生产过氧蛋白,可以在适当控制的条件(如培养基的温度、pH和培养时间)下来培养表达过氧蛋白的细胞。在一种实施方式中,可以通过使用IPTG(异丙基-β-D-硫代半乳糖吡喃糖苷)作为细胞培养中的诱导因子来诱导过氧蛋白的表达,可以将诱导时间调节至使蛋白的量最大化。可以在细胞破碎之后,通过上述常规生物化学分离技术来分离和纯化表达的过氧蛋白。
在本发明中,培养基添加剂组合物或培养基组合物也可以包含细胞的培养物,该细胞为向其中引入包括过氧蛋白的重组载体的细胞。培养物可以是包含引入过氧蛋白的细胞的培养物或去除细胞的条件培养基,以及包含由细胞分泌的过氧蛋白的培养物。
在本发明中,培养基添加剂组合物或培养基组合物可以还包含与过氧蛋白一起的生长因子。生长因子可以为但不限于选自由以下组成的组中的至少一种:例如,成纤维细胞生长因子(FGF)、碱性成纤维细胞生长因子(bFGF)、血管内皮生长因子(VEGF)、表皮生长因子(EGF)、结缔组织生长因子(CTGF)、胰岛素样生长因子(IGF)、转化生长因子(TGF)、神经生长因子(NGF)、肝细胞生长因子(HGF)、血小板源性生长因子(PDGF)、骨源性生长因子(BDGF)、干细胞因子、白血病抑制因子(LIF)、脑源性神经营养因子(BDNF)、胶质细胞源性神经营养因子(GDNF)、激活素A、头蛋白(Noggin)、骨形态发生蛋白2(BMP2)、骨形态发生蛋白4(BMP4)、血管生成素-1、音猬因子(sonic hedgehog,SHH)、Wnt、FLT-3配体(FMS相关酪氨酸激酶3配体)和集落刺激因子(CSF)。
干细胞或祖细胞可以例示为可以在本发明的培养基中培养的细胞,但不限于此。干细胞包括胚胎干细胞、成体干细胞和诱导性多能干细胞。
成体干细胞是指在整个成体内,甚至在胚胎发育之后发现的未分化的干细胞。成体干细胞具有根据周围组织的特性使细胞自身分化的位点特异性分化能力。成体干细胞可以来源于各种成体细胞,如骨髓、血液、脑、皮肤、脂肪、骨骼肌、脐带和脐带血。具体地,成体干细胞的实例包括但不限于:间充质干细胞、骨骼肌干细胞、造血干细胞、神经干细胞、肝脏干细胞、脂肪来源的干细胞、脂肪来源的祖细胞和血管内皮祖细胞。
诱导性多能细胞,也称为iPSC或重编程干细胞,是一种多能干细胞如胚胎干细胞,所述多能干细胞能够通过以下方式产生:在将4种类型的特异性重编程诱导基因引入到非多能性成体的体细胞如皮肤细胞之后表达该4种类型的特异性重编程诱导基因,或布置从将4种类型的特异性基因引入体细胞的细胞中提取的重编程诱导蛋白。诱导性多能细胞可以替代被疾病如帕金森病或I型糖尿病损伤的细胞。诱导性多能干细胞用于:采用诱导性多能干细胞进行干细胞治疗,以及疾病模型的细胞基研究和通过在体外使由患者的体细胞产生的诱导性多能细胞分化来研究各种疾病的进展来开发新药。
祖细胞是转变为特定形式和功能之前的细胞,并且能够分化为特定细胞系或特定类型的组织。祖细胞是指具有自我更新但分化潜能非常有限的细胞。内胚层前体细胞、中胚层前体细胞和外胚层前体细胞均包括在祖细胞中。
动物细胞是来源于动物(包括人)的功能和结构的基本单位。本发明的动物细胞可以包括来源于动物(包括人)的任何细胞。在本发明中,动物细胞的实例可以为但不限于:上皮细胞、内皮细胞、肌肉细胞、生殖细胞、皮肤细胞(例如,成纤维细胞、角质细胞)、免疫细胞或癌细胞。具体地,动物细胞可以例示为但不限于CHO(中国仓鼠卵巢)细胞、NS0(小鼠骨髓瘤)细胞、BHK(幼仓鼠肾)细胞、Sp2/0(小鼠骨髓瘤)细胞、人视网膜细胞、HUVEC细胞、HMVEC细胞、COS-1细胞、COS-7细胞、HeLa细胞、HepG-2细胞、HL-60细胞、IM-9细胞、Jurkat细胞、MCF-7细胞或T98G细胞。
能够在本发明的培养基中培养的细胞包括原代细胞。原代细胞是从个体的器官或组织中分离后直接在培养皿中培养的细胞。一般地,大多数细胞贴附于培养皿生长。细胞连续生长并在培养皿的底部形成单层,当不再有空间供细胞贴附时,细胞生长停止,其中原代细胞的培养称为原代培养。在培养原代细胞的情况下,主要使用了原代细胞培养基,原因是通过使用基本培养基不能获得希望的细胞生长效果。由于原代细胞培养基的高成本负担,原代细胞培养基由于进口依赖性而比基本培养基贵9倍,目前使用的培养基具有研究和实验进展不顺利的许多限制。因此,使用本发明的培养基添加剂组合物和培养基组合物的无血清培养可以使原代细胞的培养更便宜且更有效。
针对培养各种细胞考虑的培养方法可以为本领域中众所周知用于培养各种细胞的培养方法。
发明效果
本发明提供了可以培养细胞并使细胞在无血清培养体系中增殖的培养基添加剂,使用所述培养基添加剂进行的细胞的无血清培养,没有动物血清的全球供应缺乏以及与从胎牛收集血清相关的伦理问题。与组分没有清楚确定的血清不同,本发明可以提供清楚确定的细胞培养环境从而以一致的方式调节细胞活性,并且通过从根本上阻止动物物质的污染,细胞更加安全。
附图说明
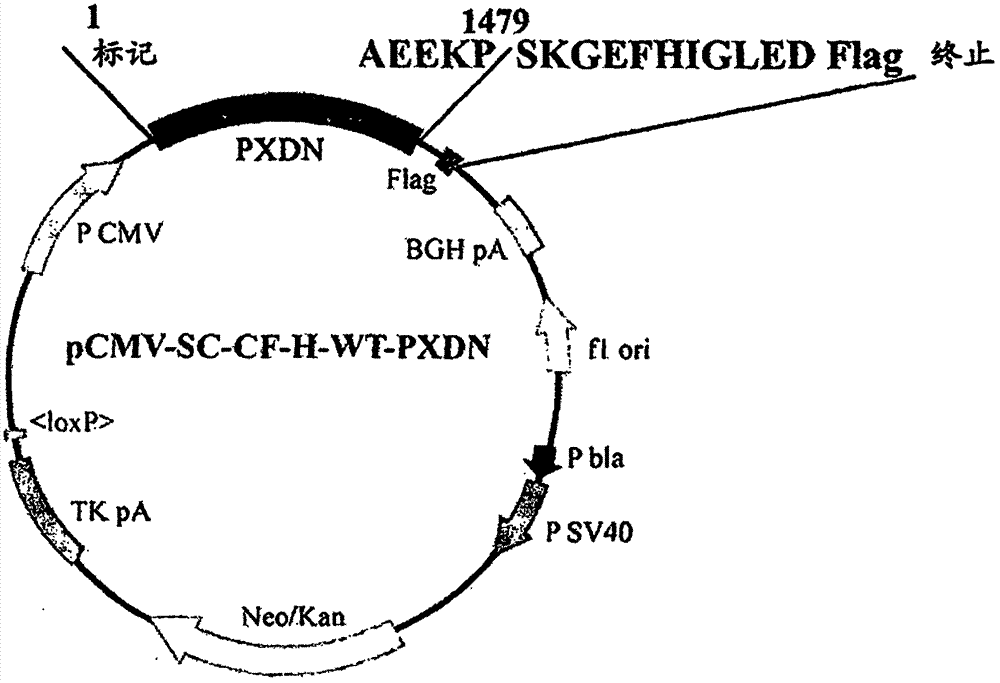
图1显示了用于表达重组人PXDN的质粒(pCMV-SC-CF-H-WT-PXDN)的图谱。
图2a显示了野生型人PXDN(WT)、N末端的ECM基序缺失的PXDN变体(ΔN)以及过氧化物酶结构域缺失的PXDN变体(ΔP)的结构。图2b显示了建立稳定表达野生型PXDN和缺失突变体的细胞系、将细胞的条件培养基(CM)添加至PXDN贫化的细胞以及测量细胞生长的过程及其结果。图2c显示了过氧化物酶活性的测量结果。
图3a显示了从表达野生型人PXDN(HEK293-H-WT-PXDN)的细胞系的条件培养基中纯化重组PXDN的过程。图3b显示了CM的SDS-PAGE分析结果,由CM纯化的PXDN蛋白和P-60蛋白的SDS-PAGE结果以及在用PXDN抗体处理纯化的PXDN蛋白和P-60蛋白之后的斑点印迹杂交(dot blot)结果。图3c显示了在非还原条件和还原条件下纯化的PXDN蛋白的SDS分析结果。图3d显示了纯化的PXDN蛋白和P-60蛋白的过氧化物酶活性的测量结果。
图4a显示了当用重组PXDN(rPXDN)蛋白和bFGF处理PXDN贫化的细胞时细胞增殖程度的测量结果。图4b显示了当在没有添加bFGF的情况下用重组PXDN(rPXDN)处理PXDN贫化的细胞时细胞存活率的测量结果。
图5a是示出了在用靶向PXDN或胶原IV的siRNA(siPXDN,siCol IV)或对照siRNA(siCTL)处理HUVEC之后,仅用bFGF或用bFGF和重组PXDN(rPXDN)处理细胞的过程的图。图5b和5c显示了在用靶向PXDN或胶原IV的siRNA或对照siRNA处理HUVECS之后,PXDN、Col IV、FN或LAM的免疫荧光染色结果(比例尺:20μm)。此外,图5d显示了在用每种siRNA处理之后检测到胶原IV NC1结构域的单体和二聚体的蛋白质印迹结果,以及显示了在用每种siRNA处理之后由生长因子刺激的ERK1/2和FAK的磷酸化程度的蛋白质印迹结果。图5e表示在siPXDN处理之后仅用bFGF或用bFGF和rPXDN处理的HUVEC细胞的免疫荧光染色结果(比例尺:20μm)。
图6a显示了检测用bFGF、纯化的rPXDN或P-60蛋白处理的HUVEC的p-ERK1/2和ERK1/2水平的蛋白质印迹结果。图6b显示了由bFGF,或者rPXDN或P-60蛋白和bFGF处理的HUVEC、HMVEC、BM-MSC和T98G细胞的细胞增殖程度的测量结果。图6c显示了当在没有添加生长因子的情况下用rPXDN或P-60蛋白处理HUVEC时细胞存活率的测量结果。图6d显示了当用各种浓度的rPXDN或P-60以及bFGF处理HUVEC时细胞增殖程度的测量结果。图6e显示了当用rPXDN或P-60以及各种生长因子(VEGF或EGF)处理HUVEC时细胞增殖程度的测量结果。
图7a表示PXDN甚至在来源于脐带血单核细胞的iPS细胞中表达,图7b显示了iPS细胞的代表性图像(左),并显示了当在添加rPXDN(100nM)的无饲养层培养基中培养iPS细胞时细胞增殖程度的测量结果(右)。
具体实施方式
在下文中,将通过实施例详细描述本发明。然而,以下实施例仅用于举例说明本发明,而不用于限制本发明的范围。
实施例1:细胞培养和试剂
根据先前描述的程序(Jaffe,Nachman等人,1973),从新生婴儿的脐带中分离出人脐静脉内皮细胞(HUVEC)。通过位于韩国天主教大学医学院(The Catholic University of Korea,College of Medicine)的机构审查委员会(Institutional Review Board)批准的程序(批准号CUMC09U157)来收集人脐带样品。人微脉管内皮细胞(HMVEC)和骨髓间充质/干细胞(BM-MSC)购自Lonza。T98G和HEK293细胞购自ATCC。HUVEC在补充有20%胎牛血清(FBS,Gibco)、30μg/ml内皮细胞生长补充剂(ECGS,BD Biosciences)、90μg/ml肝素和1%抗生素的M199培养基中培养。HMVEC在内皮细胞生长培养基2(EGM2)-MV培养基(Lonza)中培养。BM-MSC在补充有20%FBS和1%抗生素的达尔伯克改良伊格尔培养基(DMEM,Invitrogen)中培养。其他细胞在补充有10%FBS和1%抗生素的DMEM中培养。
实施例2:表达重组人PXDN和缺失突变体PXDN的质粒的构建
人PXDN的cDNA购自Open Biosystems(目录号BC140295)。PXDN开放阅读框序列通过PCR,采用PCR引物集(正向引物:GCCGCCATGGCCAAGCGCT(SEQ ID NO:1),反向引物:GGAGGGCTTTTCCTCCGCC(SEQ ID NO:2))进行扩增,并插入到pCMV-SC-CF载体(Stratagene)(哺乳动物表达载体)的克隆位点以构建表达人野生型PXDN的质粒(pCMV-SC-CF-H-WT-PXDN)。通过在用以下限制性酶:Bgl II和Sal I(缺失201-2086bp,其是N末端ECM基序,ΔN)或Sal I和BspE I(缺失2086-3317bp,其是过氧化物酶结构域,ΔP)切割质粒(pCMV-SC-CF-H-WT-PXDN)之后用Klenow酶(Takara)填充粘性末端并进行自连接来生产缺失突变体。插入DNA的序列通过DNA测序来证实。
实施例3:重组人PXDN蛋白(rPXDN)的表达和纯化
表达PXDN的HEK293细胞通过以下方式来获得:通过分别用表达人PXDN的重组质粒(pCMV-SC-CF-H-WT-PXDN)或用表达缺失变体PXDN的重组质粒转染HEK293细胞,以及通过用G418(Sigma)800μg/ml处理2周进行选择。表达rPXDN的HEK293细胞被培养至80~90%汇合,然后将培养基更换为无血清DMEM。在进一步培养24小时之后,通过获得上清液并在3,000rpm下离心来收集条件培养基(CM)。在使用3kDa分子量截留超滤单元(Amicon,Millipore)浓缩获得的CM之后,通过用20mM磷酸钾缓冲液(pH 8.0)重复稀释来缓冲液更换并进行再次浓缩。将浓缩的溶液负载在Q交换旋转柱(Thermo Scientific)上。在用25mM NaCl在20mM磷酸钾缓冲液(pH 8.0)中的溶液洗涤之后,用1M NaCl在20mM磷酸钾缓冲液(pH 8.0)中的溶液洗脱rPXDN。在调整合并的洗脱液的盐浓度之后,将溶液负载在聚丙烯酰胺葡聚糖S-300(GE Healthcare)上并通过包含150mM NaCl的磷酸钾缓冲液(pH 7.2-7.5)进行分馏。然后,使用Centricon离心过滤设备(Centricon centrifugal filter device)(截留:100kDa;Millipore)浓缩纯化的蛋白。通过用Triton X-114提取,然后用SM-2珠(Aida和Pabst,1990)处理从样品中去除内毒素,用于细胞测定。将等分部分进行SDS-PAGE,然后用考马斯亮蓝染色。
实施例4:过氧化物酶活性测定
将150μL的CM或rPXDN加入到96孔板中,并用50μL的3,3’,5,5’-四甲基联苯胺(TMB)基质溶液(Sigma)处理。在孵育30分钟后,测量在650nm下的光吸收值。
实施例5:RNA干扰和细胞转染
靶向PXDN或胶原IV的siRNA和对照siRNA(siCTL)得自ST Pharm.Co.(Seoul,Korea)。siRNA序列如下:对于PXDN敲低,正向:GCAUCAAUGCUGGCAUCUUTT(SEQ ID NO:3),反向:AAGAUGCCAGCAUUGAUGCTT(SEQ ID NO:4);对于Col IV敲低,正向:CCUCAUCUGUGAUAUAGACGGAUAUTT(SEQ ID NO:5),反向:AUAUCCGUCUAUAUCACAGAUGAGGTT(SEQ ID NO:6);对于siCTL,正向:GUUCAGCGUGUCCGGCGAGTT(SEQ ID NO:7),反向:CUCGCCGGACACGCUGAACTT(SEQ ID NO:8)。将细胞以30个细胞/mm2的密度接种并培养24小时,并使用脂质体RNAiMAX(Invitrogen)以50nM siRNA转染细胞。4小时后,用PBS洗涤细胞,然后用新鲜培养基孵育48小时。
实施例6:细胞增殖测定
使细胞在96孔板中培养24小时。在更换为适合的新鲜培养基之后,使细胞在培养物中保持48小时。在与添加的20μL MTS试剂(Promega)反应4小时之后,使用ELISA酶标仪(美谷分子仪器有限公司(Molecular Devices))在490nm下读取光吸收值,以研究细胞增殖水平。为了进行互补测定,将通过siRNA转染并培养48小时得到的PXDN缺陷型HUVEC与数个浓度的rPXDN或CM,在存在或不存在10ng/ml bFGF的情况下培养48小时。对于用rPXDN处理siRNA未处理的幼稚细胞的实验组,使细胞在包含各种重组蛋白和10ng/ml bFGF、EGF或VEGF的无血清培养基中培养48小时。
实施例7:免疫荧光分析
用PBS洗涤细胞,用100%甲醇固定5分钟,并用0.1%Triton X-100处理3分钟。非特异性蛋白结合位点用5%BSA封闭1小时。将细胞与第一抗体孵育,用PBS洗涤3次,以及与缀合有Alexa 488(Invitrogen)或Cy 3(Millipore)的第二抗体孵育2小时。使用以下第一抗体/稀释剂:PXDN(1∶500)、纤连蛋白(FN;克隆IST-4,1∶100,Sigma)、Col IV(克隆CIV22,1∶100,DAKO)和层粘连蛋白(LAM;1∶100,Abcam)。作为阴性对照,用缓冲液替换第一抗体。将1μg/ml DAPI(Sigma)加入到载玻片上以对细胞核进行染色。用共聚焦显微镜(Zeiss LSM 510 Meta,具有LSM图像检查软件)获得图像。为了完成测定,将通过siRNA转染并培养48小时得到的PXDN缺陷型HUVEC与rPXDN在存在10ng/ml bFGF的情况下培养48小时。然后,固定细胞并进行免疫荧光染色。用NIH Image J程序分析荧光图像。
实施例8:NC1烃基硫亚胺交联的检测
根据先前描述的程序(Lazar,Peterfi等人,2015)评估Col IV中交联的NC1结构域烃基硫亚胺的水平。每种siRNA转染之后培养72小时的HUVEC用300mM HEPES(pH 7.4)洗涤。用包含0.1mM盐酸苯甲脒(Sigrma)、1mM PMSF(Gibco)和1mM N-乙基马来酰亚胺(Sigma)的低渗裂解缓冲液(10mM CaCl2、50mM Hepes,pH7.4),通过刮取获得细胞裂解液。在细胞裂解液与0.5mg/ml胶原酶(Gibco)在37℃下反应24小时后进行蛋白质印迹。用Col IV α2抗体(Chondrex Inc)和缀合辣根过氧化物酶(HRP)的第二抗体来检测胶原IV NC1结构域的单体和二聚体。
实施例9:蛋白质印迹
用裂解缓冲液[50mM Tris(pH 8.0)、150mM NaCl、1%Triton X-100、1%脱氧胆酸钠、0.1%SDS、1mM Na3VO4、50mM NaF、1mM EDTA、1mM EGTA、2mM PMSF、1μg/ml胃酶抑素和蛋白质抑制剂混合物(Roche)]裂解细胞,通过在14,000rpm下离心细胞裂解液30分钟获得上清液,并且在所述上清液经历8%SDS-PAGE之后,将分离的蛋白质转移至硝酸纤维素膜上。为了阻止非特异性蛋白结合,用5%脱脂牛奶处理膜1小时,并且在连续处理第一抗体和与HRP缀合的第二抗体之后,使用ECL试剂盒(Amersham)检测蛋白条带的免疫应答。使用以下抗体作为第一抗体:Flag-标签(Abcam)、β-肌动蛋白(Sigma)、p-ERK1/2(Cell Signaling)、ERK1/2(Cell Signaling)、p-FAK(R&D Systems)和FAK(Millipore)。
实施例10:诱导性多能干细胞的细胞增殖测定
10-1:iPS细胞培养
来源于脐带血单核细胞(CMC-7)的iPS细胞得自韩国加图立大学的Ji Hyeon Ju教授(Stem Cells Int.2016;2016:1329459)。将CMC-7细胞接种到涂布有玻连蛋白(0.5ug/ml,Gibco)的平板上,并在TeSR-E8(Stemcell)培养基中培养。每24小时更换培养基。
10-2:iPS细胞增殖测定
在4℃下,用50μl 0.5μg/ml的玻连蛋白涂布96孔板。用0.05%胰蛋白酶-EDTA处理培养的CMC-7 iPS细胞,加入5ml TeSR-E8培养基,并离心(1300rpm,5min)。在去除上清液之后,将细胞悬浮于具有10μM ROCK抑制剂(Y27632,Sigma)的TeSR-E8培养基中,将1500个细胞接种在涂布有玻连蛋白的96孔板的每个孔中,并培养24小时。之后,培养基更换为具有100nM rPXDN的TeSR-E8培养基,然后培养120小时。在培养时,每24小时将培养基更换为添加rPXDN的培养基。之后,添加20μl MTS试剂(Promega),孵育3小时,并使用ELISA酶标仪(美谷分子仪器有限公司(Molecular Devices))在490nm下读取光吸收值,以研究细胞增殖水平,从而与对照进行比较。
实施例11:统计分析
数据表示为代表性实验的平均值±SEM。使用GraphPad Prism 5(GraphPad软件),具有Tukey检验的单因素方差分析(One-way ANOVA)用于比较对照和样品之间的结果。*p<0.05、**p<0.01、***p<0.001。
实验结果
1.表达PXDN的细胞系的建立和CM活性的研究:与缺失突变体PXDN的比较分析
将人PXDN cDNA(aa 1-1479)插入到巨细胞病毒启动子与Flag标签之间的哺乳动物表达质粒载体(pCMV SC-CF),以产生携带PXDN序列的重组质粒(pCMV-SC-CF-H-WT-PXDN;图1)。与其他过氧化物酶不同,PXDN包括含有免疫球蛋白C2(IgC2)-型结构域、富亮氨酸重复(LRR)和血管性血友病因子C型(vWC)的ECM基序。因此,研究了PXDN是否由细胞分泌并在细胞外作为CM的组分起作用,以及ECM基序和过氧化物酶结构域对于PXDN的功能是否必要。通过用重组质粒(pCMV-SC-CF-H-WT-PXDN)转染HEK293细胞,建立了表达重组人PXDN(rPXDN)的稳定细胞系,该细胞系命名为HEK293-H-WT-PXDN。此外,通过用表达具有缺陷型N末端ECM基序(ΔN)或过氧化物酶结构域(ΔP)的突变PXDN的质粒转染HEK293细胞来构建分别命名为HEK293-H-ΔN-PXDN和HEK293-H-ΔP-PXDN的稳定细胞系(图2a)。
将细胞系在无血清培养基(EBM)中培养,通过收集上清液获得条件培养基(CM)。在将CM加入到由PXDN siRNA敲低引起的PXDN贫化的细胞中并与10ng/ml bFGF一起培养48小时后,测量细胞增殖(图2b)。观察到,当用表达全长PXDN的HEK293-H-WT-PXDN的CM处理PXDN贫化的细胞时,细胞增殖恢复良好,然而,用HEK293-H-ΔN-PXDN或HEK293-H-ΔP-PXDN的CM,细胞增殖完全不能恢复,与用得自引入空载体的细胞的CM一样(图2b)。
此外,在HEK293-H-ΔP-PXDN CM和空载体CM中没有观察到过氧化物酶活性,在HEK293-H-ΔN-PXDN和HEK293-H-WT-PXDN CM中观察到相似的过氧化物酶活性水平(图2c)。结果表明,ECM基序和过氧化物酶结构域两者对于PXDN的功能均是必要的,暗示表达PXDN的细胞系的CM可以用于促进细胞增殖。
2.rPXDN蛋白的纯化
在通过培养HEK293-H-WT-PXDN细胞系获得CM之后,通过使用阴离子交换Q旋转柱进行的连续色谱和聚丙烯酰胺葡聚糖S-300尺寸排阻色谱,如在实施例中描述的由CM纯化rPXDN蛋白(图3a)。通过用Triton X-114提取从样品中去除内毒素,然后用SM-2珠处理以去除Triton X-114。当在还原条件下在6% SDS-PAGE凝胶中电泳CM和纯化的蛋白时,rPXDN的尺寸为170kDa(图3b)。还纯化了CM中以高水平存在的未知蛋白P-60(约60kDa)作为阴性对照蛋白。
通过PXDN抗体进行斑点印迹杂交分析(Dot blot analysis),显示P-60不与抗体进行反应,而是仅与rPXDN反应。由于在非还原条件下的SDS-PAGE分析中rPXDN的尺寸为约500kDa,因此假定rPXDN在CM中作为三聚体形式存在(图3c)。实验中使用的rPXDN的浓度基于单体确定。当通过TMB氧化方法测量纯化的rPXDN的活性时,该纯化的rPXDN的过氧化物酶活性以剂量依赖性方式增加(图3d)。因此,证实了纯化的rPXDN形成了三聚体并且具有完整的过氧化物酶活性。
3.rPXDN补偿PXDN贫化的HUVEC的增殖和存活
为了研究外源PXDN蛋白是否可以补偿PXDN敲低细胞的功能,在加入纯化的rPXDN之后,将通过siRNA敲低构建的PXDN缺陷型细胞培养48小时(图4a)。在不存在rPXDN的情况下,由siRNA转染引起的PXDN贫化的细胞的增殖与siCTL转染的细胞的增殖相比,显著降低(图4a)。另一方面,当用rPXDN处理PXDN贫化的细胞时,显示了细胞增殖根据rPXDN的加入以剂量依赖性方式恢复。结果表明PXDN在细胞外起作用。此外,在不存在bFGF的情况下,rPXDN处理阻止了PXDN贫化的细胞以剂量依赖性方式死亡(图4b)。这些结果表明纯化的rPXDN可以完全补偿PXDN贫化的HUVEC的增殖和存活。
4.rPXDN恢复PXDN贫化的细胞中的Col IV、FN和LAM装配为致密的纤维状网络
本发明人确定了在细胞的外周ECM组分中纤维状网络的装配是否需要PXDN(图5a)。观察到在PXDN贫化的细胞中,Col IV的装配显著降低,Col IV中通过交联的烃基硫亚胺键形成的NC1二聚体的比率也降低(图5b至图5d)。此外,PXDN敲低还显著抑制纤连蛋白(FN)的纤维状网络装配,中度抑制层粘连蛋白(LAM)装配。Col IV敲低细胞对FN和LAM的纤维状网络装配具有类似于PXDN敲低细胞的抑制作用。PXDN贫化还导致bFGF刺激的或VEGF刺激的FAK和ERK1/2的磷酸化作用降低,很可能是因为ECM装配的缺陷。本发明的发明人还研究了rPXDN是否可以补充PXDN贫化的细胞的缺陷型ECM装配。如图5e所示,rPXDN可以恢复PXDN贫化的细胞中所显示的Col IV、FN和LAM的差的纤维状网络装配。这些数据表明rPXDN可以用于细胞的ECM装配或存放,以便细胞经历用于细胞功能的完整ECM介导的信号传导。
5.在无血清培养基中在不直接激活ERK1/2的情况下通过rPXDN处理促进细胞增殖
本发明人测试了纯化的rPXDN是否促进使用幼稚细胞的无血清培养基中的细胞增殖。如图6a和6b中所示,当用纯化的rPXDN(100nM)处理HUVEC时,在HUVEC中没有发生ERK1/2的直接激活,然而发现,在存在bFGF的情况下通过rPXDN处理促进了HUVEC的细胞增殖。通过添加纯化的rPXDN还促进了其他原代细胞(HMVEC、BM-MSC)的生长以及建立的癌细胞系(脑肿瘤细胞系T98G)。然而,由CM纯化的P-60蛋白没有显示这样的效果。
接下来,本发明的发明人研究了在缺乏细胞因子的情况下,通过添加多种浓度的rPXDN,然后培养48小时对HUVEC的细胞存活和生长的作用,发现细胞存活率以rPXDN剂量依赖性方式增加(图6c)。在bFGF存在的情况下,在用rPXDN培养48小时之后,以剂量依赖性方式促进了HUVEC的细胞增殖(图6d)。
为了确定细胞增殖促进作用对bFGF或不考虑生长因子类型是否具有特异性,用rPXDN在VEGF或EGF的存在下培养HUVEC。P60蛋白没有显示细胞增殖促进作用,但rPXDN显示了显著的细胞增殖促进作用(图6e)。因此,这些结果表明rPXDN可以用作能够在用于培养各种细胞如干细胞和祖细胞的确定的培养基中生长和存活的佐剂。
6.在无饲养层(feeder free)的培养基中通过rPXDN处理促进iPS细胞增殖
为了研究来源于脐带血单核细胞的iPS细胞是否表达PXDN,进行了蛋白质印迹,发现为iPS细胞的CMC-7细胞与HUVEC一样,也表达PXDN(图7a)。本发明人确定了纯化的rPXDN是否促进无血清培养基中的iPS细胞增殖。如图7b所示,在添加纯化的rPXDN时,促进了细胞增殖。因此,结果表明rPXDN可以用于iPS细胞的无饲养层细胞培养。
- 还没有人留言评论。精彩留言会获得点赞!