具有改变的FcRn结合的工程化免疫球蛋白的制作方法
本发明涉及用于抗体介导的疗法的组合物和方法。特别地,本文提供了具有改变的半衰期的工程化免疫球蛋白。
背景技术:
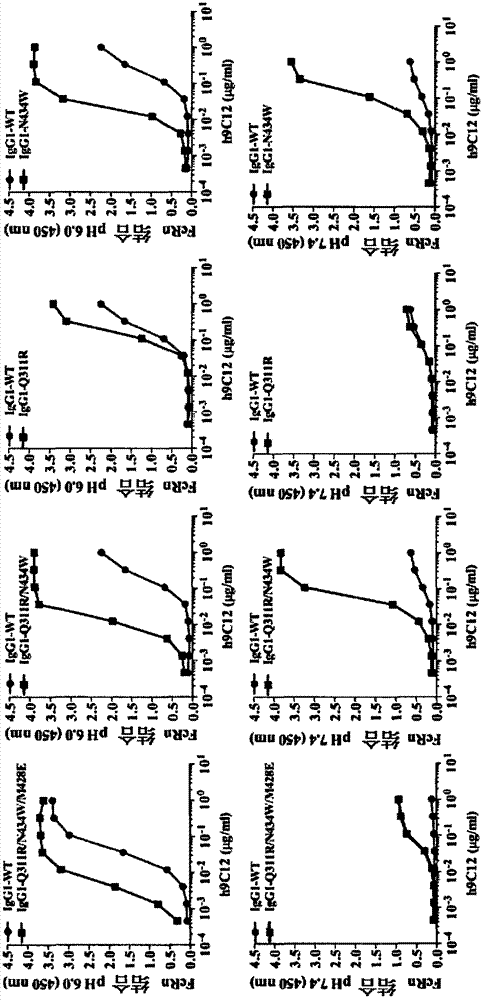
抗体是结合特异性抗原的免疫蛋白。在大多数哺乳动物中,包括人类和小鼠,抗体由成对的重多肽链和轻多肽链构建。每条链由单个免疫球蛋白(ig)结构域组成,因此通用术语免疫球蛋白用于此类蛋白。每条链由两个不同的区域组成,称为可变区域和恒定区域。轻链和重链可变区域在抗体之间显示出显著的序列多样性,并且负责结合靶标抗原。恒定区域显示了较少的序列多样性,并且负责结合许多天然蛋白以引发重要的生化事件。在人类中存在五种不同类别的抗体,包括iga(其包括亚类iga1和iga2),igd、ige、igg(其包括亚类igg1、igg2、igg3和igg4)和igm。这些抗体类别之间的区别特征是它们的恒定区域,尽管v区域中可能存在微妙的差异。图1显示了igg1抗体,在此用作描述免疫球蛋白的一般结构特征的示例,igg抗体是由两条重链和两条轻链组成的四聚体蛋白。igg重链由从n-末端连接到c-末端的四个免疫球蛋白结构域以顺序vh-ch1-ch2-ch3组成,分别指重链可变结构域、重链恒定结构域1、重链恒定结构域2和重链恒定结构域3(也称为vh-cγ1-cγ2-cγ3,分别指重链可变结构域、恒定γ1结构域、恒定γ2结构域和恒定γ3结构域)。igg轻链由从n-末端连接到c-末端的两个免疫球蛋白结构域以顺序vl-cl组成,分别指轻链可变结构域和轻链恒定结构域。抗体的可变区域含有分子的抗原结合决定簇,因此确定抗体对其靶标抗原的特异性。可变区域是如此命名的,因为它与同一类别中的其它抗体的序列最为不同。大多数序列可变性发生在互补决定区(cdr)中。总共有6个cdr,每个重链和每个轻链各3个,命名为vhcdr1、vhcdr2、vhcdr3、vlcdr1、vlcdr2和vlcdr3。cdr外部的可变区域称为框架(fr)区域。尽管不像cdr那样多样化,但是在不同抗体之间的fr区域中确实发生序列可变性。总之,这种抗体特征结构提供了稳定的支架(fr区域),免疫系统可以在其上探索大量的抗原结合多样性(cdr),以获得对一系列抗原的特异性。许多高分辨率结构可用于来自不同生物体的各种可变区域片段,一些是未结合的,一些是与抗原复合的。抗体可变区域的序列和结构特征得到充分表征(morea等,1997,biophyschem68:9-16;morea等,2000,methods20:267-279,通过引用整体并入),并且抗体的保守特征已使得能够开发大量抗体工程技术(maynard等,2000,annurevbiomedeng2:339-376,通过引用整体并入)。例如,可以将来自一种抗体(例如鼠抗体)的cdr移植到另一种抗体(例如人类抗体)的框架区域上。该方法在本领域中被称为“人源化”,能够从非人类抗体产生免疫原性较低的抗体治疗剂。包括可变区域的片段可以在不存在抗体的其它区域的情况下存在,包括例如包括vh-cγ1和vh-cl的抗原结合片段(fab)、包括vh和vl的可变片段(fv)、包括vh和vl在同一链中连接在一起的单链可变片段(scfv)以及多种其它可变区域片段(little等,2000,immunoltoday21:364-370,通过引用整体并入)。抗体的fc区域与许多fc受体和配体相互作用,赋予一系列重要的功能能力,称为效应子功能。在igg中,包括来自ch2和ch3结构域两者的氨基酸的fc上的位点介导与新生儿fc受体(fcrn)的相互作用,fcrn是一种将内吞抗体从内体再循环回到血流中的受体(raghavan等,1996,annurevcelldevbiol12:181-220;ghetie等,2000,annurevimmunol18:739-766,两者均通过引用整体并入)。该过程加上由于全长分子的大尺寸而排除肾脏过滤,导致有利的抗体血清半衰期为1周至3周。fc与fcrn的结合也在细胞内和细胞间的抗体转运中起关键作用。fc对fcrn的结合位点也是细菌蛋白a和g结合的位点。通过在蛋白纯化期间使用蛋白a或蛋白g亲和层析通常利用这些蛋白的紧密结合作为纯化抗体的手段。因此,fc上的区域的保真度对于抗体的临床特性和它们的纯化都是重要的。fcrn是几种免疫学和非免疫学过程中的关键参与者,因为它介导igg的母胎转运,调节igg和白蛋白的血清持久性,并在不同细胞区室之间转运两种配体。此外,fcrn增强抗原呈递和交叉呈递。与在胞质溶胶中发现的trim21相反,fcrn是跨膜受体,其主要存在于酸化的内体中,并通过循环途径或穿过极化细胞层的转胞吞途径转运其配体。然而,fcrn还可以增强免疫复合物的加工,然后将抗原肽呈递给t细胞。fcrn-igg相互作用的标志是fcrn以严格的ph依赖性方式结合iggfc,在酸性ph下结合并且在中性ph下不结合或释放,这是fcrn介导的细胞内外转运的先决条件。fcrn-iggfc相互作用的工程化已产生具有更短或更长的血清半衰期或改变的跨细胞层转运能力的抗体。fcrn被广泛表达,因此在造血细胞和非造血细胞中的不同细胞位置上发现。需要改善的治疗性igg,其表现出对fcrn增强的ph依赖性结合。技术实现要素:本发明涉及用于抗体介导的疗法的组合物和方法。特别地,本文提供了具有改变的半衰期的工程化免疫球蛋白。例如,在一些实施方式中,本发明提供了一种组合物,其包含:对fcrn具有改变的结合亲和力的治疗免疫球蛋白,其中,免疫球蛋白在免疫球蛋白的fc区域中包含至少一种突变。在一些实施方式中,免疫球蛋白是igg1、igg2、igg3或igg4亚类。在一些实施方式中,免疫球蛋白是本文所述的变体免疫球蛋白之一的fc融合体。在一些实施方式中,免疫球蛋白在选自例如311、434、428、438或435中的一个或多个位置处具有突变。在一些实施方式中,突变是例如igg1-q311r/n434w/m428e、igg1-q311r/n434w、igg1-q311r、igg1-n434w、igg3(b)-q311r/n434w/m428e、igg3(b)-q311r/n434w/m438e/r435h、igg1-m252s/q311r/n434w/m428e、igg1-q311r/n434p/m428e、igg1-q311r/n434w/m428d、igg1-q311r/n434w/m428e/h433k、igg1-l309k/q311r/n434w/m428e、igg1-l309r/q311r/n434w/m428e、igg1-l309s/q311r/n434w/m428e或igg3(b)-q311r/n434w/m428e/r435h(例如,免疫球蛋白的恒定区域具有选自seqidno:2、3、4、5、7、8、9、10、11、12、13、14、15或16的氨基酸序列,或与seqidno:2、3、4、5、7、8、9、10、11、12、13、14、15或16至少90%(例如91%、92%、93%、94%、95%、96%、97%、98%或99%)相同的序列)。其它实施方式提供了一种组合物,其包含:在fc区域中包含至少一种突变的免疫球蛋白,其中,所述免疫球蛋白具有改变的与fcrn的结合,并且其中,所述突变选自例如igg1-q311r/n434w/m428e、igg1-q311r/n434w、igg1-q311r、igg1-n434w、igg3(b)-q311r/n434w/m428e、igg3(b)-q311r/n434w/m438e/r435h、igg1-m252s/q311r/n434w/m428e、igg1-q311r/n434p/m428e、igg1-q311r/n434w/m428d、igg1-q311r/n434w/m428e/h433k、igg1-l309k/q311r/n434w/m428e、igg1-l309r/q311r/n434w/m428e、igg1-l309s/q311r/n434w/m428e或1gg3(b)-q311r/n434w/m428e/r435h。其它实施方式提供了对fcrn具有改变的结合的igg1免疫球蛋白,其中,免疫球蛋白具有q311r、n434w和m428e突变。在一些实施方式中,抗体结合选自例如癌症标志物、细胞因子、感染性疾病标志物或生长因子的靶标。其它实施方式提供了本文所述的免疫球蛋白在有需要的受试者中治疗或预防疾病的应用。在一些实施方式中,疾病是例如癌症、自身免疫疾病、炎性疾病、移植排斥或感染性疾,尽管特别考虑了其它疾病。在一些实施方式中,抗体结合选自例如癌症标志物、细胞因子、感染性疾病标志物或生长因子的靶标,尽管特别考虑了其它靶标。其它实施方式提供了治疗、或治疗或预防受试者疾病的方法,其包括:将本文所述的免疫球蛋白提供给有需要的受试者。其它实施方式提供了疫苗组合物,其包含本文所述的变体免疫球蛋白或其fc融合体(例如与免疫原融合)及其在受试者中产生免疫应答的应用。本文描述了另外的实施方式。附图说明图1.elisa显示了在ph6.0(上图)和7.4(下图)下,一组fc工程化的h9c12igg1变体与人类fcrn的结合。图2.spr传感图显示了在ph6.0(7.8-4000.0nm)和ph7.4(4000.0nm)下,一组fc工程化的h9c12igg1变体与人类fcrn的结合。包括igg1-m252y/s254t/t256e作为参考。图3显示了示出igg1变体的氨基酸序列的比对。fc工程化igg1变体的恒定结构域的氨基酸序列。图4显示了图3的序列。图5显示了elisa,其显示了在ph6.0和7.4下,一组fc工程化的h9c12igg1和igg3变体与人类fcrn的结合。图6显示了spr传感图,其显示了在ph6.0(1000-15.6nm)(a-d)和ph7.4(1000nm)(e-f)下,一组fc工程化的h9c12igg1变体与人类fcrn的结合。图7显示了人类fcrntg32-a1b-/-转基因小鼠中(a)h9c12和(b)nipigg1变体的体内半衰期(剩余%)。nip=4-羟基-3-碘-5-硝基苯基乙酸。图8显示了igg变体的序列。定义本文的术语“抗体”以最广泛的含义使用,并且涵盖各种抗体结构,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如双特异性抗体)和抗体片段,只要它们表现出所需的抗原结合活性即可。还包括具有fc区域的抗体片段,以及包含与免疫球蛋白的fc区域等同的区域的融合蛋白。“抗体片段”是指不是完整抗体的分子,其包含与完整抗体结合的抗原所结合的完整抗体的一部分。抗体片段的示例包括但不限于fv、fab、fab′、fab′-sh、f(ab′)2、单链抗体分子(例如scfv)、双抗体和由抗体片段形成的多特异性抗体。本文的术语“fc区域”用于定义免疫球蛋白重链的c-末端区域,其含有至少一部分恒定区域。该术语包括天然序列fc区域和变体fc区域。在一种实施方式中,人类igg重链fc区域从cys226或从pro230延伸至重链的羧基末端。然而,fc区域的c-末端赖氨酸(lys447)可以存在或可以不存在。除非本文另有说明,否则fc区域或恒定区域中氨基酸残基的编号是根据eu编号系统,也称为eu索引,如kabat等,sequencesofproteinsofimmunologicalinterest,第五版,公共卫生服务,国立卫生研究院,马里兰州贝塞斯达,1991年中所述的。本文使用的“效应子功能”是指可归因于抗体fc区域的那些生物学活性,该活性随抗体同种型而变化。抗体效应子功能的示例包括:c1q结合和补体依赖性细胞毒性(cdc);fc受体结合;抗体依赖性细胞介导的细胞毒性(adcc);吞噬作用;细胞因子分泌;通过抗原呈递细胞摄取的免疫复合物介导的抗原;下调细胞表面受体(例如b细胞受体)和b细胞活化。当用于提及蛋白时,术语“野生型”是指由细胞、组织或生物体的基因组编码的蛋白,而不是被操纵以产生合成蛋白的蛋白。术语“抗原结合结构域”是指抗原结合分子的一部分,其包含与抗原的部分或全部特异性结合并互补的区域。在抗原很大的情况下,抗原结合分子可以仅结合抗原的特定部分,该部分称为表位。抗原结合结构域可以由例如一个或多个抗体可变结构域(也称为抗体可变区域)提供。优选地,抗原结合结构域包含抗体轻链可变区域(vl)和抗体重链可变区域(vh)。术语“嵌合”抗体是指其中重链和/或轻链的一部分来源于特定来源或种类的抗体,而重链和/或轻链的其余部分来源于不同来源或种类。对于嵌合抗体,例如非抗原结合组分可以来源于多种种类,包括灵长类动物如黑猩猩和人类。人源化抗体是特别优选的嵌合抗体形式。抗体的“类别”是指其重链具有的恒定结构域或恒定区域的类型。有五种主要类别的抗体:iga、igd、ige、igg和igm,这些中的几个可以进一步分为亚类(同种型),例如igg1、igg2、igg3、igg4、iga1和iga2。对应于不同类别的免疫球蛋白的重链恒定结构域称为α、β、δ、ε、γ和μ。“与免疫球蛋白的fc区域等同的区域”旨在包括免疫球蛋白的fc区域的天然存在的等位基因变体,以及具有改变以产生取代、添加或缺失但基本上不降低免疫球蛋白介导效应子功能(例如抗体依赖性细胞毒性)的能力的变体。例如,可以从免疫球蛋白fc区域的n-末端或c-末端缺失一个或多个氨基酸,而基本上不丧失生物学功能。可以根据本领域已知的一般规则选择这些变体,以便对活性具有最小的影响(参见例如,bowie,j.u等,science247:1306-10(1990))。“框架”或“fr”是指除高变区域(hvr)(或cdr)残基之外的可变结构域残基。可变结构域的fr通常由四个fr结构域组成:fr1、fr2、fr3和fr4。因此,hvr和fr序列通常以下列顺序出现在vh(或vl)中:fr1-h1(l1)-fr2-h2(l2)-fr3-h3(l3)-fr4。术语“全长抗体”,“完整抗体”和“全抗体”在本文中可互换使用,是指具有与天然抗体结构基本上相似的结构或具有含有如本文所定义的fc区域的重链的抗体。“人类共有框架”是代表人类免疫球蛋白vl或vh框架序列的选择中最常出现的氨基酸残基的框架。通常,人类免疫球蛋白vl或vh序列的选择来自可变结构域序列的亚组。通常,序列的亚组是如kabat等,sequencesofproteinsofimmunologicalinterest,第5版,nihpublication91-3242,bethesdamd.(1991),vols.1-3中的亚组。在一种实施方式中,对于vl,亚组是亚组кi,如kabat等中的亚组,同上。在一种实施方式中,对于vh,亚组是亚组iii,如kabat等中的亚组,同上。“人源化”抗体是指嵌合抗体,其包含来自非人类hvr的氨基酸残基和来自人类fr的氨基酸残基。在某些实施方式中,人源化抗体将包含至少一个(通常两个)可变结构域中的基本上全部,其中全部或基本上全部hvr(例如cdr)对应于非人类抗体的那些,并且全部或基本上全部fr对应于人类抗体的fr。人源化抗体任选地可以包含来源于人类抗体的抗体恒定区域的至少一部分。抗体的“人源化形式”,例如非人类抗体,是指已经历人源化的抗体。如本文所用,术语“高变区域”或“hvr”是指抗体可变结构域的每个区域,其在序列中是高变的和/或形成结构上定义的环(“高变环”)。通常,天然四链抗体包含六个hvr;三个为vh(h1、h2、h3)和三个为vl(l1、l2、l3)。hvr通常包含来自高变环和/或来自“互补决定区域”(cdr)的氨基酸残基,后者具有最高的序列可变性和/或参与抗原识别。除vh中的cdr1外,cdr通常包含形成高变环的氨基酸残基。高变区域(hvr)也称为互补决定区域(cdr),并且这些术语在本文中可互换地用于指形成抗原结合区域的可变区域的部分。kabat等,美国健康与人类服务部,“免疫学兴趣蛋白序列”(1983)和chothia等,j.mol.biol.196:901-917(1987)中已经描述了该特定区域,其中,定义包括当与彼此比较时氨基酸残基的重叠或子集。然而,指抗体的cdr或其变体的任意定义的应用意图在如本文定义和使用的术语的范围内。涵盖如上文引用的每篇参考文献所定义的cdr的适当氨基酸残基列于下表1中作为比较。涵盖特定cdr的准确残基数将根据cdr的序列和大小而变化。在给定抗体的可变区域氨基酸序列的情况下,本领域技术人员可以常规地确定哪些残基包含特定cdr。当用于提及多肽时,术语“变体”和“突变体”是指与另一种通常相关的多肽相差一个或多个氨基酸的氨基酸序列。该变体可以具有“保守”变化,其中,取代的氨基酸具有相似的结构或化学特性。一种类型的保守氨基酸取代是指具有相似侧链的残基的可互换性。例如,具有脂肪族侧链的一组氨基酸是甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;具有脂肪族-羟基侧链的一组氨基酸是丝氨酸和苏氨酸;具有含有酰胺侧链的一组氨基酸是天冬酰胺和谷氨酰胺;具有芳香族侧链的一组氨基酸是苯丙氨酸、酪氨酸和色氨酸;非天然氨基酸如对氨基苯丙氨酸,具有碱性侧链的一组氨基酸是赖氨酸、精氨酸和组氨酸;以及具有含有硫侧链的一组氨基酸是半胱氨酸和甲硫氨酸。优选的保守氨基酸取代基是:缬氨酸-亮氨酸-异亮氨酸、苯丙氨酸-酪氨酸、赖氨酸-精氨酸、丙氨酸-缬氨酸和天冬酰胺-谷氨酰胺。更罕见的是,该变体可以具有“非保守”变化(例如,用色氨酸取代甘氨酸)。类似的微小变型也可以包括氨基酸缺失或插入(即添加)或两者。可以使用本领域已知的计算机程序(例如dnastar软件)找到确定可以在不消除生物活性的情况下取代、插入或缺失哪些氨基酸残基和多少氨基酸残基的指导。可以在功能测定中测试变体。优选的变体具有小于10%,优选小于5%,更优选小于2%的变化(无论是取代、缺失等)。对于氨基酸取代,使用以下命名法:原始氨基酸,位置,取代的氨基酸。因此,在位置573处用丙氨酸取代赖氨酸称为“k573a”,在位置573处用脯氨酸取代赖氨酸称为k573p。多个突变通过加号(“+”)或“/”分开,例如“gly205arg+ser411phe”或“g205r/s411f”,分别代表在位置205处用精氨酸(r)取代甘氨酸(g)且在位置411处用苯丙氨酸(f)取代丝氨酸(s)的突变。两个氨基酸序列之间或两个核苷酸序列之间的相关性由参数“同一性”描述。出于本发明的目的,使用needleman-wunsch算法(needleman和wunsch,1970,j.mol.biol.48:443-453)确定两个氨基酸序列之间的同一性程度,如在emboss包的needle程序中实施的(emboss:theeuropeanmolecularbiologyopensoftwaresuite,rice等,2000,trendsingenetics16:276-277),优选3.0.0或更高版本。使用的任选参数11644.000-ep7是10的缺口开放罚分,0.5的缺口延伸罚分和eblosum62(blosum62的emboss版本)取代矩阵。标记为“最长同一性”的needle的输出(使用-nobrief选项获得)用作百分比同一性并且如下计算:(同一性残基×100)/(比对长度-比对中的总缺口数)。表述“氨基酸位置对应于”参考序列中的位置和相似表述旨在鉴定在初级或空间结构中对应于参考序列中的特定位置的氨基酸残基。技术人员应该理解,这可以通过将给定序列与参考序列比对并鉴定与参考序列中的特定位置比对的氨基酸残基来完成。表述xnnn旨在表示位于对应于hsa中的位置nnn的位置处的氨基酸残基x,并且表述xnnny旨在表示位于对应于hsa中的位置nan的位置处的任何氨基酸x被氨基酸残基y取代。如本文所用,术语“亲和力”是指结合对的两个成员(例如免疫球蛋白和fcrn)之间结合强度的量度。kd是解离常数并且具有摩尔浓度单位。亲和常数是解离常数的倒数。亲和常数有时用作描述该化学实体的通用术语。它是结合能量的直接量度。k的自然对数与通过等式δg0=-rtln(k)的结合的吉布斯自由能线性相关,其中r=气体常数,温度以开氏度为单位。亲和力可以通过实验确定,例如通过使用市售的biacorespr单元(gehealthcare)的表面等离子共振(spr)。如本文所用,术语“在所述受试者产生免疫应答的条件下”是指免疫应答(例如先天性或获得性)的任何定性或定量诱导、产生和/或刺激。如本文所用,术语“免疫应答”是指受试者的免疫系统的应答。例如,免疫应答包括但不限于toll受体活化、淋巴因子(例如细胞因子(例如th1或th2型细胞因子)或趋化因子)表达和/或分泌、巨噬细胞活化、树突细胞活化、t细胞活化(例如cd4+或cd8+t细胞)、nk细胞活化和/或b细胞活化(例如抗体产生和/或分泌)中可检测的改变(例如增加)。免疫应答的另外示例包括免疫原(例如抗原(例如免疫原性多肽))与mhc分子结合并诱导细胞毒性t淋巴细胞(“ctl”)应答、诱导b细胞应答(例如抗体产生)和/或t-辅助淋巴细胞应答,和/或针对免疫原性多肽来源的抗原的延迟型超敏应答(dth),免疫系统细胞(例如t细胞、b细胞(例如任何发育阶段(例如浆细胞))的扩增(例如细胞群的生长),以及抗原呈递细胞所增加的抗原加工和呈递。免疫应答可以是被受试者的免疫系统识别为外来的免疫原(例如来自微生物(例如病原体)的非自身抗原,或被识别为外来的自身抗原)。因此,应理解,如本文所用,“免疫应答”是指任何类型的免疫应答,包括但不限于不限于先天免疫应答(例如toll受体信号级联的活化)、细胞介导的免疫应答(例如由t细胞(例如抗原特异性t细胞)和免疫系统的非特异性细胞介导的应答)和体液免疫应答(例如,由b细胞介导的应答(例如通过产生和分泌抗体到血浆、淋巴和/或组织液中)。术语“免疫应答”旨在包括受试者免疫系统应答抗原和/或免疫原的能力的所有方面(例如对免疫原(例如病原体)的初始应答以及作为适应性免疫应答的结果而获得的(例如记忆)应答)。如本文所用,术语“免疫”是指在暴露于能够引起疾病的微生物(例如病原体)时防止疾病(例如预防或减弱(例如抑制)疾病的体征、症状或病症)。免疫可以是先天的(例如在不存在先前暴露于抗原的情况下存在的非适应性(例如非获得性)免疫应答)和/或获得的(例如在先前暴露于抗原之后由b和t细胞介导的免疫应答(例如表现出对抗原的增加的特异性和反应性))。如本文所用,术语“免疫原”是指能够引发受试者中免疫应答的试剂(例如微生物(例如细菌、病毒或真菌)和/或其部分或组分(例如蛋白抗原))。在一些实施方式中,免疫原引发针对免疫原的免疫(例如微生物(例如病原体或病原体产物))。术语“测试化合物”是指可用于治疗或预防疾病、病症、生病或身体功能障碍,或以其它方式改变样品生理或细胞状态的任何化学实体、药物、药品等。测试化合物包含已知和潜在的治疗化合物。通过使用本发明的筛选方法筛选可以确定测试化合物是治疗的。“已知治疗化合物”是指已经显示(例如通过动物试验或先前对人类施用的经验)有效地进行这种治疗或预防的治疗化合物。如本文所用的术语“样品”以其最广泛的含义使用。如本文所用,术语“样品”以其最广泛的含义使用。在某种意义上,它可以指组织样品。在另一种意义上,它意味着包括从任何来源获得的样本或培养物,以及生物制剂。可以从动物(包括人类)获得生物样品并涵盖流体、固体、组织和气体。生物样品包括但不限于血液产品,例如血浆、血清等。这些示例不应解释为限制适用于本发明的样品类型。怀疑含有人类染色体或与人类染色体相关的序列的样品可以包含细胞、从细胞分离的染色体(例如中期染色体的扩散)、基因组dna(在溶液中或与固体支持物结合,例如用于southern印迹分析)、rna(在溶液中或与固体支持物结合,例如用于northern印迹分析)、cdna(在溶液中或与固体支持物结合)等。怀疑含有蛋白的样品可以包含细胞、组织的一部分以及含有一种或多种蛋白的提取物等。如本文所用,术语“亲和力”是指结合对的两个成员(例如免疫球蛋白和fcrn)之间结合强度的量度。kd是解离常数并且具有摩尔浓度单位。亲和常数是解离常数的倒数。亲和常数有时用作描述该化学实体的通用术语。它是结合能量的直接量度。k的自然对数与通过等式△g0=-rtln(k)的结合的吉布斯自由能线性相关,其中r=气体常数,温度以开氏度为单位。亲和力可以通过实验确定,例如通过使用市售的biacorespr单元(gehealthcare)的表面等离子共振(spr)。如本文所用,术语“在所述受试者产生免疫应答的条件下”是指免疫应答(例如先天性或获得性)的任何定性或定量诱导、产生和/或刺激。如本文所用,术语“免疫应答”是指受试者的免疫系统的应答。例如,免疫应答包括但不限于toll受体活化、淋巴因子(例如细胞因子(例如th1或th2型细胞因子)或趋化因子)表达和/或分泌、巨噬细胞活化、树突细胞活化、t细胞活化(例如cd4+或cd8+t细胞)、nk细胞活化和/或b细胞活化(例如抗体产生和/或分泌)中可检测的改变(例如增加)。免疫应答的另外示例包括免疫原(例如抗原(例如免疫原性多肽))与mhc分子结合并诱导细胞毒性t淋巴细胞(“ctl”)应答、诱导b细胞应答(例如抗体产生)和/或t-辅助淋巴细胞应答,和/或针对免疫原性多肽来源的抗原的延迟型超敏应答(dth),免疫系统细胞(例如t细胞、b细胞(例如任何发育阶段(例如浆细胞))的扩增(例如细胞群的生长),以及抗原呈递细胞所增加的抗原加工和呈递。免疫应答可以是被受试者的免疫系统识别为外来的免疫原(例如来自微生物(例如病原体)的非自身抗原,或被识别为外来的自身抗原)。因此,应理解,如本文所用,“免疫应答”是指任何类型的免疫应答,包括但不限于不限于先天免疫应答(例如toll受体信号级联的活化)、细胞介导的免疫应答(例如由t细胞(例如抗原特异性t细胞)和免疫系统的非特异性细胞介导的应答)和体液免疫应答(例如,由b细胞介导的应答(例如通过产生和分泌抗体到血浆、淋巴和/或组织液中)。术语“免疫应答”旨在包括受试者免疫系统应答抗原和/或免疫原的能力的所有方面(例如对免疫原(例如病原体)的初始应答以及作为适应性免疫应答的结果而获得的(例如记忆)应答)。如本文所用,术语“免疫”是指在暴露于能够引起疾病的微生物(例如病原体)时防止疾病(例如预防或减弱(例如抑制)疾病的体征、症状或病症)。免疫可以是先天的(例如在不存在先前暴露于抗原的情况下存在的非适应性(例如非获得性)免疫应答)和/或获得的(例如在先前暴露于抗原之后由b和t细胞介导的免疫应答(例如表现出对抗原的增加的特异性和反应性))。如本文所用,术语“免疫原”是指能够引发受试者中免疫应答的试剂(例如微生物(例如细菌、病毒或真菌)和/或其部分或组分(例如蛋白抗原))。在一些实施方式中,免疫原引发针对免疫原的免疫(例如微生物(例如病原体或病原体产物))。具体实施方式本发明涉及用于抗体介导的疗法的组合物和方法。特别地,本文提供了具有改变的半衰期的工程化免疫球蛋白。免疫球蛋白分子由通过链间二硫键连接在一起的两条相同的重多肽链和两条相同的轻多肽链组成。假定保守的三维构象,每条轻链和重链折叠成约110个氨基酸的区域。轻链包含一个可变区域(称为vl)和一个恒定区域(cl),而重链包含一个可变区域(vh)和三个恒定区域(ch1、ch2和ch3)。成对的区域相关联以形成离散结构。特别地,轻链和重链可变区域(vl和vh)相关联以形成含有抗原结合位点的“fv”区。重链和轻链两者的可变区域在从一个抗体分子到另一个抗体分子的结构和氨基酸组成方面显示出相当大的可变性,而恒定区域显示出很小的可变性。通过由重链和轻链的相关联所定义的结合位点,每种抗体识别并结合抗原,可变区域进入fv区。特定抗体分子的轻链可变区域vl和重链可变区域vh具有特异性氨基酸序列,其允许抗原结合位点呈现与该特定抗体所识别的抗原表位结合的构象。在可变区域内发现了氨基酸序列从一种抗体到另一种抗体极其可变的区域。在轻链和重链中的每一个中发现了这些所谓的“高变”区域或“互补决定区域”(cdr)中的三个。来自轻链的三个cdr和来自相应重链的三个cdr形成抗原结合位点。已经确定了许多免疫球蛋白重链和轻链的氨基酸序列,并揭示了抗体分子的两个重要特征。首先,每条链由一系列类似但不相同的序列组成,每个序列长约110个氨基酸。这些重复中的每一个对应于称为蛋白结构域的离散且紧密折叠的蛋白结构区域。轻链由两个这样的免疫球蛋白结构域组成,而igg抗体的重链含有四个。通过比较氨基酸序列揭示的第二个重要特征是重链和轻链的氨基末端序列在不同抗体之间变化很大。序列的可变性限于大约前110个氨基酸,对应于第一结构域,而其余结构域在相同同种型的免疫球蛋白链之间是恒定的。重链和轻链的氨基末端可变或v结构域(分别为vh和vl)一起构成抗体的v区域并赋予其结合特异性抗原的能力,而重链和轻链(分别为ch和cl)的恒定结构域(c结构域)构成c区域。多个重链c结构域从氨基末端到羧基末端编号,例如ch1、ch2等。上述的蛋白结构域相关联以形成更大的球状结构域。因此,当完全折叠和组装时,抗体分子包含三个相等大小的球状部分,其通过称为铰链区域的柔性多肽链连接。通过轻链与重链的氨基末端一半的相关联形成该y形结构的每个臂,而通过两条重链的羧基末端半配对形成y的主干。重链和轻链的相关联使得vh和vl结构域成对,ch1和cl结构域也是如此。ch3结构域彼此配对但ch2结构域不相互作用;连接到ch2结构域的碳水化合物侧链位于两条重链之间。通过y的两个臂末端处配对的vh和vl结构域形成两个抗原结合位点。切割多肽序列的蛋白水解酶(蛋白酶)已被用于剖析抗体分子的结构并确定分子的哪些部分负责其各种功能。用蛋白酶木瓜蛋白酶进行有限的消化将抗体分子切割成三个片段。两个片段是相同的并且含有抗原结合活性。这些被称为fab片段,用于片段抗原结合。fab片段对应于抗体分子的两个相同的臂,其含有与重链的vh和ch1结构域配对的完整轻链。另一个片段不含抗原结合活性但最初观察到容易结晶,因此将其命名为fc片段,用于可结晶的片段。该片段对应于配对的ch2和ch3结构域,并且是与效应子分子和细胞相互作用的抗体分子的一部分。重链同种型之间的功能差异主要在于fc片段。连接抗体分子的fc和fab部分的铰链区域实际上是柔性系链,允许两个fab臂的独立运动,而不是刚性铰链。本发明涉及用于针对病毒靶标的抗体介导的免疫的组合物和方法。特别地,本文提供了具有抗病毒活性的工程化免疫球蛋白。本发明提供了包含一种或多种突变的突变免疫球蛋白,优选在免疫球蛋白的fc区域或铰链区域中。在优选的实施方式中,突变以所需方式改变免疫球蛋白的功能。例如,在一些实施方式中,本发明提供了在fc区域中包含至少一个突变的变体免疫球蛋白在调节fcrn结合以增加抗体的体内半衰期中的应用。增加的半衰期对于治疗抗体是有利的。在一些实施方式中,相对于没有突变的免疫球蛋白,免疫球蛋白表现出与fcrn的改变的结合(例如增加或降低的结合亲和力)。在一些实施方式中,免疫球蛋白是igg1、igg2、igg3或igg4亚类。在一些实施方式中,免疫球蛋白在选自例如由kabat系统编号的311、428、434、435或438的一个或多个位置处具有突变。贯穿本公开内容,参考来自kabat,ea等,sequencesofproteinsofimmunologicalinterest(nationalinstitutesofhealth,bethesda,md.(1987)和(1991)的编号系统。在这些纲要中,kabat列出了每个亚类的抗体的许多氨基酸序列,并列出了该亚类中每个残基位置最常出现的氨基酸。kabat使用一种方法为所列序列中的每个氨基酸分配了残基编号,这种分配残基编号的方法已成为该领域的标准。在本说明书中遵循kabat编号方案。为了本发明的目的,为了将残基编号分配给未包括在kabat纲要中的候选抗体氨基酸序列,遵循以下步骤。通常,候选序列与kabat中的任何免疫球蛋白序列或任何共有序列一致。可以通过手动或通过计算机使用普遍接受的计算机程序完成比对;这样一个程序的示例是align2程序。通过使用大多数fab序列共有的一些氨基酸残基可以促进比对。例如,轻链和重链各自通常具有两个具有相同残基数的半胱氨酸;在vl结构域中,两个半胱氨酸通常在残基编号23和88处,并且在vh结构域中,两个半胱氨酸残基通常编号为22和92。框架残基通常但不总是具有大约相同数量的残基,然而cdr大小会有所不同。例如,在来自候选序列的cdr比与其比对的kabat序列中的cdr长的情况下,通常将后缀添加至残基编号以指示另外残基的插入。对于候选序列,例如,与残基34和36的kabat序列比对但在它们之间没有残基与残基35比对时,简单地将数字35不分配给残基。在一些实施方式中,本文描述了恒定链(例如fc)变体。本文所述的免疫球蛋白不限于特定的cdr或可变区域序列,并且能够产生或工程化以识别所需的任何抗原或表位。因此,在一些实施方式中,突变选自例如igg1-q311r/n434w/m428e、igg1-q311r/n434w、igg1-q311r、igg1-n434w、igg3(b)-q311r/n434w/m428e、igg3(b)-q311r/n434w/m438e/r435h、igg1-m252s/q311r/n434w/m428e、igg1-q311r/n434p/m428e、igg1-q311r/n434w/m428d、igg1-q311r/n434w/m428e/h433k、igg1-l309k/q311r/n434w/m428e、igg1-l309r/q311r/n434w/m428e、igg1-l309s/q311r/n434w/m428e或igg3(b)-q311r/n434w/m428e/r435h(例如,免疫球蛋白的恒定区域具有选自seqidno:2、3、4、5、7、8、9、10、11、12、13、14、15或16的氨基酸序列,或与seqidno:2、3、4、5、7、8、9、10、11、12、13、14、15或16至少90%(例如91%、92%、93%、94%、95%、96%、97%、98%或99%)相同的序列)。在一些具体实施方式中,免疫球蛋白具有q311r、n434w和m428e突变。可以将上述突变引入任何合适的免疫球蛋白分子中。在一些实施方式中,免疫球蛋白是单克隆抗体,并且优选通过重组技术产生。通过多种技术产生针对靶标抗原的单克隆抗体(例如细胞表面蛋白,如受体),包括常规的单克隆抗体方法,例如kohler和milstein,nature,256:495(1975)的体细胞杂交技术。尽管在一些实施方式中,体细胞杂交方法是优选的,但也考虑了用于产生单克隆抗体的其它技术(例如b淋巴细胞的病毒或致癌转化)。用于制备杂交瘤的优选动物系统是鼠系统。小鼠中的杂交瘤生产是完善的程序。免疫方案和用于分离免疫脾细胞的融合技术是本领域已知的。融合伴侣(例如鼠骨髓瘤细胞)和融合程序也是已知的。可以使用携带完整人类免疫系统而不是小鼠系统的转基因小鼠产生针对人类蛋白的人类单克隆抗体(mab)。来自转基因小鼠的脾细胞用感兴趣的抗原免疫,其用于产生分泌人类mab的杂交瘤,所述人类mab对来自人类蛋白的表位具有特异性亲和力。(参见例如wood等wo9i/00906;kucherlapati等wo91/10741;lonberg等wo92/03918;kay等wo92/03917[各自通过引用整体并入本文];n.lonberg等nature,368:856-859[1994];l.l.green等naturegenet.,7:13-21[1994];s.l.morrison等proc.nat.acad.sci.usa,81:6851-6855[1994];bruggeman等immunol.,7:33-40[1993];tuaillon等proc.nat.acad.sci.usa,90:3720-3724[1993]和bruggernan等eur.j.immunol.,21:1323-1326[1991])。也可以通过重组dna
技术领域:
的技术人员已知的其它方法产生单克隆抗体。已经开发了另一种方法,称为“组合抗体展示”方法,以鉴定和分离具有特定抗原特异性的抗体片段,并能够用于产生单克隆抗体。(参见例如sastry等proc.nat.acad.sci.usa,86:5728[1989];huse等science,246:1275[1989]和orlandi等proc.nat.acad.sci.usa,86:3833[1989])。在用如上所述的免疫原免疫动物后,克隆所得b细胞库的抗体库。通常已知通过使用寡聚体引物和pcr的混合物获得多种免疫球蛋白分子群的可变区域的dna序列的方法。例如,对应于5′前导序列(信号肽)序列和/或构架1(fr1)序列的混合寡核苷酸引物,以及对应于保守3′恒定区域引物的引物能够用于从许多鼠抗体pcr扩增重链和轻链可变区域。(参见例如larrick等biotechniques,11:152-156[1991])。类似的策略也能够用于从人类抗体扩增人类重链和轻链可变区域(参见例如larrick等methods:companiontomethodsinenzymology,2:106-110[1991])。可以通过本领域已知的重组dna技术产生嵌合小鼠-人类单克隆抗体。例如,用限制酶消化编码鼠(或其它种类)单克隆抗体分子的fc恒定区域的基因以除去编码鼠fc的区域,并且编码人类fc恒定区域的基因的等同部分被取代。(参见例如robinson等pct/us86/02269;欧洲专利申请184,187;欧洲专利申请171,496;欧洲专利申请173,494;wo86/01533;us4,816,567;欧洲专利申请125,023[各自通过引用整体并入本文];better等science,240:1041-1043[1988];liu等proc.nat.acad.sci.usa,84:3439-3443[1987];liu等j.immunol.,139:3521-3526[1987];sun等proc.nat.acad.sci.usa,84:214-218[1987];nishimura等canc.res.,47:999-1005[1987];wood等nature,314:446-449[1985]和shaw等j.natl.cancerinst.,80:1553-1559[1988])。通过替换fv可变区域的序列能够进一步人源化嵌合抗体,该fv可变区域不直接涉及抗原与人类fv可变区域的等同序列的结合。s.l.morrison,science,229:1202-1207(1985)和oi等bio.techniques,4:214(1986)提供了人源化嵌合抗体的一般综述。那些方法包括分离、操纵和表达编码来自重链或轻链中的至少一种的全部或部分免疫球蛋白fv可变区域的核酸序列。这种核酸的来源是本领域技术人员已知的,例如,可以从产生抗gpiibiiia抗体的杂交瘤7e3获得。然后可以将编码嵌合抗体或其片段的重组dna克隆到合适的表达载体中。可选地,可以通过cdr取代产生合适的人源化抗体(例如us5,225,539(通过引用整体并入本文);jones等,nature,321:552-525[1986];verhoeyan等,science,239:1534[1988]和beidler等,j.immunol.,141:4053[1988])。特定人类抗体的全部cdr可以用至少一部分非人类cdr替换,或者仅一些cdr可以用非人类cdr替换。仅需要替换人源化抗体与fc受体结合所需的cdr数量。可以通过能够用来源于非人类抗体的cdr替换人类抗体的至少一部分cdr的任何方法使抗体人源化。人类cdr可以用非人类cdr替换;使用寡核苷酸定点诱变。嵌合和人源化抗体也在本发明的范围内,其中特异性氨基酸已被取代、缺失或添加。特别地,优选的人源化抗体在框架区域中具有氨基酸取代,例如以改善与抗原的结合。例如,在具有小鼠cdr的人源化抗体中,位于人类框架区域的氨基酸可以被位于小鼠抗体中相应位置的氨基酸取代。已知这些取代在某些情况下改善人源化抗体与抗原的结合。在一些实施方式中,单克隆抗体是鼠抗体或其片段。在其它优选的实施方式中,单克隆抗体是牛抗体或其片段。例如,鼠抗体可以由杂交瘤产生,所述杂交瘤包括从转基因小鼠获得的b细胞,所述转基因小鼠具有包含重链转基因和与永生化细胞融合的轻链转基因的基因组。抗体可以是各种同种型,包括但不限于:igg(例如igg1、igg2、igg2a、igg2b、igg2c、igg3、igg4);igm;iga1;iga2;igasec;igd和ige。在一些优选实施方式中,抗体是igg同种型。在其它优选实施方式中,抗体是igm同种型。抗体可以是全长的(例如igg1、igg2、igg3或igg4抗体)或可以仅包括抗原结合部分(例如fab、f(ab′)2、fv或单链fv片段))。在优选实施方式中,免疫球蛋白是重组抗体(例如嵌合或人源化抗体)、亚基或其抗原结合片段(例如具有可变区域,或至少互补决定区域(cdr))。在一些实施方式中,免疫球蛋白是单价的(例如包括一对重链和轻链,或其抗原结合部分)。在其它实施方式中,免疫球蛋白是二价的(例如包括两对重链和轻链,或其抗原结合部分)。在一些实施方式中,本发明提供了疫苗组合物,其包含变体免疫球蛋白或其fc融合体和免疫原。本发明不受疫苗组合物的特定制剂的限制。实际上,除融合蛋白外,本发明的疫苗组合物可以包含一种或多种不同的试剂。这些试剂或辅助因子包括但不限于佐剂、表面活性剂、添加剂、缓冲剂、增溶剂、螯合剂、油、盐、治疗剂、药品、生物活性剂、抗菌剂和抗微生物剂(例如抗生素、抗病毒剂等)。在一些实施方式中,包含融合蛋白的疫苗组合物包含增强免疫原诱导免疫应答能力的试剂和/或辅助因子(例如佐剂)。在一些优选实施方式中,一种或多种辅助因子或试剂的存在降低了诱导免疫应答所需的免疫原的量(例如保护性免疫应答(例如保护性免疫))。在一些实施方式中,一种或多种辅助因子或试剂的存在可用于使针对细胞(例如t细胞介导的)或体液(例如抗体介导的)免疫应答的免疫应答偏斜。本发明不受本发明治疗剂中使用的辅因子或试剂的类型的限制。佐剂一般描述于疫苗设计-亚单元和佐剂方法(vaccinedesign--thesubunitandadjuvantapproach)中,由powell和newman编辑,plenumpress,newyork,1995。本发明不受所用佐剂类型的限制(例如用于组合物(例如药物组合物)中)。例如,在一些实施方式中,合适的佐剂包括铝盐,例如氢氧化铝凝胶(明矾)或磷酸铝。在一些实施方式中,佐剂可以是钙、铁或锌的盐,或可以是酰化酪氨酸、或酰化糖、阳离子或阴离子衍生多糖或聚磷腈的不溶性悬浮液。通常,通过抗原与免疫系统细胞的相互作用对抗原产生免疫应答。免疫应答可以大致分为两类:体液和细胞介导的免疫应答(例如传统上分别以抗体和细胞效应子保护机制为特征)。这些类型的应答被称为th1型应答(细胞介导的应答)和th2型免疫应答(体液应答)。免疫应答的刺激可以由免疫系统的细胞或组分对干预(例如暴露于免疫原)的直接或间接应答引起。可以以许多方式测量免疫应答,包括免疫系统细胞的活化、增殖或分化(例如b细胞、t细胞、树突细胞、apc、巨噬细胞、nk细胞、nkt细胞等);上调或下调标志物和细胞因子的表达;iga、igm或igg滴度的刺激;脾肿大(包括增加的脾细胞);各种器官中的增生和混合细胞浸润。可以针对免疫刺激评估的免疫系统的其它应答、细胞和组分是本领域已知的。尽管理解该机制对于实施本发明不是必需的,并且本发明不限于任何特定的作用机制,但在一些实施方式中,本发明的组合物和方法诱导细胞因子的表达和分泌(例如通过巨噬细胞、树突细胞和cd4+t细胞)。特定细胞因子的表达调控可局部或全身发生。已知细胞因子谱可以确定免疫应答中的t细胞调节和效应子功能。在一些实施方式中,可以诱导th1型细胞因子,因此,本发明的免疫刺激组合物可以促进th1型抗原特异性免疫应答,包括细胞毒性t细胞(例如从而避免不需要的th2型免疫应答(例如参与增强疾病严重性的th2型细胞因子(例如il-13)的产生(例如il-13诱导粘液形成)))。细胞因子在指导t细胞应答中起作用。辅助(cd4+)t细胞通过产生作用于其它免疫系统细胞(包括b和其它t细胞)的可溶性因子来协调哺乳动物的免疫应答。大多数成熟的cd4+t辅助细胞表达两种细胞因子谱中的一种:th1或th2。th1型cd4+t细胞分泌il-2、il-3、ifn-γ、gm-csf和高水平的tnf-α。th2细胞表达il-3、il-4、il-5、il-6、il-9、il-10、il-13、gm-csf和低水平的tnf-α。th1型细胞因子促进细胞介导的免疫和体液免疫,其特征在于免疫球蛋白类别转换为小鼠中的igg2a和人类中的igg1。th1应答也可能与延迟型超敏和自身免疫疾病相关。th2型细胞因子主要诱导体液免疫并诱导类别转换为igg1和ige。与th1应答相关的抗体同种型通常具有中和和调理能力,而与th2应答相关的那些与过敏应答更相关。已经显示了几种因素影响免疫应答对th1或th2型应答的偏斜。最具特征的调节剂是细胞因子。il-12和ifn-γ是阳性th1和阴性th2调节剂。il-12促进ifn-γ产生,ifn-γ为il-12提供正反馈。il-4和il-10对于建立th2细胞因子谱和下调th1细胞因子产生似乎是重要的。因此,在优选实施方式中,本发明提供了在受试者中刺激th1型免疫应答的方法,其包括向受试者施用包含免疫原的组合物。然而,在其它实施方式中,本发明提供了刺激受试者中th2型免疫应答的方法(例如如果需要平衡t细胞介导的应答),其包括向受试者施用包含免疫原的组合物。在进一步优选实施方式中,可以使用佐剂(例如可以与本发明的组合物共同施用)以使针对th1或th2型免疫应答的免疫应答偏斜。例如,诱导th2或减弱th1应答的佐剂包括但不限于明矾、皂苷和sb-as4。诱导th1应答的佐剂包括但不限于mpl、mdp、iscoms、il-12、ifn-γ和sb-as2。可以在本发明的组合物和方法中使用几种其它类型的th1型免疫原(例如作为佐剂)。这些包括但不限于以下内容。在一些实施方式中,使用单磷酰脂质a(例如特别是3-de-o-酰化的单磷酰脂质a(3d-mpl))。3d-mpl是由montana的ribiimmunochem制造的已知佐剂。在化学上,它通常作为3-脱氧-酰化单磷酰脂质a与4、5或6个酰化链的混合物提供。在一些实施方式中,使用二磷酰脂质a和其3-o-脱酰基变体。这些免疫原中的每一种都可以通过gb2122204b中描述的方法纯化和制备,该文献通过引用整体并入本文。已经描述了其它纯化和合成的脂多糖(参见例如美国专利号6,005,099和ep0729473;hilgers等,1986,int.arch.allergy.immunol.,79(4):392-6;hilgers等,1987,immunology,60(1):141-6和ep0549074,其各自通过引用整体并入本文)。在一些实施方式中,3d-mpl以颗粒制剂的形式使用(例如具有小于0.2μm直径的小粒径,描述于ep0689454中,其通过引用整体并入本文)。在一些实施方式中,皂苷在本发明的组合物中用作免疫原(例如th1型佐剂)。皂苷是众所周知的佐剂(参见例如lacaille-dubois和wagner(1996)phytomedicinevol2pp363-386)。皂苷的示例包括quila(来源于南美树quillajasaponariamolina的树皮)及其部分(参见例如美国专利号5,057,540;kensil,critrevtherdrugcarriersyst,1996,12(1-2):1-55和ep0362279,其各自通过引用整体并入本文中)。还考虑了在本发明中有用的是溶血性皂苷qs7、qs17和qs21(quila的hplc纯化级分;参见例如kensil等(1991).j.immunology146,431-437,美国专利号5,057,540;wo96/33739;wo96/11711和ep0362279,其各自通过引用整体并入本文)。还考虑了有用的是qs21和聚山梨醇酯或环糊精的组合(参见例如wo99/10008,其通过引用整体并入本文中)。在一些实施方式中,含有未甲基化的cpg二核苷酸(“cpg”)的免疫原性寡核苷酸用作佐剂。cpg是dna中存在的胞嘧啶-鸟苷二核苷酸基序的缩写。当通过全身和粘膜途径施用时,cpg在本领域中已知为佐剂(参见例如wo96/02555,ep468520,davis等j.immunol,1998,160(2):870-876;mccluskie和davis,j.immunol.,1998,161(9):4463-6;以及美国专利申请号20050238660,其各自通过引用整体并入本文)。例如,在一些实施方式中,免疫刺激序列是嘌呤-嘌呤-c-g-嘧啶-嘧啶;其中,cg基序不是甲基化的。尽管理解该机制对于实施本发明不是必需的,并且本发明不限于任何特定的作用机制,但在一些实施方式中,一种或多种cpg寡核苷酸的存在活化包括天然杀伤细胞(其产生ifn-γ)和巨噬细胞在内的各种免疫亚群。在一些实施方式中,将cpg寡核苷酸配制成本发明的组合物以用于诱导免疫应答。在一些实施方式中,cpg的游离溶液与抗原一起共同施用(例如存在于溶液中(参见例如wo96/02555;通过引用并入本文))。在一些实施方式中,cpg寡核苷酸共价缀合至抗原(参见例如wo98/16247,通过引用并入本文),或与载体如氢氧化铝一起配制(参见例如brazolot-millan等proc.natl.acadsci.,usa,1998,95(26),15553-8)。在一些实施方式中,佐剂与包含本发明的免疫原的组合物一起使用,该佐剂例如为完全弗氏佐剂和不完全弗氏佐剂、细胞因子(例如白细胞介素(例如il-2、ifn-γ、il-4等)、巨噬细胞集落刺激因子、肿瘤坏死因子等)、细菌adp-核糖基化毒素的解毒突变体(如霍乱毒素(ct)、百日咳毒素(pt)或大肠杆菌热不稳定毒素(lt)),特别是lt-k63(其中在位置63处野生型氨基酸被赖氨酸取代)、lt-r72(其中在位置72处的野生型氨基酸被精氨酸取代)、ct-s109(其中在位置109处野生型氨基酸被丝氨酸取代)和pt-k9/g129(其中在位置9处的野生型氨基酸被赖氨酸取代且在位置129处被甘氨酸取代)(参见例如wo93/13202和w092/19265,其各自通过引用并入本文)以及其它免疫原性物质(例如增强本发明组合物的有效性)。发现本发明使用的佐剂的另外示例包括聚(二(羧基苯氧基)磷腈(pcpp聚合物;virusresearchinstitute,usa);脂多糖衍生物如单磷酰脂质a(mpl;ribiimmunochemresearch,inc.,hamilton,mont.)、胞壁酰二肽(mdp;ribi)和苏氨酰-胞壁酰二肽(t-mdp;ribi);om-174(与脂质a相关的葡糖胺二糖;ompharmasa,meyrin,switzerland)和利什曼原虫延伸因子(纯化的利什曼原虫蛋白;corixacorporation,seattle,wash.)。在与组合物组合或共同施用之前,佐剂可以添加到包含免疫原的组合物中,可选地,佐剂可以与载体一起配制,例如脂质体、或金属盐(例如铝盐(例如氢氧化铝))。在一些实施方式中,包含免疫原的组合物包含单一佐剂。在其它实施方式中,组合物包含两种或更多种佐剂(参见例如wo94/00153;wo95/17210;wo96/33739;wo98/56414;wo99/12565;wo99/11241和wo94/00153,其各自通过引用整体并入本文)。在一些实施方式中,包含免疫原的组合物包含一种或多种粘膜粘附剂(参见例如美国专利申请号20050281843,其通过引用整体并入本文)。本发明不受所用粘膜粘附剂类型的限制。实际上,多种粘膜粘附剂被认为可用于本发明,包括但不限于聚(丙烯酸)(例如卡波姆和聚卡波非)、聚乙烯醇、聚乙烯吡咯烷酮、多糖(例如藻酸盐和壳聚糖)、羟丙基甲基纤维素、凝集素、菌毛蛋白和羧甲基纤维素的交联衍生物。尽管理解该机制对于实施本发明不是必需的,并且本发明不限于任何特定的作用机制,但在一些实施方式中,由于与不使用粘膜粘附剂时暴露于免疫原的持续时间和/或量相比,使用粘膜粘附剂时受试者所经历的免疫原的持续时间和/或暴露量增加,粘膜粘附剂(例如在包含免疫原的组合物中)的使用增强了受试者中免疫应答的诱导(例如施用本发明的组合物)。在一些实施方式中,免疫球蛋白和/或疫苗组合物与适当的盐和缓冲液一起使用,以使组合物递送至受试者。当将组合物引入到患者体内时也使用缓冲剂。水性组合物包含分散在药学上可接受的载体或水介质中的有效量的组合物。这种组合物也称为接种物。短语“药学上或药理学上可接受的”是指当施用于动物或人类时不产生不利、过敏或其它不良反应的分子实体和组合物。如本文所用,“药学上可接受的载体”包括任何和全部溶剂、分散介质、包衣、抗细菌和抗真菌剂、等渗和吸收延迟剂等。除非任何常规介质或试剂与本发明的载体或细胞不相容,否则考虑其在治疗组合物中的用途。补充的活性成分也可以并入组合物中。在本发明一些实施方式中,活性组合物包括典型的药物制剂。根据本发明的这些组合物的施用可以是通过任何常用途径进行的,只要靶标组织可通过该途径获得。这包括口腔、鼻腔、颊、直肠、阴道或局部施用。可选地,可以通过原位、皮内、皮下、肌肉内、腹膜内或静脉内注射施用。还可以肠胃外或腹膜内施用该组合物。适当地与表面活性剂如羟丙基纤维素混合以在水中制备作为游离碱或药理学上可接受的盐的活性化合物的溶液。也可以在甘油、液体聚乙二醇及其混合物和油中制备分散体。在通常的储存和使用条件下,这些制剂含有防腐剂以防止微生物的生长。适于注射使用的药物形式包括无菌水溶液或分散体和用于临时制备无菌可注射溶液或分散体的无菌粉末。载体可以是溶剂或分散体介质,其含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇等)、其合适的混合物和植物油。例如,通过使用包衣(如卵磷脂),在分散体的情况下通过维持所需的粒度和通过使用表面活性剂,可以维持适当的流动性。可以通过各种抗细菌剂和抗真菌剂(例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸、硫柳汞等)来防止微生物的作用。在许多情况下,可能优选包括等渗剂,例如糖或氯化钠。通过在组合物中使用延迟吸收的试剂(例如单硬脂酸铝和明胶)可以实现可注射组合物的延长吸收。通过在适当的溶剂中掺入所需量的活性化合物和以上列举的各种其它成分,如果需要,然后通过过滤灭菌制备无菌可注射溶液。通常,通过将各种灭菌活性成分掺入无菌载体中来制备分散体,所述无菌载体含有碱性分散体介质和来自上面列举的那些的所需其它成分。在用于制备无菌可注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥技术,该方法可以从其先前无菌过滤的溶液中得到活性成分和任何另外所需成分的粉末。在配制时,以与剂量制剂相容的方式和治疗有效的量施用组合物。易于以多种剂型施用制剂,例如可注射溶液、药品释放胶囊等。例如,对于在水溶液中的肠胃外施用,如果需要,适当地缓冲溶液,并且首先用足够的盐水或葡萄糖使液体稀释剂等渗。这些特定的水溶液特别适用于静脉内、肌肉内、皮下和腹膜内施用。例如,可以将一次剂量溶解在1ml等渗nacl溶液中,并且将其添加到1000ml的皮下注射液中或者在建议的输注部位注射(参见例如“remington′spharmaceuticalsciences”第15版,第1035-1038和1570-1580页)。在本发明一些实施方式中,在治疗混合物中将活性颗粒或试剂配制成每剂量包含约0.0001至1.0毫克、或约0.001至0.1毫克、或约0.1至1.0或甚至约10毫克左右。可以施用多次剂量。适用于其它施用方式的另外制剂包括阴道栓剂和子宫托。也可以使用直肠子宫托或栓剂。栓剂是各种重量和形状的固体剂型,通常是药物,用于插入直肠、阴道或尿道。插入后,栓剂软化、融化或溶解在腔体液中。通常,对于栓剂,传统的粘合剂和载体可以包括例如聚亚烷基二醇或甘油三酯;可以由含有0.5%-10%,优选1%-2%范围内的活性成分的混合物形成这种栓剂。阴道栓剂或子宫托通常为球状或卵形,每个重约5g。阴道药物的多种物理形式是可用的,例如霜剂、凝胶或液体,这些都不同于栓剂的典型概念。在本发明的上下文中“治疗”是指全部或部分缓解与障碍或疾病相关的症状,或减缓、抑制或停止这些症状的进一步发展或恶化,或预防或防治患有疾病或障碍风险的受试者的疾病或障碍。因此,例如,治疗病毒感染可以包括抑制或预防受试者中病毒的复制或减少受试者中病毒感染的症状。如本文所用,本发明化合物的“治疗有效量”是指化合物的量,其全部或部分缓解与障碍或疾病相关的症状,或减缓、抑制或停止这些症状的进一步发展或恶化,或预防或防治患有疾病或障碍风险的受试者的疾病或障碍。受试者是可以受益于施用本文所述化合物的任何动物。在一些实施方式中,受试者是哺乳动物,例如人类、灵长类动物、狗、猫、马、牛、猪、啮齿动物(例如大鼠或小鼠)。通常,受试者是人类。用于本发明的治疗有效量的本文所述的化合物可以根据施用途径和剂型而变化。有效量的本发明化合物通常落在约0.001至100mg/kg/天的范围内,更通常在约0.05至10mg/kg/天的范围内。通常,选择用于本发明的一种或多种化合物以提供表现出高治疗指数的制剂。治疗指数是毒性和治疗效果之间的剂量比,其可以表达为ld50和ed50之间的比率。ld50是对50%人群致死的剂量,ed50是在50%人群中治疗有效的剂量。通过动物细胞培养物或实验动物中的标准药学方法测定ld50和ed50。本发明还提供了药物组合物和药物,其可以通过将一种或多种本文所述化合物、其药学上可接受的盐、其立体异构体、其互变异构体或溶剂化物与药学上可接受的载体、赋形剂、粘合剂或稀释剂等结合来制备,以抑制或治疗原发性和/或转移性前列腺癌。此类组合物可以是例如小颗粒、粉末、片剂、胶囊、糖浆、栓剂、注射剂、乳剂、酏剂、悬浮液或溶液的形式。可以配制本组合物用于各种施用途径,例如通过口腔、肠胃外、局部、直肠、鼻腔或通过植入的库。肠胃外或全身施用包括但不限于皮下、静脉内、腹膜内和肌肉内注射。以下剂型是作为示例给出的,不应解释为限制本发明。对于口腔、颊和舌下施用,粉末、悬浮液、小颗粒、片剂、丸剂、胶囊、软胶囊和囊片作为固体剂型是可接受的。这些可以通过例如将一种或多种本发明化合物或其药学上可接受的盐或互变异构体与至少一种添加剂如淀粉或其它添加剂混合而制备。合适的添加剂是蔗糖、乳糖、纤维素糖、甘露醇、麦芽糖醇、右旋糖酐、淀粉、琼脂、藻酸盐、几丁质、脱乙酰壳多糖、果胶、黄蓍胶、阿拉伯树胶、明胶、胶原蛋白、酪蛋白、白蛋白、合成或半合成聚合物或甘油酯。任选地,口腔剂型可以含有其它有助于施用的成分,例如惰性稀释剂,或润滑剂如硬脂酸镁,或防腐剂如对羟基苯甲酸酯或山梨酸,或抗氧化剂如抗坏血酸、生育酚或半胱氨酸,崩解剂,粘合剂,增稠剂,缓冲剂,甜味剂,调味剂或芳香剂。片剂和丸剂可以用本领域已知的合适的包衣材料进一步处理。用于口腔施用的液体剂型可以是药学上可接受的乳剂、糖浆、酏剂、悬浮液和溶液的形式,其可以含有惰性稀释剂,例如水。可以使用无菌液体(例如但不限于油、水、醇和这些的组合)将药物制剂和药物制备成液体悬浮液或溶液。可以添加药学上合适的表面活性剂、悬浮剂、乳化剂用于口腔或肠胃外施用。如上所述,悬浮液可以包括油。这些油包括但不限于花生油、芝麻油、棉籽油、玉米油和橄榄油。悬浮液制剂还可以含有脂肪酸酯,例如油酸乙酯、肉豆蔻酸异丙酯、脂肪酸甘油酯和乙酰化脂肪酸甘油酯。悬浮液制剂可以包括醇,例如但不限于乙醇、异丙醇、十六烷醇、甘油和丙二醇。醚类例如但不限于聚(乙二醇)、石油烃类(如矿物油和凡士林)和水也可用于悬浮液制剂中。可注射剂型通常包括水性悬浮液或油悬浮液,其可以使用合适的分散剂或润湿剂和悬浮剂来制备。可注射形式可以是溶液相或悬浮液形式,其用溶剂或稀释剂制备。可接受的溶剂或载体包括无菌水、林格氏溶液或等渗盐水溶液。可选地,无菌油可用作溶剂或悬浮剂。通常,油或脂肪酸是非挥发性的,包括天然或合成油、脂肪酸、甘油单酯、甘油二酯或甘油三酯。对于注射,药物制剂和/或药物可以是适合用如上所述的适当溶液重构的粉末。这些示例包括但不限于冷冻干燥、旋转干燥或喷雾干燥的粉末、无定形粉末、小颗粒、沉淀物或颗粒。对于注射,制剂可任选地含有稳定剂、ph调节剂、表面活性剂、生物利用度调节剂和这些的组合。对于直肠施用,药物制剂和药物可以是用于在肠、乙状结肠弯曲和/或直肠中释放化合物的栓剂、软膏剂、灌肠剂、片剂或霜剂的形式。通过将一种或多种本发明化合物或该化合物的药学上可接受的盐或互变异构体与可接受的载体(例如可可脂或聚乙二醇)混合来制备直肠栓剂,所述载体在正常储存温度下以固相存在,在适合于在体内(例如直肠中)释放药品的温度下以液相存在。油也可用于制备软明胶类型和栓剂的制剂。水、盐水、葡萄糖水溶液和相关的糖溶液以及甘油可用于制备悬浮液制剂,该制剂也可以含有悬浮剂,例如果胶、卡波姆、甲基纤维素、羟丙基纤维素或羧甲基纤维素,以及缓冲剂和防腐剂。可以通过鼻或口吸入将本发明化合物施用至肺部。用于吸入的合适药物制剂包括溶液、喷雾剂、干粉剂或含有任何适当溶剂和任选其它化合物(例如但不限于稳定剂、抗微生物剂、抗氧化剂、ph调节剂、表面活性剂、生物利用度调节剂和这些的组合)的气溶胶。用于吸入施用的制剂含有赋形剂,例如乳糖、聚氧乙烯-9-月桂基醚、甘氨胆酸盐和脱氧胆酸盐。水性和非水性气溶胶通常用于通过吸入递送本发明化合物。通常,通过将化合物的水溶液或悬浮液与常规的药学上可接受的载体和稳定剂一起配制来制得水性气溶胶。载体和稳定剂随特定化合物的需要而变化,但通常包括非离子表面活性剂(tween,pluronics或聚乙二醇),无害蛋白如血清白蛋白、脱水山梨糖醇酯、油酸、卵磷脂、氨基酸(如甘氨酸)、缓冲剂、盐、糖或糖醇。通常由等渗溶液制备气溶胶。非水悬浮液(例如在碳氟化合物推进剂中)也可用于递送本发明的化合物。使用吸入器、雾化器、加压包装或喷雾器和合适的推进剂(例如但不限于加压的二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷、氮气、空气或二氧化碳)方便地递送含有根据本发明使用的化合物的气溶胶。在加压气溶胶的情况下,可以通过提供阀门来控制剂量单位以递送计量的量。可以配制用于吸入器或吹入器的例如明胶的胶囊和药筒,其含有化合物和合适的粉末基质如乳糖或淀粉的粉末混合物。使用声波喷雾器递送本发明的气溶胶是有利的,因为喷雾器可以使试剂暴露于剪切最小化,该剪切可导致化合物的降解。对于鼻腔施用,药物制剂和药物可以是含有适当溶剂和任选其它化合物(例如但不限于稳定剂、抗微生物剂、抗氧化剂、ph调节剂、表面活性剂、生物利用度调节剂和这些的组合)的喷雾剂、滴鼻剂或气溶胶。对于以滴鼻剂形式施用,化合物可以配制成油性溶液或凝胶。对于鼻气溶胶的施用,可以使用任何合适的推进剂,包括压缩空气、氮气、二氧化碳或基于烃的低沸点溶剂。用于局部(包括颊和舌下)或透皮施用本发明化合物的剂型包括粉末、喷雾剂、软膏剂、糊剂、霜剂、洗剂、凝胶、溶液和贴剂。活性成分可以在无菌条件下与药学上可接受的载体或赋形剂以及可能需要的任何防腐剂或缓冲剂混合。可以用例如赋形剂如乳糖、滑石、硅酸、氢氧化铝、硅酸钙和聚酰胺粉末或这些物质的混合物来制备粉末和喷雾剂。软膏剂、糊剂、霜剂和凝胶还可以含有赋形剂,例如动物和植物脂肪、油、蜡、石蜡、淀粉、黄蓍胶、纤维素衍生物、聚乙二醇、硅氧烷、膨润土、硅酸、滑石和氧化锌或其混合物。透皮贴剂具有提供本发明化合物向身体受控递送的附加优点。可以通过将试剂溶解或分散在适当的介质中来制得这种剂型。吸收增强剂也可用于增加本发明化合物在皮肤上的通量。可以通过提供速率控制膜或将化合物分散在聚合物基质或凝胶中来控制这种通量的速率。除了上述那些代表性剂型外,药学上可接受的赋形剂和载体通常是本领域技术人员已知的,因此包括在本发明中。此类赋形剂和载体描述于例如“remingtonspharmaceuticalsciences”mackpub.co.,newjersey(1991)中,其通过引用并入本文。如下所述,本发明的制剂可以设计成短效、快速释放、长效和持续释放。因此,药物制剂也可以配制用于控释或缓释。本组合物还可以包含例如胶束或脂质体,或一些其它包囊形式,或者可以以延长释放形式施用以提供延长的储存和/或递送效果。因此,药物制剂和药物可以被压缩成小丸或圆柱体,并作为贮库注射剂或作为植入物如支架进行肌肉内或皮下植入。这种植入物可以使用已知的惰性材料,例如硅氧烷和可生物降解的聚合物。可以根据受试者的疾病状况、年龄、体重、一般健康状况、性别和饮食,剂量间隔,施用途径,排泄率和药品组合调整具体剂量。含有有效量的任何上述剂型都在常规实验的范围内,因此,在本发明的范围内。在本发明一些实施方式中,提供了用于治疗和预防任何数量的障碍的方法和组合物。发现治疗抗体可用于治疗例如癌症、自身免疫疾病、感染(例如病毒感染)等。在一些实施方式中,将本文所述的免疫球蛋白与另一种治疗剂(例如抗癌剂、免疫抑制剂或抗病毒剂)组合施用。在一些实施方式中,用本文所述的免疫球蛋白的治疗在其它试剂治疗之前或之后以数分钟至数周的间隔进行。在将其它试剂和免疫球蛋白分别应用于细胞的实施方式中,通常确保在每次递送的时间之间相当长的一段时间没有到期,使得多种疗法仍然能够对细胞发挥有利的组合效果。在这种情况下,考虑了在彼此约12-24小时内将细胞与两种形式接触,更优选彼此在约6-12小时内接触,最优选仅约12小时的延迟时间。在某些情况下,可能需要显著延长治疗时间,然而,在各个施用之间的几天(2至7)至数周(1至8)的时间间隔时可能失效。在一些实施方式中,使用超过一次施用本发明的免疫治疗组合物或其它药剂。可以使用各种组合,其中免疫球蛋白是“a”且另一种试剂是“b”,如下例所示:a/b/a、b/a/b、b/b/a、a/a/b、b/a/a、a/b/b、b/b/b/a、b/b/a/b、a/a/b/b、a/b/a/b、a/b/b/a、b/b/a/a、b/a/b/a、b/a/a/b、b/b/b/a、a/a/a/b、b/a/a/a、a/b/a/a、a/a/b/a、a/b/b/b、b/a/b/b、b/b/a/b。考虑了其它组合。在本发明一些实施方式中,将一种或多种本发明化合物和另外的活性剂以序列和时间间隔施用于受试者(更通常是人类),使得化合物可以与其它试剂一起起作用,以相对于如果以其它方式施用而获得的益处而提供增强的益处。例如,另外的活性剂可以通过共同制剂共同施用,同时施用或在不同时间点以任何顺序依次施用;然而,如果不同时施用,它们应该在足够接近的时间内施用,以便提供所需的治疗或预防效果。在一些实施方式中,化合物和另外的活性剂在重叠的时间发挥其效果。每种另外的活性剂可以以任何适当的形式和通过任何合适的途径分开施用。在其它实施方式中,在施用另外的活性剂之前、同时或之后施用化合物。在各种示例中,在相隔少于约1小时、相隔约1小时、相隔约1小时至约2小时、相隔约2小时至约3小时、相隔约3小时至约4小时、相隔约4小时至约5小时、相隔约5小时至约6小时、相隔约6小时至约7小时、相隔约7小时至约8小时、相隔约8小时至约9小时、相隔约9小时至约10小时、相隔约10小时至约11小时、相隔约11小时至约12小时、相隔不超过24小时或相隔不超过48小时内施用化合物和另外的活性剂。在其它示例中,同时施用化合物和另外的活性剂。在其它示例中,通过共同制剂同时施用化合物和另外的活性剂。在其它示例中,在相隔约2至4天、相隔约4至6天、相隔约1周、相隔约1至2周或相隔超过2周内施用化合物和另外的活性剂。在某些示例中,将本发明化合物和任选的另外活性剂循环施用于受试者。循环疗法涉及施用第一试剂一段时间,然后施用第二试剂和/或第三试剂一段时间并重复该顺序施用。循环疗法可以提供多种益处,例如减少对一种或多种疗法的抗性的发展,避免或减少一种或多种疗法的副作用和/或改善治疗的功效。在其它示例中,以少于约3周、约每2周一次、约每10天一次或约每周一次的周期施用本发明一些实施方式的一种或多种化合物和任选的另外的活性剂。一个循环可以包含通过每个循环输注约90分钟、每个循环输注约1小时、每个循环输注约45分钟、每个循环输注约30分钟或每个循环输注约15分钟以施用本发明化合物和任选的第二活性剂。每个循环可以包含至少1周的休息、至少2周的休息、至少3周的休息。施用循环数为约1至约12个循环,更通常为约2至约10个循环,更通常为约2至约8个循环。治疗过程可以同时施用于受试者,即在一段时间间隔内分别施用单独剂量的另外的活性剂,使得本发明化合物可以与另外的活性剂一起起作用。例如,将每周施用一次一种组分与每2周施用一次或每3周施用一次其它组分组合。换句话说,即使不同时或在同一天施用治疗剂,施用方案也同时进行。另外的活性剂可以与本发明化合物相加或更通常地协同作用。在一个示例中,在同一药物组合物中将一种或多种本发明化合物与一种或多种第二活性剂同时施用。在另一个示例中,在分开的药物组合物中将一种或多种本发明化合物与一种或多种第二活性剂同时施用。在又一个示例中,在施用第二活性剂之前或之后施用一种或多种本发明化合物。本发明考虑了通过相同或不同的施用途径(例如口腔和肠胃外)施用本发明化合物和第二活性剂。在某些实施方式中,当将本发明化合物与可能产生不良副作用(包括但不限于毒性)的第二活性剂同时施用时,可以有利地以低于引起不良副作用的阈值的剂量施用第二活性剂。事实上,任何抗原都可以被igg变体靶向,包括但不限于属于以下靶标抗原列表的蛋白、亚基、结构域、基序和/或表位,其包括可溶性因子如细胞因子和膜结合因子,包括跨膜受体:17-ia、4-1bb、4dc、6-酮-pgf1a、8-异pgf2a、8-氧代基-dg、a1腺苷受体、a33、ace、ace-2、激活素、激活素a、激活素ab、激活素b、激活素c、激活素ria、激活素riaalk-2、激活素ribalk-4、激活素riia、激活素riib、adam、adam10、adam12、adam15、adam17/tace、adam8、adam9、adamts、adamts4、adamts5、趱址素、afgf、alcam、alk、alk-1、alk-7、α-1抗胰蛋白酶、α-v/β-1拮抗剂、ang、ang、apaf-1、ape、apj、app、april、ar、arc、art、青蒿琥酯、抗id、aspartic、心房钠尿因子、av/b3整合素、axl、b2m、b7-1、b7-2、b7-h、b淋巴细胞刺激因子(blys)、bace、bace-1、bad、baff、baff-r、bag-1、bak、bax、bca-1、bcam、bc1、bcma、bdnf、b-ecgf、bfgf、bid、bik、bim、blc、bl-cam、blk、bmp、bmp-2bmp-2a、bmp-3骨质素、bmp-4bmp-2b、bmp-5、bmp-6vgr-1、bmp-7(op-1)、bmp-8(bmp-8a、op-2)、bmpr、bmpr-ia(alk-3)、bmpr-ib(alk-6)、brk-2、rpk-1、bmpr-ii(brk-3)、bmps、b-ngf、bok、蛙皮素、骨源性神经营养因子、bpde、bpde-dna、btc、补体因子3(c3)、c3a、c4、c5、c5a、c10、ca125、cad-8、降钙素、camp、癌胚抗原(cea)、癌相关抗原、组织蛋白酶a、组织蛋白酶b、组织蛋白酶c/dppi、组织蛋白酶d、组织蛋白酶e、组织蛋白酶h、组织蛋白酶l、组织蛋白酶o、组织蛋白酶s、组织蛋白酶v、组织蛋白酶x/z/p、cbl、cci、cck2、ccl、ccl1、ccl11、ccl12、ccl13、ccl14、ccl15、ccl16、ccl17、ccl18、ccl19、ccl2、ccl20、ccl21、ccl22、ccl23、ccl24、ccl25、ccl26、ccl27、ccl28、ccl3、ccl4、ccl5、ccl6、ccl7、ccl8、ccl9/10、ccr、ccr1、ccr10、ccr10、ccr2、ccr3、ccr4、ccr5、ccr6、ccr7、ccr8、ccr9、cd1、cd2、cd3、cd3e、cd4、cd5、cd6、cd7、cd8、cd10、cd11a、cd11b、cd11c、cd13、cd14、cd15、cd16、cd18、cd19、cd20、cd21、cd22、cd23、cd25、cd27l、cd28、cd29、cd30、cd30l、cd32、cd33(p67蛋白)、cd34、cd38、cd40、cd40l、cd44、cd45、cd46、cd49a、cd52、cd54、cd55、cd56、cd61、cd64、cd66e、cd74、cd80(b7-1)、cd89、cd95、cd123、cd137、cd138、cd140a、cd146、cd147、cd148、cd152、cd164、ceacam5、cftr、cgmp、cinc、肉毒梭菌毒素、产气荚膜梭菌毒素、ckb8-1、clc、cmv、cmvul、cntf、cntn-1、cox、c-ret、crg-2、ct-1、ctack、ctgf、ctla-4、cx3cl1、cx3cr1、cxcl、cxcl1、cxcl2、cxcl3、cxcl4、cxcl5、cxcl6、cxcl7、cxcl8、cxcl9、cxcl10、cxcl11、cxcl12、cxcl13、cxcl14、cxcl15、cxcl16、cxcr、cxcr1、cxcr2、cxcr3、cxcr4、cxcr5、cxcr6、细胞角蛋白肿瘤相关抗原、dan、dcc、dcr3、dc-sign、衰变加速因子、des(1-3)-igf-i(脑igf-1)、dhh、地高辛、dnam-1、dna酶、dpp、dppiv/cd26、dtk、ecad、eda、eda-a1、eda-a2、edar、egf、egfr(erbb-1)、ema、emmprin、ena、内皮素受体、脑啡肽、enos、eot、嗜酸粒细胞趋化蛋白、epcam、ephrinb2/ephb4、epo、ercc、内皮细胞选择素、et-1、因子iia、因子vii、因子viiic、因子ix、成纤维细胞活化蛋白(fap)、fas、fcr1、fen-1、铁蛋白、fgf、fgf-19、fgf-2、fgf3、fgf-8、fgfr、fgfr-3、纤维蛋白、fl、flip、flt-3、flt-4、卵泡束激素、fractalkine、fzd1、fzd2、fzd3、fzd4、fzd5、fzd6、fzd7、fzd8、fzd9、fzd10、g250、gas6、gcp-2、gcsf、gd2、gd3、gdf、gdf-1、gdf-3(vgr-2)、gdf-5(bmp-14、cdmp-1)、gdf-6(bmp-13、cdmp-2)、gdf-7(bmp-12、cdmp-3)、gdf-8(抑制肌骨素)、gdf-9、gdf-15(mic-1)、gdnf、gdnf、gfap、gfra-1、gfr-α1、gfr-α-2、gfr-α3、gitr、胰高血糖素、glut4、糖蛋白iib/iiia(gpiib/iiia)、gm-csf、gp130、gp72、gro、生长激素释放因子、半抗原(np-帽或nip-帽)、hb-egf、hcc、hcmvgb包膜糖蛋白、hcmv)gh包膜糖蛋白、hcmvul、造血生长因子(hgf)、hepbgp120、肝素酶、her2、her2/neu(erbb-2)、her3(erbb-3)、her4(erbb-4)、单纯疱疹病毒(hsv)gb糖蛋白、hsvgd糖蛋白、hgfa、高分子量黑色素瘤相关抗原(hmw-maa)、hivgp120、hiviiibgp120v3环、hla、hla-dr、hm1.24、hmfgpem、hrg、hrk、人类心肌肌球蛋白、人类巨细胞病毒(hcmv)、人类生长激素(hgh)、hvem、1-309、iap、icam、icam-1、icam-3、ice、icos、ifng、ig、iga受体、ige、igf、igf结合蛋白、igf-1r、igfbp、igf-i、igf-ii、il、il-1、il-1r、il-2、il-2r、il-4、il-4r、il-5、il-5r、il-6、il-6r、il-8、il-9、il-10、il-12、il-13、il-15、il-18、il-18r、il-23、干扰素(inf)-α、nf-β、ifn-γ、抑制素、inos、胰岛素a链、胰岛素b链、胰岛素样生长因子1、整合素α2、整合素α3、整合素α4、整合素α4/β7、整合素α4/β7、整合素α5(αv)、整合素α5/β1、整合素α5/β3、整合素α6、整合素β1、整合素β2、干扰素γ、ip-10、i-tac、je、激肽释放酶2、激肽释放酶5、激肽释放酶6、激肽释放酶11、激肽释放酶12、激肽释放酶14、激肽释放酶15、激肽释放酶l1、激肽释放酶l2、激肽释放酶l3、激肽释放酶l4、kc、kdr、角质形成细胞生长因子(kgf)、层粘连蛋白5、lamp、lap、lap(tgf-1)、潜在tgf-1、潜在tgf-1bp1、lbp、ldgf、lect2、lefty、lewis-y抗原、lewis-y相关抗原、lfa-1、lfa-3、lfo、lif、light、脂蛋白、lix、lkn、lptn、l-选择素、lt-a、lt-b、ltb4、ltbp-1、肺表面活性剂、促黄体激素、淋巴毒素β受体、mac-1、madcam、mag、map2、marc、mcam、mcam、mck-2、mcp、m-csf、mdc、mer、金属蛋白酶(metalloproteases)、mgdf受体、mgmt、mhc(hla-dr)、mif、mig、mip、mip-1-α、mk、mmac1、mmp、mmp-1、mmp-10、mmp-11、mmp-12、mmp-13、mmp-14、mmp-15、mmp-2、mmp-24、mmp-3、mmp-7、mmp-8、mmp-9、mpif、mpo、msk、msp、粘蛋白(muc1)、muc18、苗勒管抑制物质、mug、musk、naip、nap、ncad、n-钙粘素、nca90、ncam、ncam、脑啡肽酶、神经营养因子3、神经营养因子4、或神经营养因子6、神经生长因子抗体、神经生长因子(ngf)、ngfr、ngf-β、nnos、no、nos、npn、nrg-3、nt、ntn、ob、ogg1、opg、opn、osm、ox40l、ox40r、p150、p95、padpr、甲状旁腺激素、parc、parp、pbr、pbsf、pcad、p-钙粘素、pcna、pdgf、pdgf、pdk-1、pecam、pem、pf4、pge、pgf、pgi2、pgj2、pin、pla2、胎盘碱性磷酸酶(plap)、pigf、plp、pp14、胰岛素原、松弛素原、蛋白c、ps、psa、psca、前列腺特异性膜抗原(psma)、pten、pthrp、ptk、ptn、r51、rank、rankl、rantes、rantes、松弛素a链、松弛素b链、肾素、呼吸道合胞病毒(rsv)f、rsvfgp、ret、类风湿因子、rlip76、rpa2、rsk、s100、scf/kl、sdf-1、serine、血清白蛋白、sfrp-3、shh、sigirr、sk-1、slam、slpi、smac、smdf、smoh、sod、sparc、stat、steap、steap-ii、tace、taci、tag-72(肿瘤相关糖蛋白-72)、tarc、tca-3、t细胞受体(例如t细胞受体α/β)、tdt、teck、tem1、tem5、tem7、tem8、tert、睾丸plap样碱性磷酸酶、tfr、tgf、tgf-α、tgf-β、tgf-βpan特异性、tgf-βr1(alk-5)、tgf-βrii、tgf-βriib、tgf-βriii、tgf-β1、tgf-β2、tgf-β3、tgf-β4、tgf-β5、凝血酶、胸腺ck-1、甲状腺刺激素、tie、timp、tiq、组织因子、tmeff2、tmpo、tmprss2、tnf、tnf-α、tnf-αβ、tnf-β2、tnfc、tnf-ri、tnf-rii、tnfrsf10a(trailr3apo-2、dr4)、tnfrsf10b(trailr2dr5、killer、trick-2a、trjck-b)、tnfrsf10c(trailr3dcr1、lit、trid)、tnfrsf10d(trailr4dcr2、trundd)、tnfrsf11a(rankodfr、trancer)、tnfrsf11b(opgocif、tr1)、tnfrsf12(tweakrfn14)、tnfrsf13b(taci)、tnfrsf13c(baffr)、tnfrsf14(hvematar、hvea、lightr、tr2)、tnfrsf16(ngfrp75ntr)、tnfrsf17(bcma)、tnfrsf18(gitraitr)、tnfrsf19(troytaj、trade)、tnfrsf19l(relt)、tnfrsf1a(tnfr1cd120a、p55-60)、tnfrsf1b(tnfriicd120b、p75-80)、tnfrsf26(tnfrh3)、tnfrsf3(ltbrtnfriii、tnfcr)、tnfrsf4(ox40act35、txgp1r)、tnfrsf5(cd40p50)、tnfrsf6(fasapo-1、apt1、cd95)、tnfrsf6b(dcr3m68、tr6)、tnfrsf7(cd27)、tnfrsf8(cd30)、tnfrsf9(4-1bbcd137、ila)、tnfrsf21(dr6)、tnfrsf22(dctrailr2tnfrh2)、tnfrst23(dctrailr1tnfrh1)、tnfrsf25(dr3apo-3、lard、tr-3、tramp、wsl-1)、tnfsf10(trailapo-2配体、tl2)、tnfsf11(trance/rank配体odf、opg配体)、tnfsf12(tweakapo-3配体、dr3配体)、tnfsf13(apriltall2)、tnfsf13b(baffblys、tall1、thank、tnfsf20)、tnfsf14(lighthvem配体、ltg)、tnfsf15(tl1a/vegi)、tnfsf18(gitr配体aitr配体、tl6)、tnfsf1a(tnf-a连接蛋白、dif、tnfsf2)、tnfsf1b(tnf-blta、tnfsf1)、tnfsf3(ltbtnfc、p33)、tnfsf4(ox40配体gp34、txgp1)、tnfsf5(cd40配体cd154、gp39、higm1、imd3、trap)、tnfsf6(fas配体apo-1配体、apt1配体)、tnfsf7(cd27配体cd70)、tnfsf8(cd30配体cd153)、tnfsf9(4-1bb配体cd137配体)、tp-1、t-pa、tpo、trail、trailr、trail-r1、trail-r2、trance、转铁蛋白受体、trf、trk、trop-2、tsg、tslp、肿瘤相关抗原ca125、表达lewisy相关碳水化合物的肿瘤相关抗原、tweak、txb2、ung、upar、upar-1、尿激酶、vcam、vcam-1、vecad、ve-钙粘素、ve-钙粘素-2、vefgr-1(fit-1)、vegf、vegfr、vegfr-3(flt-4)、vegi、vim、病毒抗原、vla、vla-1、vla-4、vnr整合素、血管假性血友病因子、wif-1、wnt1、wnt2、wnt2b/13、wnt3、wnt3a、wnt4、wnt5a、wnt5b、wnt6、wnt7a、wnt7b、wnt8a、wnt8b、wnt9a、wnt9a、wnt9b、wnt10a、wnt10b、wnt11、wnt16、xcl1、xcl2、xcr1、xcr1、xedar、xiap、xpd以及激素和生长因子的受体。本领域技术人员将理解,上述靶标列表不仅指特异性蛋白和生物分子,还指生物化学途径或包含它们的途径。例如,提及ctla-4作为靶标抗原意味着构成t细胞共刺激途径的配体和受体(包括ctla-4、b7-1、b7-2、cd28和任何其它未发现的结合这些蛋白的配体或受体)也是靶标。因此,本文所用的靶标不仅指特异性的生物分子,还指与所述靶标相互作用的蛋白组和所述靶标所属的生物化学途径的成员。本领域技术人员将进一步理解,任何上述靶标抗原、结合它们的配体或受体、或其相应生化途径的其它成员,可以与本发明的fc变体可操作地连接以产生fc融合。因此例如,可以通过将fc变体可操作地连接至egf、tgf-b或结合egfr的任何其它的配体(发现或未发现的)来构建靶向egfr的fc融合体。因此,本发明的fc变体可以与egfr可操作地连接以产生结合egf、tgf-b或结合egfr的任何其它配体(发现或未发现的)的fc融合体。因此,实际上任何多肽,无论是配体、受体,还是一些其它蛋白或蛋白结构域(包括但不限于上述靶标和构成其相应生物化学途径的蛋白)可以与本发明的fc变体可操作地连接以开发fc融合体。合适抗原的选择取决于所需的应用。对于抗癌治疗,期望具有其表达限于癌细胞的靶标。已经证明特别适合抗体疗法的一些靶标是具有信号传导功能的靶标。其它治疗抗体通过抑制受体与其同源配体之间的结合来阻断受体的信号传导而发挥其效果。治疗抗体的另一种作用机制引起受体下调。通过其靶标抗原信号传导使其它抗体不起作用。在一些情况下,使用针对感染性疾病试剂的抗体。在一种实施方式中,将本发明的fc变体掺入针对细胞因子的抗体中。可选地,fc变体与细胞因子融合或共轭。本文所用的“细胞因子”是指由一种细胞群释放的蛋白的通用术语,其作为细胞间介质作用于另一种细胞。例如,如penichet等,2001,jimmunolmethods248:91-101(通过引用明确并入)中所述,细胞因子可以与抗体融合以提供一系列所需特性。这些细胞因子的示例是淋巴因子、单核因子和传统的多肽激素。细胞因子中包括生长激素如人类生长激素、n-甲硫氨酰人类生长激素和牛生长激素;甲状旁腺激素;甲状腺素;胰岛素;胰岛素原;松弛素;松弛素原;糖蛋白激素如卵泡刺激素(fsh)、促甲状腺激素(tsh)和黄体生成素(lh);肝生长因子;成纤维细胞生长因子;催乳素;胎盘催乳素;肿瘤坏死因子-α和-β;苗勒管抑制物质;小鼠促性腺激素相关肽;抑制素;激活素;血管内皮生长因子;整合素;血小板生成素(tpo);神经生长因子如ngf-β;血小板生长因子;转化生长因子(tgf)如tgf-α和tgf-β;胰岛素样生长因子-i和-ii;促红细胞生成素(epo);骨诱导因子;干扰素如干扰素-α、β和-γ;集落刺激因子(csf)如巨噬细胞-csf(m-csf);粒细胞-巨噬细胞-csf(gm-csf)和粒细胞-csf(g-csf);白细胞介素(il),如il-1、il-1α、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9、il-10、il-11、il-12;il-15,一种肿瘤坏死因子如tnf-α或tnf-β;c5a;以及其它包括lif和试剂盒配体(kl)的多肽因子。如本文所用,术语细胞因子包括来自天然来源或来自重组细胞培养物的蛋白,以及天然序列细胞因子的生物活性等同物。细胞因子和可溶性靶标(例如tnf超家族成员)是与本发明的变体一起使用的优选靶标。例如,抗vegf、抗-ctla-4和抗-tnf抗体或其片段是用于增加fcrn结合的fc变体的特别好的抗体。针对这些靶标的治疗剂经常涉及自身免疫疾病的治疗,并且需要长时间内多次注射。因此,由本发明的变体引起的较长血清半衰期和较低频率的治疗是特别优选的。批准用于临床试验或开发中的许多抗体和fc融合体可以受益于本发明的fc变体。这些抗体和fc融合体在本文中称为“临床产品和候选物”。因此,在优选实施方式中,发现本发明的fc多肽可用于一系列临床产品和候选物中。例如,靶向cd20的许多抗体可以受益于本发明的fc多肽。例如,发现本发明的fc多肽可用于与利妥昔单抗基本上相似的抗体(idec/genentech/roche)(参见例如美国专利号5,736,137),经批准用于治疗非霍奇金淋巴瘤的嵌合抗cd20抗体;humax-cd20,一种目前由genmab开发的抗cd20,描述于美国专利号5,500,362中的抗cd20抗体,ame-133(appliedmolecularevolution),ha20(immunomedics,inc.),humalym(intracel)和pro70769(pct/us2003/040426,名称为“免疫球蛋白变体及其应用”)。靶向表皮生长因子受体家族成员的许多抗体,包括egfr(erbb-1)、her2/neu(erbb-2)、her3(erbb-3)、her4(erbb-4)可能受益于本发明的fc多肽。例如,发现本发明的fc多肽可用于与曲妥珠单抗(genentech)基本上相似的抗体(参见例如美国专利号5,677,171),一种批准用于治疗乳腺癌的人源化抗her2/neu抗体;帕妥珠单抗(rhumab-2c4,omnitargtm),目前由genentech开发;美国专利号4,753,894中描述的抗her2抗体;西妥昔单抗(imclone)(美国专利号4,943,533;pctwo96/40210),用于多种癌症的临床试验中的嵌合抗egfr抗体;abx-egf(美国专利号6,235,883),目前由abgenix-immunex-amgen开发;humax-egfr(美国系列号10/172,317),目前由genmab开发;425,emd55900、emd62000和emd72000(merckkgaa)(美国专利号5,558,864;murthy等1987,archbiochembiophys.252(2):549-60;rodeck等,1987,jcellbiochem.35(4):315-20;kettleborough等,1991,proteineng.4(7):773-83);icr62(癌症研究所)(pctwo95/20045;moditahedi等,1993,j.cellbiophys.1993,22(1-3):129-46;modjtahedi等,1993,brj.cancer.1993,67(2):247-53;modjtahedi等,1996,brjcancer,73(2):228-35;modjtahedi等,2003,intjcancer,105(2):273-80);theracimhr3(ymbiosciences,canada和centrodeimmunologiamolecular,cuba(美国专利号5,891,996;美国专利号6,506,883;mateo等,1997,immunotechnology,3(1):71-81);mab-806(路德维希癌症研究所,memorialsloan-kettering)(jungbluth等,2003,procnatlacadsciusa.100(2):639-44);ksb-102(ksbiomedix);mr1-1(ivax,国家癌症研究所(pctwo0162931a2)和sc100(scancell)(pctwo01/88138)。在另一种优选实施方式中,发现本发明的fc多肽可用于阿仑单抗(millenium),一种目前批准用于治疗b细胞慢性淋巴细胞白血病的人源化单克隆抗体。发现本发明的fc多肽可用于多种抗体或fc融合体,其与其它临床产品和候选物基本上相似,包括但不限于莫罗单抗-cd3(orthoclone),一种由orthobiotech/johnson&johnson开发的抗-cd3抗体,替伊莫单抗一种由idec/scheringag开发的抗cd20抗体,单抗奥佐米星一种由celltech/wyeth开发的抗cd33(p67蛋白)抗体,阿法赛特一种biogen开发的抗lfa-3fc融合体,由centocor/lilly开发的阿昔单抗由novartis开发的巴利昔单抗由medimmune开发的帕利珠单抗英夫利昔单抗一种由centocor开发的抗tnfα抗体,阿达木单抗一种由abbor开发的抗tnfα抗体,humicadetm,一种由celltech开发的抗tnfα抗体,依那西普一种由immunex/amgen开发的抗tnfαfc融合体,abx-cbl,一种由abgenix开发的抗cd147抗体,abx-il8,一种由abgenix开发的抗il8抗体,abx-ma1,一种由abgenix开发的抗muc18抗体,pemtumomab(r1549,90y-muhmfg1),一种由antisoma开发的抗muc1,therex(r1550),一种由antisoma开发的抗muc1抗体,由antisoma开发的angiomab(as1405),由antisoma开发的hubc-1,由antisoma开发的硫铂(as1407),(那他珠单抗),一种由biogen开发的抗α-4-β-1(vla-4)和α-4-β-7抗体,vla-1mab,一种由biogen开发的抗vla-1整合素抗体,ltbrmab,一种由biogen开发的抗淋巴毒素β受体(ltbr)抗体,cat-152,一种由剑桥抗体技术公司开发的抗tgf-β2抗体,j695,一种由剑桥抗体技术公司和abbott开发的抗il-12抗体,cat-192,一种由剑桥抗体技术公司和genzyme开发的抗tgfβ1抗体,cat-213,一种由剑桥抗体技术公司开发的抗体嗜酸性粒细胞趋化因子抗体,lymphostat-btm,一种由剑桥抗体技术公司和人类基因组科学公司开发的抗blys抗体,trail-r1mab,一种由剑桥抗体技术公司和人类基因组科学公司开发的抗trail-r1抗体,avastintm(贝伐单抗,rhumab-vegf),一种由genentech开发的抗vegf抗体,由genentech开发的抗her受体家族抗体,抗组织因子(atf),一种由genentech开发的抗组织因子抗体,xolairtm(奥马珠单抗),一种由genentech开发的抗ige抗体,raptivatm(依法利珠单抗),一种由genentech和xoma开发的抗cd11a抗体,由genentech和千禧制药开发的mln-02抗体(原ldp-02),humaxcd4,一种由genmab开发的抗cd4抗体,humax-il15,一种由genmab和amgen开发的抗il15抗体,由genmab和medarex开发的humax-inflam,humax-癌症,一种由genmab和medarex以及oxfordgcosciences开发的抗乙酰肝素酶i抗体,由genmab和amgen开发的humax-淋巴瘤,由genmab开发的humax-tac,idec-131,一种由idec制药开发的抗cd40l抗体,idec-151(克立昔单抗),一种由idec制药开发的抗cd4抗体,idec-114,一种由idec制药开发的抗cd80抗体,idec-152,一种由idec制药开发的抗cd23,由idec制药开发的抗癌巨噬细胞迁移因子(mif)抗体,bec2,一种由imclone开发的抗独特型抗体,imc-1c11,一种由imclone开发的抗kdr抗体,dc101,一种由imclone开发的抗flk-1抗体,由imclone开发的抗ve钙粘素抗体,cea-cidetm(拉贝珠单抗),一种由immunomedics开发的抗癌胚抗原(cea)抗体,lymphocidetm(依帕珠单抗),一种由immunomedics开发的抗cd22抗体,由immunomedics开发的afp-cide,由immunomedics开发的myelomacide,由immunomedics开发的lkocide,由immunomedics开发的prostacide,mdx-010,一种由medarex开发的抗ctla4抗体,mdx-060,一种由medarex开发的抗cd30抗体,由medarex开发的mdx-070,由medarex开发的mdx-018,osidemtm(idm-1),一种由medarex和immuno-designedmolecules开发的抗her2抗体,humaxtm-cd4,一种由medarex和genmab开发的抗cd4抗体,humax-il15,一种由medarex和genmab开发的抗il15抗体,cnto148,一种由medarex和centocor/j&j开发的抗tnfα抗体,cnto1275,一种由centocor/j&j开发的抗细胞因子抗体,mor101和mor102,一种由morphosys开发的抗细胞间粘附分子-1(icam-1)(cd54)抗体,mor201,一种由morphosys开发的抗成纤维细胞生长因子受体3(fgfr-3)抗体,(visilizumab),一种由蛋白质设计实验室开发的抗cd3抗体,huzaftm,一种由蛋白质设计实验室开发的抗γ干扰素抗体,由蛋白质设计实验室开发的抗α5β1整合素,由蛋白质设计实验室开发的抗il-12,ing-1,一种由xoma开发的抗ep-cam抗体和mln01,一种由xoma开发的抗β2整合素抗体,本段中所有上述引用的参考文献都通过引用明确地并入本文。本发明的fc多肽可以掺入上述临床候选物和产品中,或掺入与它们基本上相似的抗体和fc融合体中。本发明的fc多肽可以掺入上述临床候选物和产品中,该临床候选物和产品的形式是人源化的,亲和力成熟的,工程化的或以某种其它方式修饰的。在一种实施方式中,本发明的fc多肽用于治疗自身免疫、炎症或移植适应症。与这些疾病相关的靶标抗原和临床产品以及候选物包括但不限于抗α4β7整合素抗体如ldp-02,抗β2整合素抗体如ldp-01,抗补体(c5)抗体如5g1.1,抗cd2抗体如bti-322,medi-507,抗cd3抗体如okt3,smart抗cd3,抗cd4抗体如idec-151,mdx-cd4,okt4a,抗cd11a抗体,抗cd14抗体如ic14,抗cd18抗体,抗cd23抗体如idec152,抗cd25抗体如赛尼哌(zenapax),抗cd40l抗体如5c8,antova,idec-131,抗cd64抗体如mdx-33,抗cd80抗体如idec-114,抗cd147抗体如abx-cbl,抗e-选择素抗体如cdp850,抗gpiib/iiia抗体如reopro/阿昔单抗,抗icm3抗体如icm3,抗ice抗体如vx-740,抗fcr1抗体如mdx-33,抗ige抗体如rhumab-e25,抗il-4抗体如sb-240683,抗il-5抗体如sb-240563,sch55700,抗il-8抗体如abx-il8,抗干扰素γ抗体,抗tnf(tnf、tnfα、tnfα、tnf-α)抗体如cdp571,cdp870,d2e7,英夫利昔单抗,mak-195f和抗vla-4抗体如antegren。本发明的fc变体(例如与fcrn结合增加的fc变体)可用于tnf抑制剂分子中以提供增强的特性。有用的tnf抑制剂分子包括抑制哺乳动物中tnf-α作用的任何分子。合适的示例包括fc融合体(依那西普)以及抗体(阿达木单抗)和(英夫利昔单抗)。使用本发明的fc变体工程化以增加fcfn结合的单克隆抗体(例如remicade和humira)可以通过增加的半衰期转化为更好的功效。在一些实施方式中,使用针对感染性疾病的抗体。针对真核细胞的抗体包括靶向酵母细胞的抗体,包括但不限于酿酒酵母、多形汉逊酵母、脆壁克鲁维酵母和乳酸克鲁维酵母、季也蒙毕赤酵母和巴斯德毕赤酵母、粟酒裂殖酵母、疟原虫和解脂耶氏酵母。针对其它真菌细胞的抗体也是有用的,包括与念珠菌属菌株相关的靶标抗原,该菌株包括光滑念珠菌、白色念珠菌、克鲁氏菌、葡萄牙念珠菌和c.maltosa以及曲霉属、隐球菌属、组织胞浆菌属、球孢子菌属、芽孢杆菌属和青霉菌属等。针对与原生动物相关的靶标抗原的抗体包括但不限于与锥虫、利什曼原虫种类(包括杜氏利什曼原虫);疟原虫属、卡氏肺孢子虫、小球隐孢子虫、贾第鞭毛虫、溶组织内阿米巴和环孢子虫相关的抗体。针对原核抗原的抗体也是有用的,包括针对合适细菌的抗体,例如致病性和非致病性原核生物,包括但不限于芽孢杆菌(包括炭疽芽孢杆菌);弧菌(例如霍乱弧菌);埃希氏菌属(例如产肠毒素大肠杆菌),志贺氏菌(例如痢疾杆菌);沙门氏菌(例如伤寒沙门氏菌);分枝杆菌(例如结核分枝杆菌,麻风杆菌);梭菌(例如肉毒芽孢梭菌、破伤风芽孢梭菌、艰难梭状芽胞杆菌、产气荚膜梭状芽胞杆菌);comyebacterium(例如白喉杆菌);链球菌(化脓性链球菌、肺炎链球菌);金黄色葡萄球菌(例如金黄色酿脓葡萄球菌);嗜血杆菌(例如流感嗜血杆菌);奈瑟菌(例如脑膜炎奈瑟氏菌、淋病奈瑟氏菌);耶尔森氏鼠疫杆菌(例如蓝氏耶尔森氏菌、鼠疫耶尔辛杆菌),假单胞菌(例如铜绿假单胞菌、恶臭假单胞菌);衣原体(例如沙眼衣原体);博德特氏菌(例如百日咳);密螺旋体(例如钯密螺旋体);炭疽杆菌,鼠疫杆菌,布鲁氏菌属,土拉热弗朗西丝菌,鼻疽假单胞菌,类鼻疽伯克氏菌,鼻疽假单胞菌,类鼻疽伯克氏菌,c.botulinum,沙门氏菌属,sebv.霍乱毒素b,大肠杆菌o157:h7,李斯特菌属,白色毛孢子菌,红酵母属,异常汉森酵母,肠杆菌属,克雷伯氏菌属,李斯特菌属,支原体属等。在某些方面,抗体针对病毒感染;这些病毒包括但不限于正粘病毒(例如流感病毒),副粘病毒(例如呼吸道合胞病毒、腮腺炎病毒、麻疹病毒),腺病毒,鼻病毒,冠状病毒,呼肠孤病毒,披盖病毒(例如风疹病毒),细小病毒,痘病毒(例如天花病毒、痘苗病毒),肠道病毒(例如脊髓灰质炎病毒、柯萨奇病毒),肝炎病毒(包括a、b和c),疱疹病毒(例如单纯疱疹病毒、水痘-带状疱疹病毒、巨细胞病毒、爱泼斯坦-巴尔病毒),轮状病毒,诺瓦克病毒,汉坦病毒,沙粒病毒,弹状病毒(例如狂犬病毒),逆转录病毒(包括hiv、htlv-1和-ii),乳多空病毒(例如乳头瘤病毒),多瘤病毒和小核糖核酸病毒等。实施例实施例1用于改善的fcrn结合的fc工程化新生儿fc受体(fcrn)调节人体中igg的3周长igg半衰期。用于改善ph依赖性与fcrn结合的igg抗体的工程化导致具有延长的半衰期/改变的药代动力学和细胞转运特性的抗体的示例。材料和方法细胞培养。在37℃下在湿度5%、95%co2空气培养箱中将细胞系hek293e维持在补充有10%fbs、100u/ml青霉素,100μg/ml链霉素的dmem中。可溶性重组人fcrn的产生。已经描述了编码重组截短形式的野生型人fcrn的真核pcdna3载体的构建,该载体含有编码三个细胞外结构域(α1-α3)的cdna,其c末端与编码来自血吸虫(schistosomajaponicum)的谷胱甘肽s-转移酶(gst)的cdna融合(berntzen,g,等jimmunolmethods,2005.298(1-2):p.93-104;andersen,j.t.,等febsj,2008.275(16):p.4097-110)。该载体还含有编码人β2-微球蛋白和epstein-barr病毒源复制序列的cdna,通过使用聚乙烯亚胺max(polysciences)瞬时转染人胚肾293e(hek293e)细胞产生gst标记的hfcrn,使用所述gstrapff柱从收获的上清液中纯化受体(bemtzen等,同上;andersen等,同上)。使用杆状病毒表达载体系统产生单体his标记的人fcrn(kim,j.k.,等fcrn.eurjimmunol,1999.29(9):p.2819-25)。编码his标记的人fcrn的病毒原种是来自sallyward博士(德克萨斯大学,西南医学中心,达拉斯,德克萨斯州)的善意馈赠。简而言之,使用提供有ni2+离子的histraphp柱(gehealthcare)纯化人fcrn。用含有0.05%叠氮化钠的1×pbs预平衡柱子,用1×pbs、0.05%叠氮化钠(ph10.9)将上清液的ph调节至ph7.2,然后以流速5ml/min施加到histraphp柱上。用200ml1×pbs洗涤柱子,然后用50ml25mm咪唑、1×pbs(ph7.3)洗涤,以及用250mm咪唑、1×pbs(ph7.4)洗脱人fcrn。使用amicronultra-10过滤单元(millipore)将收集的蛋白缓冲液交换至1×pbs,然后分离单体级分。在使用amiconultra柱(millipore)浓缩蛋白之前,使用hiload26/600superdex200制备级柱(gehealthcare)分离单体级分并储存在4℃。fc工程化igg1变体的构建和产生。编码人源化9c12igg1变体的载体基于plnoh2/plnok表达系统(norderhaug,l,等jimmunolmethods,1997.204(1):p.77-87)。具体地,将源自杂交瘤细胞系tc31-9c12.c9(developmentalstudieshybridomabank,universityofiowa)(varghese,r.,等jvirol,2004.78(22):p.12320-32)的重(h)和轻(l)链可变(v)基因合成为克隆盒,其侧翼为由内切核酸酶bsmi/bsiwi识别的限制性位点。然后将基因片段亚克隆到plnoh2-niphigg1-wt-orip和nipplnok-orip中,分别产生编码嵌合人h链和l链的plnoh2-hexonhigg1-wt-orip和hexonplnok-orip。通过用含有所需突变的片段交换ch2和ch3基因片段,编码载体plnoh2-hexonhigg1-wt-orip的h链进一步用于产生h9c12变体。使用内切核酸酶agei和sfii识别的独特限制性位点交换ch2片段,而使用sfii和bamhi(全部来自newenglandbiolabs)交换ch3片段。在使用lipofectamine2000(lifetechnologies)将h链和l链载体共转染到hek293e细胞中后,使用ch1特异性captureselect柱(lifetechnologies)从收集的上清液中纯化h9c12igg1变体。使用superdex200柱(gehealthcare)通过sec色谱分离单体级分。通过非还原sds-page(lifetechnologies)验证蛋白完整性。elisa。将重组adv5六邻体(abdserotech)(在pbs中稀释至1μg/ml)包被在96孔板(nunc)中,并在4℃、o/n下温育。使用pbs/4%脱脂乳(s)(acumedia)封闭剩余的表面积,然后用pbs/0.005%吐温20(t)洗涤四次。将在pbs/t/s中稀释的滴定量的h9c12变体添加到孔中,并在室温下温育1小时。如上洗涤后,将在pbs/s/t中稀释的可溶性gst标记的人fcrn添加到孔中,并在室温下温育1小时。如上洗涤后,在添加的pbs/s/t(rocklandimmunochemicals,u.s.a)中稀释hrp-共轭的抗gst抗体(1∶8000),然后在室温下温育1小时。如上洗涤后,通过添加四甲基苯甲酸(tmb)溶液(calbiochem)使结合的人fcrn可视化。通过添加100μl1mhcl终止反应,并使用sunrise读板仪(tecan)记录450nm处的吸收。使用ph6.0或ph7.4的pbs进行elisa。spr。biacore3000仪器(gehealthcare)用于所有动力学测量。根据制造商的说明,通过胺偶联将人源化的9c12igg1变体固定在cm5传感器芯片上。通过注射溶解在ph4.5的10mm乙酸钠(gehealthcare)中的1-2.5μg/mligg1变体进行偶联。使用hbs-p缓冲液(0.01mhepes,0.15nacl,0.005%表面活性剂p20,ph7.4)作为运行和稀释缓冲液。随后,注射系列浓度的可溶性单体人fcrn。使用biaevaluation软件进行动力学分析,并将结合数据拟合至简单的一阶(1∶1)langmuir生物分子相互作用模型。结果本文描述了fc工程化的igg抗体,其具有如下与人fcrn的结合改变。三重突变体q311r/n434w/m428e显示出改善的ph依赖性结合,超出了公开的实施例。实施例2该实施例描述了另外的与人fcrn改变的结合的igg1和igg3变体。材料和方法在体内研究中,c57bl/6j遗传背景上的tg32-alb-/-小鼠携带fcrnhc(fcgrttm1dcr)和白蛋白(albem12mvw)的无效等位基因,并在天然hfcrn启动子的控制下表达hfcrnhc(fcgrt)的基因组转基因。tg32-alb-/-小鼠(性别-雌性,年龄7-9周,体重17至27g,5只小鼠/组)通过腹膜内注射接受5mg/kgigg1变体。在注射后1、3、5、7、10、12、16、19、23、30和37天从眼眶后窦抽取血样(25μl)。样品收集后,立即将血液与1μl1%k3-edta混合以防止凝结,然后在4℃以17000×g离心5分钟。分离血浆,在50%甘油/pbs溶液中1∶10稀释,然后储存在-20℃直至由elisa分析。体内研究在thejacksonlaboratory(barharbor,me)中进行。表面等离子体共振-biacoret200仪器(gehealthcare)用于所有动力学测量。根据制造商的说明书,通过胺偶联将h9c12变体固定在cm5传感器芯片上。对于所有实验,将ph6.0的磷酸盐缓冲液(67mm磷酸盐,0.15mnacl,0.005%tween20)或ph7.4的hbs-p缓冲液(0.1mhepes,0.15nacl,0.005%表面活性剂p20)分别用作运行和再生缓冲液。以50μl/min的流速在25℃下注射系列浓度的重组人fcrn(1000.0-15.6)nm。使用biaevaluation软件进行动力学分析,并将结合数据拟合为简单的一阶(1∶1)langmuir相互作用模型。elisa-如实施例1中所述进行表2igg1-wtigg1-q311r/n434w/m428eigg1-m252s/q311r/n434w/m428eigg1-q311r/n434p/m428eigg1-q311r/n434w/m428digg1-q311r/n434w/m428e/h433kigg1-l309k/q311r/n434w/m428eigg1-l309r/q311r/n434w/m428eigg1-l309s/q311r/n434w/m428eigg3(b)-q311r/n434w/m428e/r435h结果结果显示在图5-7和表3-5中。表5.人fcrntg32半合子小鼠的半衰期(天)。上述说明书中提及的所有出版物和专利均通过引用并入本文中。在不脱离本发明的范围和精神的情况下,本发明所述方法和系统的各种修饰和变型对于本领域技术人员来说是显而易见的。尽管已经结合特定的优选实施方式描述了本发明,但是应该理解的是,要求保护的本发明不应该不适当地限于这些特定的实施方式。实际上,对于相关领域的技术人员显而易见的,用于实施本发明的所述模式的各种修饰旨在落入所附权利要求的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1