使用具有辅因子回收的电化学生物反应器模块的改进方法与流程
本申请要求2016年3月14日提交的美国临时申请第62/308,175号的优先权权益,通过引用将该申请的公开内容全文纳入本文。
本公开一般涉及改变化合物的氧化态的生物介导反应的用途,特别是涉及改变给定化学化合物中碳原子的氧化态的生物介导反应的用途。
更具体地,本公开涉及利用电化学生物反应器模块(ebm)的改进方法,其中在氧化形式的烟酰胺腺嘌呤二核苷酸辅因子的电化学还原期间产生的不需要形式的烟酰胺腺嘌呤二核苷酸辅因子通过ebm被回收用于再循环。
背景技术:
已经广泛报道了进行还原并且能够将所提供的底物还原成所需还原产物的酶的使用。(dodds等人,j.am.chem.soc.,(1988)110(2),577-583;dodds等人,proceedingschiraleurope’95.伦敦,(1995),55-62;a.liese等人,applmicrobiolbiotechnol(2007)76:237–248;liese,a.;第2版.enzymecatalysisinorganicsynthesis(有机合成中的酶催化),(2002),3,1419-1459;kula,m.r.;kragl,u.stereoselect.biocatal.(2000),839–866;chartrain,m.;greasham,r.;moore,j.;reider,p.;robinson,d.;buckland,b.j.mol.catal.b:enzym.(2001),11,503–512;patel,r.n.enzymemicrob.technol.(2002),31,804–826;patel,r.n.adv.appl.microbiol.(2000),47,33–78;patel,r.n.;hanson,r.l.;banerjee,a.;szarka,j.am.oilchem.soc.(1997),74,1345–1360;hummel,w.adv.biochem.eng.biotechnol.(1997),58,145–184;whitesides等人,appl.biochem.andbiotech.(1987)14,147-197;whitesides等人,biotechnologyandgeneticengineeringreviews(生物技术与基因工程综述),第6卷.9月,1988)。
为了实现所提供的底物的这种还原,必须向反应提供电子。在体内和体外的生物系统中,这些通常称为“还原当量”的电子由通常称为“辅因子”的小分子提供。最常见的辅因子是烟酰胺腺嘌呤二核苷酸,nad。还存在磷酸化形式的辅因子,并且两种形式都向催化需要还原当量的反应的酶提供还原当量。
烟酰胺腺嘌呤二核苷酸辅因子以氧化态和还原态存在,并且在公开文献中它们分别缩写为nad(p)+和nad(p)h。但是,这里将避免使用这些缩写。
最通常地,从烟酰胺腺嘌呤二核苷酸辅因子的还原态接受还原当量的酶被称为“氧化还原酶”,并且被国际生物化学和分子生物学联合命名委员会(nomenclaturecommitteeoftheinternationalunionofbiochemistryandmolecularbiology)分类为ec1.n.n.n。特别感兴趣的是ec1.1.n.n和ec1.2.n.n类中通常称为“脱氢酶”或“酮还原酶”的酶,以及ec1.13.n.n和ec.1.14.n.n类中称为“单加氧酶”的酶。最后一组酶也称为“p450”酶或“cyp”酶。
当使用在诸如碳水化合物的碳源上生长的微生物进行由这些酶催化的反应时,通过将一部分碳水化合物氧化成co2来产生还原当量,即,提供给微生物的一些碳水化合物牺牲性地氧化,以便为微生物提供电子以用于各种代谢过程。虽然所得到的电子对于微生物是理想的和有用的,但是通过氧化为co2而牺牲的碳原子会损失。还可以提供除碳水化合物之外的碳源,其也被牺牲以产生所需的还原当量。很明显,虽然这种体内过程可以进行氧化还原酶催化的所需反应,但是可能难以从体内系统的环境中回收所需的产物,例如发酵液。因此利用体外系统进行所需反应是有利的。
可以分离所需的氧化还原酶并将其用于体外催化反应。通过体外系统可以实现明显改善的化学过程,该系统允许在类似于标准催化化学过程的过程中使用过多的氧化还原酶。这样的系统避免了从发酵液中回收所需反应产物的问题,并且还提供以下优点:允许在非生理条件下使用酶,可以使用多种方法固定或以其他方式容纳酶,并允许其长时间使用。这种固定或其他容纳方法还允许从酶系统中简单有效地回收所需的反应产物。在无细胞系统中使用分离的酶的另一个优点是可以使用多种酶,从而允许进行一系列反应。
含有有用的氧化还原酶的微生物在自然界中是众所周知的,并且可以通过简单的筛选快速发现(a.zaks等人,tetrahedron(2004)60,789-797)。如果需要特定的氧化还原酶,可以在标准的工业上有用的宿主如酿酒酵母(s.cerevisiae)或大肠杆菌(e.coli)中容易地克隆和过表达酶,通过标准方法分离,并用于体外系统。
然而,仍然必须向这种体外系统提供还原当量。类似于体内系统,可以提供被氧化的牺牲性底物。这产生所需的烟酰胺腺嘌呤二核苷酸辅因子的还原态,以为所需反应提供还原当量。
显然,对牺牲性底物的需要除去了体内系统的至少一些优点,因为现在必须将次要产物(牺牲性底物的氧化产物)与所需产物分离。虽然甲酸盐可以用作牺牲性底物,因此产生co2,但是这需要使用另外的酶,即甲酸脱氢酶,这可能不方便。
因此,最理想的是以不需要牺牲性底物或其他酶的方式提供反应所需的电子,即氧化还原酶所需的还原当量。
如果可以从外部源提供电子,即电流,那么将消除提供牺牲性底物以提供电子的需要,并且氧化还原酶可以用作常规催化剂,从而在不需要活细胞或相关的酶系统或过程的情况下进行反应。
其他人已经认识到这种情况,并且已经发表了许多通过电化学方法将电子传递给生物系统的尝试。
park和zeikus在j.bacteriol.181:2403-2410,1999中报道了称为中性红(neutralred)的化合物将与烟酰胺腺嘌呤二核苷酸辅因子进行可逆的化学氧化还原,即还原形式的中性红(nr还原)具有足够低的氧化还原值,它会将电子转移给烟酰胺腺嘌呤二核苷酸辅因子并因此将其从氧化态还原为还原态。在这个过程中,中性红被氧化成nr氧化物质,该nr氧化物质随后可以从阴极接受电子,从而回到还原形式nr还原,进而可以再次还原烟酰胺腺嘌呤二核苷酸辅因子的氧化态。
zeikus等人的美国专利第7,250,288b2号讨论了改善电化学生物反应器系统中电极效率的需要,并提出了改进方法,例如将烟酰胺腺嘌呤二核苷酸辅因子、中性红和富马酸还原酶与电极连接以改善电子转移特性。虽然上述方法可以改善电子转移特性,但是改进电化学生物反应器系统设计及其以其他方式(例如下面描述的那些方式)的使用也可能是有利的。
在pct公开号wo2014039767a1,“电化学生物反应器模块及其使用方法(electrochemicalbioreactormoduleandmethodsofusingthesame)”中揭示了通过电化学方法提供还原当量的要求。在pct公开号wo2016070168a1,“改进的电化学生物反应器模块及其用途(improvedelectrochemicalbioreactormoduleandusethereof)”中公开了使用分离的酶以及将氧化形式的烟酰胺腺嘌呤二核苷酸辅因子电化学还原成其还原形式,以及要考虑的因素。
当烟酰胺腺嘌呤二核苷酸辅因子的氧化态被电化学还原时,可以产生几种不同的还原物质。这些物质的区别仅在于烟酰胺环上形式上发生还原的位置。这可以在烟酰胺环的2-位、4-位或6-位,这些物质分别被称为1,2-二氢-nad、1,4-二氢-nad和1,6-二氢-nad异构体。(chakraverty等人,biochem.biophys.rescomm.,(1964),15(3),262-268;chakreverty等人,jour.biol.chem(1969),244(15),4208-4217)。这些如下文说明a所示。烟酰胺环的碳原子以氧化形式编号,氮原子作为位置1。所需的还原产物是1,4-二氢-nad异构体,通常称为β-nadh,这是大多数脱氢酶、酮还原酶和p450酶所需的辅因子的生物活性形式。其他异构体——1,2-二氢-nad和1,6-二氢-nad——对脱氢酶、酮还原酶或p450酶没有已知的有用生物活性。
第四种物质,即nad辅因子的二聚体,也可以在烟酰胺腺嘌呤二核苷酸的氧化态的电化学还原过程中形成。该物质被称为4,4'-二聚体,并且也在说明a中显示。与辅因子的1,2-二氢-nad和1,6-二氢-nad形式一样,二聚体对于氧化还原酶没有已知的有用的生物活性,不能向其递送还原当量(burnett等人,biochem.(1968),10(7),3328-3333;biellmann等人,tetrahedronletters(1978)7,683-686;kirkor等人,eur.j.biochem.(2000),267,5014-5022)。
说明a
在为了向氧化还原酶提供还原当量而电化学还原初始量的烟酰胺腺嘌呤二核苷酸辅因子的氧化态的系统中,将形成所需的生物活性1,4-二氢-nad异构体,并且向系统中的氧化还原酶(或多种氧化还原酶)提供还原当量,并且该1,4-二氢-nad异构体将氧化回氧化的烟酰胺腺嘌呤二核苷酸辅因子,以为另一个电化学还原循环做好准备。然而,最初由氧化的烟酰胺腺嘌呤二核苷酸辅因子的电化学还原产生的两种非生物活性异构体1,2-二氢-nad和1,6-二氢-nad以及4,4'-二聚体不会被消耗,只会留在系统中。由于向氧化还原酶有效递送还原当量产生的氧化的烟酰胺腺嘌呤二核苷酸辅因子将再次还原,得到三种异构体的混合物,再加上二聚体,如同前面的还原过程。以这种循环方式,可用于电化学还原的氧化的烟酰胺腺嘌呤二核苷酸辅因子的量持续减少,并且在短时间后,基本上没有剩余。四十年前就已经认识到这个问题(whitesides等人,appl.biochem.andbiotech.(1987)14,147-197;whitesides等人,biotechnologyandgeneticengineeringreviews,第6卷.9月,1988)。
因此,除去在氧化的烟酰胺腺嘌呤二核苷酸辅因子电化学还原为所需的1,4-二氢-nad物质(即β-nadh)的过程中会产生的不需要的1,2-二氢-nad和1,6-二氢-nad异构体以及4,4'-二聚体是有用的。此外,回收1,2-二氢-nad和1,6-二氢-nad异构体作为所需的1,4-二氢-nad异构体或作为初始氧化态的烟酰胺腺嘌呤二核苷酸辅因子是有用的。
本文提供了用于实现上述目标的方法和系统。通过阅读说明书和权利要求,本公开的其他目的、特征和优点将是显而易见的。
技术实现要素:
在一个方面,本公开提供了用于电化学产生nad(p)h2还原当量的系统,该系统包括:
(a)电化学电池,其包括容纳在阳极室中的阳极和容纳在阴极室中的阴极;
(b)含有nad(p)的第一工艺流,其通过阴极室并与阴极持续接触,电子从阴极转移到nad(p),以产生含有还原物质1,4-nad(p)h2、1,2-nad(p)h2、1,6-nad(p)h2和[nad(p)]2的第二工艺流,同时任选地产生氢;
(c)氧化还原酶或p450酶的底物,该底物在氧化还原酶或p450酶存在下与第二工艺流接触时,转化为产物,同时伴随着消耗第二工艺流中的1,4-nad(p)h2,产生第一回收nad(p)和第三工艺流;和
(d)肾胺酶(renalase)、绿豆酚氧化酶(mungbeanphenoloxidase)和约254nm或超过约320nm的波长下的光照中的至少一种,当这些条件与第三工艺流接触时,将该工艺流中1,2-nad(p)h2、1,6-nad(p)h2和[nad(p)]2中的至少一种转化为第二回收nad(p)和任选的第三回收nad(p)。
在一些实施方式中,该系统包括用于将1,2-nad(p)h2和1,6-nad(p)h2转化为第二回收nad(p)的肾胺酶。
在一些实施方式中,该系统包括用于将1,2-nad(p)h2、1,6-nad(p)h2和/或[nad(p)]2转化为第二回收nad(p)和/或第三回收nad(p)的绿豆酚氧化酶。
在一些实施方式中,该系统包括用于将[nad(p)]2转化为nad(p)的光照。
在一些实施方式中,该系统包括肾胺酶和绿豆酚氧化酶。例如,第三工艺流可以与肾胺酶接触,从而使1,2-nad(p)h2和1,6-nad(p)h2转化为第二回收nad(p)以及得到第四工艺流,其中第四工艺流可以与绿豆酚氧化酶接触以将其中的[nad(p)]2转化为第三回收nad(p)。
在一些实施方式中,该系统包括肾胺酶和光照。例如,第三工艺流可以与肾胺酶接触,从而使1,2-nad(p)h2和1,6-nad(p)h2转化为第二回收nad(p)以及得到第四工艺流,其中第四工艺流可以与光照接触以将其中的[nad(p)]2转化为第三回收nad(p)。
在一些实施方式中,该系统包括绿豆酚氧化酶和光照。例如,第三工艺流可以与绿豆酚氧化酶接触,从而使1,2-nad(p)h2和1,6-nad(p)h2转化为第二回收nad(p)以及得到第四工艺流,其中第四工艺流可以与光照接触以将其中的[nad(p)]2转化为第三回收nad(p)。
在一些实施方式中,该系统可以在一个或多个工艺流中包括能够将电子转移至nad(p)的电子转移介体(etm)。该系统还可包括过氧化氢酶,用于分解由肾胺酶、绿豆酚氧化酶和/或光照产生的过氧化氢。
另一个方面涉及用于电化学产生nad(p)h2还原当量的方法,该方法包括:
(a)提供电化学电池,其包括容纳在阳极室中的阳极和容纳在阴极室中的阴极;
(b)使含有nad(p)的第一工艺流通过阴极室并与阴极持续接触,电子从阴极转移到nad(p),以产生含有还原物质1,4-nad(p)h2、1,2-nad(p)h2、1,6-nad(p)h2和[nad(p)]2的第二工艺流,同时任选地产生氢;
(c)使第二工艺流与氧化还原酶或p450酶的底物接触,使得该底物在氧化还原酶或p450酶存在下转化为产物,同时伴随着消耗第二工艺流中的1,4-nad(p)h2,以及产生第一回收nad(p)和第三工艺流;和
(d)使第三工艺流与肾胺酶、绿豆酚氧化酶和约254nm或超过约320nm的波长下的光照中的至少一种接触,从而将该工艺流中的1,2-nad(p)h2、1,6-nad(p)h2和[nad(p)]2中的至少一种转化为第二回收nad(p)和任选的第三回收nad(p)。
在一些实施方式中,该方法可进一步包括使第三工艺流与肾胺酶接触,用于将1,2-nad(p)h2和1,6-nad(p)h2转化为第二回收nad(p)。
在一些实施方式中,该方法可进一步包括使第三工艺流与绿豆酚氧化酶接触,用于将1,2-nad(p)h2、1,6-nad(p)h2和/或[nad(p)]2转化为第二回收nad(p)和/或第三回收nad(p)。
在一些实施方式中,该方法可进一步包括使第三工艺流与光照接触,用于将[nad(p)]2转化为nad(p)。
在一些实施方式中,该方法可进一步包括使第三工艺流与肾胺酶接触,使得其中的1,2-nad(p)h2和1,6-nad(p)h2转化为第二回收nad(p)以及得到第四工艺流,并且还包括使第四工艺流与绿豆酚氧化酶接触以将其中的[nad(p)]2转化为第三回收nad(p)。
在一些实施方式中,该方法可进一步包括使第三工艺流与肾胺酶接触,使得其中的1,2-nad(p)h2和1,6-nad(p)h2转化为第二回收nad(p)以及形成第四工艺流,并且还包括使第四工艺流与光照接触以将其中的[nad(p)]2转化为第三回收nad(p)。
在一些实施方式中,该方法可进一步包括使第三工艺流与绿豆酚氧化酶接触,使得其中的1,2-nad(p)h2和1,6-nad(p)h2转化为第二回收nad(p)以及形成第四工艺流,并且还包括使第四工艺流与光照接触以将其中的[nad(p)]2转化为第三回收nad(p)。
在一些实施方式中,该方法还可以包括在一个或多个工艺流中提供能够将电子转移至nad(p)的电子转移介体(etm)。
在一些实施方式中,该方法还可包括提供过氧化氢酶,用于分解由肾胺酶、绿豆酚氧化酶和/或光照产生的过氧化氢。
在一些实施方式中,该方法还可以包括使第三工艺流返回阴极室。
在本文公开的任何系统和方法中,可以由诸如大肠杆菌(escherichiacoli)、枯草芽孢杆菌(bacillussubtilis)、谷氨酸棒杆菌(corynebacteriumglutamicum)、酿酒酵母(saccharomycescerevisiae)、巴斯德毕赤酵母(pichiapastoris)和巨大芽孢杆菌(bacillusmegaterium)的微生物重组表达肾胺酶和/或绿豆酚氧化酶。
在某些实施方式中,肾胺酶可以是突变形式(天然存在的或基因工程化的),其对1,4-nad(p)h2的氧化活性比野生型肾胺酶低,并且/或者对1,2-nad(p)h2和1,6-nad(p)h2的氧化活性比野生型肾胺酶高。在一些实例中,该突变形式可以由诸如大肠杆菌(escherichiacoli)、枯草芽孢杆菌(bacillussubtilis)、谷氨酸棒杆菌(corynebacteriumglutamicum)、酿酒酵母(saccharomycescerevisiae)、巴斯德毕赤酵母(pichiapastoris)和巨大芽孢杆菌(bacillusmegaterium)的微生物重组表达。
绿豆酚氧化酶可以是突变形式(天然存在的或基因工程化的),其对1,4-nad(p)h2的氧化活性比野生型绿豆酚氧化酶低,并且/或者对1,2-nad(p)h2、1,6-nad(p)h2和/或[nad(p)]2的氧化活性比野生型绿豆酚氧化酶高。在一些实施方式中,该突变形式由诸如大肠杆菌(escherichiacoli)、枯草芽孢杆菌(bacillussubtilis)、谷氨酸棒杆菌(corynebacteriumglutamicum)、酿酒酵母(saccharomycescerevisiae)、巴斯德毕赤酵母(pichiapastoris)和巨大芽孢杆菌(bacillusmegaterium)的微生物重组表达。
本文还提供了通过将氧化形式的磷酸化或非磷酸化形式的烟酰胺腺嘌呤二核苷酸辅因子还原为氧化还原酶系统来提供电化学产生的还原能力的方法,以催化底物分子的转化。
该方法可包括防止辅因子材料损失为还原形式的步骤,所述还原形式不被氧化还原酶系统用于催化底物分子的转化。
该方法可包括对烟酰胺腺嘌呤二核苷酸辅因子的氧化态进行电化学还原,以得到所需的1,4-二氢-nad物质与不需要的1,2-二氢-nad和1,6-二氢-nad物质以及不需要的4,4’-二聚体的混合物。在向氧化还原酶提供还原当量的过程中,所需的1,4-二氢-nad物质被转化回氧化形式的烟酰胺腺嘌呤二核苷酸辅因子,所述氧化还原酶的存在是为了催化底物分子的转化。剩余的1,2-二氢-nad和1,6-二氢-nad物质、4,4'-二聚体以及氧化态的烟酰胺腺嘌呤二核苷酸辅因子的混合物受到肾胺酶的作用。该酶在氧气存在下将1,2-二氢-nad和1,6-二氢-nad物质氧化回烟酰胺腺嘌呤二核苷酸辅因子的氧化态,在此过程中产生过氧化氢。绿豆酶也通过使用氧气将4,4'-二聚体氧化回烟酰胺腺嘌呤二核苷酸辅因子的两个氧化态分子,并产生过氧化氢。因此,初始通过氧化形式的烟酰胺腺嘌呤二核苷酸辅因子的电化学还原产生的所有物质,无论是期望的还是不希望的,都返回到烟酰胺腺嘌呤二核苷酸辅因子的原始氧化态,并且没有辅因子材料损失。4,4'-二聚体是光活性的,可以通过适当波长的照射返回到烟酰胺腺嘌呤二核苷酸辅因子物质的氧化态;这种照射可以代替绿豆氧化酶或与绿豆氧化酶结合进行。
附图简要说明
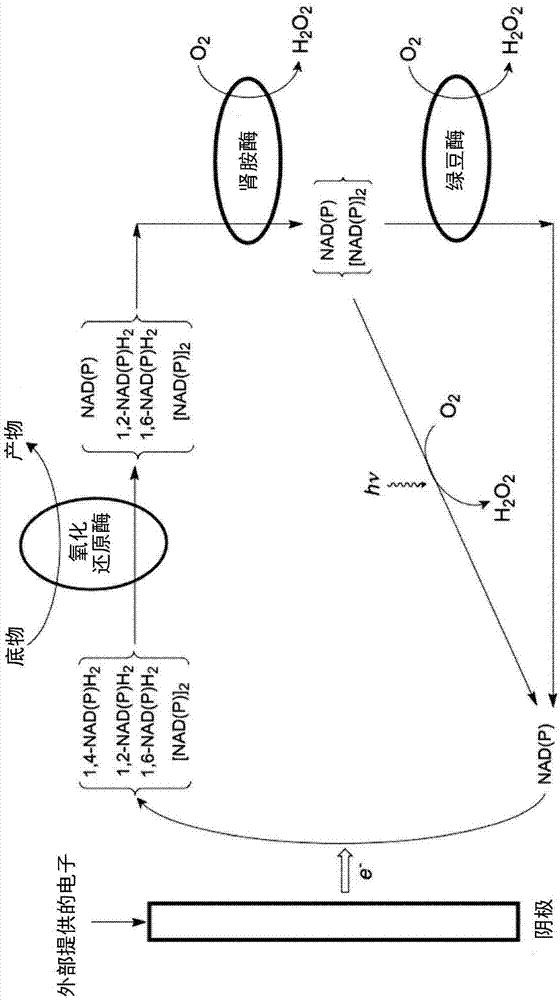
图1示意性地示出了利用肾胺酶、绿豆酚氧化酶和任选的光照以从所需的1,4-二氢-nad物质加上不需要的1,2-二氢-nad和1,6-二氢-nad物质和不需要的4,4'-二聚体的混合物中回收和再循环辅因子材料,所述混合物是通过氧化态的烟酰胺腺嘌呤二核苷酸辅因子的电化学还原形成的。在图1中,烟酰胺腺嘌呤二核苷酸辅因子的1,2-二氢-nad、1,4-二氢-nad和1,6-二氢-nad物质被分别称为1,2-nad(p)h2、1,4-nad(p)h2和1,6-nad(p)h2,而4,4'-二聚体称为[nad(p)]2,氧化形式称为nad(p)。
具体实施方式
目前的文献最常使用描述符“nad(p)+”来表示磷酸化和非磷酸化形式的烟酰胺腺嘌呤二核苷酸的氧化态,而用“nad(p)h”表示还原态。通过向氧化态添加两个电子和两个质子,产生磷酸化和非磷酸化形式的烟酰胺腺嘌呤二核苷酸的还原态。这种常见的命名法具有误导性,因为对普通描述符“nad(p)+”和“nad(p)h”的简单理解表示磷酸化和非磷酸化形式的烟酰胺腺嘌呤二核苷酸的氧化态为带正电荷的物质“nad(p)+”,而磷酸化和非磷酸化形式的烟酰胺腺嘌呤二核苷酸的还原态“nad(p)h”显示为相对于氧化态仅增加了一个氢。这些表示都不是真实的情况。磷酸化和非磷酸化形式的烟酰胺腺嘌呤二核苷酸的氧化态是中性分子,其中烟酰胺环的氮带有形式正电荷,其被去质子化的磷酸键之一的负电荷平衡,从而形成内盐或两性离子。相对于氧化态,磷酸化和非磷酸化形式的烟酰胺腺嘌呤二核苷酸的还原态已在形式上接受氢分子h2,这通过被两个质子平衡的两个单电子转移而实现。这在形式上通过以下平衡化学反应显示:
nad(p)+2h++2e-→nad(p)h2
所公开的非磷酸化形式的烟酰胺腺嘌呤二核苷酸的氧化态和还原态的分子量清楚地表明了该反应的实际情况,分子量分别为663.43da和665.44da,两者之间的差是单个氢分子h2的分子量。
在本公开中,描述符“nad(p)”表示磷酸化和非磷酸化形式的烟酰胺腺嘌呤二核苷酸的氧化态,而描述符“nad(p)h2”表示磷酸化和非磷酸化形式的烟酰胺腺嘌呤二核苷酸的还原态。此外,描述符“1,2-nad(p)h2”、“1,4-nad(p)h2”和“1,6-nad(p)h2”用于表示在nad(p)还原时可能出现的烟酰胺环的三种立体异构体,其中氢分子已经在形式上添加到烟酰胺环的1,2-、1,4-和1,6-位。本领域技术人员清楚,1,4-nad(p)h2通常称为β-nadh,并且是对氧化还原酶和p450酶具有活性的磷酸化和非磷酸化形式的烟酰胺腺嘌呤二核苷酸的还原态的立体异构体。
在本公开中,用描述符“[nad(p)]2”表示还已知由于单电子转移到nad(p)而形成的4,4'-二聚体。
在一些实施方式中,本公开涉及先前在pct专利申请公开号wo2014039767a1和wo2016070168a1中描述的“电化学生物反应器模块”(ebm)的改进形式和改进用途,这两篇专利文献通过引用整体并入本文。
ebm可以包括以下组件中的一个或多个:
a.容纳在阳极室中的阳极和容纳在阴极室中的阴极;
b.在阳极室中的与阳极接触的去离子水;
c.将阳极室与阴极室隔开的质子渗透性膜;
d.在阴极室中的与阴极持续接触的液相,所述液相任选地包含能够将还原当量转移到氧化还原酶系统的电子转移介体(etm),所述氧化还原酶系统包含氧化还原酶和辅因子;
e.含有底物的工艺流,所述底物待通过氧化还原酶系统催化而转化成所需产物;
f.位于阴极和工艺流之间的膜,所述膜能够防止任选的etm和氧化还原酶系统明显进入工艺流;和
g.在阳极和阴极之间提供电压的外部电源。
在某些实施方式中,本公开的改进的ebm或使用该ebm的方法可包括肾胺酶、绿豆酚氧化酶和光照,以回收由nad(p)的电化学还原产生的不需要形式的辅因子。
肾胺酶(moran等人,j.am.chem.soc.(2013),135,13980-13987;moran,g.r.,biochimicaetbiophysicaacta1864(2016)177–186)能够将1,2-二氢-nad和1,6-二氢-nad物质氧化回烟酰胺腺嘌呤二核苷酸辅因子的氧化态。
从绿豆中分离出的另一种酶,目前称为“绿豆酚氧化酶”(fricksetal,arch.biochem.biophys,(1973)169,837-841)。该酶氧化4,4'-二聚体[nad(p)]2,其可以在电化学还原条件下形成回烟酰胺腺嘌呤二核苷酸的氧化态。同样据报道,这种酶具有与肾胺酶相同的活性,也能够将1,2-nad(p)h2和1,6-nad(p)h2物质氧化回烟酰胺腺嘌呤二核苷酸的氧化态(kono等人,bull.agr.chem.soc.日本,(1958)22(6)404-410)。
最近还显示,电化学制备的4,4'-二聚体在约254nm或超过320nm的波长下的光照导致重新生成烟酰胺腺嘌呤二核苷酸的氧化态。(czochralska等人,(1980)arch.biochem.biophys.199,497;czochralska等人,(1990)photochem.photobiol.51,401-410)。
因此,在用于回收辅因子材料并且防止辅因子材料损失为不被氧化还原酶如脱氢酶、酮还原酶或p450酶使用的形式的方法中引入肾胺酶和绿豆酚氧化酶以及对烟酰胺腺嘌呤二核苷酸的[nad(p)]2二聚体进行光照是有用的。
在一个实施方式中,本公开提供一种方法,该方法包括:
a)使含有nad(p)的工艺流通过电化学电池的阴极室,从而产生所需的生物活性1,4-nad(p)h2,以及不需要的1,2-nad(p)h2、1,6-nad(p)h2和[nad(p)]2物质;
b)提供底物分子,该底物分子通过氧化还原酶(例如脱氢酶或酮还原酶或p450酶)的催化反应转化,以产生所需的产物分子;
c)使含有所需和不需要的辅因子物质的工艺流与氧化还原酶(例如脱氢酶或酮还原酶或p450酶)接触,所述氧化还原酶能够使1,4-nad(p)h2提供的还原当量来进行所需的将底物分子转化为所需产物分子的反应,同时将1,4-nad(p)h2转化回nad(p);
d)通过在氧气存在下使工艺流与肾胺酶接触足够的时间来从工艺流中存在的剩余的不需要的1,2-nad(p)h2和1,6-nad(p)h2辅因子物质中回收辅因子材料,所述足够的时间使所述肾胺酶能够催化工艺流中可能存在的不需要的1,2-nad(p)h2和1,6-nad(p)h2物质氧化为氧化形式的辅因子nad(p);
e)通过在氧气存在下使工艺流与绿豆酚氧化酶接触足够的时间来从工艺流中存在的不需要的[nad(p)]2物质回收辅因子材料,所述足够的时间使所述绿豆酚氧化酶能够催化工艺流中存在的任何[nad(p)]2氧化为氧化形式的辅因子nad(p);
f)将现在含有作为氧化形式nad(p)的所有原始烟酰胺腺嘌呤二核苷酸的工艺流返回到电化学电池的阴极室中以进行还原。
在一个实施方式中,使含有nad(p)的工艺流通过电化学电池的阴极室,从而产生1,2-nad(p)h2、1,4-nad(p)h2、1,6-nad(p)h2和4,4’-二聚体[nad(p)]2。含有nad(p)h2物质的混合物的工艺流随后与氧化还原酶(例如脱氢酶、酮还原酶或p450酶)接触,所述氧化还原酶能够使用来自1,4-nad(p)h2的还原当量来进行所需的将底物分子转化为所需产物分子的反应,同时将1,4-nad(p)h2转化回nad(p)。如pct专利申请公开号wo2016070168a1中所述,利用1,4-nad(p)h2的酶可以存在于工艺流中,固定在珠子或其它合适的材料上并保持在填充柱中,或者由膜包含,该专利文献的全部内容通过引用并入本文。
然后,在接触氧化还原酶之后和在1,4-nad(p)h2已经转化回nad(p)之后,使工艺流与肾胺酶接触。在氧气存在下,肾胺酶将可能存在的不需要的1,2-nad(p)h2和1,6-nad(p)h2物质氧化回nad(p),同时产生过氧化氢。可以存在诸如过氧化氢酶之类的酶或合适的无机催化剂(例如mno2)以分解过氧化氢,从而防止过氧化氢的有害影响。
可以将肾胺酶固定在珠子或合适的载体上,固定在膜上或由膜包含,或通过酶促反应领域的技术人员已知的其他标准方法防止其在工艺流中自由流通。由于肾胺酶对所需的1,4-nad(p)h2物质具有一定的活性并且会将其氧化回nad(p),所以更好的是肾胺酶在工艺流中不能自由流通,并且在工艺流中存在的1,4-nad(p)h2已经被氧化还原酶消耗并且已经用于在底物上进行有用的反应之后,使工艺流与肾胺酶接触。
然后在氧气存在下使工艺流与绿豆酚氧化酶接触,存在的任何不需要的4,4'-二聚体[nad(p)]2由此被氧化回nad(p),同时产生过氧化氢。可以将绿豆酚氧化酶固定在珠子或合适的载体上,固定在膜上或由膜包含,或通过酶促反应领域的技术人员已知的其他标准方法防止其在工艺流中自由流通。由于绿豆酚氧化酶对所需的1,4-nad(p)h2物质具有一定的活性并且会将其氧化回nad(p),所以更好的是绿豆酚氧化酶在工艺流中不能自由流通,并且在工艺流中存在的所需的1,4-nad(p)h2已经被氧化还原酶消耗之后,使工艺流与绿豆酚氧化酶接触。
在另一个实施方式中,在接触氧化还原酶之后,工艺流可以首先与绿豆酚氧化酶接触,用于将不需要的[nad(p)]2氧化回nad(p),然后与肾胺酶接触,用于将不需要的1,2-nad(p)h2和1,6-nad(p)h2物质氧化回nad(p)。
在另一个实施方式中,在与氧化还原酶接触后,可以使工艺流与肾胺酶接触,随后用254nm或超过320nm波长的光进行照射,以将不需要的[nad(p)]2二聚体分解回nad(p)。
在另一个实施方式中,在接触氧化还原酶之后,工艺流可以与绿豆酚氧化酶接触,不仅用于将不需要的[nad(p)]2二聚体氧化回nad(p),而且可以使不需要的1,2-nad(p)h2和1,6-nad(p)h2物质氧化成nad(p),这是因为已知绿豆酚氧化酶对将不需要的1,2-nad(p)h2和1,6-nad(p)h2物质氧化回nad(p)也具有活性。
本领域技术人员清楚的是,通过上述使工艺流与肾胺酶、绿豆酚氧化酶接触或用254nm或超过320nm波长的光对其进行光照的步骤,从不需要的1,2-nad(p)h2、1,6-nad(p)h2和[nad(p)]2物质回收作为nad(p)的辅因子材料的方法中的步骤顺序可以是任何顺序或组合。
本领域技术人员将清楚,绿豆酚氧化酶和肾胺酶可以通过已知方法进行工程改造,以获得更高的稳定性并因此在方法中具有更长的寿命,或者实现更高的活性,或者使固定化更容易和提高固定化的效率,或能够更有效地表达和分离这些酶。
对于酶促反应领域的技术人员来说同样清楚的是,绿豆酚氧化酶可以经过工程改造,使得其除了对将不需要的[nad(p)]2二聚体氧化成nad(p)具有活性外,还对将不需要的1,2-nad(p)h2和1,6-nad(p)h2物质氧化为nad(p)具有增强的活性。
在某些实施方式中,可以将肾胺酶和绿豆酚氧化酶工程改造为对所需的1,4-nad(p)h2物质具有不明显的(例如低于野生型)活性,但是对由nad(p)的电化学还原产生的不需要的1,2-nad(p)h2、1,6-nad(p)h2和[nad(p)]2物质具有有用的(例如高于野生型)的活性。然后可以将这些酶与工艺流一起流通,或者可以固定或以其他方式包含酶并以任何方便的顺序与工艺流接触,包括在使工艺流与作用于所提供的底物的氧化还原酶或p450酶接触之前进行。
实施例
实施例i
该实施例描述了一种示例性方法,其中不需要的1,2-nad(p)h2和1,6-nad(p)h2异构体被肾胺酶再氧化成nad(p),并且不需要的[nad(p)]2二聚体被绿豆酚氧化酶氧化裂解成nad(p)。
为了证明本公开中描述的方法,如burnett和underwood(biochem.7(10),3328-3333,1968)所述,从绿豆幼苗中提取绿豆酚氧化酶。将基因人肾胺酶同种型1克隆到质粒上以在大肠杆菌中表达,包括密码子优化。pandini等人揭示了肾胺酶的序列[蛋白质表达和纯化(proteinexpressionandpurification)72(2010)244-253]。该酶以包涵体表达,如padini等人(proteinexpressionandpurification72(2010)244-253)所述对该包涵体进行收集并重折叠。将肾胺酶(mw=35kda)保持在容器中,该容器具有入口和出口,在入口和出口之间具有渗透膜,该渗透膜的截留分子量足够低以防止肾胺酶通过它,并且截留分子量又足够高,使得工艺流中存在的所有烟酰胺腺嘌呤二核苷酸物质都可以通过它。使用截留分子量为10kda的膜。以类似的方式,将绿豆酚氧化酶保持在单独的容器中,该容器具有入口和出口,在入口和出口之间也包括具有渗透性的膜,该膜的截留分子量足够低使得绿豆酚氧化酶无法通过它,但是截留分子量又足够高,使得工艺流中存在的所有烟酰胺腺嘌呤二核苷酸物质都能够通过它。使用截留分子量为10kda的膜。为了允许使用证实存在有用量的所需1,4-nad(p)h2辅因子的氧化还原酶,所述膜系统如2016年5月6日公开的pct专利申请wo2016070168a1中所述,对于含有酶的目的也描述于美国专利第4,705,704号和第5,077,217号。使用马肝醇脱氢酶(horseliveralcoholdehydrogenase),其中环己酮或苯甲醛用作醇脱氢酶的底物。制备含有1至2mmnad(p)的工艺流并缓冲至适合所有三种酶的ph;使用7.5的ph值。将含有nad(p)的工艺流泵送通过电化学电池的阴极室,其在约2伏特下通电,并且nad(p)辅因子被还原以得到所需的1,4-nad(p)h2形式的辅因子,以及还得到不需要的1,2-nad(p)h2、1,6-nad(p)h2和4,4’-二聚体[nad(p)]2形式的辅因子。离开阴极室,nad(p)工艺流经过含有醇脱氢酶的膜系统,其中所需的1,4-nad(p)h2形式的辅因子为醇脱氢酶提供还原当量,环己酮或苯甲醛底物分别被还原成环己醇或苄醇产物,因此消耗了1,4-nad(p)h2形式的辅因子并产生氧化形式的nad(p)。然后,工艺流行进至容纳肾胺酶的容器的入口。工艺流与肾胺酶混合,并且肾胺酶将不需要的1,2-nad(p)h2和1,6-nad(p)h2形式的辅因子氧化成nad(p)。然后,工艺流通过膜,但肾胺酶被膜保持在其容器中。在通过膜之后,工艺流行进至容纳肾胺酶的容器的出口。工艺流由此行进至容纳绿豆酚氧化酶的容器的入口。该工艺流与绿豆酚氧化酶混合,该酶将不需要的4,4’二聚体[nad(p)]2形式的辅因子氧化成nad(p)。然后,工艺流通过膜,但绿豆酚氧化酶被膜保持在其容器中。工艺流通过容纳绿豆酚氧化酶的容器的出口排出,这样一来,仅含nad(p),因为其他形式的辅因子已经全部被醇脱氢酶、肾胺酶和绿豆酚氧化酶氧化。将工艺流返回泵,并送入阴极室以重复循环。
实施例ii
该实施例描述了一种示例性方法,其中不需要的1,2-nad(p)h2和1,6-nad(p)h2异构体被肾胺酶再氧化成nad(p),并且不需要的[nad(p)]2二聚体在254nm的紫外光的光照下氧化裂解成nad(p)。
使用实施例i中描述的方法,不同之处在于容纳绿豆酚氧化酶的容器被石英管代替,通过该石英管,工艺流可以不受任何膜的阻碍而流动。在石英管外面存在紫外灯,用254nm的光照射石英管,光线穿过石英,并使辅因子的4,4-二聚体[nad(p)]2光裂解为nad(p)。离开石英管后,工艺流返回泵,并送入阴极室以重复循环。
等同形式
本公开尤其提供了用于为生物系统提供还原当量的新方法和装置。虽然已经讨论了本主题公开的特定实施方式,但是以上说明书是说明性的而非限制性的。在阅读本说明书后,本公开的许多变化对于本领域技术人员而言将变得显而易见。本公开的全部范围应该通过参考权利要求及其等同物的全部范围和说明书以及这些变化来确定。
通过引用纳入
以上引用的所有出版物、专利和专利申请均出于所有目的通过引用整体并入本文,其程度如同每个单独的出版物或专利申请被具体指出通过引用并入。
- 还没有人留言评论。精彩留言会获得点赞!