用于有效活化NKT细胞的技术的制作方法
本发明涉及用于有效活化nkt细胞的技术。更具体地,本发明涉及用于产生具有优异nkt细胞活化活性的nkt细胞配体-脉冲的(pulsed)细胞的方法,通过所述方法获得的细胞,所述细胞的药物用途等。
[
背景技术:
]
自然杀伤(下文nk)t细胞是属于新型淋巴细胞谱系且显示与其它淋巴细胞谱系(t、b、nk细胞)的特征不同的特征的免疫细胞。nkt细胞与nk细胞有关,因为nkt细胞中存在细胞毒性的穿孔蛋白颗粒(非专利文献1)。然而,由于nkt细胞不仅表达nk细胞标志物而且表达t细胞受体(tcr),因此其为明显不同的新细胞群(非专利文献2)。nkt细胞具有产生th-1型细胞因子(主要是ifn-γ)和th-2型细胞因子(主要是il-4)两者的能力(非专利文献3),且因此表明nkt细胞可能在平衡免疫系统方面发挥作用(非专利文献4)。因此,如果可以控制nkt细胞的作用,可以治疗由免疫系统的平衡异常引起的各种疾病、特别是癌症和感染性疾病。
nkt细胞的最显著的特性是nkt细胞中表达的tcr的α链在一个物种的所有个体中是相同的。这表明同种异体生物体中的所有nkt细胞都通过识别相同的物质而被活化。该α链在人体中是vα24,且在小鼠中是vα14,并且其在两个物种之间具有非常高的同源性。此外,已知仅非常有限种类的β链与α链配对。因此,该tcr也称为“不变型tcr”。其特征还在于nkt细胞的tcr识别糖脂,而一般t细胞的tcr识别蛋白片段。
α-半乳糖苷神经酰胺(α-galcer)是从毛里求斯群海绵(agelasmauritianus,其是一种海洋海绵)的提取物分离的糖脂,并且被报道为强烈地活化nkt细胞(非专利文献5)。α-半乳糖苷神经酰胺由以树突细胞(dc)等代表的抗原递呈细胞(apc)摄取,且然后由与主要组织相容性复合体(mhc)i类分子类似的cd1d蛋白递呈在细胞膜上。由于在物种中仅存在一种该cd1d分子并且其对所有人都是共有的,所以α-galcer成为所有人共有的药物。通过使用nkt细胞中唯一的tcrα链识别因此呈递的cd1d蛋白和α-半乳糖苷神经酰胺的复合物来活化nkt细胞,并起始各种免疫反应。
近年来,已经注意到如上所述的nkt细胞的功能,并且已经开发了含有α-galcer作为活性成分的癌症的治疗药物。然而,通过施用α-galcer活化的nkt细胞同时产生ifn-γ(刺激细胞介导的免疫且可用于治疗癌症和感染性疾病的细胞因子)和il-4,其对于细胞免疫是抑制性的。作为结果,两者的功能相互抵消,导致可能指出对癌症和感染性疾病的治疗的效果可能并不总是足够的。
因此,已经开发了许多α-galcer衍生物,其强烈地活化nkt细胞并优先于il-4产生ifn-γ(专利文献1-5)。
由α-galcer活化的nkt细胞通过表达各种杀细胞诱导剂诸如穿孔蛋白等直接显示针对靶细胞的细胞毒活性(非专利文献1、6)。它们是非常独特的细胞,因为它们表现出通过由活化的nkt细胞迅速且大量产生的th1-型细胞因子诸如干扰素-γ等、树突细胞(dc)的成熟等,对nk细胞和cd8+t细胞的细胞毒活性的增强作用(非专利文献7)。此外,在小鼠癌症转移模型中揭示,通过细胞疗法发挥更有效的抗肿瘤作用,在所述细胞疗法中,经由通过树突细胞(dc)呈递施用α-galcer,而不是单独施用α-galcer(非专利文献8)。基于这些研究,已经进行了靶向nkt细胞的免疫细胞疗法的临床开发,其中施用用nkt细胞配体诸如α-galcer等脉冲的dc以在体内活化nkt细胞并且其抗肿瘤作用被用于治疗和预防癌症和感染性疾病。
例如,非专利文献9已经报道,在用于非小细胞肺癌的α-galcer-脉冲的dc治疗中,通过施用α-galcer-脉冲的dc增加外周血细胞中产生ifn-γ的细胞的一组病例与非增加病例组相比显示总体存活期的显著延长。尽管α-galcer反应性的产生ifn-γ的细胞通常是nkt细胞,但已经发现在施用α-galcer-脉冲的dc后nk细胞增加(非专利文献10、11),并且表明通过α-galcer-脉冲的dc疗法活化的nkt细胞对其他免疫细胞的佐剂作用。鉴于产生ifn-γ的细胞的增加和存活期延长作用之间的密切关系,如何增强ifn-γ产生被认为对于改善通过使用用nkt细胞配体诸如α-galcer等脉冲的抗原呈递细胞的免疫细胞疗法来治疗和预防癌症和感染性疾病的结果是重要的。
在非专利文献9中的α-galcer-脉冲的dc疗法中,通过将通过组分血液采样从患者收集的所有外周血细胞在gm-csf和il-2存在的情况下培养1至2周来获得树突细胞。此外,在施用于患者前一天,将树突细胞用α-galcer脉冲,培养1天,并通过滴注静脉内施用获得的α-galcer-脉冲的dc。在该培养系统中,单核细胞来源的dc的成熟由于培养细胞中含有的t细胞产生的il-4、tnf-α而进行,并且α-galcer的呈递能力得到增强。
通常,通过将单核细胞在gm-csf和il-4存在的情况下在外周血中培养约6天来获得未成熟树突细胞,将未成熟树突细胞与炎性细胞因子(tnf-α、il-1β、il-6)一起培养约2天以产生成熟的树突细胞,并将成熟的树突细胞用nkt细胞配体诸如α-galcer等脉冲,由此活化nkt细胞(非专利文献5、12)。
如上所述,成熟树突细胞专门用作nkt细胞的抗原呈递细胞,并且单核细胞和未成熟树突细胞被认为不能适当地将抗原呈递至nkt细胞并有效地活化nkt细胞。另一方面,成熟树突细胞的制备需要长期培养。
[文献列表]
[专利文献]
专利文献1:wo2008/102888a1
专利文献2:wo2009/119692a1
专利文献3:wo2010/030012a1
专利文献4:wo2011/552842a1
专利文献5:wo2013/162016a1
[非专利文献]
非专利文件1:proc.natl.acad.sci.usa1998,95,5690-5693
非专利文件2:j.immunol.1995,155,2972-2983
非专利文件3:j.immunol.1998,161,3271-3281
非专利文件4:science,1997,278,1623-1626
非专利文件5:science,1997,278,1626-1629
非专利文件6:cancerres1999;59:5102-5105
非专利文件7:natimmunol2003;4:1164-1165
非专利文件8:jimmunol1999;163:2387-2391
非专利文件9:jimmunol2009;182:2492-2501
非专利文件10:clincancerres2006;12:6079-6086
非专利文件11:cancersci2008;99:638-645.
非专利文件12:natimmunol,2002,3(9):867-874。
[发明概述]
[本发明待解决的问题]
本发明的一个目的是提供用于在相对短时段内产生具有强nkt细胞活化能力的nkt细胞配体-脉冲的细胞的技术。
[解决问题的方式]
本发明人已经进行了深入研究以试图解决前述问题。作为结果,他们扭转了“树突细胞的抗原呈递和由此t细胞活化”的常识,并且发现,当nkt细胞被活化时,胚胎未分化阶段中的单核细胞,即cd14阳性细胞,作为抗原呈递细胞和脉冲的细胞,优于树突细胞。他们显示,在il-4不存在的情况下,在仅含有nkt细胞配体和gm-csf的培养基中培养cd14阳性细胞,增加nkt细胞活化所必需的cd40表达,并提供能够强烈地活化nkt细胞的nkt细胞配体-脉冲的细胞。在已经从cd14阳性细胞建立的单核细胞和cd14阳性细胞系的情况下,可以通过在gm-csf和il-4不存在的情况下在仅含有nkt细胞配体的培养基中培养来获得nkt细胞配体-脉冲的cd14阳性细胞系。在两个产生步骤中,足够的孵育期为约2天。这表明不需要将cd14阳性细胞分化为树突细胞的步骤,并且直接从分离的cd14阳性细胞或cd14阳性细胞系获得nkt细胞配体-脉冲的细胞。获得的nkt细胞配体-脉冲的细胞(nkt细胞配体-脉冲的cd14阳性细胞或nkt细胞配体-脉冲的cd14阳性细胞系)强烈地诱导nkt细胞的增殖、nkt细胞的ifn-γ产生和细胞毒活性。
本发明人已经基于上述发现进一步研究并完成本发明。
因此,本发明提供了以下:
[1]用于产生nkt细胞配体-脉冲的细胞(即nkt细胞配体-脉冲的cd14阳性细胞或nkt细胞配体-脉冲的cd14阳性细胞系)的方法,其包括在含有nkt细胞配体和gm-csf且基本上不含il-4的培养基中培养分离自人外周血的cd14阳性细胞的步骤(产生方法1)或在含有nkt细胞配体且基本上不含gm-csf和il-4的培养基中培养分离的cd14阳性细胞系的步骤(产生方法2)。
[2][1]的方法,其中所述培养基基本上不含scf和/或flt3l。
[3][1]或[2]的方法,其中分离的cd14阳性细胞具有不小于70%的纯度。
[4][1]至[3]中任一项的方法,其中将所述细胞在添加所述nkt细胞配体后培养至少16小时。
[5][4]的方法,其中将所述细胞在添加所述nkt细胞配体后培养16-72小时。
[6][1]至[5]中任一项的方法,其中所述nkt细胞配体是由下式(vi)代表的化合物,或其盐:
其中
x是亚烷基或-nh-;
r1和r2是相同或不同的,且各自为氢原子、烷基、羟基、烷氧基、或任选地具有取代基的芳基,r1和r2任选地与邻近氮原子一起形成5-或6-元环;
r3是具有1-20个碳原子的烃基;且
r4是具有1-30个碳原子的烃基。
[7][6]的方法,其中所述nkt细胞配体是由下式代表的化合物,或其盐:
[8][1]至[7]中任一项的方法,其中所述培养基中所述nkt细胞配体的浓度为至少30ng/ml。
[9]用于产生nkt细胞配体-脉冲的细胞(nkt细胞配体-脉冲的cd14阳性细胞或nkt细胞配体-脉冲的cd14阳性细胞系)的方法,其包括在含有nkt细胞配体和gm-csf且基本上不含il-4的培养基中培养cd14阳性细胞的步骤(产生方法1)或在含有nkt细胞配体且基本上不含gm-csf和il-4的培养基中培养cd14阳性细胞系的步骤(产生方法2)。
[10][9]的方法,其中所述培养基基本上不含scf和/或flt3l。
[11][9]或[10]的方法,其中将所述细胞在添加所述nkt细胞配体后培养至少16小时。
[12][11]的方法,其中将所述细胞在添加所述nkt细胞配体后培养40-72小时。
[13][9]至[12]中任一项的方法,其中所述nkt细胞配体是由下式(vi)代表的化合物,或其盐:
其中
x是亚烷基或-nh-;
r1和r2是相同或不同的,且各自为氢原子、烷基、羟基、烷氧基、或任选地具有取代基的芳基,r1和r2任选地与邻近氮原子一起形成5-或6-元环;
r3是具有1-20个碳原子的烃基;且
r4是具有1-30个碳原子的烃基。
[14][13]的方法,其中所述nkt细胞配体是由下式代表的化合物,或其盐:
[15][9]至[14]中任一项的方法,其中所述培养基中所述nkt细胞配体的浓度为至少30ng/ml。
[16]通过[1]至[15]中任一项的方法获得的nkt细胞配体-脉冲的细胞。
[17]细胞制备物,其包含[16]的细胞。
[18]nkt细胞活化剂,其包含[16]的细胞。
[19]用于治疗或预防癌症或感染性疾病的药剂,其包含[16]的细胞。
[20]用于活化测试受试者中的nkt细胞的方法,其包括将[16]的细胞或[17]的细胞制备物施用于所述测试受试者。
[21][20]的方法,其中所述测试受试者患有癌症或感染性疾病,或具有患有癌症或感染性疾病的病史。
[22]用于治疗或预防测试受试者中的癌症或感染性疾病的方法,其包括将[16]的细胞或[17]的细胞制备物施用于所述测试受试者。
[23][16]的细胞,其用于活化nkt细胞。
[24][16]的细胞,其用于治疗或预防癌症或感染性疾病。
[25][17]的细胞制备物,其用于活化nkt细胞。
[26][17]的细胞制备物,其用于治疗或预防癌症或感染性疾病。
[27][16]的细胞在生产用于活化nkt细胞的药物中的用途。
[28][16]的细胞在生产用于治疗或预防癌症或感染性疾病的药物中的用途。
[发明效果]
根据本发明,预期在相对短的时间段内产生具有强nkt细胞活化能力的nkt细胞配体-脉冲的细胞。通过本发明的方法获得的nkt细胞配体-脉冲的细胞强烈地诱导nkt细胞的增殖、nkt细胞的ifn-γ产生和细胞毒活性。因此,它可用作用于治疗或预防疾病诸如癌症、感染性疾病等;或癌症的转移或复发的细胞制备物。
[附图简述]
图1显示人外周血cd14阳性细胞(在用rk-163脉冲之前)、通过在nkt细胞配体rk-163和gm-csf存在的情况下培养cd14阳性细胞2天而获得的“rk-163-脉冲的人cd14阳性细胞”以及在nkt细胞配体rk-163和gm-csf和il-4存在的情况下培养6天的“rk-163-脉冲的人树突细胞”的表面抗原表达模式的比较。阴影表示阴性对照抗体。此外,还显示通过将通过使用自动细胞分离器的淘析方法从人外周血的单采液获得的cd14阳性细胞在nkt细胞配体rk-163和gm-csf存在的情况下培养2天获得的“rk-163-脉冲的人elu-cd14阳性细胞”的表面抗原表达模式。“rk-163-脉冲的人elu-cd14阳性细胞”显示与通过其他分离方法获得的rk-163-脉冲的cd14阳性细胞相同的结果(cd14阳性、cd1d阳性、cd40阳性)。
图2显示从人外周血cd14阳性细胞制备的“rk-163-脉冲的人cd14阴性细胞”、从cd14阴性细胞制备的“rk-163-脉冲的人cd14阴性细胞”和“rk-163-脉冲的人树突细胞”的ifn-γ产生诱导效力(nkt细胞活化作用)的比较结果。
图3显示通过在各种rk-163脉冲浓度下培养人外周血cd14阳性细胞制备的“rk-163-脉冲的人cd14阳性细胞”的ifn-γ产生诱导效力(nkt细胞活化作用)。
图4显示通过将人外周血cd14阳性细胞和nkt细胞配体rk-163脉冲培养不同时间而制备的“rk-163-脉冲的人cd14阳性细胞”,相对于nkt细胞的ifn-γ产生诱导效力(nkt细胞活化作用)、回收率和存活率。比较用α-galcer脉冲的人cd14阳性细胞的nkt细胞活化能力(ifn-γ产生诱导效力)、回收率和存活率。
图5显示通过在含有gm-csf的培养基中以各种接种密度将人外周血cd14阳性细胞和rk-163培养48小时而获得的rk-163-脉冲的人cd14阳性细胞的活细胞数、存活率和回收率。
图6显示“α-galcer或rk-163-脉冲的人cd14阳性细胞”和“α-galcer或rk-163-脉冲的人树突细胞”诱导nkt细胞的增殖的能力的比较结果。
图7显示从人外周血cd14阳性细胞制备的“rk-163-脉冲的人cd14阳性细胞”和“rk-163-脉冲的人树突细胞”诱导nkt细胞的细胞毒活性的能力的比较结果。
图8显示通过将人外周血cd14阳性细胞与各种nkt细胞配体(rcai-85、rcai-137、rk-163)在gm-csf存在的情况下培养48小时而培养获得的“nkt细胞配体-脉冲的人cd14阳性细胞”的nkt细胞活化(ifn-γ产生诱导)能力。
图9显示源自人外周血的“rk-163-脉冲的人cd14阳性细胞”的抗肿瘤作用。
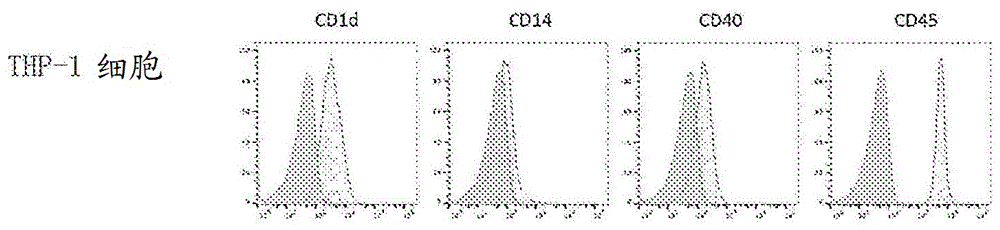
图10-1显示人cd14阳性细胞系thp-1细胞的表面抗原表达模式。
图10-2显示人cd14阳性细胞系u937细胞的表面抗原表达模式。
图10-3显示人ips-cd14阳性细胞系的表面抗原表达模式。
图11显示各自用rk-163脉冲的人thp-1、u937和人ips-cd14阳性细胞系对人nkt细胞系的ifn-γ产生诱导作用。
图12显示产生rk-163-脉冲的人cd14阳性细胞系中的rk-163脉冲时间和对人nkt细胞系的ifn-γ产生诱导作用之间的相关性。
图13显示rk-163-脉冲的人cd14阳性细胞系(thp-1、ips-cd14阳性细胞系)对nkt细胞的细胞毒活性的诱导。
图14a显示用rk-163或α-galcer脉冲的小鼠树突细胞诱导的抗肿瘤作用。
图14b显示由rk-163-脉冲的人cd14阳性细胞系(thp-1细胞、u937细胞)诱导的抗肿瘤作用。
图15a显示通过施用rk-163-脉冲的小鼠树突细胞诱导的nkt细胞的佐剂作用,而对nk细胞的活化。
图15b显示通过施用rk-163-脉冲的人cd14阳性细胞系诱导的nkt细胞的佐剂作用,而对nk细胞的活化。
图16a显示施用的rk-163-脉冲的小鼠树突细胞(它们迅速从体内消失)的药代动力学。
图16b显示施用的rk-163-脉冲的人cd14阳性细胞系(它们迅速从体内消失)的药代动力学。
图17a显示当施用rk-163-脉冲的人cd14阳性细胞系时血液急性毒性标志物(ast和alt)的水平的时程变化。
图17b显示当施用rk-163-脉冲的人cd14阳性细胞系时肝脏和脾脏的重量的时程变化。
图18显示通过软琼脂集落形成方法,辐射照射的rk-163-脉冲的人cd14阳性细胞系的致瘤性测试结果。
图19a显示rk-163-脉冲的小鼠树突细胞对记忆t细胞的诱导。
图19b显示rk-163-脉冲的人cd14阳性细胞系对记忆t细胞的诱导。
[实施方案的描述]
<nkt细胞配体-脉冲的细胞>:
本发明提供了nkt细胞配体-脉冲的细胞。本发明的nkt细胞配体-脉冲的细胞,即nkt细胞配体-脉冲的cd14阳性细胞和nkt细胞配体-脉冲的cd14阳性细胞系,活化nkt细胞并具有诱导nkt细胞的增殖、ifn-γ产生、佐剂作用、长期免疫记忆诱导和/或针对肿瘤细胞的细胞毒活性的活性。
“nkt细胞配体脉冲”意味着摄入细胞的nkt细胞配体通过cd1d蛋白被呈递在细胞膜上。下文详细描述“nkt细胞”、“nkt细胞配体”、“cd14阳性细胞”和“cd14阳性细胞系”的定义。nkt细胞配体没有特别限制,只要它是这样的化合物,其结合cd1d,当在cd1d分子上呈递时被nkt细胞上且nkt细胞特有的t细胞受体(nkt细胞受体)特异性识别,并且可以特异性活化nkt细胞。例如,nkt细胞配体是具有前述活性的糖脂,优选α-galcer或其类似物,并且鉴于其强烈地诱导nkt细胞的ifn-γ产生的事实,来自下述的nkt细胞配体中,iii或vi中描述的化合物是优选的,具体地,rcai-85、rcai-137或rk-163(rcai-124)优选的。最优选的nkt细胞配体是rk-163(rcai-124)。
本发明的nkt细胞配体-脉冲的细胞可以是哺乳动物细胞。哺乳动物的实例包括啮齿动物诸如小鼠、大鼠、仓鼠、豚鼠等,实验动物诸如兔等;家畜诸如猪、牛、山羊、马、绵羊、水貂等;宠物诸如狗、猫等;和灵长类动物诸如人类、猴、猕猴、狨猴、猩猩、黑猩猩等。优选的哺乳动物是灵长类动物,更优选人类。
当使用本发明的nkt细胞配体-脉冲的细胞进行处理时,本发明的nkt细胞配体-脉冲的细胞优选对测试受试者(患者)是同种异体的。例如,将nkt细胞配体-脉冲的人细胞施用于人。本发明的nkt细胞配体-脉冲的细胞是自体细胞(遗传同系的)或异源细胞(遗传同种异体的)。
本发明的nkt细胞配体-脉冲的细胞优选是cd14阳性的。本发明的nkt细胞配体-脉冲的细胞中cd14阳性细胞的比例例如不小于50%,优选不小于60%,不小于70%,不小于80%或不小于90%。
本发明的nkt细胞配体-脉冲的细胞优选是cd1d阳性的。本发明的nkt细胞配体-脉冲的细胞中cd1d阳性细胞的比例例如不小于50%,优选不小于60%,不小于70%,不小于80%或不小于90%。
本发明的nkt细胞配体-脉冲的细胞优选是cd40阳性的。本发明的nkt细胞配体-脉冲的细胞中cd40阳性细胞的比例例如不小于50%,优选不小于60%,不小于70%,不小于80%或不小于90%。
在一个优选实施方案中,本发明的nkt细胞配体-脉冲的细胞是cd14阳性cd1d阳性cd40阳性的。本发明的nkt细胞配体-脉冲的细胞中cd14阳性cd1d阳性cd40阳性细胞的比例例如不小于50%,优选不小于60%,不小于70%,不小于80%或不小于90%。
在一个实施方案中,本发明的nkt细胞配体-脉冲的细胞是单核细胞或由单核细胞建立的细胞系。细胞系可以通过本领域普通技术人员选择的任何已知方法建立。cd14是众所周知的单核细胞标志物。
本发明的nkt细胞配体-脉冲的细胞不是树突细胞。因此,本发明的nkt细胞配体-脉冲的细胞中的树突细胞标志物的表达是限制性的,或者本发明的nkt细胞配体-脉冲的细胞不表达树突细胞标志物。本发明的nkt细胞配体-脉冲的细胞中cd209(树突细胞标志物)阳性细胞的比例例如不超过40%,优选不超过30%,不超过20%,不超过10%,不超过5%或不超过1%(例如,0%)。树突细胞通常是cd14阴性的。
本发明的nkt细胞配体-脉冲的细胞是分离的。“分离”意味着已经进行除去除了期望细胞和组分以外的因子的操作,并且不存在天然存在的状态。“分离的nkt细胞配体-脉冲的细胞”的纯度(nkt细胞配体-脉冲的细胞数占细胞总数的百分比)通常不小于70%,优选不小于80%,不小于90%,不小于95%,不小于98%,不小于99%或不小于99.5%,最优选100%。
本发明的nkt细胞配体-脉冲的细胞可以例如通过下述方法产生。
<nkt细胞配体-脉冲的细胞的产生>
(产生方法1)
本发明提供了nkt细胞配体-脉冲的细胞的产生方法,其包括在含有nkt细胞配体和gm-csf且基本上不含il-4的培养基中培养分离的cd14阳性细胞的步骤(本发明的产生方法1)。
cd14是具有53-55kda的分子量的糖基-磷脂酰肌醇(gpi)结合的单链膜糖蛋白,并且已知为单核细胞的标志物细胞表面抗原。对应于cd14阳性细胞的细胞优选在所有哺乳动物中从造血干细胞分化,并且在分化成巨噬细胞或树突细胞、更优选单核细胞之前是祖细胞。
在本说明书中,当通过标志物分子(抗原)的表达的存在或不存在来表示细胞的表型时,其通过抗体与标志物分子的特异性结合的存在或不存在来指示,除非另有规定。通过标志物分子的表达的存在或不存在来确定细胞的表型通常通过使用针对标志物分子等的特异性抗体的流式细胞术分析来进行。标志物分子的“阳性”表达意味着标志物分子在细胞表面上表达,并且可以证实抗体与标志物分子的特异性结合。
产生方法1中使用的cd14阳性细胞可以源自哺乳动物。哺乳动物没有特别限制,只要nkt细胞配体-脉冲的细胞可以通过产生方法1产生。哺乳动物的实例包括啮齿动物诸如小鼠、大鼠、仓鼠、豚鼠等,实验动物诸如兔等;家畜诸如猪、牛、山羊、马、绵羊、水貂等;宠物诸如狗、猫等;和灵长类动物诸如人类、猴、猕猴、狨猴、猩猩、黑猩猩等。优选的哺乳动物是灵长类动物,更优选人类。
在本说明书中,cd14的命名遵循人cd14的命名。
可能存在其中除了人类以外的哺乳动物不具有对应于人cd14的抗原基因的情况。在本发明中,无论是否存在cd14的表达,将此类哺乳动物的单核细胞作为对应于“cd14阳性细胞”的细胞进行处理。
当使用通过产生方法1获得的细胞进行处理时,产生方法1中使用的cd14阳性细胞(例如,单核细胞)优选对受试者是同种异体的。待用于本发明中的cd14阳性细胞(例如,单核细胞)是自体细胞(遗传同系的)或异源细胞(遗传同种异体的)。
从含有cd14阳性细胞的组织分离待用于产生方法1中的cd14阳性细胞(例如,单核细胞)。组织的实例包括但不限于外周血、脐带血、骨髓、脾、胸腺、淋巴结、肝、肿瘤组织等。优选地从外周血或脐带血分离待用于产生方法1中的cd14阳性细胞(例如,单核细胞)。分离的cd14阳性细胞可以是cd14阳性细胞系,其被建立为来自从含有cd14阳性细胞的组织分离的cd14阳性细胞的细胞系。细胞系的建立可以根据本领域普通技术人员自由选择的已知方法进行。此外,分离的cd14-阳性细胞可以是在重编程任何细胞后通过分化诱导再次建立的cd14-阳性细胞。用于重编程任何细胞的方法的实例包括但不限于us-b-8048999、us-b-8058065、us-b-8129187、us-b-8278104、us-b-8791248、us-b-9145547中描述的方法。作为用于从重编程细胞获得cd14阳性细胞的方法,例如可以提及grigoriadis等人,blood,2010年4月8日;115(14):2769-76和stemcells,2016年12月;34(12):2852-2860。该方法不限于此,因为本领域普通技术人员可以自由地优化该方法。
待用于产生方法1中的cd14阳性细胞(例如,单核细胞)是分离的。“分离”意味着已经进行除去除了期望细胞和组分以外的因子的操作,并且不存在天然存在的状态。“分离的cd14阳性细胞”的纯度(cd14阳性细胞数占细胞总数的百分比)通常不小于70%,优选不小于80%,不小于90%,不小于95%,不小于98%,不小于99%或不小于99.5%,最优选100%。类似地定义其他种类的细胞。
可以通过使用特异性结合cd14的抗体并根据方法诸如抗体结合的磁珠、细胞分选仪、淘选等,从前述含有cd14阳性细胞(例如,单核细胞)的组织分离cd14阳性细胞(例如,单核细胞)。此外,cd14阳性细胞(例如,单核细胞)可以通过使用自动细胞分离器的淘析方法从人外周血的单采液分离。
例如,首先,从外周血、脐带血等制备单核细胞级分。单核细胞级分通过例如使用ficoll-paqueplus(gehealthcarejapan)的密度梯度离心、单采液等来制备。接下来,用特异性结合cd14并用荧光染料、磁珠等标记的抗体染色单核细胞级分,并使用细胞分选仪、磁柱等分离cd14阳性细胞(例如,单核细胞)。cd14阳性细胞(例如,单核细胞)可以通过简单的淘选方法(包括将cd14阳性细胞附接至皮氏培养皿)从单核细胞级分分离。此外,可以使用通过使用自动细胞分离器(由terumo等制造)的淘析方法,从人外周血的单采液获得的cd14阳性细胞(例如,单核细胞)浓缩级分。
也可以使用特异性结合单核细胞和巨噬细胞的其他标志物(例如,mhci类样分子(cd1d等)、cd11b、cd15、cd86等)的抗体来代替特异性结合cd14的抗体。
在培养开始时,待用于产生方法1中的分离的cd14阳性细胞中cd1d阳性细胞的比例通常不小于70%,优选不小于80%,不小于90%,不小于95%,不小于98%,不小于99%或不小于99.5%,最优选100%。
然后,将分离的cd14阳性细胞在含有nkt细胞配体和gm-csf且基本上不含il-4的培养基中培养。优选地,从前述生物组织分离的cd14阳性细胞的原代培养物在含有nkt细胞配体和gm-csf且基本上不含il-4的培养基中进行。
nkt细胞是表达nk受体-特异性t细胞受体(不变型tcr)和nk受体的两种抗原受体的淋巴细胞。与一般t细胞不同,nkt细胞上的t细胞受体库非常有限。例如,小鼠nkt细胞(有时被称为vα14nkt细胞)上的t细胞受体的α链由不变型vα14和jα18基因区段编码(procnatlacadsciusa,83,p.8708-8712,1986;procnatlacadsciusa,88,p.7518-7522,1991;jexpmed,180,p.1097-1106,1994),且人nkt细胞上的t细胞受体的α链由与小鼠vα14和jα18基因区段高度同源的不变型vα24编码。nkt细胞通过细胞上的t细胞受体(这也称为nkt细胞受体)识别呈递在cd1d分子上的“nkt细胞配体”。
nkt细胞配体是这样的化合物,其当在cd1d分子上呈递时被nkt细胞上且nkt细胞特有的t细胞受体(nkt细胞受体)特异性识别,并且可以特异性活化nkt细胞。可用于本发明中的nkt细胞配体是,例如,具有前述活性的糖脂,优选α-galcer或其类似物。例如,可以提及以下化合物。
i.式(i)化合物或其盐或溶剂化物。
(在上述式中,r11是h或oh,x1是7-27中任一个的整数,r21是选自以下(a)-(e)的取代基(y1是5-17中任一个的整数),(a)-ch2(ch2)y1ch3,(b)-ch(oh)(ch2)y1ch3,(c)-ch(oh)(ch2)y1ch(ch3)2,(d)-ch=ch(ch2)y1ch3,(e)-ch(oh)(ch2)y1ch(ch3)ch2ch3,且r31-r91是由以下i)或ii)定义的取代基:i)r31、r61,且当r81是h时,r41是h、oh、nh2、nhcoch3或选自以下基团(a)-(d)的取代基:
且r51是oh或选自以下基团(e)和(f)的取代基:
r71是oh或选自以下基团(a)-(d)的取代基:
r91是h、ch3、ch2oh或选自以下基团(a')-(d')的取代基:
ii)当r31、r61和r71各自是h时,r41是h、oh、nh2、nhcoch3或选自以下基团(a)-(d)的取代基:
r51是oh或选自以下基团(e)和(f)的取代基:
r81是oh或选自以下基团(a)-(d)的取代基:
r91是h、ch3、ch2oh或选自以下基团(a')-(d')的取代基:
这些中,(2s,3s,4r)-1-o-(α-d-吡喃半乳糖基)-2-二十六烷酰基氨基-1,3,4-十八烷三醇(在本说明书中,也称为α-半乳糖苷神经酰胺,α-galcer)是优选的。α-galcer的结构式显示于下式(a)中:
式(i)化合物可以通过wo94/09020、wo94/02168、wo94/24142、wo98/44928、science,278,p.1626-1629,1997等中描述的方法产生。
ii.由式(ii)代表的化合物,或其盐:
其中r1是α-碳环糖残基,r2和r3各自独立地是具有1-28个碳原子的取代或未取代的烃基,x是氧原子、硫原子、-ch2-或-nh-,且y是-ch2-、-ch(oh)-或-ch=ch-。
具体地,以下化合物是优选的。
[1](2s,3s,4r)-1-(5a-碳-α-d-吡喃半乳糖基氧基)-2-(二十六烷酰基氨基)-3,4-十八烷二醇
[2](2s,3s,4r)-1-(5a-碳-α-d-吡喃半乳糖基硫基)-2-(二十六烷酰基氨基)-3,4-十八烷二醇
[3](2s,3s,4r)-1-(5a-碳-α-d-吡喃葡萄糖基氧基)-2-(二十六烷酰基氨基)-3,4-十八烷二醇
[4](2s,3s,4r)-1-(5a-碳-α-d-吡喃葡萄糖基硫基)-2-(二十六烷酰基氨基)-3,4-十八烷二醇
[5](2s,3s,4r)-1-(5a-碳-α-d-吡喃岩藻糖基氧基)-2-(二十六烷酰基氨基)-3,4-十八烷二醇。
式(ii)化合物或其盐可以通过wo2008/102888、美国专利号8299223等中描述的方法产生。
iii.由式(iii)代表的化合物,或其盐:
其中r1是氢原子、具有1-7个碳原子的烷基、具有1-6个碳原子的烷氧基或卤素原子,r2和r3各自独立地是具有1-28个碳原子的取代或未取代的烃基,且y是-ch2-、-ch(oh)-或-ch=ch-,条件是当r1是氢原子时,r2是具有24-28个碳原子的取代或未取代的烃基。
具体地,以下化合物是优选的。
rcai-61
rcai-64
rcai-85
rcai-165
式(iii)化合物或其盐可以通过wo2009/119692、美国专利号8551959等中描述的方法产生。
iv.由式(iv)代表的化合物,或其盐:
其中r1是具有1-30个碳原子的烃基,r2是具有1-20个碳原子的烃基,r3是氢原子或具有1-5个碳原子的烃基,r4和r5是相同或不同的或者各自为氢原子或具有1-5个碳原子的烃基,或者r4和r5接合以形成具有1-5个碳原子的二价烃基,其任选地与相邻的亚乙基二氧基形成环结构。
式(iv)化合物或其盐可以通过wo2010/030012、美国专利号8580751等中描述的方法产生。
v.由式(v)代表的化合物或其盐:
其中r1是吡喃醛糖残基,其中6-位羟基任选地被烷基化,r2是具有1-26个碳原子且任选地具有取代基的烃基,r3是氢原子或具有1-26个碳原子且任选地具有取代基的烃基,r4是具有1-21个碳原子且任选地具有取代基的烃基,x是氧原子或-ch2-,且y是-ch2-、-ch(oh)-或-ch=ch-。
具体地,以下化合物或其盐是优选的。
[1](2s,3s,4r)-1-(α-d-吡喃半乳糖基氧基)-2-(二十四烷酰基脲基)-3,4-十八烷二醇
[2](2s,3s,4r)-1-(α-d-吡喃半乳糖基氧基)-2-(十六烷基脲基)-3,4-十八烷二醇
[3](2s,3s,4r)-1-(6-o-甲基-α-d-吡喃半乳糖基氧基)-2-(二十四烷酰基脲基)-3,4-十八烷二醇。
式(v)化合物或其盐可以通过wo2011/552842、美国专利号8853173等中描述的方法产生。
vi.由式(vi)代表的化合物或其盐。
由下式代表的化合物,或其盐:
其中:
x是亚烷基或-nh-;
r1和r2是相同或不同的,且各自是氢原子、烷基、羟基、烷氧基、或任选地具有取代基的芳基,r1和r2任选与邻近氮原子一起形成5-或6-元环;
r3是具有1-20个碳原子的烃基;
r4是具有1-30个碳原子的烃基。
具体地,以下化合物是优选的。
rk-163(rcai-124)
rcai-137
式(vi)化合物或其盐可以通过wo2013/162016a1、us2015/152128a1等中描述的方法产生。
为了强烈地诱导nkt细胞的ifn-γ产生,在上述nkt细胞配体中,上述iii或vi中描述的化合物是优选的,且具体地,
rcai-85
rcai-137
rk-163(rcai-124)
是优选的。
待用于产生方法1中的nkt细胞配体最优选为rk-163(rcai-124)。
用于培养cd14阳性细胞(例如,单核细胞)的培养基中nkt细胞配体的浓度没有特别限制,只要通过产生方法1获得的nkt细胞配体-脉冲的细胞可以活化nkt细胞。其通常不小于1ng/ml,优选地不小于10ng/ml,更优选地不小于30ng/ml。理论上,培养基中nkt细胞配体浓度的上限是其溶解度。即使浓度设定得不必要地高,nkt细胞配体-脉冲的细胞活化nkt细胞的作用也达到平台。从培养成本的方面来看,其通常不超过10000ng/ml,优选地不超过1000ng/ml,更优选地不超过300ng/ml。因此,待添加至培养基中的nkt细胞配体的浓度范围通常为1-10000ng/ml,优选地10-1000ng/ml,更优选地30-300ng/ml。
将gm-csf添加至待用于培养cd14阳性细胞(例如,单核细胞)的培养基中。培养基中gm-csf的浓度没有特别限制,只要诱导培养后获得的nkt细胞配体-脉冲的细胞中cd40的表达。其通常不小于6.7ng/ml,优选地不小于33.3ng/ml,更优选地不小于53.3ng/ml。理论上,培养基中gm-csf浓度的上限是其溶解度。即使浓度设定得不必要地高,其作用也达到平台。从培养成本的方面来看,其通常不超过666.7ng/ml,优选地不超过133.3ng/ml,更优选地不超过66.7ng/ml。因此,培养基中gm-csf的浓度通常为6.7-666.7ng/ml,优选地33.3-133.3ng/ml,更优选地53.3-66.6ng/ml。当gm-csf浓度由其生物活性(iu)表示时,将以下转化公式应用于上述浓度:gm-csf1mg=1.5x107iu。
重要地,待用于培养cd14阳性细胞(例如,单核细胞)的培养基基本上不含il-4。当在含有gm-csf和il-4的培养基中培养分离的cd14阳性细胞(例如,单核细胞)时,可以诱导未成熟的树突细胞。在树突细胞中,几乎不识别cd1d的表达,并且通过将nkt细胞配体呈递至nkt细胞来活化nkt细胞的能力较低。相反,在产生方法1中,可以通过在含有gm-csf且基本上不含il-4的培养基中培养分离的cd14阳性细胞(例如,单核细胞)来获得具有活化nkt细胞的高能力、同时维持cd1d表达的细胞。“基本上不含il-4”意味着培养基中il-4的浓度低于分离的cd14阳性细胞(例如,单核细胞)被诱导成未成熟树突细胞的浓度。待用于培养cd14阳性细胞的培养基中il-4的浓度通常小于0.01ng/ml,优选地小于0.001ng/ml,更优选地小于0.0001ng/ml(例如,0ng/ml)。因此,在一个优选实施方案中,在培养分离的cd14阳性细胞(例如,单核细胞)中,不向培养物中添加外源il-4。
待用于培养cd14阳性细胞(例如,单核细胞)的培养基优选地基本上不含flt-3l。尽管flt-3l可以促进cd14阳性细胞分化为树突细胞,但在产生方法1中不期望分化成树突细胞。此外,flt-3l的添加可以降低在培养cd14阳性细胞后的细胞存活率、活细胞数和细胞回收率。“基本上不含flt-3l”意味着培养基中flt-3l的浓度低于分离的cd14阳性细胞被诱导成未成熟树突细胞的浓度。在一个实施方案中,待用于培养cd14阳性细胞的培养基中flt-3l的浓度通常小于0.01ng/ml,优选地小于0.001ng/ml,更优选地小于0.0001ng/ml(例如,0ng/ml)。因此,在一个优选实施方案中,在培养分离的cd14阳性细胞(例如,单核细胞)中,不向培养物中添加外源flt-3l。
待用于培养cd14阳性细胞(例如,单核细胞)的培养基优选地基本上不含scf。尽管已报道scf参与分化成树突细胞,但在产生方法1中不期望分化成树突细胞。此外,scf的添加可以降低在培养cd14阳性细胞后的细胞存活率、活细胞数和细胞回收率。“基本上不含scf”意味着培养基中flt-3l的浓度低于促进分化成树突细胞的浓度。在一个实施方案中,待用于培养cd14阳性细胞的培养基中scf的浓度通常小于0.01ng/ml,优选地小于0.001ng/ml,更优选地小于0.0001ng/ml(例如,0ng/ml)。因此,在一个优选实施方案中,在培养分离的cd14阳性细胞(例如,单核细胞)中,不向培养物中添加外源scf。
待用于培养cd14阳性细胞(例如,单核细胞)的培养基优选地基本上不含il-2。il-2活化污染培养物的t细胞以诱导il-4的产生,并且该il-4可以促进cd14阳性细胞分化成树突细胞。“基本上不含il-2”意味着培养基中il-2的浓度低于活化t细胞的浓度。在一个实施方案中,待用于培养cd14阳性细胞的培养基中il-2的浓度通常小于0.01ng/ml,优选地小于0.001ng/ml,更优选地小于0.0001ng/ml(例如,0ng/ml)。因此,在一个优选实施方案中,在培养分离的cd14阳性细胞(例如,单核细胞)中,不向培养物中添加外源il-2。
除了上述那些以外,待用于培养cd14阳性细胞(例如,单核细胞)的培养基在gm-csf以外还可以含有一种或多种细胞因子(白介素、趋化因子、干扰素、造血因子、细胞生长因子、细胞毒因子、脂肪因子、神经营养因子等),只要可以通过产生方法1产生有效地活化nkt细胞的nkt细胞配体-脉冲的细胞。
在一个实施方案中,除了gm-csf以外,待用于培养cd14阳性细胞(例如,单核细胞)的培养基基本上不含细胞因子(白介素、趋化因子、干扰素、造血因子、细胞生长因子、细胞毒因子、脂肪因子、神经营养因子等)。在该实施方案中,培养基中除了gm-csf以外的每种细胞因子的浓度例如小于0.01ng/ml,优选地小于0.001ng/ml,更优选地小于0.0001ng/ml(例如,0ng/ml)。在一个优选实施方案中,在培养分离的cd14阳性细胞(例如,单核细胞)中不向培养物中,添加除了gm-csf以外的外源细胞因子。
在产生方法1中待添加至培养基中的蛋白质因子可以源自与待培养的cd14阳性细胞(例如,单核细胞)相同的动物物种,或者可以源自不同的动物物种。优选地,其源自相同的动物物种。例如,当培养人cd14阳性细胞(例如,人单核细胞)时,添加人来源的蛋白质因子(例如,人gm-csf等)。“人来源的”蛋白质因子意味着该因子的氨基酸序列与人类中天然表达的因子的氨基酸序列相同。
作为待用于培养cd14阳性细胞(例如,单核细胞)的培养基的基础培养基,可以使用本身已知的那些,并且没有特别限制,只要可以通过产生方法1产生nkt细胞配体-脉冲的细胞。例如,可以提及rpmi-1640、dmem、emem、α-mem、f-12、f-10、m-199、ham等。也可以使用经修饰用于培养淋巴细胞等的培养基(例如,aim-v),并且可以使用上述基础培养基的混合物。
培养基可以含有本身已知的添加剂。添加剂没有特别限制,只要可以通过产生方法1产生nkt细胞配体-脉冲的细胞。例如,可以提及有机酸(例如,丙酮酸钠等)、氨基酸(例如,非必需氨基酸、l-谷氨酰胺等)、还原剂(例如,2-巯基乙醇等)、缓冲剂(例如,hepes等)、抗生素(例如,链霉素、青霉素、庆大霉素等)等。优选地含有本身已知的浓度范围的每种添加剂。
所述培养基可以含有或不含有血清。血清没有特别限制,只要其源自哺乳动物且可以通过产生方法1产生nkt细胞配体-脉冲的细胞。其优选地是源自上述哺乳动物的血清(例如,胎牛血清、人血清等)。可以使用由其收集待培养的cd14阳性细胞(例如,单核细胞)的受试者的自体血清。也可以使用血清的替代添加剂(例如,敲除血清替代物(ksr)(由invitrogen制造)等)来代替血清。尽管只要可以通过产生方法1产生nkt细胞配体-脉冲的细胞,血清的浓度没有特别限制,但其通常为0.1-30(v/v)%。
从避免化学不确定组分的污染的方面来看,用于培养cd14阳性细胞(例如,单核细胞)的培养基可以优选为无血清培养基。无血清培养基意指不含未调节或未纯化血清的培养基,且含有源自纯化血液的组分和源自动物组织的组分(例如,生长因子)的培养基对应于无血清培养基。
分离的cd14阳性细胞(例如,单核细胞)可以通过例如如下的培养物:离心从前述生物样品分离的cd14阳性细胞(例如,单核细胞)以回收细胞,除去上清液培养基,将细胞悬浮于前述含有nkt细胞配体和gm-csf且基本上不含il-4的培养基中,在培养皿中接种细胞并将它们培养给定时间。可以将分离的cd14阳性细胞(例如,单核细胞)悬浮于不含nkt细胞配体和/或gm-csf且基本上不含il-4的培养基中,接种在培养皿中,并且将nkt细胞配体和/或gm-csf添加至培养基中至给定浓度。可以通过根据期望目的控制培养皿等来适当地按比例放大培养物。
培养开始时cd14阳性细胞(例如,单核细胞)的接种密度没有特别限制,只要可以通过产生方法1产生nkt细胞配体-脉冲的细胞。由于预期达到相当高的存活率、回收率和存活细胞数,其通常为0.42×106-3.42×106(个细胞/cm2),优选地,1.68×106-3.42×106(个细胞/cm2)。分母的面积表示培养容器的底部面积。
在含有nkt细胞配体的培养基中分离的cd14阳性细胞(例如,单核细胞)的培养期(即,通过nkt细胞配体的脉冲时间)没有特别限制,只要可以通过产生方法1产生nkt细胞配体-脉冲的细胞。从确定地呈递nkt细胞配体和增强活化nkt细胞的能力的方面来看,其通常不小于16小时,优选地16-72小时,更优选地20-72小时。
作为其他培养条件,可以使用通常用于淋巴细胞培养技术中的那些。例如,培养温度通常为约30-40℃,优选地约37℃。co2浓度通常为约1-10%,优选地约5%。湿度通常为约70-100%,优选地约95-100%。
通过此类培养操作,nkt细胞配体被摄入cd14阳性细胞(例如,单核细胞)中并通过cd1d蛋白呈递在细胞膜上,由此可以获得nkt细胞配体-脉冲的细胞。
在产生方法1中获得的nkt细胞配体-脉冲的细胞活化nkt细胞并具有诱导nkt细胞的增殖的活性、ifn-γ的产生和/或针对肿瘤细胞的细胞毒活性。
获得的nkt细胞配体-脉冲的细胞可以通过在培养和分离nkt细胞后共培养细胞并评估ifn-γ产生来证实。通过共培养nkt细胞配体-脉冲的细胞和分离的nkt细胞,nkt细胞被活化并诱导ifn-γ的产生。
通过产生方法1获得的nkt细胞配体-脉冲的细胞优选是cd14阳性的。通过产生方法1获得的nkt细胞配体-脉冲的细胞中cd14阳性细胞的比例例如不小于50%,优选地不小于60%,不小于70%,不小于80%或不小于90%。
通过产生方法1获得的nkt细胞配体-脉冲的细胞优选是cd1d阳性的。通过上述培养获得的细胞群中cd1d阳性细胞的比例例如不小于50%,优选地不小于60%,不小于70%,不小于80%或不小于90%。
通过产生方法1获得的nkt细胞配体-脉冲的细胞优选是cd40阳性的。通过上述培养获得的细胞群中cd40阳性细胞的比例例如不小于50%,优选地不小于60%,不小于70%,不小于80%或不小于90%。
在一个优选实施方案中,通过产生方法1获得的nkt细胞配体-脉冲的细胞是cd14阳性cd1d阳性cd40阳性的。通过上述培养获得的细胞群中cd14阳性cd1d阳性cd40阳性细胞的比例例如不小于50%,优选地不小于60%,不小于70%,不小于80%或不小于90%。通过在含有nkt细胞配体和gm-csf且基本上不含il-4的培养基中培养分离的cd14阳性细胞(例如,单核细胞),诱导cd40的表达(其对于nkt细胞的活化是重要的),同时维持cd1d的表达,并预计获得具有活化nkt细胞的高能力的细胞。
产生方法1可以包括洗涤步骤,以在含有nkt细胞配体和gm-csf且基本上不含il-4的培养基中培养分离的cd14阳性细胞(例如,单核细胞)和回收nkt细胞配体-脉冲的细胞后,去除释放到培养基中的过量nkt细胞配体。对于洗涤,可以使用适当的培养基、盐水、磷酸盐缓冲盐水、林格氏溶液等。
(产生方法2)
本发明提供了nkt细胞配体-脉冲的cd14阳性细胞系的产生方法,其包括在含有nkt细胞配体且基本上不含gm-csf和il-4的培养基中,培养通过建立(永生化)cd14阳性细胞诸如单核细胞等而获得的cd14阳性细胞系的步骤(本发明的产生方法2)。
cd14阳性细胞系可以是由cd14阳性细胞诸如单核细胞等建立的细胞系。可以通过例如在基本上不含gm-csf和il-4的培养基中培养来制备cd14阳性细胞系。可以根据上述产生方法1制备cd14阳性细胞系,除了用于培养的培养基可以不含nkt配体。
此外,也可以通过从由单核细胞等建立的细胞系中选择满足cd14阳性cd1d阳性表达模式的细胞系来获得实现该目的的cd14阳性细胞系。此类细胞系的实例包括thp-1和u937。
还可以使用从重编程细胞(多能干细胞)诸如ips细胞等,分化和建立的cd14阳性细胞系。作为用于从重编程细胞获得cd14阳性细胞系的方法,例如可以提及grigoriadis等人,blood,2010年4月8日;115(14):2769-76和stemcells,2016年12月;34(12):2852-2860。该方法不限于此,因为本领域普通技术人员可以自由地优化该方法。
待进行产生方法2的cd14阳性细胞系优选地是分离的。
待进行产生方法2的cd14阳性细胞系优选地是cd14阳性的。在培养开始时,待用于产生方法2中的分离的cd14阳性细胞系中cd1d阳性细胞的比例通常不小于70%,优选地不小于80%,不小于90%,不小于95%,不小于98%,不小于99%或不小于99.5%,最优选地100%。
可以根据上述产生方法1在含有nkt细胞配体的培养基中培养cd14阳性细胞系,除了用于培养的培养基基本上不含gm-csf。
待用于培养cd14阳性细胞系的培养基中gm-csf的浓度通常小于0.01ng/ml,优选地小于0.001ng/ml,更优选地小于0.0001ng/ml(例如,0ng/ml)。因此,在一个优选实施方案中,在培养cd14阳性细胞系中,不向培养物中添加外源gm-csf。
分离的cd14阳性细胞系在含有nkt细胞配体的培养基中的培养期(即,通过nkt细胞配体的脉冲时间)没有特别限制,只要可以通过产生方法2产生nkt细胞配体-脉冲的cd14阳性细胞系。其通常不小于2小时,优选地2-72小时。与产生方法1相比,产生方法2需要短时间,并且例如,约2小时的脉冲时间可以提供活化nkt细胞的能力。因此,产生方法2中的脉冲时间可以是,例如,不超过32小时,不超过24小时,不超过8小时,不超过7小时,不超过4小时。
在产生方法2中获得的nkt细胞配体-脉冲的cd14阳性细胞系活化nkt细胞并具有诱导nkt细胞的增殖的活性、ifn-γ的产生和/或针对肿瘤细胞的细胞毒活性。
在产生方法2中获得的nkt细胞配体-脉冲的cd14阳性细胞系优选地是cd14阳性的。通过上述培养获得的细胞群中cd14阳性细胞的比例例如不小于50%,优选地不小于60%,不小于70%,不小于80%或不小于90%。
通过产生方法2获得的nkt细胞配体-脉冲的cd14阳性细胞系优选地是cd1d阳性的。通过上述培养获得的细胞群中cd1d阳性细胞的比例例如不小于50%,优选地不小于60%,不小于70%,不小于80%或不小于90%。
通过产生方法2获得的nkt细胞配体-脉冲的cd14阳性细胞系优选地是cd40阳性的。通过上述培养获得的细胞群中cd40阳性细胞的比例例如不小于50%,优选地不小于60%,不小于70%,不小于80%或不小于90%。
在一个优选实施方案中,通过产生方法2获得的nkt细胞配体-脉冲的cd14阳性细胞系优选地是cd14阳性cd1d阳性cd40阳性的。通过上述培养获得的细胞群中cd14阳性cd1d阳性cd40阳性细胞的比例例如不小于50%,优选地不小于60%,不小于70%,不小于80%或不小于90%。通过在含有nkt细胞配体且基本上不含gm-csf和il-4的培养基中培养cd14阳性cd1d阳性细胞系,nkt细胞配体被快速地呈递在cd1d上,cd40增强表达且预计获得具有活化nkt的高能力的细胞。
产生方法2可以包括洗涤步骤,以在含有nkt细胞配体且基本上不含gm-csf和il-4的培养基中培养cd14阳性细胞系和回收nkt细胞配体-脉冲cd14阳性细胞系后,去除释放到培养基中的过量nkt细胞配体。对于洗涤,可以使用适当的培养基、盐水、磷酸盐缓冲盐水、林格氏溶液等。
<含有nkt细胞配体-脉冲的cd14阳性细胞或nkt细胞配体-脉冲的cd14阳性细胞系的细胞制备物>
本发明还提供了含有本发明的上述nkt细胞配体-脉冲的cd14阳性细胞或nkt细胞配体-脉冲的cd14阳性细胞系的细胞制备物。nkt细胞配体-脉冲的cd14阳性细胞和nkt细胞配体-脉冲的cd14阳性细胞系可以分别通过本发明的上述产生方法1和产生方法2获得。在本发明的细胞制备物中含有的nkt细胞配体-脉冲的cd14阳性细胞或nkt细胞配体-脉冲的cd14阳性细胞系可以处于这样的状态,其中每个细胞被悬浮,细胞被凝结以形成细胞聚集体,或混合非粘附细胞和聚集体。nkt细胞配体-脉冲的cd14阳性细胞或nkt细胞配体-脉冲的cd14阳性细胞系通常悬浮于药学上可接受的稀释载体(例如盐水、缓冲液等)中。nkt细胞配体-脉冲的cd14阳性细胞或nkt细胞配体-脉冲的cd14阳性细胞系可以通过如下配制为细胞制备物:在必要时添加蛋白诸如白蛋白等,以及添加剂诸如药理活性成分等,并且任选地将混合物置于容器诸如小瓶、袋、注射器等中。可以将每1小瓶或1剂量的nkt细胞配体-脉冲的细胞的数量调整为,例如,1×105-1×109个细胞。或者,可以浓缩nkt细胞配体-脉冲的cd14阳性细胞或nkt细胞配体-脉冲的cd14阳性细胞系,并将其用于获得细胞制备物。可以适当地选择稀释载体、蛋白和添加剂以与细胞制备物中含有的细胞群相容。还可以进一步添加保护剂诸如dmso等,并冷冻混合物以获得细胞制备物。
本发明的细胞制备物可以用作nkt细胞活化剂或疾病的预防或治疗剂(下面详细描述),对于所述疾病,预期直接或间接通过nkt细胞的增殖(nkt细胞计数的增加)、ifn-γ产生和/或细胞毒活性(各自由nkt细胞的活化诱导)的预防或治疗效果。
<疾病的预防或治疗方法,对于所述疾病,预期直接或间接通过nkt细胞的增殖(nkt细胞计数的增加)、ifn-γ产生和/或细胞毒活性(各自由nkt细胞的活化诱导)的预防或治疗效果,所述方法包括施用nkt细胞配体-脉冲的cd14阳性细胞或nkt细胞配体-脉冲的cd14阳性细胞系>
根据本发明,可以通过将本发明的上述nkt细胞配体-脉冲的cd14阳性细胞或nkt细胞配体-脉冲的cd14阳性细胞系或含有nkt细胞配体-脉冲的cd14阳性细胞或nkt细胞配体-脉冲的cd14阳性细胞系的细胞制备物施用于测试受试者来活化测试受试者中的nkt细胞。具体地,在本发明中,可以通过活化测试受试者中的nkt细胞来诱导nkt细胞的增殖(nkt细胞计数的增加)、ifn-γ产生、佐剂作用、长期免疫记忆和/或细胞毒活性。因此,预期通过将本发明的上述nkt细胞配体-脉冲的cd14阳性细胞或nkt细胞配体-脉冲的cd14阳性细胞系或含有nkt细胞配体-脉冲的cd14阳性细胞或nkt细胞配体-脉冲的cd14阳性细胞系的细胞制备物施用于测试受试者来预防或治疗疾病,对于所述疾病,预期直接或间接通过测试受试者中的nkt细胞的增殖(nkt细胞计数的增加)、ifn-γ产生、佐剂作用、长期免疫记忆和/或细胞毒活性(各自由nkt细胞的活化诱导)的预防或治疗效果。
在本说明书中,“测试受试者”是指待通过本发明的方法治疗的受试者。例如,可以提及哺乳动物,诸如人、小鼠、大鼠、兔、狗、猫、牛、马、猴、猪等。其优选为人类。
预期直接或间接通过nkt细胞的增殖(nkt细胞计数的增加)、ifn-γ产生、佐剂作用、长期免疫记忆和/或细胞毒活性(各自由nkt细胞的活化诱导)的预防或治疗效果的疾病的实例包括各种癌(例如,乳腺癌、结肠直肠癌、肺癌、前列腺癌、食道癌、胃癌、肝癌、胆道癌、脾癌、肾癌、膀胱癌、子宫癌、睾丸癌、甲状腺癌、胰腺癌、脑肿瘤、卵巢癌、皮肤癌、血液肿瘤(例如,成人t细胞白血病、慢性髓样白血病、恶性淋巴瘤等)等);各种感染性疾病,例如病毒性疾病(例如,由乙型肝炎病毒、丙型肝炎病毒、丁型肝炎病毒导致的病毒性肝炎、疱疹、获得性免疫缺陷综合征(aids)、流行性感冒等)、细菌感染性疾病(例如,药物抗性结核病、非典型分枝杆菌感染等)、真菌病(例如,念珠菌感染等)等。测试受试者合适地是患有癌症或具有癌症的既往病史的哺乳动物(例如,人),或患有感染性疾病或具有感染性疾病的既往病史的哺乳动物(例如,人)。本发明的细胞制备物也可适用于治疗或预防感染性疾病、癌症转移或复发。
nkt细胞可以活化各种免疫细胞(例如,细胞毒性t细胞、nk细胞等),其直接作用于体内的癌细胞和病原体感染的细胞。因此,本发明的细胞制备物可适用于治疗或预防感染性疾病,而与癌症或病原体的种类无关。
施用方法不受限制,只要其可以使本发明的细胞制备物到达存在于患病部位中或其周围的nkt细胞。例如,可以提及静脉内施用、动脉内施用、粘膜内施用、施用于淋巴结中、施用于患病部分组织中等。具体地,可以将细胞制备物通过注射针直接递送至患者的疾病部位。此外,也可以将细胞制备物通过导管施用于静脉或动脉中。
待一次施用的细胞群的数量没有特别限制,只要其是足以活化存在于患病部分中或其周围的nkt细胞并预防或治疗目标疾病的数量。例如,其为1×104-1×109个细胞/体重kg,优选地1×105-1×107个细胞/体重kg,更优选地1×105-1×106个细胞/体重kg。此外,所述细胞制备物中细胞的浓度通常为1×104-1×107个细胞/ml,优选地1×105-5×106个细胞/ml,更优选地3×105-3×106个细胞/ml。可以根据测试受试者的状况、疾病的严重程度等多次进行施用。
可以从自体cd14阳性细胞(例如,单核细胞)(遗传同系的)或异源的(遗传同种异体的)cd14阳性细胞(例如,单核细胞)或cd14阳性细胞系(包括从重编程细胞诸如ips细胞等分化诱导且建立的cd14阳性细胞系)来制备待用于测试受试者中的nkt细胞配体-脉冲的cd14阳性细胞或nkt细胞配体-脉冲的cd14阳性细胞系。优选的是,将从测试受试者自身的cd14阳性细胞(例如,单核细胞)制备的nkt细胞配体-脉冲的cd14阳性细胞施用于测试受试者。还优选施用于经预测与异源nkt细胞配体-脉冲的cd14阳性细胞或nkt细胞配体-脉冲的cd14阳性细胞系具有相容性的测试受试者。
本说明书中引用的任何出版物中公开的内容,包括专利和专利申请,在此以其整体通过引用并入,达到其已经在本文中公开的程度。
下文通过参考实施例更详细解释本发明。本发明不受以下实施例等的限制。
[实施例]
[实施例1]
1.材料和方法
1)起始材料:从脐带血和健康个体外周血分离和纯化cd14阳性细胞(单核细胞)
(1)使用抗cd14抗体从人外周血分离和纯化cd14阳性细胞(单核细胞)
使用ficoll-paqueplus(gehealthcarejapan,codeno.17144002)从志愿者健康个体的外周血(300ml)分离单核细胞层(回收细胞数:9.7x108),并使用抗cd14抗体结合的微珠(miltenyibiotech,订货号130-050-201)分离和纯化cd14阳性细胞(回收细胞数:10.7x108,回收率:10.5%,cd14阳性率:99.2%,存活率:98.0%)。一部分细胞进行树突细胞的分化培养。使用抗cd14抗体结合的微珠未分离的细胞级分作为cd14阴性细胞回收。
(2)使用细胞分离器从人外周血单采液分离和纯化cd14阳性细胞(单核细胞)
使用细胞分离器(由terumo制造:elutra)从志愿者健康个体的外周血单采液(99ml)分离单核细胞细胞部分(回收细胞数:1.1x109),并分离人cd14阳性细胞(人elu-cd14阳性细胞)(回收总细胞数:1.1x109,单核细胞回收率:49.1%,cd14阳性率:75.1%,存活率:98.3%)。在通过该方法的分离和纯化中,与使用cd14抗体的分离和纯化相比,回收率急剧改进。作为结果,可以获得许多cd14阳性细胞。
(3)从人脐带血分离和纯化cd14阳性细胞(单核细胞)
使用抗cd14抗体结合的微珠(miltenyibiotech,订货号130-050-201)从人脐带血分离和纯化cd14阳性细胞(单核细胞),已使用hes(羟乙基淀粉)从所述人脐带血去除大部分红细胞,并用含有葡聚糖(rikenbioresourcecenter,tsukuba)的冷冻剂冷冻(含有总白细胞),(回收细胞数:10.7x108,回收率:10.5%,cd14阳性率:99.2%,存活率:98.0%)。一部分细胞进行树突细胞的分化培养。使用抗cd14抗体结合的微珠未分离的细胞级分作为cd14阴性细胞回收。
2)使用cd14阳性细胞(单核细胞)产生抗原呈递细胞用于活化nkt细胞
(1)通过在添加gm-csf下培养2天来产生“rk-163-脉冲的人cd14阳性细胞”和“rk-163-脉冲的人elu-cd14阳性细胞”
将使用抗cd14抗体分离后立即得到的人单核细胞(cd14阳性细胞)和通过淘析方法从人外周血的单采液获得的单核细胞(cd14阳性细胞)(人elu-cd14阳性细胞)分别以3x106/ml的细胞密度重悬浮于添加有细胞因子[53.3ng/ml单独的重组人gm-csf(miltenyibiotec)]的aim-v培养基中,并以1ml/孔接种于24-孔培养板(falcon)中。同时,添加rk-163(将散装粉末溶解于添加有dmso和0.5%tween20的pbs中)至终浓度100ng/ml,并将细胞在37℃、5%co2下培养48小时,以得到“rk-163-脉冲的人cd14阳性细胞”和“rk-163-脉冲的人elu-cd14阳性细胞”。如下测量存活率、回收率和nkt活化作用(ifn-γ产生、细胞数增加、细胞毒活性)。
(2)cd14阳性细胞(单核细胞)分化培养成树突细胞(dc)和产生“rk-163-脉冲的人树突细胞”
为了比较新型技术与常规方法,将1)中获得的人cd14阳性细胞(单核细胞)以1x106/ml的细胞浓度悬浮于aim-v(gibco,codeno.0870112-dk)培养基中,并以5ml/孔接种于6-孔培养板(falcon)中。添加重组人gm-csf53.3ng/ml和il-434.7ng/ml(均为miltenyibiotech),并将混合物在37℃、5%co2下培养6天以诱导分化成树突细胞。其后,添加rk-163(将散装粉末溶解于添加有dmso和0.5%tween20的pbs中)至终浓度100ng/ml,并将细胞在37℃、5%co2下培养48小时,以得到“rk-163-脉冲的人树突细胞”。
3)分析方法
(1)活细胞数和存活率的计算方法
用0.4%台盼蓝(bio-rad)染色后,用tc20tm自动化细胞计数器(bio-rad)测量未染色的活细胞和蓝色染色的死细胞两次。计算其平均值并计算活细胞数和存活率。
(2)荧光活化的细胞分选(facs)分析
将藻红蛋白标记的针对以下抗原中每一种的抗人抗体[cd14(克隆hcd14,biolegend)、cd11c(克隆3.9,biolegend)、cd11b(克隆icrf44,bdbiosciences)、cd45(克隆hi30,biolegend)、hla-dr(克隆l243,biolegend)、cd1d(克隆51.1,biolegend)、cd40(克隆5c3,biolegend)、cd95(fas)(克隆dx2,biolegend)、cd80(克隆2d10,biolegend)、cd86(克隆it2.2,biolegend)和cd209(克隆dc-sign,miltenyibiotech)]添加至细胞中,并在阴影下在4℃下进行静态反应30分钟。离心和洗涤后,将细胞悬浮于0.5%人血清白蛋白添加的pbs中,并通过流式细胞仪(facscantoii,bdbiosciences)检查cd14阳性细胞的纯度和各种表面抗原的表达。
(3)nkt细胞活化作用(ifn-γ产生)的测量
为了制备通过将使用抗-cd14抗体分离后立即得到的人cd14阳性细胞(单核细胞)和人cd14阴性细胞或人elu-cd14阳性细胞(单核细胞)用gm-csf和nkt细胞配体rk-163培养2天而获得的细胞(分别称为“rk-163-脉冲的人cd14阳性细胞”、“rk-163-脉冲的人cd14阴性细胞”、“rk-163-脉冲的人elu-cd14阳性细胞”)以及在2)-(2)中通过添加gm-csf和il-4培养6天而诱导分化的树突细胞(称为“rk-163-脉冲的人树突细胞”),将rk-163(散装粉末溶解于添加有dmso和0.5%tween20的pbs中)添加至每种细胞中至100ng/ml的终浓度,并将细胞在37℃、5%co2下培养48小时以产生“rk-163-脉冲的细胞”。培养后,将回收的细胞离心洗涤两次,并通过tc20tm自动化细胞计数器计算台盼蓝染色后的活细胞数。将rk-163-脉冲的细胞和人nkt细胞系分别悬浮于添加10%胎牛血清(sigma,lotno.114k525)的rmpi-1640(invitrogen)中至1x106/ml,将每种细胞悬浮液以1x105/0.1ml/孔的细胞浓度接种于96孔圆底培养板中,并将细胞在37℃、5%co2下培养48小时。培养后,回收200μl上清液,并使用市售的elisa试剂盒(bdbiosciences)测量产生和分泌的ifn-γ。
该研究基于riken“关于人类靶向研究的伦理规定(ethicalprovisionsregardinghuman-targetedstudies)”并且在研究开始前获得了研究所伦理审查委员会的批准。该研究是按照序言和“关于人体医学研究的伦理指南(ethicsguidelinesonmedicalresearchforhuman)”(教育、文化、体育、科学和技术部,卫生、劳动和福利部)的规定进行。
2.结果和讨论
(1)人外周血“cd14阳性细胞(单核细胞)”、“rk-163-脉冲的人cd14阳性细胞”“rk-163-脉冲的人elu-cd14阳性细胞”和“rk-163-脉冲的人树突细胞”的表面抗原表达模式
在从人外周血分离后立即得到的cd14阳性细胞(单核细胞)中,cd1d和cd14抗原的表达极高,并且几乎没有观察到树突细胞的特征(cd14阴性、cd209阳性)。
另一方面,在gm-csf存在的情况下用nkt细胞配体rk-163培养2天的“rk-163-脉冲的人cd14阳性细胞”中,活化nkt细胞并诱导inf-γ产生的cd40的表达迅速增强,但未发现树突细胞的特征(cd14阴性、cd209阳性)。“rk-163-脉冲的人cd14阳性细胞”和“rk-163-脉冲的人elu-cd14阳性细胞”仍然表达cd14和cd1d。作为cd14阳性细胞,证实它们是与树突细胞不同的细胞。
通过在gm-csf+il-4存在的情况下培养cd14阳性细胞(单核细胞)6天获得的“rk-163-脉冲的人树突细胞”中,发现cd40的高表达。然而,几乎没有观察到cd14抗原的表达,并且cd1d的表达也显著降低(图1)。cd1d结合nkt配体(rk-163),并且是nkt细胞活化以及cd40的表达的必需分子。因此,“rk-163-脉冲的cd14阳性细胞”被认为对于nkt细胞活化是最佳的,因为其显示两者的高表达。另一方面,“rk-163-脉冲的人树突细胞”中cd1d表达的减少表明其可能是nkt细胞活化降低的原因,即使观察到nkt细胞活化必需的cd40分子的表达。
(2)从人外周血cd14阳性细胞(单核细胞)或cd14阴性细胞制备的“rk-163-脉冲的人cd14阳性细胞”、“rk-163-脉冲的人cd14阴性细胞”、“rk-163-脉冲的人树突细胞”的ifn-γ产生诱导效力(nkt细胞活化作用)的比较
当人nkt细胞系与“rk-163-脉冲的人cd14阳性细胞”共培养时,检查ifn-γ的产生,以发现其比与“rk-163-脉冲的人树突细胞”共培养时高约3倍。通过在由cd14抗体-结合的微珠分离后立即用配体脉冲“cd14阴性细胞”获得的“rk-163-脉冲人cd14阴性细胞”的nkt细胞活化(即从nkt细胞产生ifn-γ)能力较低(图2)。结果揭示,与“rk-163-脉冲的人树突细胞”和“rk-163-脉冲的人cd14阴性细胞”相比,“rk-163-脉冲的人cd14阳性细胞”显示极高的nkt细胞活化作用。
(3)将从人外周血分离的cd14阳性细胞(单核细胞)在含有gm-csf的培养基中在各种浓度的rk-163存在的情况下培养48小时,并评估获得的rk-163-脉冲的cd14阳性细胞的nkt细胞活化作用(ifn-γ产生诱导)。作为结果,以30ng/ml-300ng/ml的浓度的rk-163脉冲提供具有nkt细胞活化作用的rk-163-脉冲的cd14阳性细胞(图3)。
(4)制备“rk-163-脉冲的人cd14阳性细胞”中,rk-163脉冲时间对ifn-γ产生诱导效力(nkt细胞活化作用)的影响
将抗cd14抗体结合的微珠分离后立即得到的cd14阳性细胞分离,在含有100ng/ml的nkt配体rk-163或其他nkt细胞配体α-galcer和gm-csf(53.3ng/ml)的培养基中进行脉冲培养各种时间(0、16、48、64和72小时),并比较对nkt细胞诱导ifn-γ产生的活性的影响。作为结果,在脉冲后16小时起发现ifn-γ产生诱导活性,并且在48-72小时后发现高活性(图4,左侧)。当时的回收率和存活率在48小时最高(图4,右侧)。因此,对于抗cd14抗体结合的微珠分离后立即得到的cd14阳性细胞的nkt细胞活化能力(ifn-γ产生诱导)、回收率、存活率的全体,rk-163脉冲后48小时是良好条件(图4)。
(5)通过将从人外周血中分离的cd14阳性细胞(单核细胞)在重组人gm-csf(53.3ng/ml)和rk-163(100ng/ml)存在的情况下rk-163脉冲培养2天,来研究提供最有效的rk-163-脉冲的cd14阳性细胞的细胞浓度。具体地,将从人外周血分离的cd14阳性细胞以各种细胞密度(0.42-3.42x106/cm2)悬浮在aim-v培养基中,接种于24-孔板中,在37℃、5%co2下培养48小时,并评估活细胞数、存活率和回收率(图5)。
(6)研究α-galcer或rk-163-脉冲的人cd14阳性细胞和α-galcer或rk-163-脉冲的人树突细胞对nkt细胞的增殖能力的影响
通过用与上述相同的方式产生的“α-galcer或rk-163-脉冲的人cd14阳性细胞”或“α-galcer或rk-163-脉冲的人树突细胞”,在aim-v(50%)和rpmi-1640(45%)且含有fcs(5%)(sigma,lot14k525)、丙酮酸钠、neaa(非必需氨基酸)、2-me、il-2(100u/ml)(imunace)的混合培养基中培养8-10天来刺激人nkt细胞,并测量nkt细胞的增殖活性。将nkt细胞和rk-163-脉冲的cd14阳性细胞或rk-163-脉冲的树突细胞的混合比率设定为1:1.5-5。
作为结果,显示rk-163或α-galcer-脉冲的cd14阳性细胞比rk-163或α-galce-脉冲的树突细胞远远更强烈地诱导nkt细胞的增殖。此外,在α-galcer-脉冲的cd14阳性细胞和rk-163-脉冲的cd14阳性细胞之间未发现nkt细胞增殖诱导活性的特别差异(图6)。
(7)研究rk-163-脉冲的人cd14阳性细胞和rk-163-脉冲的人树突细胞对nkt细胞的细胞毒性的影响
通过用与上述相同的方式产生的“rk-163-脉冲的人cd14阳性细胞”或“rk-163-脉冲的人树突细胞”在aim-v(50%)和rpmi-1640(45%)且含有fcs(5%)(适合于ips细胞增殖的批次)、丙酮酸钠、neaa、2-me、il-2(100u/ml)(imunace)的混合培养基中培养8-10天来刺激人nkt细胞。将nkt细胞和rk-163-脉冲的cd14阳性细胞或rk-163-脉冲的树突细胞的混合比率设定为1:1.5-5。将获得的人nkt细胞与ncih460细胞(人肺癌细胞系)在96孔圆底板上在含有fbs(10%)的完全rpmi-1640培养基中一起培养4小时,并检查针对ncih460细胞的细胞毒活性。将靶细胞(ncih460细胞)的数量设定为1×104个细胞/孔,并将效应物:靶标比率设定为3:1和10:1。
作为结果,显示通过将人nkt细胞与“rk-163-脉冲的人cd14阳性细胞”共培养获得的人nkt细胞具有比通过与“rk-163-脉冲的人树突细胞”共培养获得的人nkt细胞更强的细胞毒活性(图7)。此外,与α-galcer相比,发现rk-163诱导对人nkt细胞更强的细胞毒活性。
(8)研究通过用各种nkt细胞配体(rcai-85、rcai-137、rk-163)脉冲培养获得的“nkt细胞配体-脉冲的cd14阳性细胞”的nkt细胞活化能力(ifn-γ产生诱导)
使用rcai-85(100ng/ml)、rcai-137(100ng/ml)代替rk-163,将从人外周血分离的cd14阳性细胞(单核细胞)脉冲48小时,以得到每种配体-脉冲的cd14阳性细胞。将1x105个rk-163-脉冲的cd14阳性细胞或其他配体-脉冲的cd14阳性细胞接种于96孔圆底板中,并与1x105个人nkt细胞在含有10%fbs的完全rpmi-1640培养基中共培养48小时,并测量培养基中ifn-γ的浓度。作为结果,显示rk-163-脉冲的cd14阳性细胞和其他配体-脉冲的cd14阳性细胞强烈地诱导nkt细胞产生ifn-γ,如同rk-163-脉冲的cd14阳性细胞(图8)。
(9)研究“rk-163-脉冲的人cd14阳性细胞”的体内抗肿瘤作用
经证实,“rk-163-脉冲的人cd14阳性细胞”实际上在携带肿瘤的动物中显示抗肿瘤作用。
将b16小鼠黑色素瘤细胞移植至c57bl/6雌性小鼠的脾脏中,并且在4天后静脉内施用根据实施例1的方法制备的“rk-163-脉冲的人cd14阳性细胞”。将小鼠在10天后安乐死,分离肝脏,制备其匀浆并溶解于1nnaoh中,并回收上清液。通过分光光度计测量上清液中黑色素染料的吸光度,绘制分析曲线并定量从脾脏转移至肝脏中的肿瘤细胞的数量。
作为结果,“rk-163-脉冲的人cd14阳性细胞”显示强烈的抗肿瘤作用和显著抑制的黑色素瘤肿瘤细胞的转移(图9)。
[实施例2]
1.材料和方法
1)起始材料1:人来源的cd14阳性细胞系(这里典型地,使用thp-1细胞、u9375细胞、从人ips细胞诱导的cd14阳性细胞系(下文称为人ips-cd14阳性细胞系))。
thp-1细胞和u937细胞获得自ecacc,jcrb。使用的ips-cd14阳性细胞系是由熊本大学的senju先生建立的细胞(senju等人.stemcells,27:1021-1031,2009)。
2)使用人来源的cd14阳性细胞系产生抗原呈递细胞用于nkt细胞活化
将人cd14阳性细胞系thp-1细胞和u937细胞悬浮于rpmi1640/10%fbs培养基中至1-3x106个细胞/ml,并以1ml/孔的细胞密度接种于24-孔培养板(falcon)中。同时,添加rk-163(将散装粉末溶解于添加有dmso和0.5%tween20的pbs中)至终浓度100ng/ml,并将细胞在37℃、5%co2下在gm-csf不存在的情况下培养8-48小时,以得到“rk-163-脉冲的人cd14阳性细胞系”。
以与thp-1和u937相同的方式,将ips-cd14阳性细胞在rk-163存在的情况下培养8-48小时,以得到“rk-163-脉冲的人ips-cd14阳性细胞系”。
3)分析方法
(1)活细胞数和存活率的计算方法
用0.4%台盼蓝(bio-rad)染色后,用tc20tm自动化细胞计数器(bio-rad)测量未染色的活细胞和蓝色染色的死细胞两次。计算其平均值并计算活细胞数和存活率。
(2)荧光活化的细胞分选(facs)分析方法
将藻红蛋白标记的针对以下抗原中每一种的抗人抗体[cd14(克隆hcd14,biolegend)、cd11c(克隆3.9,biolegend)、cd11b(克隆icrf44,bdbiosciences)、cd45(克隆hi30,biolegend)、hla-dr(克隆l243,biolegend)、cd1d(克隆51.1,biolegend)、cd40(克隆5c3,biolegend)、cd95(fas)(克隆dx2,biolegend)、20、cd80(克隆2d10,biolegend)、cd86(克隆it2.2,biolegend)和cd209(克隆dc-sign,miltenyibiotech)]添加至细胞中,并在阴影下在4℃下进行静态反应30分钟。离心和洗涤后,将细胞悬浮于添加0.5%人血清白蛋白的pbs中,并通过流式细胞仪(facscantoii,bdbiosciences)检查cd14阳性细胞的纯度和各种表面抗原的表达。
(3)nkt细胞活化作用(ifn-γ产生)的测量
将人来源的cd14阳性细胞系(这里使用thp-1、u937和人来源的ips-cd14阳性细胞)中的任一种和nkt细胞配体rk-163在gm-csf存在或不存在的情况下培养8-48小时,以制备“rk-163-脉冲的人cd14阳性细胞系”。培养后,将回收的细胞通过离心洗涤两次,并通过tc20tm自动化细胞计数器计算台盼蓝染色后的活细胞数。将rk-163-脉冲的细胞和人nkt细胞系分别悬浮于添加10%胎牛血清(sigma,lotno.114k525)的rmpi-1640(invitrogen)中至1x106/ml,将每种细胞悬浮液以1x105/0.1ml/孔的细胞浓度接种于96孔圆底培养板中,并将细胞在37℃、5%co2下培养48小时。培养后,回收200μl上清液,并使用市售的elisa试剂盒(bdbiosciences)测量产生和分泌的ifn-γ。
2.结果和讨论
(1)人来源的cd14阳性细胞系(使用thp-1、u937和人来源的ips-cd14阳性细胞)的表面抗原表达模式
thp-1、u937和人来源的ips-cd14阳性细胞的表面抗原表达模式分别显示于图10-1、10-2和10-3中。在nkt细胞配体-脉冲的thp-1细胞和ips-cd14阳性细胞中,通过facs分析发现nkt配体的抗原呈递所必需的cd1d分子的表达和nkt细胞活化所必需的cd40分子的表达。在u937细胞中,通过facs分析也发现cd1d的表达,并且在rk-163脉冲后cd40mrna的表达增加。因此,显示不仅实施例1中描述的人外周血来源的cd14阳性细胞、而且cd14阳性细胞系也可以有效地活化nkt细胞。
(2)“rk-163-脉冲的人cd14阳性细胞系”(使用thp-1、u937和人来源的ips-cd14阳性细胞)的ifn-γ产生诱导效力(nkt细胞活化作用)的比较
将人nkt细胞系与每种“rk-163-脉冲的人cd14阳性细胞系”共培养,并检查每种人nkt细胞系的ifn-γ产生。与从人外周血cd14阳性细胞制备的“rk-163-脉冲的人cd14阳性细胞”类似,显示“rk-163-脉冲的人cd14阳性细胞系”也具有高nkt细胞活化作用(图11)。
(3)制备“rk-163-脉冲的人来源的cd14阳性细胞系”中,rk-163脉冲时间对ifn-γ产生诱导效力(nkt细胞活化作用)的影响
将人来源的cd14阳性细胞系(u937细胞)在nkt配体rk-163(100ng/ml)和gm-csf存在或不存在的情况下脉冲培养各种时间(2-48小时),并比较对nkt细胞诱导ifn-γ产生的活性的影响。作为结果,在脉冲后2小时起发现ifn-γ产生诱导活性(图12,左侧)。
此外,在gm-csf不存在的情况下,将thp-1用rk-163(100ng/ml)脉冲培养8-24小时,将3x105个“rk-163-脉冲thp-1细胞系”的细胞静脉内注射至c57bl/6小鼠,在24小时后收集血液样品,并定量血液ifn-γ浓度,以发现脉冲后7小时起血液ifn-γ浓度增加(图12,右侧)。
从上述结果清楚的是,表达cd14和cd1d的细胞系,如thp-1、u937,甚至在gm-csf不存在的情况下也可以用非常短的脉冲处理诱导nkt细胞的ifn-γ产生。
(4)rk-163-脉冲的人来源的cd14阳性细胞系(这里使用thp-1和人来源的ips-cd14阳性细胞系)对nkt细胞的细胞毒活性的影响
以与实施例1(7)中相同的方式,研究对人nkt细胞的细胞毒活性的影响。也就是说,通过与“rk-163-脉冲的人来源的cd14阳性细胞系”以“1:1.5-5”的混合比率培养16-24小时来刺激人nkt细胞。将获得的人nkt细胞系与ncih460细胞(人肺癌细胞系)或yac-1细胞(小鼠淋巴瘤来源的细胞)一起在96孔圆底板上在含有fbs(10%)的完全rpmi-1640培养基中培养4小时,并检查针对ncih460细胞或yac-1细胞的细胞毒活性。将靶细胞(ncih460细胞或yac-1)的数量设定为1×104个细胞/孔,并将效应物:靶标比率设定为3:1和10:1。
作为结果,甚至当使用“rk-163-脉冲的人来源的cd14阳性细胞系”时也诱导nkt细胞的细胞毒活性(图13)。
(5)研究“rk-163或α-galcer-脉冲的小鼠树突细胞”和“rk-163-脉冲的人cd14阳性细胞系”的体内抗肿瘤作用
经证实,“rk-163或α-galcer-脉冲的小鼠树突细胞”和“rk-163-脉冲的人cd14阳性细胞系”实际上在携带肿瘤的动物中显示抗肿瘤作用。
将b16小鼠黑色素瘤细胞移植至c57bl/6雌性小鼠的脾脏中,并且在4天后静脉内施用根据实施例1的方法制备的rk-163或α-galcer-脉冲的小鼠树突细胞(来源于c57bl/6)。将小鼠在10天后安乐死,分离肝脏,制备其匀浆并溶解于1nnaoh中,并回收上清液。通过分光光度计测量上清液中黑色素染料的吸光度,绘制分析曲线并定量从脾脏转移至肝脏中的肿瘤细胞的数量。
作为结果,与“α-galcer-脉冲的小鼠树突细胞”相比,“rk-163-脉冲的小鼠树突细胞”显示强烈的抗肿瘤效果和显著抑制的黑色素瘤肿瘤细胞的转移(图14a)。
类似地,在“rk-163-脉冲的人cd14阳性细胞系”(thp-1细胞、u937细胞)中也显示出强烈的抗肿瘤作用(图14b)。
(6)rk-163-脉冲的小鼠树突细胞和rk-163-脉冲的人cd14阳性细胞系(这里使用thp-1、u937)的佐剂作用
nkt细胞的抗肿瘤作用不仅通过对肿瘤的直接作用诱导,而且通过活化其他免疫活性细胞的佐剂作用诱导。评估rk-163-脉冲的小鼠树突细胞和rk-163-脉冲的人cd14阳性细胞系是否活化体内的nkt细胞并通过其佐剂作用活化先天免疫系统nk细胞。
将rk-163-脉冲的小鼠树突细胞(来源于c57bl/6)静脉内施用于c57bl/6小鼠。将小鼠14天后安乐死,对脾细胞进行facs分析,并检查nk细胞级分(nk1.1阳性、tcrβ阴性)中活化标志物(cd69)的表达。作为结果,经证实,几乎所有(100%)nk细胞都被活化(活化标志物cd69分子的表达增加),并且nkt细胞在体内诱导强烈的佐剂效应(图15a)。
此外,ova(卵清蛋白)抗原被认为是人工肿瘤抗原,将ova-脉冲的脾细胞和rk-163-脉冲的人cd14阳性细胞系(thp-1或u937)静脉内施用于c57bl/6小鼠,体内ova反应性t细胞和nkt细胞同时被活化。4天后再次施用rk-163-脉冲的人cd14阳性细胞系,并在施用后1周进行facs分析。
作为结果,清楚的是nk细胞级分中cd69的表达也通过施用rk-163脉冲的人cd14/cd1d阳性细胞系而增强,并且nk细胞被nkt细胞的佐剂作用活化(图15b)。
(7)rk-163-脉冲的小鼠树突细胞和rk-163-脉冲的人cd14阳性细胞系的细胞动力学
使用b6.cd45.1(ly.5.1)同类小鼠作为受体,静脉内施用rk-163-脉冲的小鼠树突细胞,并检查体内rk-163-脉冲的树突细胞的动力学。作为结果,细胞主要分布在肺中,且然后在施用后1小时分布于肝脏中,但在24小时内减少,并且仅在肺中观察到。72小时后,在任何器官中均未观察到分布,并且清楚的是,细胞从体内迅速消失(图16a)。
此外,将rk-163-脉冲的人cd14阳性细胞系(这里是u937细胞)静脉内施用于c57bl/6小鼠,并观察药代动力学。作为结果,清楚的是,细胞系迅速从体内清除,并在24小时后在肿瘤器官中几乎观察不到,并从体内迅速清除(图16b)。
这些结果表明,rk-163-脉冲的人cd14阳性细胞系可以是高度安全的癌症免疫细胞治疗药物。
(8)rk-163-脉冲的人cd14阳性细胞系的毒性
为了评估rk-163-脉冲的人cd14阳性细胞系的急性毒性,将rk-163-脉冲的人cd14阳性细胞系(这里是u937细胞)静脉内注射一次至c57bl/6小鼠,并观察到直至第14天的急性毒性。作为结果,ast和alt在施用后第5天升高,但在第14天恢复至施用前的状态(图17a)。此外,在施用后第5天观察到肝脏和脾脏的重量增加,但在第14天恢复至施用前的状态(图17b)。
这也表明本发明的方法可以是高度安全的癌症治疗方法。
(9)rk-163-脉冲的人cd14阳性细胞系的致瘤性
rk-163-脉冲的人cd14阳性细胞系(这里是thp-1或u937)是永生化的并且可以在一般培养条件下无限生长。也就是说,当在动物体内发生增殖时,可以形成肿瘤。因此,使用通过用辐射照射rk-163-脉冲的人cd14阳性细胞系以丧失增殖能力而获得的样品进行通过软琼脂集落形成方法的致瘤性测试。
使用软琼脂集落形成测定试剂盒(cytoselect96wellcelltransformationassaykit,cellbiolabs),根据试剂盒的实验程序手册进行实验。在rk-163-脉冲的人cd14阳性细胞系(u937或thp-1)上照射x-射线,将细胞系接种在软琼脂上,培养8天,并测量增殖能力。作为结果,未发现增殖能力,并且显示细胞系也可用于人体内的癌症免疫疗法而不形成肿瘤(图18)。
(10)通过rk-163-脉冲的小鼠树突细胞和rk-163-脉冲的人cd14阳性细胞系诱导长期免疫记忆
nkt细胞的抗肿瘤作用不仅通过nkt细胞的直接作用发挥作用,而且通过活化其他免疫活性细胞的佐剂作用发挥作用。一部分活化的免疫活性细胞长时间保留在体内以形成免疫记忆。经证实,通过rk-163-脉冲的小鼠树突细胞活化的nkt细胞的佐剂作用活化抗原特异性ctl并形成长期记忆。
方法:
卵清蛋白(ova)被认为是人工肿瘤抗原,将ova-脉冲的脾细胞和rk-163-脉冲的小鼠树突细胞(均源自c57bl/6)被静脉内施用于c57bl/6小鼠,并同时活化体内ova反应性t细胞和nkt细胞。4天后再次施用rk-163-脉冲的小鼠树突细胞。从施用后一周起,将小鼠随时间安乐死,收集脾细胞,并针对ova反应性ctl的存在进行facs分析。
结果:
同时施用rk-163-脉冲的小鼠树突细胞可以有效地诱导与ova反应并产生ifn-γ的效应ctl。分析ova反应性ctl的细胞表面分子(cd44和cd62l)。同时施用rk-163-脉冲的小鼠树突细胞增加cd44+cd62l+效应记忆ctl的数量和cd44+cd62l-中枢记忆ctl的数量最长达4周,并且清楚的是,有效地诱导和维持形成免疫记忆最长达6个月的记忆t细胞(图19a)。其后,证实长期记忆可以维持最长达9个月。
类似地,显示在“rk-163-脉冲的人来源的cd14阳性细胞系”(thp-1细胞、u937细胞)中诱导和维持形成免疫记忆的cd8记忆t细胞(图19b)。
虽然本发明已经着重于优选的实施方案进行描述,但对于本领域技术人员显而易见的是,可以改变优选的实施方案。本发明旨在可以通过除了在本说明书中详细描述的方法以外的方法来实施本发明。因此,本发明涵盖“权利要求”的要旨和范围中涵盖的所有修改。
本文引用的任何出版物中公开的内容,包括专利和专利申请,在此以其整体通过引用并入,达到其已经在本文中公开的程度。
[产业实用性]
根据本发明,预期nkt细胞配体-脉冲的cd14阳性细胞和nkt细胞配体-脉冲的cd14阳性细胞系在相对短的时段内产生。通过本发明的方法获得的nkt细胞配体-脉冲的cd14阳性细胞和nkt细胞配体-脉冲的cd14阳性细胞系强烈地诱导nkt细胞的增殖、nkt细胞的ifn-γ产生和细胞毒活性。因此,它们可用作用于治疗或预防疾病诸如癌症、感染性疾病等的细胞制备物。
本申请基于在日本提交的专利申请号2016-091674(申请日:2016年4月28日),其内容完全并入本文。
- 还没有人留言评论。精彩留言会获得点赞!