一种具有抗菌活性化合物及其纯化制备方法和应用与流程
本发明涉及药物化学领域,具体涉及一种抗菌化合物及其纯化制备方法,以及其在制备抗菌药物及生物农药中的应用。
背景技术:
由于抗生素的滥用,耐药菌以及由耐药菌,特别是革兰氏阴性耐药菌引起的感染在全世界范围内已经到了前所未有的程度,原有抗生素的治疗效果已经大幅降低,新的疾病不断出现,快速发现高效、优质新抗生素成为全世界的重要课题。抗生素是以放线菌为代表的药用微生物的次级代谢产物,发现包括新物种在内的新药用微生物资源是发现新抗生素的基础之一。经过几十年的深入挖掘,从普通生境中发现新药用微生物菌种和新抗生素的机率均大大降低,而极端环境(如:海洋、荒漠、盐湖、冰川等)中的药用微生物尚未大规模勘探和开发。
技术实现要素:
为解决上述技术问题,本发明提供了一种抗菌化合物及其纯化制备方法,该化合物是从一种链霉菌中纯化制备得到,可用于制备抗菌药物及生物农药。研究表明该化合物具有广谱抗菌活性,可明显抑制真菌及细菌的生长,有新型抗菌药物开发的价值。
具体技术方案如下:
一种具有抗菌活性化合物,化合物化学式为C22H15NO5,R构型,结构式如下:
所述具有抗菌活性化合物可应用于制备抗菌药物及生物农药。
具有抗菌活性化合物的纯化制备方法,包括以下步骤:
(1)将从海洋样品中分离得到的灰色链霉菌划线接种于固体培养基上,28℃培养3~4日,直至长出白色的孢子,接种到液体培养基,28℃,150~220rpm/min,摇床培养8~12日收获发酵物;
(2)过滤发酵物获得发酵液和菌丝体,发酵液经大孔吸附树脂柱提取,菌丝体经丙酮破碎提取,减压浓缩提取物,合并后利用有机溶剂萃取,减压浓缩得总浸膏;
(3)总浸膏经硅胶柱层析,通过甲醇/二氯甲烷混合洗脱溶液进行梯度洗脱,收集洗脱组分,将收集的洗脱组分进行ODS反相柱层析,收集80%有机醇洗脱部分,浓缩,进行HPLC高效液相色谱制备得到外消旋体混合物,并进一步通过手性HPLC制备得到抗菌化合物。
步骤(1)所述培养基为半海水ISP2培养基、纯海水ISP2培养基的一种,优选为半海水ISP2培养基。
步骤(2)所述大孔吸附树脂柱,为弱极性或非极性的大孔吸附树脂,优选弱极性。
步骤(2)所述萃取选用的溶剂可以为乙酸乙酯、正丁醇中的一种,优选为乙酸乙酯。
步骤(3)所述甲醇/二氯甲烷混合洗脱溶液甲醇与二氯甲烷的体积比为5:95。
步骤(3)所述的有机醇为甲醇、乙醇中的一种,优选为乙醇。
步骤(3)所述高效液相色谱溶剂,可用甲醇、乙醇、乙腈等溶剂中的一种或几种,优选甲醇,其与水的配比优选55%。
本方法的优点是:本发明从海洋来源的链霉菌发酵液中得到了一种吲哚酮类化合物,经紫外、高分辨质谱、核磁共振及单晶衍射等波普学数据确定该化合物为全新结构的吲哚酮类化合物。对该化合物进行抗菌实验发现,其对金黄色葡萄球菌、白色念珠菌及黄瓜炭疽病菌等具有较好的抑制活性。因此,该化合物有望成为抗菌药物的先导化合物并具有良好的开发前景。
附图说明
图1为本发明抗菌化合物正离子质谱图(HR-ESI-MS)。
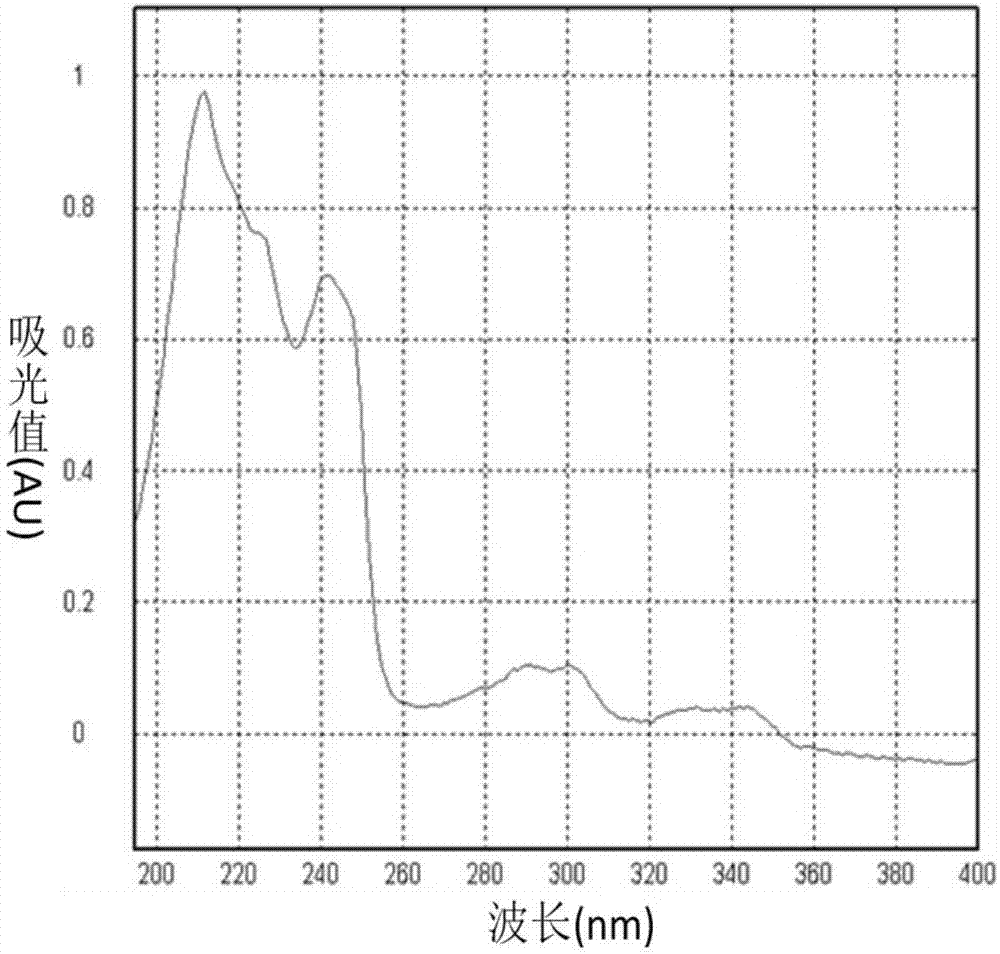
图2为本发明抗菌化合物UV谱。
具体实施方式
下面结合具体实施例和附图对本发明进行详细说明,但本发明的保护范围不受实施例和附图所限。
实施例1
抗菌化合物的制备
将海洋灰色链霉菌划线接种于ISP2半海水固体培养基上,28℃培养3日后,取少量菌体接种到ISP2半海水液体培养基中,28℃,180rpm摇床培养10日收获发酵物。过滤发酵物获得发酵液和菌丝体,发酵液经XAD-16大孔吸附树脂柱提取,菌丝体经丙酮破碎提取,减压浓缩提取物,合并后利用乙酸乙酯萃取,减压浓缩得总浸膏。总浸膏经硅胶柱层析,进行梯度洗脱,收集甲醇:二氯甲烷为5:95(体积比)的洗脱组分,将收集的洗脱组分进行ODS反相柱层析,收集80%有机醇洗脱部分,浓缩,进行HPLC制备得到外消旋体混合物,并进一步通过手性HPLC制备得到本发明抗菌化合物。
对实施例1制备的化合物进行结构确证
(1)使用的仪器与材料为:Jasco P-1020数字式旋光仪,Agilent TOF/6500高分辨率质谱,岛津UV-2401型可见-紫外分光光度计,核磁为Bruke Avance III 500NMR spectrometer。
(2)对化合物结构进行鉴定:
本发明抗菌化合物无色固体,易溶于二甲亚砜、甲醇,丙酮、氯仿、微溶于水,[α]D25–53.3(Acetone,c 0.04);UV(Acetonitrile)λmax(logε)210(3.9),242(3.7),302(2.8),342(2.4)nm;HRESIMS[M+H]+,m/z334.1075(Δ-0.4mmu)。图1为本发明抗菌化合物正离子质谱图(HR-ESI-MS)。图2为本发明抗菌化合物UV谱。本发明抗菌化合物一维和二维核磁数据如表1所示。
表1本发明抗菌化合物核磁数据(1H NMR 500MHz,13C NMR 125MHz)。
据此确定了化合物的平面结构,进一步通过单晶衍射实验确定了本发明抗菌化合物的构型R构型。
将实施例1制备的化合物进行抗菌活性初步测评
(1)菌株的发酵:将生长良好的斜面培养物分别接种于含100mLYIM38#培养基的500mL三角瓶中,180rpm旋转摇床,28℃培养7d。
(2)发酵液的处理及样品制备:发酵液在4500rpm离心20min,将菌丝体与发酵液分开;对菌体进行处理,加适量的丙酮浸泡菌体过夜后,过滤,将丙酮通过旋转蒸发仪蒸干,菌丝弃掉;发酵液的处理,以50%发酵液体积的乙酸乙酯萃取,合并后蒸干。
(3)抗菌活性测定:
吸取甲醇溶解的乙酸乙酯萃取物和菌丝体丙酮浸提物60μL,分2次加到直径为5mm的圆形无菌滤纸片上,待甲醇挥干后,贴于含有指示菌的检定平板上,同时以甲醇为阴性对照,以双抗(1000unit/mL青霉素和1000mg/mL链霉素)作为阳性对照,细菌于37℃培养12h、真菌37℃培养48h,观察并记录抑菌圈的大小。
本发明抗菌化合物对白色念珠菌、马尔尼菲青霉菌及芦笋茎枯病菌有较好抑制活性。如表2所示。
表2本发明抗菌化合物的抑菌活性
如表2可见,本发明抗菌化合物对白色念珠菌、马尔尼菲青霉菌和芦笋茎枯病菌有较好抑制活性。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!