抗菌肽MSI-99在烟草叶绿体中的表达及鉴定表达后的抗性方法与流程
本发明涉及抗菌肽MSI-99在烟草叶绿体中的表达及鉴定表达后的抗性方法。
背景技术:
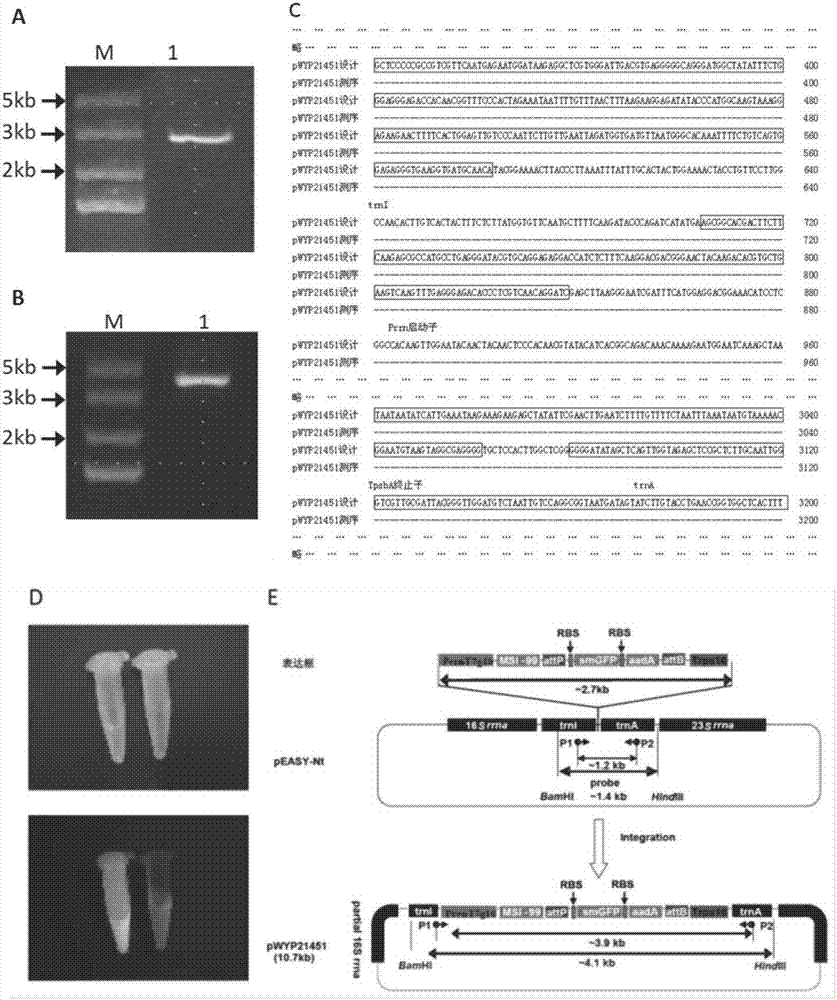
:稻瘟病是水稻三大真菌性病害之一,国际水稻研究所统计数据表明,稻瘟病每年约造成6000万美元的经济损失。稻瘟病病原菌生理小种数量多,受气候、品种、栽培耕作习惯等多种因素的影响,年份间不同小种的消长变化无常,采用常规的育种手段难以获得对多个小种均具抗性的水稻品种,结果是一个对当时优势小种具有较强抗性的水稻品种,投放生产后短短几年便可能丧失抗性。通过转几丁质酶基因、壳聚糖基因、抗菌肽和植物防卫素基因和水稻自身抗性基因等手段,提高水稻的抗稻瘟病水平已相继报道,但仅限于实验室水平,目前大田生产中,稻瘟病防控仍以药物为主。抗菌肽通常由12-50个氨基酸组成,数量众多,广泛存在于动物、植物和微生物中,具有抗细菌、真菌和病毒等广谱抗性。抗菌肽MSI-99是蛙皮素II的衍生物,由23个氨基酸组成,通过His7修饰为Lys,使其避免植物内切酶的影响。氨基酸的改变在保持其功能的同时,使其不易被植物体内的蛋白酶识别而降解,因此这种抗菌肽适用于多种受体材料的遗传转化,在提高农作物的抗病性方面具有很好的应用潜力。基于此,它与另一种抗菌肽Myp30是蛙皮素及其衍生物家族中仅有的两个成功用于农作物转基因的事例。目前,MSI-99基因已经先后被转入烟草、香蕉、西红柿、土豆、油菜、菠萝、葡萄等多种作物中,证实其能够提高作物对多种细菌或真菌性病原体的抗性。尽管Alan等的研究表明转MSI-99基因的番茄对细菌性病原体的抗性明显高于真菌性病害,但DeGray等的研究则证实当MSI-99在植物叶绿体中高效表达时,转基因植株提取物能够抑制3种真菌病原体Aspergillusflavus、Fusariummoniliforme和Verticilliumdahliae95%以上的孢子萌发。因此,我们选择叶绿体表达MSI-99,研究其对水稻真菌病害的抑制作用。技术实现要素:针对上述现有技术存在的问题,本发明提供一种抗菌肽MSI-99在烟草叶绿体中的表达,在烟草叶绿体中表达抗菌肽MSI-99基因,提取转基因烟草叶片中的粗蛋白,分析其对9种不同来源的稻瘟病分离物的菌丝体生长是否具有抑制作用,表明烟草叶绿体来源的MSI-99对多个稻瘟病生理小种具有明显的抑制作用,为培育叶绿体转基因水稻抗稻瘟病新品种以及新型生物农药的研制奠定基础。为了实现上述目的,本发明采用的技术方案是:一种抗菌肽MSI-99在烟草叶绿体中的表达,包括以下步骤:步骤(1)、载体构建;步骤(2)、烟草叶绿体转化和同质化筛选;步骤(3)、分子检测。优选的是,步骤(1)中载体构建包括:MSI99基因、aadA基因和GFP基因的密码子优化;载体pWYP21451的构建,线性化载体的准备;插入片段的准备;重组载体的无缝连接。上述任一方案优选的是,MSI99基因、aadA基因和GFP基因的密码子优化的具体方法为:WORKS3.0及SyntheticGeneDesigner将MSI99基因、aadA基因、GFP基因在不改变其编码的氨基酸序列的情况下,进行密码子优化工作,并将经过优化后的核苷酸序列进行分析,依次记录其GC含量及分布性、CAI值、最适密码子使用频率、重复序列结构域。上述任一方案优选的是,MSI99基因、aadA基因和GFP基因的密码子优化之后,将优化的3个基因序列依次置于烟草Prrn启动子和Trps16终止子之间,并在每个基因前添加核糖体结合位点,MSI99基因与Prrn启动子紧密相连,且在GFP基因和aadA基因两端添加位点特异性重组位点attP和attB序列。上述任一方案优选的是,所述线性化载体的准备方法:取质粒pEASY-Nt,用NsiI酶切,酶切体系37℃反应2h,回收酶切产物,获得载体片段。上述任一方案优选的是,所述插入片段的准备方法:将获得的表达框片段无缝连接到线性化的载体片段上,提取质粒pEASY-synth,进行PCR扩展目的片段,所获得的PCR产物经PCR回收试剂盒回收,即为插入片段。上述任一方案优选的是,所述重组载体的无缝连接方法:将获得的载体片段和插入片段建立连接体系,将重组的混合液体转化大肠杆菌感受态细胞Mach1,涂于含卡那霉素和氨苄青霉素的平板上,过夜培养,挑取单菌落至含抗生素的LB培养液中,振荡过夜培养;将获得的菌液提取重组质粒,稀释后作为模板,进行PCR鉴定,即获得烟草叶绿体表达载体pWYP21451。上述任一方案优选的是,步骤(3)中分子检测包括目的基因、选择性标记基因的PCR检测;叶绿体转基因同质化的PCR检测;Southernblot分析;GFP荧光检测;蛋白表达分析。上述任一方案优选的是,所述目的基因、选择性标记基因的PCR检测包括MSI99基因的PCR检测、GFP基因的PCR检测和aadA基因的PCR检测。上述任一方案优选的是,步骤(3)之后还包括转基因烟草中MSI99的活性分析。上述任一方案优选的是,所述MSI99的活性分析包括MSI99的热稳定性分析;抗菌肽MSI99对烟草病害的防治分析;抗菌肽MSI99对稻瘟病的离体和活体抗性活性分析。本发明还提供一种鉴定上述方法表达后对稻瘟病的抗性方法:首先用MTT法确定最小抑制浓度;对于活体抗性,接种水稻幼苗的菌液浓度为5×105个孢子/mL,接种后幼苗在温度为28℃,相对湿度为95%的黑暗条件下放置24h;喷施浓度为8.0ug/mL的MSI-99蛋白粗提液一次,48h后再次喷施;每10株幼苗喷施3mL;7天后调查植株发病情况。上述任一方案优选的是,所述蛋白粗提液获取方法为按照1:4的质量比,将表达MSI-99的叶绿体转基因烟草新鲜叶片与PBS缓冲液混合后,置于研钵或榨汁机中进行提取获得,并在使用前用清水进行至少100倍稀释。蛋白粗提液为转基因烟草叶片中提取。本发明的有益效果是:本发明提供一种抗菌肽MSI-99在烟草叶绿体中的表达及鉴定表达后的抗性方法,在烟草叶绿体中表达抗菌肽MSI-99基因,提取转基因烟草叶片中的粗蛋白,分析其对9种不同来源的稻瘟病分离物的菌丝体生长是否具有抑制作用,表明烟草叶绿体来源的MSI-99对多个稻瘟病生理小种具有明显的抑制作用,为培育叶绿体转基因水稻抗稻瘟病新品种以及新型生物农药的研制奠定基础。本发明除了在烟草中高效表达了MSI-99,同时首次发现了其对稻瘟病两种病原菌提取物的有效抗性。实验结果表明,一般抗菌肽在100℃高温条件下,可以耐受10-15min而不失活。本发明的耐热试验表明,MSI-99在120℃的高温下,至少可以耐受20min而不丧失活性,这在提高生物农药适应性和延长有效性方面均有益处。附图说明图1、密码子优化及表达框的设计:A,密码子优化前后的生物信息学分析;B,载体烟草叶绿体表达框的结构;GFP:可溶修饰型绿色荧光蛋白基因;aadA:氨基糖苷-3'-腺苷转移酶基因;Pprrn、Trps16:源于烟草叶绿体基因组的调控元件;T7g10:T7噬菌体基因10的引导序列;attP、attB:重组酶识别位点。图2、载体pWYP21451的构建:A:以pEASY-synth为模板,扩增出的约2.8kb的Pprrn-T7g10-smGFP-aadA-Trps16表达框;M:100bpPlusDNALadder;1、2:PCR产物;B:以质粒pWYP21451为模板,扩增出的约4kb的特异性条带;M:100bpPlusDNALadder;1、2:PCR产物;C:插入片段测序结果比对;D:GFP在大肠杆菌中表达情况,携带质粒pWYP21451的大肠杆菌菌液(左侧离心管)和不携带任何质粒的大肠杆菌菌液(右侧离心管)在可见光(上侧图)、紫外光(下侧图)下的荧光现象;E:载体pWYP21451的构建示意图。图3、叶绿体转化植株的同质化筛选、GFP表达和T1代抗性鉴定;A,B,C:在筛选培养基上生长的抗性愈伤或抗性再生植株在第一、第二、第三轮筛选中的情形;D-E:转基因烟草在生根培养基和土壤中的生长情况,E:左侧为转基因植株右侧为野生型植株;F-I:激光共聚焦显微镜下的转基因原生质体,F:白光下的细胞结构,G:叶绿素自身发出的红色荧光,H:绿色荧光,I:叶绿体发出的荧光叠加的效果;J:T1代同质化转基因植株(1,3,4)在含有500mg/L壮观霉素的MS培养基上正常生长,而野生型(WT)植株则白化死亡。图4、载体pWYP21451对烟草叶绿体基因组的整合过程。图5、抗性再生植株分子检测:A:利用引物MSI99重组F,MSI99重组R对再生植株中目的基因MSI99进行PCR检测;M:200bpmarker;-:未转化的烟草植株;+:重组质粒pWYP21451;1-11:部分转基因植株;B:利用引物GFP检测F,GFP检测R对再生植株中目的基因GFP进行PCR检测;M:200bpmarker;-:未转化的烟草植株;+:重组质粒pWYP21451;1-11:部分转基因植株;C:利用引物aadA检测F,aadA检测R对再生植株中目的基因aadA进行PCR检测。M:100bpPluslandder;-:未转化的烟草植株;+:重组质粒pWYP21451;1-11:部分转基因植株;D:利用引物Nt检测F,Nt检测R对第二轮筛选再生植株的同质化情况进行PCR检测;M:Trans15KDNAMarker;-:未转化的烟草植株;+:重组质粒pWYP21451;1-11:部分转基因植株;E:利用引物Nt检测F,Nt检测R对第3轮筛选再生植株的同质化情况进行PCR检测;M:Trans15KDNAMarker;-:未转化的烟草植株;+:重组质粒pWYP21451;1-5:转基因植株;F:Southern杂交分析;其中M:trans8kDNAMarker;WT:野生型对照;1-4:转基因植株;pEASY-Nt载体HindIII和BamHI间的片段。图6、绿色荧光蛋白的表达分析,A:紫外灯下野生型对照发出自发的红色荧光;B:紫外灯下转基因植株发出绿色荧光;C,叶绿素激发出的荧光;D,绿色荧光蛋白激发出的荧光;E,荧光叠加效果。图7、转基因烟草植株蛋白表达分析,A:SDS-PAGE分析;B:WesternBlot分析;M:BluePlusIIProteinMarker;WT:野生型植株;1-5:转基因烟草植株,箭头表示绿色荧光蛋白条带。图8、目的蛋白MSI-99在转基因后代中的表达量,WT:野生型植株;1-4:四个不同的转化株系。图9、转基因烟草的抗真菌试验和MSI-99的离体抗性分析,A:转基因植株的叶片接种后没有出现扩散的病斑;B:野生型对照叶片接种后出现坏死病斑;C:大肠杆菌抑菌圈试验。图10、目的蛋白MSI-99对两种水稻生理小种的抗性分析,A:三周后的水稻幼苗接种ZA11和ZE18后,分别喷施含有MSI-99的粗提液和PBS缓冲液两次后,统计植株的感病比例;B:喷施含有MSI-99的粗提液和PBS缓冲液两次后,叶片上病斑的情况,照片于喷施7天后拍摄。具体实施方式下面结合附图对本发明作进一步说明。为了实现上述目的,本发明采用的技术方案是:实施例11.材料与方法1.1试验材料1.1.1植物材料烟草材料为大花烟草(NicotianaalataLinketOttocv.Grandiflora),为本实验室保存。水稻(Oryzasativacv.Lijiangtuanheigu,丽江团黑谷),由吉林农业大学马景勇研究员惠赠,为稻瘟病感病品种。1.1.2质粒和菌种大肠杆菌(Escherichiacoli)Mach1菌株为本实验室保存;烟草赤星病病菌(Alternariaalternata)、稻瘟病病菌(Magnaporthegrisea,无性世代为Phyriculariagrisea)ZA11和ZE18菌株均由本实验室从水稻田分离鉴定并保存。设计烟草叶绿体表达所需的Prrn-T7g10-MSI99-GFP-aadA-Trps16表达盒。Prrn启动子和Trps16终止子分别为烟草叶绿体(GenBank登录号:NC_001879)16SrRNA的启动子和3'端成熟序列;所包含的三个基因MSI99、GFP、aadA均利用DNA2.0软件根据烟草叶绿体密码子偏好性进行密码子优化。在GFP基因上游、aadA基因下游分别插入同源重组酶识别的attP位点和attB位点用于切除筛选标记基因。该片段交由金斯特生物服务有限公司合成,合成后插入到质粒pUC57的HindIII酶切位点后命名为pUC57-Ntsynth。1.1.3工具酶内切酶BamHI、HindIII购自美国Promega公司。1.1.4PDA培养基马铃薯200g/L,20g/L蔗糖,0.8%琼脂pH值为5.8。1.1.5引物用引物设计软件PrimerPremier5.0设计用于扩增烟草叶绿体基因组(GenBank登录号:NC_001879)中的16S-trnI-trnA-23S片段的引物(NtF,NtR),用于检测选择性标记基因GFP的引物(GFP检测F,GFP检测R),检测选择性标记基因aadA的引物(aadA检测F,aadA检测R),检测目的基因MSI99的引物(MSI99检测F,MSI99检测R),检测同质化程度的引物(Nt检测F,Nt检测R),Southern杂交探针引物(NtprobeF,NtprobeR)。以上引物由北京六合华大基因公司合成。GFP检测F:5′-GTAAGGGAGAAGAACTTTTCACTGG-3′GFP检测R:5′-AGATTGTGTGGACAGGTAATGGTTG-3′aada检测F:5′-CGACATCATTCCGTGGCGTTATCC-3′aada检测R:5′-ACCTTGGTGATCTCGCCTTTCACG-3′MSI99检测F:5′-AGCATTGCCCGAGGAT-3′MSI99检测R:5′-TCAGCTCTTAGCAGACATTG-3′Nt检测F:5′-GGTCGGAACAAGTTGATAG-3′Nt检测R:5′-CAGTAGAGTCTTTCAGTGGC-3′NtprobeF:5′-AATGGAGCACCTAACAACGCATCTTC-3′NtprobeR:5′-TAATGCGTTCCACTTATTGAACAGGG-3′Synth重组F:5′-AATGGAGCACCTAACAACGCATCTTC-3′Synth重组R:5′-TAATGCGTTCCACTTATTGAACAGGG-3′NtprobeF:5′-AATGGAGCACCTAACAACGCATCTTC-3′NtprobeR:5′-TAATGCGTTCCACTTATTGAACAGGG-3′M13F:5'-CGCCAGGGTTTTCCCAGTCACGAC-3'M13R:5'-AGCGGATAACAATTTCACACAGGA-3'1.2试验方法1.2.1载体构建1)MSI99基因、aadA基因和GFP基因的密码子优化使用DNAWORKS3.0(http://mcl1.ncifcrf.gov/dnaworks)及SyntheticGeneDesigner将MSI99基因、aadA基因、GFP基因在不改变其编码的氨基酸序列的情况下,按照codonusagedatabases数据库(http://www.kazusa.or.jp/codon/index.html)中提供的烟草密码子偏好性进行密码子优化工作,并将经过优化后的核苷酸序列将其代入GenscriptRareCodonAnalysisTool(http://www.genscript.com.cn/rare_codon_analysis_tool.html)中进行分析,依次记录其GC含量及分布性、CAI值、最适密码子使用频率、重复序列结构域等。将经过密码子优化的3个基因序列依次置于烟草Prrn启动子和Trps16终止子之间,并在每个基因前添加合适的核糖体结合位点,MSI99基因与Prrn启动子紧密相连,且在GFP基因和aadA基因两端添加用于位点特异性重组位点attP和attB序列,即完成所需表达框的设计工作。该表达框为一个启动子驱动的3个基因的多顺反子,即烟草Prrn启动子驱动MSI99基因、GFP基因和aadA基因并以Trps16为终止子的表达框。设计完成后交由上海杰瑞生物技术有限公司合成,命名为质粒pUC57-Ntsynth。2)载体pWYP21451的构建2.1)线性化载体的准备将质粒pEASYBs-Nt用限制性内切酶NsiI进行消化反应,使得同源序列16S-trnI-trnA-23S的trnI和trnA之间的非编码区域发生断裂,为在该位置插入化学合成的Prrn-T7g10-MSI99-smGFP-aadA-Trps16表达盒做准备。取1μg质粒pEASY-Nt,用NsiI酶切,酶切体系如表1所示:表1酶切体系成分37℃反应2h。用PCR回收试剂盒(具体方法见2.2.1.4.1)回收酶切产物,该酶切产物即载体片段1。2.2)插入片段的准备根据化学合成的Prrn-T7g10-MSI99-smGFP-aadA-Trps16表达盒序列设计引物“Synth重组F”和“Synth重组R”,并在两引物的5’端各添加15bp同源序列(pEASY-Nt被NsiI酶切开的两端),以确保通过PCR扩增的表达框两端与pEASY-Nt被NsiI酶切开的两端都包含15bp的同源序列。利用金斯特生物公司的重组克隆试剂盒进行重组反应,将所获得的表达框片段无缝连接到线性化的载体上去。质粒DNA小量提取法提取质粒pUC57-Ntsynth,将其浓度稀释至50ng/μL后作为模板,利用TransStartFastPfuHSDNApolymerase进行PCR扩展目的片段,所获得的PCR产物经PCR回收试剂盒回收,即为插入片段。PCR反应体系如表2所示:表2PCR反应体系PCR程序为:95℃预变性5min;95℃变性45sec,50℃退火40sec,72℃延伸4min,30个循环;72℃后延伸10min。0.8%琼脂糖凝胶电泳检测PCR产物。2.3)重组载体的无缝连接上述获得的载体片段1和插入片段1,用购自金斯特生物公司的重组克隆试剂盒建立以下连接体系,如表3所示:表3连接体系载体片段1(100-200ng/μL)6μL插入片段1(100-200ng/μL)3μL10×CloneEZBuffer2μLCloneEZEnzyme2μLddH2O7μL用移液枪轻轻吸打溶液充分混合后,16℃孵育1h,并置于冰上终止反应,将重组的混合液体按照热激法转化大肠杆菌感受态细胞Mach1,涂于含50μg/mL卡那霉素和50μg/mL氨苄青霉素的LB平板上,37℃过夜培养。挑取单菌落至含抗生素的LB培养液中,37℃振荡过夜培养。将获得的菌液与不含该重组质粒的大肠杆菌菌液分别在含有50μg/mL壮观霉素的LB平板上划线,37℃过夜培养,观察大肠杆菌生长状况,并将两者在紫外灯下进行观察,检测是否有绿色荧光活性。同时将获得的菌液用质粒小量提取试剂盒提取重组质粒,稀释至浓度为50ng/μL后作为模板,利用引物“Nt检测F”、“Nt检测R”进行PCR鉴定。PCR反应体系如表4所示:表4PCR反应体系PCR程序为:95℃预变性5min;95℃变性45sec,50℃退火40sec,72℃延伸4min,30个循环;72℃后延伸10min。交与上海生物有限公司测序正确后,即获得烟草叶绿体表达载体pWYP21451。1.2.2烟草叶绿体转化和同质化筛选第一轮筛选:轰击过的叶片背面朝上在恢复养基上25℃暗培养3天。暗培养后,将叶片切成5mm×5mm的小片,背面朝下放在筛选培养基Ⅰ(含500mg/L壮观霉素)上,以16h光照、8h黑暗的光周期25℃培养,每20天更换培养基。产生不定芽后,用365nm紫外灯检测,将产生绿色荧光的不定芽剪下,置于生根培养基Ⅰ(含500mg/L壮观霉素)上。PCR检测选择性标记基因GFP、aadA以及目的基因MSI-99。第二轮筛选:选取转基因植株中绿色荧光较强的植株,将其叶子切成5mm×5mm的小片,背面朝下放在筛选培养基Ⅱ(含625mg/L壮观霉素)上,以16h光照、8h黑暗的光周期25℃培养,每20天更换培养基。产生不定芽后,剪下不定芽在生根培养基Ⅱ(含625mg/L壮观霉素)上生根。PCR检测其同质化程度。第三轮筛选:选取经PCR检测转化率高的植株,将其叶子切成5mm×5mm的小片,背面朝下放在筛选培养基Ⅲ(含750mg/L壮观霉素)上,如上述方法进行筛选;此筛选在出不定芽后重复一次,最后获得的不定芽在生根培养基Ⅲ(含750mg/L壮观霉素)上生根。PCR检测其同质化程度。第四轮筛选:选取经PCR检测转化率高的植株,将其叶子切成5mm×5mm的小片,背面朝下放在筛选培养基Ⅳ(含1000mg/L壮观霉素)上,如上述方法进行筛选;此筛选在出不定芽后重复一次,最后获得的不定芽在生根培养基Ⅳ(含1000mg/L壮观霉素)上生根。PCR检测其同质化程度,并通过southern杂交验证同质化检测结果。1.2.3分子检测1)目的基因、选择性标记基因的PCR检测将第一轮筛选出的能够产生绿色荧光的再生植株叶片用CTAB法提取总DNA,设计引物通过PCR检测选择性标记基因GFP、aadA以及目的基因MSI99。A.MSI99基因的PCR检测由于目的基因MSI99的长度仅有72bp,不利于进行PCR检测,所以试验中我们利用软件PrimerPremier5.0根据MSI99基因序列和与之相连的Prrn启动子序列设计用于PCR检测Prrn-MSI99片度是否整合到烟草叶绿体基因组中所需的引物“MSI99检测F”和“MSI99检测R”(“MSI99检测F”位于Prrn启动子序列内和“MSI99检测R”位于MSI99基因序列内),两条引物之间的距离为218bp,使用TransStartFastPfuDNApolymerase进行PCR检测。MSI99与PCR检测的体系与条件如表5所示:表5PCR程序为:95℃预变性5min;95℃变性45sec,50℃退火40sec,72℃延伸10sec,30个循环;72℃后延伸5min。B.GFP基因的PCR检测利用软件PrimerPremier5.0根据GFP基因序列设计用于PCR检测GFP基因是否整合到烟草叶绿体基因组中所需的引物“GFP检测F”和“GFP检测R”(序列见2.1.5),两条引物之间的距离为596bp,使用TransStartFastPfuDNApolymerase进行PCR检测。GFP基因PCR反应体系如表6所示:表6PCR程序为:95℃预变性5min;95℃变性45sec,50℃退火40sec,72℃延伸30sec,30个循环;72℃后延伸5min。C.aadA基因的PCR检测利用软件PrimerPremier5.0根据aadA基因序列设计用于PCR检测GFP基因是否整合到烟草叶绿体基因组中所需的引物“aadA检测F”和“aadA检测R”(序列见2.1.5),两条引物之间的距离为451bp,使用TransStartFastPfuDNApolymerase进行PCR检测,PCR检测的体系如表7所示。表7aadA基因PCR检测的体系:PCR程序为:95℃预变性5min;95℃变性45sec,50℃退火40sec,72℃延伸30sec,30个循环;72℃后延伸5min。2)叶绿体转基因同质化的PCR检测将第二轮、第三轮筛选出的再生植株叶片用CTAB法(操作步骤见2.2.1.1)提取总DNA,在叶绿体基因组的trnI和trnA基因之间设计引物“Nt检测F”和“Nt检测R”通过PCR检测第二轮、第三轮筛选所获得的再生植株的同质化程度。PCR反应体系如表8所示:表8PCR程序为:95℃预变性5min;95℃变性45sec,50℃退火40sec,72℃延伸2min,30个循环;72℃后延伸5min。3)Southernblot分析取4μg叶绿体DNA用BamHI和HindIII酶切,0.8%琼脂凝胶80V电泳3个小时后转移到硝酸纤维素膜上,紫外交联两次,每次30秒,间隔2分钟。按照Roche公司试剂盒提供的方法进行Southern杂交分析,探针为trnI-trnA区段BamHI和HindIII内切酶之间约1.4kb的片段。具体操作参见专利一种人源碱性成纤维细胞生长因子、烟草叶绿体表达载体及生产方法(申请号:201510310239.3,申请日:2015-06-08,公开号:CN104946656A)。4)GFP荧光检测按照专利一种人源碱性成纤维细胞生长因子、烟草叶绿体表达载体及生产方法(申请号:201510310239.3,申请日:2015-06-08,公开号:CN104946656A)的方法,对转基因材料进行整株荧光分析。对转基因植株表达的目的蛋白N端的GFP标签进行荧光检测。在365nm的紫外光下,转基因植株在暗室中发出强烈的绿色荧光,表明绿色荧光蛋白获得大量表达,而对照株则表现为自发红光荧光(如图6所示)。5)蛋白表达分析定性分析:将野生型烟草植株与经分子鉴定确定的T1代烟草叶绿体转基因植株分别提取总可溶性蛋白(totalsolubleprotein,TSP),经提Branford等方法测定总蛋白浓度后取一定量的蛋白进行SDS电泳及Western检测分析外源基因在植物叶绿体中的表达情况。电泳泳结束后其中一块用考马斯亮蓝染色另一块通过半干转膜法把的蛋白转移至PVDF膜上,经封闭后与MSI-99抗体孵育,最后用显色法在膜上分析。定量分析:分别提取T1代烟草叶绿体转基因植株幼叶、成熟叶和衰老叶片各100mg,研磨后按上述方法提取总可溶性蛋白,设置非转基因阴性对照,用间接ELISA方法检测MSI-99的表达量。1.2.4转基因烟草中MSI99的活性分析1)MSI99的热稳定性分别提取对照非转基因烟草的总蛋白和同质化转基因植株的总蛋白,用PBS缓冲液稀释成浓度均为5mg/mL的总蛋白粗提液。用打孔器将1mm厚的滤纸打成直径5mm的圆盘,经高温灭菌后分别浸泡在上述两种总蛋白的粗提液中5min,分别设置未处理、室温放置处理20min和120℃高温处理20min三个水平,之后将其置于已涂满大肠杆菌的LB固体培养基平皿上,37℃培养过夜,次日观察抑菌环情况。2)抗菌肽MSI99对烟草病害的防治从培养了7天的马铃薯培养基上收集烟草赤星病(Alternariaalternata)的分生孢子,调整成终浓度为107个孢子/mL的悬浮液。用记号笔分别在野生型植株和叶绿体转基因植株叶片表面做标记,然后用毛笔分别蘸含有烟草白粉病菌和烟草赤星病菌的菌液,在叶片上反复接种,1周后观察接菌部位是否发生相应的病变,并照相记录。3)抗菌肽MSI99对稻瘟病的离体和活体抗性活性分析供试稻瘟病菌病原菌共2种,分别为ZA11和ZE18,是东北稻区主要危害小种。这两个小种采集自2014年水稻田间,并通过显微鉴定、16S测序、对峙实验等方式进行鉴定并保存在本实验室。首先用MTT法确定最小抑制浓度(MIC)。方法是用PDA培养基培养两种真菌一周,然后浸泡了转基因植株蛋白粗提液的灭菌滤纸小圆片放置在培养皿的中间,四周均匀放置4块直径为5毫米的菌苔。培养皿倒置后在28℃温度下培养10-15天,观察抑菌圈的大小。对于活体抗性,接种水稻幼苗的菌液浓度调整为5×105个孢子/mL,接种后幼苗在温度为28℃,相对湿度为95%的黑暗条件下放置24h。然后,喷施浓度为8.0ug/mL的MSI-99蛋白粗提液一次,48h后再次喷施。每10株幼苗喷施3mL。7天后调查植株发病情况,其中0-3级被认定为抗病,而4-9级则被认定为感病。设置喷施PBS缓冲液作为对照。2.试验结果2.1外源基因的密码子优化与表达框设计按照codonusagedatabases数据库(http://www.kazusa.or.jp/codon/index.html)中提供的烟草密码子偏好性,利用软件DNA2.0的算法对GenBank上登录的MSI99基因、GFP基因、aadA基因进行密码子优化,并使用GenscriptRareCodonAnalysisTool分析基因优化前后的差异。结果表明经过密码子优化后,MSI99基因、GFP基因、aada基因构成的多顺反子中密码子适应指数(Codonadaptionindex),CAI值分别由0.59上升到0.94。其GC含量由49.72%下降至42.39,较之前更接近烟草叶绿体基因组的GC含量标准(38.94%),密码子中,第1位碱基GC含量46.54%、第2位碱基GC38.78%、第3位碱基GC31.51%且分布均匀,没有明显的GC富集区或AT富集区。密码子使用频率分布(CodonFrequencyDistribution,CFD)中可以看出,经优化后基因所使用的密码子均分布最适密码子使用频率91-100%之间。基因已具备在烟草叶绿体中进行高效表达的生物信息学条件。进一步根据Dannel等的研究结果,对叶绿体表达载体中的启动子、终止子、核糖体结合位点、5’非翻译区和3’非翻译区进行优化选择和合理组合,最终采用同时具有转录活性强、能够转录多个顺反子、受光周期影响不显著等特点的启动16SrRNA转录的Prrn启动子,具有增强表达作用的T7g10区域作为MSI99的5’非翻译区,经典的“GTAGGGAGGGATTT”序列作为GFP基因和aadA基因的核糖体结合位点(ribosomebindingsite,RBS),三个基因依次顺联构成多顺反子,终止子为16S核糖体3'端成熟序列Trps16终止子,该序列具有稳定成熟的mRNA的能力。设计Prrn-T7g10-MSI99-smGFP-aadA-Trps16表达盒通过化学合成方式进行合成,考虑到一旦成功完成叶绿体转基因工作并实现叶绿体转基因烟草植株同质化的筛选工作以后,筛选标记基因GFP基因和aadA基因的使命即已完全达成,其在转基因植株叶绿体基因组中没有存在的价值,且由于上述基因的存在会极大地消耗转基因烟草植株通过光合作用固定的能量。因此,在表达框中GFP基因和aadA基因前后各添加用于重组切除的重组酶识别位点attP和attB。完成设计后将该基因交给上海杰瑞生物技术有限公司合成,合成后置于pUC57载体上,命名该质粒为pUC57-Ntsynth。密码子优化及表达框的设计如图1所示。2.2载体pWYP21451的构建携带烟草基因组16S-trnI-trnA-23S同源序列的载体pEASY-Nt经限制性内切酶NsiI消化后成功的获得了线性化的载体片段,通过PCR纯化试剂盒进行回收并用NanoDrop2000核酸测定仪测定回收后的载体浓度为173ng/μL,该浓度达到金斯瑞生物公司的重组克隆试剂盒进行连接反应的浓度要求,保存于4℃冰箱中备用。如图2A所示通过PCR反应成功的将Prrn-T7g10-MSI99-smGFP-aadA-Trps16表达盒扩增分离出来,且由于引物“synth重组F”和“synth重组R”的5’端各添加15bp同源序列(载体pEASY-Nt被NsiI酶切开的两端),使得PCR产物两端含有与pEASY-Nt被NsiI酶切开的两端15bp的同源序列,可以通过金斯特生物公司的重组克隆试剂盒进行无缝连接。由于目的条带单一,故通过通过PCR纯化试剂盒进行回收并用NanoDrop2000核酸测定仪测定回收后的载体浓度为514ng/μL,经重蒸水稀释到浓度为194ng/μL后与所获得的线性化载体片段进行重组连接反应,并将反应产物转化大肠杆菌。对所获得的转化子用“Nt检测F”和“Nt检测R”作为引物进行PCR检测,结果(图2B)证明表达框Prrn-T7g10-MSI99-smGFP-aadA-Trps16已成功连入载体pEASY-Nt的限制性内切酶NsiI的识别位点中。将该载体交由上海生工测序,测序结果进一步证实了该片段已成功连入载体,插入方向与预先设计的一致(图2C),将重组载体命名为:pWYP21451。对携带重组载体pWYP21451的大肠杆菌进行抗生素抗性鉴定发现,载体pWYP21451不仅能够赋予其宿主细胞对卡那霉素和氨苄青霉素的抗性,还能够使其在含有壮观霉素的LB培养基上生长。该研究证实了表达框Prrn-T7g10-MSI99-smGFP-aadA-Trps16已插入载体中,且在Prrn启动子的驱动下aadA基因实现了表达。为进一步验证这一推断,将携带重组载体pWYP21451的大肠杆菌和不携带任何载体的大肠杆菌进行紫外观察,结果发现携带重组载体pWYP21451的大肠杆菌具有绿色荧光,这是说明在Prrn启动子的驱动下GFP基因得到表达(图2D),进一步证实了表达框Prrn-T7g10-MSI99-smGFP-aadA-Trps16已插入载体中,且Prrn启动子在大肠杆菌细胞中具有转录活性。2.3叶绿体转化植株的获得及分子检测将轰击过的叶片背面朝上在恢复养基上25℃暗培养3天。继而,将叶片切成5mm×5mm的小片,背面朝下放在筛选培养基Ⅰ上,以16小时光照、8小时黑暗的光周期25℃培养,15天左右,叶片逐渐膨胀变厚,体积增加4-6倍。自开始诱导培养起,每20天更换一次培养基(筛选培养基Ⅰ)。培养至40天左右有绿色的愈伤组织出现,与周围白色(浅绿色、或黄绿色)愈伤组织具有明显差别。继续在筛选培养基Ⅰ上培养,10天左右分化出不定芽(图3A),再经过7-10天不定芽长至1cm左右。将不定芽剪下,置于生根培养基Ⅰ上培养,大概20天即可生根,得到完整的再生植株。继而对其进行PCR检查,由图5A-C可知,选择性标记基因GFP、aadA以及目的基因MSI99均已转入植株。第一轮筛选工作完成共获得三块愈伤组织,43个再生植株。此时剪下少许叶片制备成原生质体并在共聚焦显微镜下检测可以见到烟草叶绿体中有明显的绿色荧光信号(图3F-I),统计视野范围内能够发出绿色荧光信号的细胞数目在占细胞总数的比例,选择比例高的再生植株作为第二轮筛选的材料来源。第二轮筛选产生的愈伤组织与第一轮有所不同(如图3B),产生的愈伤组织都是绿色的愈伤组织,并且愈伤组织出现在叶片伤口边缘,不像第一轮筛选时出现在叶片背面某一基因枪轰击的转化点,仅经过30天即分化出不定芽。不定芽长至1cm时剪下,置于生根培养基Ⅱ上培养,大概20天即可生根,得到第二轮筛选的再生植株。由图4可知,使用Nt检测F和Nt检测R作为引物,以野生型烟草叶绿体DNA为模板进行PCR扩增,扩增出的条带较小,而以质粒pWYP21451或重组后的烟草叶绿体DNA为模板进行PCR扩增则目的条带较大。因而,通过PCR扩增出的不同条带亮度比较,大体推测出再生植株转化后的同质化程度。当PCR扩增仅得到3.9kb的条带时,便可以确定转化植株达到同质化水平。根据第二轮筛选的再生植株的同质化PCR检测结果(如图5D),选择3.9kb处得条带较亮的植株(图5D中的再生植株7、再生植株8)按照第二轮筛选的方法进行第三、四轮筛选,直至选择到重组型的叶绿体DNA分子同质化为止。图5E的PCR结果表明,经过第3轮筛选后,叶绿体转基因植株除编号2的植株以外都达到同质化水平。大量提取再生植株叶绿体DNA,用BamHI和HindIII酶切叶绿体DNA做的SouthernBlot分析。如图4所示,以烟草叶绿体trnI和trnA基因间的片段为探针,质粒pWYP21451带Prrn-T7g10-MSI99-smgfp-aadA-Trps16表达盒,插入野生型烟草叶绿体基因组trnI和trnA间的NsiI位点,形成重组基因组。P1、P2是PCR检测引物,野生型预计扩增片段约为1.2kb,转化株预计扩增片段约为3.9kb;BamHI和HindIII用于Southern杂交检测的酶切反应,trnI与trnA间约1.4kb的片段为杂交探针。由于转化后的叶绿体DNA分子在BamHI和HindIII酶切位点间的片段发生变化,因而可以根据1.4kb处(野生型)和4.1kb处(重组型)杂交信号的深浅,判断重组型叶绿体DNA和野生型叶绿体DNA在烟草叶绿体转化再生植株中所占的比例。杂交结果(图5F)显示,除再生植株2以外的3个叶绿体转基因植株都达到了同质化。图5所示,A:利用引物MSI99重组F,MSI99重组R对再生植株中目的基因MSI99进行PCR检测。M:200bpmarker;-:未转化的烟草植株;+:重组质粒pWYP21451;1-11:部分转基因植株;B:利用引物GFP检测F,GFP检测R对再生植株中目的基因GFP进行PCR检测。M:200bpmarker;-:未转化的烟草植株;+:重组质粒pWYP21451;1-11:部分转基因植株。C:利用引物aadA检测F,aadA检测R对再生植株中目的基因aadA进行PCR检测。M:100bpPluslandder;-:未转化的烟草植株;+:重组质粒pWYP21451;1-11:部分转基因植株;D:利用引物Nt检测F,Nt检测R对第二轮筛选再生植株的同质化情况进行PCR检测。M:Trans15KDNAMarker;-:未转化的烟草植株;+:重组质粒pWYP21451;1-11:部分转基因植株;E:利用引物Nt检测F,Nt检测R对第3轮筛选再生植株的同质化情况进行PCR检测。M:Trans15KDNAMarker;-:未转化的烟草植株;+:重组质粒pWYP21451;1-5:转基因植株;F:Southern杂交分析。其中M:trans8kDNAMarker;WT:野生型对照;1-4:转基因植株。探针为pEASY-Nt载体HindIII和BamHI间的片段。2.4GFP荧光分析在紫外灯下(图6A,B),野生型烟草植株的叶片发出红色荧光,这是由于叶绿体中所含有的叶绿素受到紫外线激发产生的。而叶绿体转基因烟草植株在紫外灯照射下发出较强的绿色荧光,说明在烟草中的GFP基因大量表达,产生的绿色荧光蛋白在紫外线照射下产生的绿色荧光将叶绿素受激发产生的红色荧光遮盖掉了。将叶绿体转基因烟草植株的叶片在纤维素酶和果胶酶的作用下制成原生质体,在共聚焦显微镜下做进一步的观察。图6C-E依次是1000×放大原生质体中叶绿体内叶绿素受紫外激发下所发出的红色荧光(图6C),488nm激发光下绿色荧光蛋白所发出的绿色荧光(图6D)以及红色荧光与绿色荧光的叠加图(图6E)。图6E中我们可以看到,绿色荧光与红色荧光完全重合,得知表达的绿色荧光蛋白都存在于叶绿体中而没有进入细胞质。2.5转基因烟草外源蛋白表达分析将经过SouthernBlot分析的烟草叶绿体转基因植株和阴性对照(野生型植株)分别用PBS缓冲液提取植物总可溶性蛋白,并用Branford法测定其可溶性总蛋白浓度,添加适量PBS缓冲液稀释至10mg/ml,各取5μL进行SDS-PAGE分析。由于SDS-PAGE电泳的分辨率通常无法显示出分子量小于10kD的蛋白,故无法通过蛋白电泳分析直接分析目的基因MSI99的表达情况,但MSI99和smGFP同属于一个多顺反子,且smGFP位于MSI99的下游,因此通过分析GFP蛋白的表达,可以间接分析MSI99的表达。SDS-PAGE分析结果如图7A所示,在所有4个转基因植株的可溶性蛋白中,均存在27KD绿色荧光蛋白GFP的特异性带(右侧箭头所示),而野生型植株则没有,由此可以推断目的基因MSI99也得到了表达。为了判断MSI-99是否得到了表达,我们进行分了Westernblot分析,结果如图7B所示。结果表明,无论是否同质化,4个泳道均出现杂交信号,而野生型对照中则没有杂交信号,说明均有目的蛋白的表达。进一步的ELISA分析结果显示,成熟叶片中的目的蛋白表达水平显著高于幼嫩叶片和衰老的叶子,而野生型植物没有检测到MSI-99的表达。成熟叶中表达水平最高的3号株系到达89.75ug/g·鲜重。在所有四个转基因株系中,衰老叶子的MSI-99表达量相对高于幼嫩的叶子(如图8所示)。2.6叶绿体转基因烟草中MSI99的活性分析为了评价抗菌肽MSI-99的活性,我们首先采用大肠杆菌进行验证。结果表明,野生型植物的叶片提取物没有抗菌活性,表现为没有抑菌圈(图9C1)。含有MSI-99的转基因植株叶片中的提取物,不经任何处理,可以形成抑菌圈(图9C2);在室温下放置20min,也可以形成抑菌圈(图9C3)。但是,当转基因植株的提取物在120℃加热20min之后,仍然能够保留抗菌活性,可以形成抑菌圈(图9C4),而且面积大小和未处理的抑菌圈大小类似,表明该蛋白具有很好的热稳定性。三个同质化的转基因株系接种烟草真菌病的链格孢属(Alternariaalternate)病原体,结果证明转基因植物的叶子上没有形成坏死病斑(图9A),而非转基因植株的叶子出现了明显的坏死症状(图9B)。更重要的是,MSI-99对两个稻瘟病生理小种表现出明显的抑制效应。从野生型植株中的提取物没有抑制ZA11菌丝体(图9D)和ZE18菌丝体(图9F)的生长,因为没有形成抑菌圈。相反,转基因植株的提取物分别对上述两种生理小种则产生了显著的抑制效果(图9E,图9G)。图中可见当周围的菌丝伸长靠近中间的滤纸圆片时,其生长明显受到抑制,结果二者均形成了明显的抑菌圈。据我们所知,这是第一次报到MSI-99对稻瘟病病菌具有抑制作用。该发现为开发防治稻瘟病的新型生物农药提供了一个新途径。如图9所示A:转基因植株的叶片接种后没有出现扩散的病斑;B:野生型对照叶片接种后出现坏死病斑;C:大肠杆菌抑菌圈试验,其中野生型对照植株总蛋白粗提液(1)没有抑菌环,转基因植株总蛋白粗提液未处理(2)、室温放置20min处理(3)和120℃高温处理20min(4)均可以形成大小一致的抑菌圈。野生型植株总蛋白粗提液对稻瘟病菌分离物ZA11(D)和ZE18(F)菌丝体的生长没有影响,无法形成抑菌环;转基因植株总蛋白粗提液对分离物ZA11(E)和ZE18(G)菌丝体的生长有抑制作用,均形成了明显的抑菌圈。2.7在水稻幼苗期鉴定MSI-99对稻瘟病的抗性首先,MSI-99蛋白对两种生理小种ZA11和ZE18的最小抑制浓度(MIC)分别是0.625ug/mL和1.25ug/mL,然后分别在水稻品种丽江团黑谷的幼苗期检测了MSI-99对两个小种的抗性。从图10A的结果可以看出,水稻品种在接种病原菌之后再喷施含有MSI-99的蛋白粗提液能有效防止水稻病原菌的感染。水稻品种接种ZA11和ZE18后喷施转基因叶片蛋白粗提液,受感染植物的比例分别是7.55%和5.49%。与此同时,作为对照喷施PBS的水稻品种感染两种生理小种的比例依次为80.32%和82.20%。从水稻叶片上的病斑可以明显观察到其差别(图10B)。接种后喷施PBS缓冲液,叶片上出现明显的坏死症状,而喷施MSI-99的则没有出现坏死症状。表明稻瘟病菌的活性明显受到MSI-99的抑制。3.结论MSI-99属于蛙皮素(magainins)II的衍生物,已在烟草的叶绿体基因组中表达,并证明对烟草中三种真菌病害(Aspergillusflavus黄曲霉,Fusariummoniliforme镰刀菌,Verticilliumdahliae大丽轮枝菌)95%的萌发小孢子具有抑制生长的作用。本文除了在烟草中高效表达了MSI-99,同时首次发现了其对稻瘟病两种病原菌提取物的有效抗性。此外,研究表明,一般抗菌肽在100℃高温条件下,可以耐受10-15min而不失活。本研究的耐热试验表明,MSI-99在120℃的高温下,至少可以耐受20min而不丧失活性,这为提高生物农药适应性和延长有效性均有益处。由于抗菌肽MSI99自身的抗菌特性,一般无法在原核生物中如大肠杆菌中表达抗菌肽用于生物反应器的研发。因此,利用叶绿体表达量高的特点在植物叶绿体中大量表达目的蛋白,用于提高植物的抗病性和植物生物反应器研究是一个合乎逻辑的恰当选择。与此同时,考虑到前述的过量表达可能对表型生长造成的负面影响,我们在构建表达载体策略时,需要在表达量与表型生长之间找到一个平衡点,而不是过分追求高表达而影响了植物的其它农艺性状。以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本
技术领域:
的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1