一种促进干细胞扩增及干性维持的胶原材料及其制备方法与流程
本发明涉及一种促进干细胞扩增及干性维持的胶原材料及其制备方法。
背景技术:
外源干细胞移植是组织损伤修复的重要手段,干细胞具有自我更新和分化能力,可以分化为特定类型的组织细胞,促进组织再生,同时干细胞也可以通过旁分泌作用改善损伤微环境,促进损伤修复。但是干细胞在体外扩增培养过程中,随着细胞增殖分裂时间的延长,细胞的干性会逐渐降低。因此,如何建立一种能促进干细胞扩增且保持扩增后干细胞特性的培养方法对组织损伤修复至关重要。
技术实现要素:
本发明的目的是提供一种促进干细胞扩增及干性维持的胶原材料及其制备方法。
本发明首先提供了一种胶原材料的制备方法,包括如下步骤:
(1)取牛筋膜组织,去除表面的肌肉和脂肪,用水清洗;
(2)取完成步骤(1)的组织,置于含磷酸三丁酯的液体中浸泡;
(3)取完成步骤(2)的组织,置于水中浸泡并清洗;
(4)取完成步骤(3)的组织,置于nacl溶液中浸泡;
(5)取完成步骤(4)的组织,置于水中浸泡并清洗;
(6)取完成步骤(5)的组织,置于表面活性剂溶液中浸泡;
(7)取完成步骤(6)的组织,置于水中浸泡并清洗;
(8)取完成步骤(7)的组织,置于naoh溶液中浸泡;
(9)取完成步骤(8)的组织,置于水中浸泡并清洗;
(10)取完成步骤(9)的组织,进行冷冻干燥,得到干燥组织;
(11)取步骤(10)得到的干燥组织,溶于醋酸溶液,然后将体系ph调至6-8;
(12)将完成步骤(11)的整个体系转移到透析袋在水中进行透析;
(13)完成步骤(12)后,收集透析袋内的整个体系,然后进行冷冻干燥,得到干粉,即为干粉状胶原材料。
步骤(1)中,所述水为去离子水。
步骤(2)中,含磷酸三丁酯的液体是将磷酸三丁酯和水混合得到的。步骤(2)中,磷酸三丁酯的浓度可为0.5g/100ml-1.5g/100ml,具体可为1g/100ml。步骤(2)中,浸泡的温度可为2℃-16℃,具体可为4℃。步骤(2)中,浸泡的时间可为18小时-72小时,具体可为48小时。
步骤(3)中,所述水为去离子水。步骤(3)中,浸泡温度可为2℃-16℃,具体可为4℃。步骤(3)中,浸泡并清洗可为“每5分钟-15分钟换水,共换水10次-20次”,具体可为“每10分钟换水,共换水15次,最后一次换水10分钟后完成本步骤”。
步骤(4)中,nacl溶液是将nacl溶于ph7.6、25mmol/l的tris-hcl缓冲液得到的。步骤(4)中,nacl的浓度可为1m-2m,具体可为1.5m。步骤(4)中,浸泡的温度可为2℃-16℃,具体可为4℃。步骤(4)中,浸泡的时间为10分钟-60分钟,具体可为40分钟。
步骤(5)中,所述水为去离子水。步骤(5)中,浸泡温度可为2℃-16℃,具体可为4℃。步骤(5)中,浸泡并清洗可为“每5分钟-15分钟换水,共换水8次-20次”,具体可为“每10分钟换水,共换水9次,最后一次换水10分钟后完成本步骤”。
步骤(6)中,表面活性剂溶液为表面活性剂水溶液。步骤(6)中,表面活性剂溶液中,表面活性剂的浓度可为1%-5%(体积比),具体可为3%(体积比)。步骤(6)中,表面活性剂可为tween-20、tween-21、tween-40、tween-60、tween-61、tween-80、tween-81、tween-85、triton-100、triton-114等。步骤(6)中,浸泡的温度可为2℃-16℃,具体可为4℃。步骤(6)中,浸泡的时间为30分钟-120分钟,具体可为80分钟。
步骤(7)中,所述水为去离子水。步骤(7)中,浸泡温度可为2℃-16℃,具体可为4℃。步骤(7)中,浸泡并清洗可为“每15分钟-25分钟换水,共换水15次-25次”,具体可为“每20分钟换水,共换水19次,最后一次换水20分钟后完成本步骤”。
步骤(8)中,naoh溶液为naoh水溶液。步骤(8)中,naoh溶液中,naoh的浓度可为0.5m-4m,具体可为2m。步骤(8)中,浸泡的温度可为2℃-16℃,具体可为4℃。步骤(8)中,浸泡的时间为10分钟-60分钟,具体可为30分钟。
步骤(9)中,所述水为去离子水。步骤(9)中,浸泡温度可为2℃-16℃,具体可为4℃。步骤(9)中,浸泡并清洗可为“每3分钟-10分钟换水,共换水15次-25次”,具体可为“每5分钟换水,共换水19次,最后一次换水5分钟后完成本步骤”。
步骤(10)中,所述冷冻干燥的时间可为24小时-72小时,具体可为48小时。
步骤(11)中,所述醋酸溶液为醋酸水溶液。步骤(11)中,醋酸溶液为0.05m-1m醋酸溶液,具体可为0.5m醋酸溶液。步骤(11)中,干燥组织与醋酸溶液的配比为“1g-5g:100ml-500ml”,具体配比可为“1g-5g:150ml”或“3g:100ml-500ml”,具体配比可为“3g:150ml”。步骤(11)中,醋酸溶液为预冷的醋酸溶液。所述预冷的温度为2℃-16℃,具体可为4℃。步骤(11)中,溶于醋酸溶液的实现方式可为“2℃-16℃搅拌2小时-24小时”,具体可为“4℃搅拌12小时”。步骤(11)中,体系ph调至7。步骤(11)中,用naoh水溶液调ph,具体用4mnaoh水溶液调ph。
步骤(12)中,所述透析袋的截留分子量为1000da-100kda,具体可为3000da。步骤(12)中,所述水为去离子水。步骤(12)中,透析的时间可为3天-10天,具体可为7天。步骤(12)中,透析过程中每天换水,具体可每天换水3次。步骤(12)中,透析的温度为2℃-16℃,具体可为4℃。
步骤(13)中,所述冷冻干燥的时间可为24小时-72小时,具体可为48小时。
所述方法还包括如下步骤(14):取步骤(13)得到的干粉状胶原材料,用溶剂溶解,得到凝胶状胶原材料。步骤(14)中,溶剂可为生理盐水或磷酸盐缓冲液。所述磷酸盐缓冲液可为ph7-8的磷酸盐缓冲液,具体可为ph7.4的pbs缓冲液。步骤(14)中,干粉状胶原材料与溶剂的配比可为“0.2-4g:100ml”,具体可为“3g:100ml”。
以上任一所述方法制备得到的干粉状胶原材料也属于本发明的保护范围。
以上任一所述方法制备得到的凝胶状胶原材料也属于本发明的保护范围。
本发明还保护以上任一所述干粉状胶原材料或凝胶状胶原材料在制备产品中的应用;所述产品的功能为培养干细胞。
本发明还保护一种产品,其活性成分为以上任一所述干粉状胶原材料或凝胶状胶原材料;所述产品的功能为培养干细胞。
本发明还保护以上任一所述干粉状胶原材料或凝胶状胶原材料在培养干细胞中的应用。
本发明还保护一种培养干细胞的方法,包括如下步骤:将干细胞与所述凝胶状胶原材料混合,然后进行培养。干细胞与凝胶状胶原材料的配比可为“102-108个细胞:500μl-1000μl凝胶状胶原材料”,具体可为“5×103个-105个细胞:500μl-1000μl凝胶状胶原材料”,更具体可为“5×103个细胞:500μl凝胶状胶原材料”或“105个细胞:1000μl凝胶状胶原材料”。所述培养的时间可为5-7天。所述培养的条件具体可为:37℃、5%co2、饱和湿度。
本发明还保护一种培养干细胞的方法,包括如下步骤:将干细胞、所述干粉状胶原材料和溶剂混合,然后进行培养。干细胞、干粉状胶原材料和溶剂的配比可为“102-108个细胞:1mg-40mg干粉状胶原材料:500μl-1000μl溶剂”。干细胞、干粉状胶原材料和溶剂的配比可为“5×103个-105个细胞:1mg-40mg干粉状胶原材料:500μl-1000μl溶剂”。干细胞、干粉状胶原材料和溶剂的配比具体可为“5×103个-105个细胞:15mg-30mg干粉状胶原材料:500μl-1000μl溶剂”。干细胞、干粉状胶原材料和溶剂的配比具体可为“5×103个细胞:15mg干粉状胶原材料:500μl溶剂”。干细胞、干粉状胶原材料和溶剂的配比具体可为“105个细胞:30mg干粉状胶原材料:1000μl溶剂”。溶剂可为生理盐水或磷酸盐缓冲液。所述磷酸盐缓冲液可为ph7-8的磷酸盐缓冲液,具体可为ph7.4的pbs缓冲液。
以上任一所述干细胞可为间充质干细胞。所述间充质干细胞具体可为骨髓间充质干细胞。以上任一所述间充质干细胞具体可为鼠间充质干细胞。以上任一所述骨髓间充质干细胞具体可为第1代骨髓间充质干细胞至第6代骨髓间充质干细胞,更具体可为第3代骨髓间充质干细胞。
本发明提供的的胶原材料,可以与干细胞混合后进行细胞三维体外培养,与传统的二维平皿培养相比,这种材料可以促进干细胞体外增殖,并促干细胞特性的维持,培养一段时间后,干细胞相关基因以及干细胞生长因子相关基因具有较高的表达水平,干细胞具有良好的向成骨细胞的分化能力以及良好的向脂肪细胞的分化能力。生长因此是干细胞分泌的具有促进组织损伤修复的功能。
本发明提供的胶原材料对于干细胞培养具有重大的应用推广价值。
将本发明提供的胶原材料与干细胞混合后注射到组织损伤部位,可以改善干细胞生存的微环境,调控干细胞特性,从而取得有效修复损伤组织的效果,因此本发明为组织损伤修复提供了新方法。
附图说明
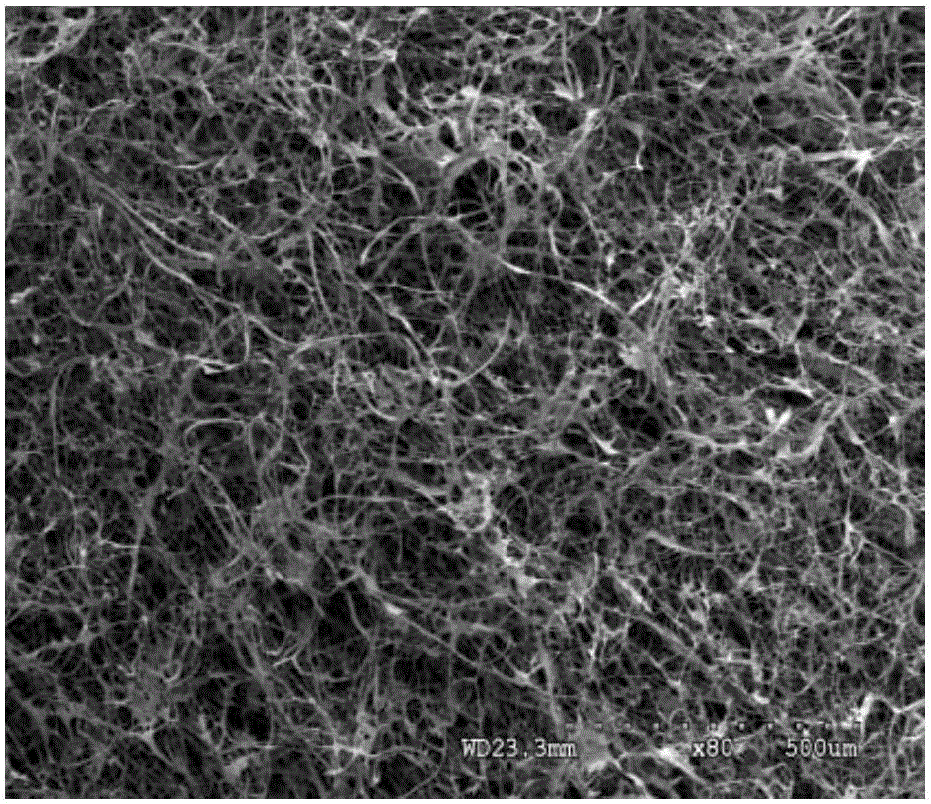
图1为干粉状胶原材料在显微镜下的照片。
图2为凝胶状胶原材料的照片。
图3为实施例3中检测细胞数目的结果。
图4为实施例3中检测处于s期细胞的比例的结果。
图5为实施例4中检测干细胞相关基因的表达水平的结果。
图6为实施例4中检测干细胞向成骨细胞的分化能力的结果。
图7为实施例4中检测干细胞向脂肪细胞的分化能力的结果。
图8为实施例4中检测干细胞生长因子基因的表达水平的结果。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。实施例中所用的淋巴细胞分离液的比重为1.077g/l。实施例中,冷冻干燥均采用0.1mpa真空度。如无特殊说明,实施例中的pbs缓冲液均为ph7.4的pbs缓冲液。干细胞培养液:含10%(体积百分含量)fbs、100μg/ml青霉素和100u/ml硫酸链霉素,余量为l-dmem培养液。消化液:含0.25g/100ml胰酶、0.01g/100mledta,溶剂为ph7.6的pbs缓冲液。sd大鼠:维通利华sd大鼠,品系代码101。
实施例1、胶原材料的制备
1、取牛筋膜组织,去除表面多余肌肉和脂肪。
2、取步骤1得到的组织,用去离子水充分清洗,然后置于含磷酸三丁酯的液体中4℃浸泡48小时(每12小时换液,即更换新的含磷酸三丁酯的液体)。
含磷酸三丁酯的液体是将磷酸三丁酯和水混合得到的。本实施例中,磷酸三丁酯的浓度为1g/100ml。实际应用中,磷酸三丁酯的浓度为0.5g/100ml-1.5g/100ml均可。
实际应用中,2℃-16℃均可。
实际应用中,浸泡时间为18小时-72小时均可。
3、取完成步骤2的组织,置于去离子水中4℃浸泡(每10分钟更换去离子水,共换水15次,最后一次换水10分钟后完成本步骤)。
实际应用中,2℃-16℃均可。
实际应用中,可每5分钟-15分钟更换去离子水,共换水10次-20次。
4、取完成步骤3的组织,置于nacl溶液中4℃浸泡40分钟。
nacl溶液是将nacl溶于ph7.6、25mmol/l的tris-hcl缓冲液得到的。本实施例中,nacl的浓度为1.5m。实际应用中,nacl的浓度为1m-2m均可。
实际应用中,2℃-16℃均可。
实际应用中,浸泡时间为10分钟-60分钟均可。
5、取完成步骤4的组织,置于去离子水中4℃浸泡(每10分钟更换去离子水,共换水9次,最后一次换水10分钟后完成本步骤)。
实际应用中,2℃-16℃均可。
实际应用中,可每5分钟-15分钟更换去离子水,共换水8次-20次。
6、取完成步骤5的组织,置于表面活性剂溶液中浸泡。
本实施例中,采用的表面活性剂溶液为3%(体积比)tween-20水溶液,4℃浸泡80分钟。
实际应用中,所述表面活性剂溶液为表面活性剂水溶液。
实际应用中,所述表面活性剂溶液中,表面活性剂的浓度为1%-5%(体积比)。
实际应用中,所述表面活性剂可为tween-20、tween-21、tween-40、tween-60、tween-61、tween-80、tween-81、tween-85、triton-100、triton-114等。
实际应用中,2℃-16℃均可。
实际应用中,浸泡时间为30分钟-120分钟。
7、取完成步骤6的组织,置于去离子水中4℃浸泡(每20分钟更换去离子水,共换水19次,最后一次换水20分钟后完成本步骤)。
实际应用中,2℃-16℃均可。
实际应用中,可每15分钟-25分钟更换去离子水,共换水15次-25次。
8、取完成步骤7的组织,置于2mnaoh水溶液中4℃浸泡30分钟。
实际应用中,可采用0.5m-4mnaoh水溶液。
实际应用中,2℃-16℃均可。
实际应用中,浸泡时间为10分钟-60分钟均可。
9、取完成步骤8的组织,置于去离子水中4℃浸泡(每5分钟更换去离子水,共换水19次,最后一次换水5分钟后完成本步骤)。
实际应用中,2℃-16℃均可。
实际应用中,可每3分钟-10分钟更换去离子水,共换水15次-25次。
10、取完成步骤9的组织,进行48小时的冷冻干燥,得到干燥的组织。
实际应用中,冷冻干燥24小时-72小时均可。
11、称取3g步骤10得到的干燥的组织,溶于150ml4℃预冷的0.5m醋酸水溶液中,4℃搅拌12小时。
实际应用中,可采用取1g-5g步骤10得到的干燥组织。
实际应用中,可采用100ml-500ml醋酸水溶液。
实际应用中,可采用0.05m-1m醋酸水溶液。
实际应用中,2℃-16℃预冷均可。
实际应用中,2℃-16℃搅拌2小时-24小时均可。
12、完成步骤11后,在体系中加入4mnaoh水溶液,调ph为7。
实际应用中,调ph为6-8均可。
13、将完成步骤12的整个体系转移到透析袋(透析袋截留分子量为3000da)中,将透析袋放入去离子水中,4℃透析7天(每天更换去离子水3次)。
实际应用中,可采用截留分子量为1000da-100kda的透析袋。
实际应用中,2℃-16℃均可。
实际应用中,透析3天-10天均可。
14、完成步骤13后,收集透析袋内的整个体系,进行48小时的冷冻干燥,得到干粉,即为干粉状胶原材料。
实际应用中,冷冻干燥24-72小时均可。
粉状胶原材料在显微镜下的照片见图1,为胶原细丝组成的多孔结构。
15、取3g步骤14得到的干粉,用100ml生理盐水溶解,得到凝胶状胶原材料。
实际应用中,也可采用磷酸盐缓冲液代替生理盐水作为溶剂。
实际应用中,干粉和溶剂的配比为可:0.2-4g:100ml。
凝胶状胶原材料的照片见图2,为乳白色凝胶状。
实施例2、制备骨髓间充质干细胞
1、颈椎脱臼法处死sd大鼠,取双侧股骨及胫骨,用不含血清的dmem培养液冲洗骨髓腔并收集液相,即为骨髓液。
2、将1体积份骨髓液缓慢加入到1体积份淋巴细胞分离液中,室温、2000rpm离心20min(离心管内液体分为3层,单核细胞富集于中间层),取中间层,用5mlpbs缓冲液重悬,然后1200rpm离心6min,收集细胞沉淀。
3、取步骤2收集的细胞,用干细胞培养液悬浮,得到细胞悬液。
4、将步骤3得到的细胞悬液接种至t25细胞培养瓶(每个细胞培养瓶约接种6×107个细胞)中,置于37℃、5%co2、95%饱和湿度的培养箱中培养36小时(实际应用中,培养24-48小时均可)。
5、完成步骤4后,用pbs缓冲液洗涤(除去未贴壁的造血细胞),采用干细胞培养液(每隔2~3天更换新的干细胞培养液)、置于37℃、5%co2、95%饱和湿度的培养箱中培养,直至达到70%~80%的汇合度。
6、完成步骤5后,用pbs缓冲液洗涤,然后用消化液消化并收集细胞,即为原代骨髓间充质干细胞。
7、进行持续传代。原代骨髓间充质干细胞传代得到第1代骨髓间充质干细胞,第1代骨髓间充质干细胞传代得到第2代骨髓间充质干细胞,第2代骨髓间充质干细胞传代得到第3代骨髓间充质干细胞。
每次传代的方法均为:用消化液消化细胞,然后用干细胞培养液悬浮,然后接种至细胞培养瓶中,然后将培养瓶置于37℃、5%co2、饱和湿度的培养箱中静置培养,直至达到70%~80%汇合度。
实施例3、胶原材料可促进骨髓间充质干细胞增殖
1、收集实施例2得到的第3代骨髓间充质干细胞,用干细胞培养液悬浮,得到细胞悬液。
2、分组处理
试验组:将250μl步骤1制备的细胞悬液(含5×103个骨髓间充质干细胞)与500μl实施例1制备的凝胶状胶原材料混合,然后加至35mm细胞培养皿中,在37℃、5%co2、饱和湿度的培养箱中进行培养。
对照组:将250μl步骤1制备的细胞悬液(含5×103个骨髓间充质干细胞)加至35mm细胞培养皿中,在37℃、5%co2、饱和湿度的培养箱中进行培养。
进行三个重复处理,结果取平均值。
在不同培养时间点(1天、3天、5天和7天)分别检测细胞数目。结果见图3。培养5天后以及培养7天后,试验组的细胞数目显著高于对照组。
在培养5天后,进行细胞周期分析,处于s期细胞的比例见图4。试验组处于s期细胞的比例显著高于对照组。
以上结果表明,与对照组(采用平皿进行二维培养)相比,试验组(采用凝胶状胶原材料进行三维培养)可以促进间充质干细胞增殖。
实施例4、胶原材料可促进骨髓间充质干细胞特性的维持
1、收集实施例2得到的第3代骨髓间充质干细胞,用干细胞培养液悬浮,得到细胞悬液。
2、分组处理
试验组:将500μl步骤1制备的细胞悬液(含105个骨髓间充质干细胞)与1ml实施例1制备的凝胶状胶原材料混合,然后加至60mm细胞培养皿中,在37℃、5%co2、饱和湿度的培养箱中进行培养。
对照组:将500μl步骤1制备的细胞悬液(含105个骨髓间充质干细胞)加至60mm细胞培养皿中,在37℃、5%co2、饱和湿度的培养箱中进行培养。
每组设置五个重复处理,后续结果取平均值。
3、检测干细胞相关基因的表达水平
步骤2中培养5天后,收集细胞,提取总rna,采用定量rt-pcr检测干细胞相关基因(rex1基因、sox2基因、oct-4基因及nanog基因)的表达情况。采用gapdh基因作为内参基因。
用于检测rex1基因的引物如下:
f:5’-aagacctttcttgccaggtt-3’;r:5’-ccaccctttagcttctctcc-3’。
用于检测sox2基因的引物如下:
f:5’-attacccgcagcaaaatgac-3’;r:5’-tttttgcgttaatttggatgg-3’。
用于检测oct-4基因的引物如下:
f:5’-ccccatttcaccacactctactc-3’;r:5’-gtgacaggaacagagggaaagg-30-3’。
用于检测nanog基因的引物如下:
f:5’-gactagcaacggcctgactca-3’;r:5’-ctgcaatggatgctgggata-30-3’。
用于检测gapdh基因的引物如下:
f:5’-gacatgccgcctggagaaac-3’;r:5’-agcccaggatgccctttagt-3’。
将对照组细胞基因的相对表达水平作为1,计算试验组细胞基因的表达倍数。
结果见图5。图5中,每组左侧的柱子对应试验组,右侧的柱子对应对照组。试验组细胞的各个干细胞基因的表达水平均显著高于对照组。
4、检测干细胞向成骨细胞的分化能力
步骤2中培养5天后,收集细胞,进行成骨诱导,分析干细胞的分化能力。
①用pbs缓冲液洗涤细胞,加入消化液进行消化(显微镜下观察,待细胞由梭形变为圆形时,用血清终止消化),然后用吸管轻轻吹打,使细胞从培养皿表面脱离下来,得到细胞悬液。
②将步骤①得到的细胞悬液转移至离心管中,1200rpm离心6分钟,弃上清,轻弹管底细胞,使其充分散开避免团块产生,用新鲜的干细胞培养基重悬,显微镜下计数,得到1×105个细胞/ml的细胞悬液,用吸管轻轻吹打混匀。
③取2ml步骤②制备的细胞悬液,加入10cm2细胞培养皿中,轻轻摇动使其散布均匀,避免细胞聚集在皿中央,置于于37℃、5%co2、饱和湿度的co2培养箱中培养至达到80%-90%汇合度。
④完成步骤③后,更换培养基为成骨诱导液,每3天半量换液一次,置于于37℃、5%co2、饱和湿度的co2培养箱中培养14天。
成骨诱导液:含10%(体积比)fbs、10-7mol/l地塞米松、10mmol/lβ-磷酸甘油、0.05mmol/l抗坏血酸,余量为高糖dmem培养基。
⑤完成步骤④后,收集细胞,提取总rna,利用定量rt-pcr检测成骨相关基因(coli基因、bsp基因和ocn基因)的表达。采用gapdh基因作为内参基因。
用于检测coli基因的引物如下:
f:5’-ggagagtactggatcgaccctaac-3’;r:5’-ctgacctgtctccatgttgca-3’。
用于检测bsp基因的引物如下:
f:5’-gtgcacatgcgtttttatca-3’;r:5’-tgctccttagacccacactc-3’。
用于检测ocn基因的引物如下:
f:5’-atctatggcaccaccgttta-3’;r:5’-tccatactttcgaggcagag-3’。
用于检测gapdh基因的引物如下:
f:5’-gacatgccgcctggagaaac-3’;r:5’-agcccaggatgccctttagt-3’。
将对照组细胞基因的相对表达水平作为1,计算试验组细胞基因的表达倍数。
结果见图6。图6中,每组左侧的柱子对应试验组,右侧的柱子对应对照组。试验组细胞进行成骨诱导后的各个成骨相关基因的表达水平均显著高于对照组。
5、检测干细胞向脂肪细胞的分化能力
步骤2中培养5天后,收集细胞,进行向脂肪细胞分化的诱导,分析干细胞的分化能力。
①用pbs缓冲液洗涤细胞,加入消化液进行消化(显微镜下观察,待细胞由梭形变为圆形时,用血清终止消化),然后用吸管轻轻吹打,使细胞从培养皿表面脱离下来,得到细胞悬液。
②将步骤①得到的细胞悬液转移至离心管中,1200rpm离心6分钟,弃上清,轻弹管底细胞,使其充分散开避免团块产生,用新鲜的干细胞培养基重悬,显微镜下计数,得到1×105个细胞/ml的细胞悬液,用吸管轻轻吹打混匀。
③取2ml步骤②得到的细胞悬液,加入10cm2细胞培养皿中,轻轻摇动使其散布均匀,避免细胞聚集在皿中央,置于于37℃、5%co2和饱和湿度的co2培养箱中培养至达到80%-90%汇合度。
④完成步骤③后,更换培养基为成脂诱导液,每3天半量换液一次,置于于37℃、5%co2和饱和湿度的co2培养箱中培养14天。
成脂诱导液:含10%(体积比)fbs、10-6mol/l地塞米松、0.5mmol/l1-甲基-3-异丁基-黄嘌呤、0.1mmol/l抗坏血酸,余量为高糖dmem培养基。
⑤完成步骤④后,收集细胞,提取总rna,利用定量rt-pcr检测成脂相关基因(pparγ基因、cfd基因和adipoq基因)的表达。采用gapdh基因作为内参基因。
用于检测pparγ基因的引物如下:
f:5’-gtggaagctgtgcaagagat-3’;r:5’-catgaatccttgtccctctg-3’。
用于检测cfd基因的引物如下:
f:5’-gatgtcctgcagcaactga-3’;r:5’-ggttgctctctgcacacat-3’。
用于检测adipoq基因的引物如下:
f:5’-taattcagagcagcccgtag-3’;r:5’-tggggataacactcagaacc-3’。
用于检测gapdh基因的引物如下:
f:5’-gacatgccgcctggagaaac-3’;r:5’-agcccaggatgccctttagt-3’。
将对照组细胞基因的相对表达水平作为1,计算试验组细胞基因的表达倍数。
结果见图7。图7中,每组左侧的柱子对应试验组,右侧的柱子对应对照组。试验组细胞进行向脂肪细胞分化的诱导后的各个成脂相关基因的表达水平均显著高于对照组。
6、检测干细胞生长因子基因的表达水平
步骤2中培养5天后,收集细胞,提取总rna,采用定量rt-pcr检测干细胞生长因子基因(igf1基因、hgf基因、vegfa基因及bfgf基因)的表达情况。采用gapdh基因作为内参基因。
用于检测igf1基因的引物如下:
f:5’-gctggtggacgctcttcagtt-3’;r:5’-tttggcaggtgttccgatgtt-3’。
用于检测hgf基因的引物如下:
f:5’-gatgtccatgagagaggcga-3’;r:5’-tcaatccagtgtagccccag-3’。
用于检测vegfa基因的引物如下:
f:5’-acagaaggggagcagaaagcccat-3’;r:5’-cgctctgaccaaggctcacagt-3’。
用于检测bfgf基因的引物如下:
f:5’-gaaccggtacctggctatga-3’;r:5’-cagttcgtttcagtgccaca-3’。
用于检测gapdh基因的引物如下:
f:5’-gacatgccgcctggagaaac-3’;r:5’-agcccaggatgccctttagt-3’。
将对照组细胞基因的相对表达水平作为1,计算试验组细胞基因的表达倍数。
结果见图8。图8中,每组左侧的柱子对应试验组,右侧的柱子对应对照组。试验组细胞各个生长因子基因的表达水平均显著高于对照组。
- 还没有人留言评论。精彩留言会获得点赞!