斑茅野生种受干旱胁迫表达的基因SaWRKY的制作方法
本发明属分子生物学技术领域,具体涉及干旱胁迫下的wrky转录因子基因sawrky,以及扩增该基因的专用引物,通过相对定量rt-pcr技术检测该蛋白基因在斑茅野生种中差异表达的方法。
背景技术
斑茅(erianthusarundinaceus(retz.)jeswiet)是甘蔗近缘野生种之一,又名大密、笆茅、大巴茅,多年生、密丛高大草本,具有分布区域广、耐干旱、耐贫瘠、分蘖能力强等优良特性,是甘蔗育种中拥有较大利用价值的材料。育种工作的成败在很大程度上取决于对育种原始材料的占有量和研究利用的广度及深度,因此,斑茅野生种质资源的收集工作深受甘蔗育种专家的重视。近年来,能源植物的研究成为全球范围内的热点,斑茅因产量高、生长快、抗逆性强、能效高以及生产成本低,符合作为能源草的特征,有研究表明斑茅有作为能源草的潜力。因此,开发利用斑茅资源,挖掘斑茅的抗旱基因,培育优异种质特性是解决当前斑茅利用和甘蔗新种质创新中所遇到问题的最佳途径,为甘蔗抗旱育种提供科学依据有着重要意义(陈健文,phillipa.jackson,劳方业,刘睿,陈勇生,邓海华.应用issr标记鉴定斑茅bc2杂种真实性[j].中国糖料,2008(01):1-3.)。
wrky转录因子家族是植物中特有的一种转录因子,也是植物中最大的转录调控因子家族之一,其中wrky结构域是wrky转录因子最突出的一个特点,这是一个在家族成员中高度保守的60个氨基酸的区域,其靠近氨基(n)末端有7个保守的氨基酸残基wrkygqk。它参与调控植物的多种进程:植物病理反应过程、生物胁迫过程、非生物胁迫过程、生长发育过程和激素合成过程。在植物病理过程中,wrky转录因子主要参与ja和sa的信号途径激活植物的抗病性,目前在水稻、拟南芥、油菜等作物中均发现wrky基因在病原真菌和激素处理(aba、ja、sa、et、细胞分裂素的一种或多种)反应应答。(eulgem,thomas,rushton,etal.thewrkysuperfamilyofplanttranscriptionfactors[j].trendsinplantscience,2000,5(5):199-206.文锋,吴小祝,廖亮,等.wrky转录因子在植物抗逆生理中的研究进展[j].广西植物,2017,37(1):69-79.)。目前在甘蔗研究上,尤其关于斑茅野生种抗旱有关的wrky基因未见报道。
技术实现要素:
本发明目的是为了提高现有栽培甘蔗品种的抗逆性,使甘蔗在干旱逆境中能高产稳产从而适应近年来气候恶化的情况,提供一个新的斑茅野生种中受干旱胁迫诱导的wrky转录因子基因,还提供一种扩增该基因的专用引物,以及一种检测该基因在斑茅野生种受干旱胁迫的差异表达的方法,从而进一步为甘蔗抗旱性育种奠定基础并提供候选基因。
本发明从受干旱胁迫的斑茅野生种中利用同源克隆技术克隆获得一个wrky转录因子基因sawrky,在ncbi数据库中比对分析,与禾本科高粱wrky基因的同源性为75%,推测该基因编码蛋白为wrky转录因子,故将该基因命名为基因sawrky。
本发明的技术方案如下:
1.斑茅野生种受干旱胁迫表达的基因sawrky,其全长核苷酸序列如seqidno:1所示。
2.扩增技术方案1所述的斑茅野生种受干旱胁迫表达的基因sawrky的专用引物,所述专用引物由上游引物gp-f和下游引物gp-r组成,所述上游引物gp-f的碱基序列如seqidno:2所示,所述下游引物gp-r的碱基序列如seqidno:3所示。
3.一种检测基因sawrky在斑茅野生种中受干旱胁迫的差异表达方法,包括干旱胁迫处理、总rna的提取、cdna第一链的合成、相对定量rt-pcr技术检测基因sawrky在斑茅野生种中受干旱胁迫的差异表达情况,其特征在于:
在相对定量rt-pcr技术检测基因sawrky在斑茅野生种中受干旱胁迫的差异表达情况中,使用的特异引物由上游引物qf和下游引物qr组成,所述上游引物qf碱基序列如seqidno:4所示,所述下游引物qr的碱基序列如seqidno:5所示;所述基因sawrky的全长核苷酸序列如seqidno:1所示。
4.根据技术方案3所述的一种检测基因sawrky在斑茅野生种中受干旱胁迫的差异表达方法,其特征在于:
在相对定量rt-pcr技术检测基因sawrky在斑茅野生种中受干旱胁迫的差异表达情况中,相对定量rt-pcr反应体系为:2×superrealpremixplus10μl,10μm上游引物qf0.6μl,10μm下游引物qr0.6μl,cdna模板1μl,50×roxreferencedye0.6μl,rnase-freeddh2o12.2μl,总体积25μl;相对定量rt-pcr反应程序:95℃预变性15min,95℃变性10s,60℃退火32s,40个循环。
5.根据技术方案3或4所述的一种检测基因sawrky在斑茅野生种中受干旱胁迫的差异表达方法,其特征在于:
在干旱胁迫处理中将伸长期的斑茅野生种设为对照组和处理组,对照组按常规供水,处理组干旱胁迫8d,所述干旱胁迫8d为连续8d不浇水。
本发明首次提出了斑茅野生种受低温干旱胁迫表达的基因sawrky,以及扩增它的专用引物、检测该基因在斑茅野生种中受干旱胁迫中差异表达的特异引物和方法。在检测中该基因在没有干旱胁迫的情况下在斑茅中少量表达,在经过干旱胁迫处理后在斑茅野生种中的表达量为对照的数倍,说明该基因在斑茅野生种受到干旱胁迫后表达量上升,且抗旱性强的斑茅野生种表达量处理前后均高于抗旱性较弱的斑茅野生种,说明所述基因sawrky属于受干旱胁迫表达的诱导型表达基因,表明基因sawrky在斑茅野生种受到干旱胁迫后能迅速的参与干旱胁迫响应过程,该基因通过表达量的上调从而调控斑茅野生种的抗旱机制。本发明为认识斑茅wrky基因的抗逆机制,以及利用斑茅野生种进行分子育种提供了技术支撑和候选基因。
本发明检测基因sawrky在斑茅野生种受干旱胁迫的差异表达的方法,所设计的特异引物在相对定量rt-pcr中特异性强,无杂带产生,熔解曲线显示无引物二聚体产生。在内参基因的选择上,主要以25srrna,actin两内参,而本试验选择最合适甘蔗的内参25srrna,其稳定性更高。本相对定量rt-pcr采用sybrgreeni嵌合荧光法进行,具有特异性强,灵敏度高,重复性好等特点。
序列表中seqidno:1所示的是基因sawrky的全长核苷酸序列。
序列表中seqidno:2所示的是扩增基因sawrky的上游引物gp-f的碱基序列。
序列表中seqidno:3所示的是扩增基因sawrky的下游引物gp-r的碱基序列。
序列表中seqidno:4所示的是特异引物的上游引物qf的碱基序列。
序列表中seqidno:5所示的是特异引物的下游引物qr的碱基序列。
序列表中seqidno:6所示的是内参基因25srrna的上游引物25s-f的碱基序列。
序列表中seqidno:7所示的是内参基因25srrna的下游引物25s-r的碱基序列。
附图说明
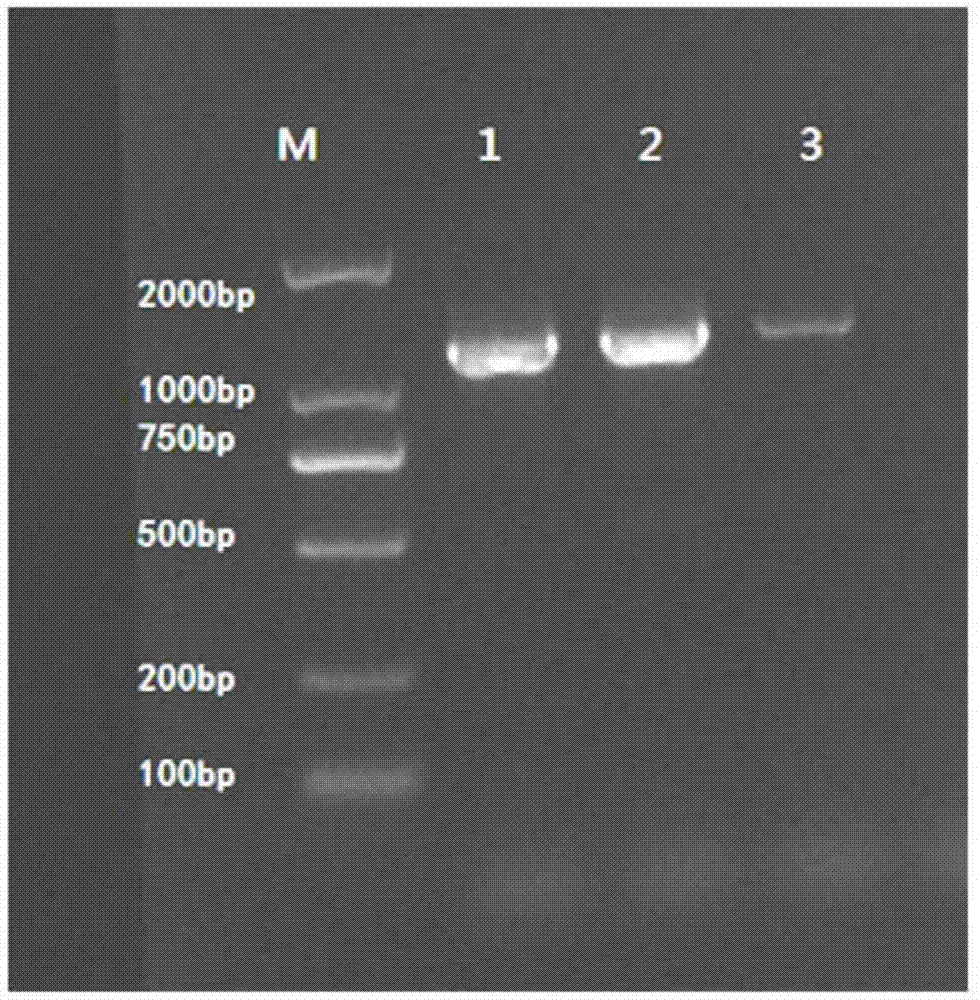
图1:基因sawrky的扩增结果。图1中,m:maker;泳道1、泳道2、泳道3分别为退火温度57℃、58℃、60℃下的扩增产物。
图2:相对定量rt-pcr技术检测基因sawrky在不同斑茅材料受干旱胁迫的差异表达图。图2中,纵坐标表示基因sawrky的相对表达量,横坐标表示不同处理下不同斑茅材料的名称。90-14表示对照组斑茅90-14(抗旱性强的斑茅),90-14t表示干旱处理组斑茅90-14,82-53表示对照组云南82-53(抗旱性较弱的斑茅),82-53t表示干旱处理组云南82-53。
图3:rt-pcr技术检测基因sawrky中所用的特异引物为上游引物qf和下游引物qr在不同退火温度下的检测结果。m:maker;泳道1、泳道2、泳道3、泳道4、泳道5、泳道6均是以斑茅90-14的cdna为模板在泳道1-2的退火温度为57℃、泳道3-4的退火温度为58℃、泳道5-6的退火温度为60℃下的扩增产物。
具体实施方式
以下实施例用于对本发明作进一步说明,各实施例中无特殊说明的为常规方法。
实验材料:根据前期生理指标的测定,筛选出抗旱性强的斑茅90-14,抗旱性较弱的云南82-53两个不同无性系斑茅野生种材料,将云南82-53和斑茅90-14种植于云南农业大学甘蔗研究所的甘蔗资源圃内(云南昆明,海拔1950m)。
参考文献:
斑茅90—14材料文献:[1]杨清辉,李富生,肖凤回,何顺长.斑茅染色体和植物学性状观察研究[j].云南农业大学学报,1997(04):253-256.(斑茅90—14见附表)。
云南82—53材料文献:[1]蔡青.甘蔗近缘属斑茅、滇蔗茅遗传多样性与种质创新研究[d].云南大学,2013.12.01.(云南82—53见表2-1研究材料栏编号39,表3-1序号8)。
斑茅90—14、云南82—53两个斑茅材料可采集或通过本申请人获得,本申请人云南农业大学地址:云南省昆明市盘龙区沣源路452号,邮编650201。
实施例1斑茅野生种受干旱胁迫表达的基因sawrky的获得:
一、设计扩增斑茅野生种受干旱胁迫表达的基因sawrky全长序列的专用引物
根据前期试验获得的斑茅材料的高通量转录组测序数据,进行生物信息学分析筛选,利用生物软件primer5.0、oligo7设计扩增基因sawrky的专用引物,该专用引物由上游引物gp-f和下游引物gp-r组成,所述上游引物gp-f的碱基序列如seqidno:2所示,所述下游引物gp-r的碱基序列如seqidno:3所示,该专用引物送上海生工公司合成。
二、干旱处理的斑茅野生种叶片的总rna提取。
(1)干旱胁迫处理:将斑茅90-14和云南82-53两种斑茅材料的植株分别按常规种植于各花盆,每种材料分为对照组和处理组,对照组和处理组的每种材料均设三个重复。对照组按常规浇水,处理组干旱胁迫8d,所述干旱胁迫8d是:先与对照组相同按常规浇水,当种植的材料进入伸长期时连续8d不浇水,后采集其两种斑茅野生种植株的叶片,同时采集两个对照组斑茅野生种植株的叶片,采样时间均为上午8:30-9:30。所述伸长期是指蔗株自开始拔节至伸长基本停止。当处理组干旱胁迫8d时,花盆内的土壤含水量下降了20%,认为达到了重度干旱胁迫。
(2)将对照组的云南82-53、对照组的斑茅90-14、处理组的云南82-53、处理组的斑茅90-14的叶片分别置于研钵中加液氮快速磨碎,每100mg样品加入1mltrizol提取液,涡旋振荡15s。每个样品在15~30℃放置5min;加入氯仿,氯仿的用量为每使用1mltrizol加入200μl氯仿,盖好管盖,涡旋振荡15s,15~30℃放置3min。
(3)4℃,12000rpm离心15min,此时溶液分为三层:黄色的是有机相,中间层和上层无色的是水相,rna主要存在水相中,把水相转移至另一新的无rnase离心管中。
(4)向得到的水相中加入等体积的异丙醇,混匀,15~30℃放置20-30min。
(5)4℃,12000rpm离心10min,弃上清。
(6)加入用rnase-freeddh2o配制的体积分数为75%的乙醇洗涤沉淀,用量为每使用1mltrizol用1mlrnase-freeddh2o配制的体积分数为75%的乙醇。
(7)4℃,5000rpm离心3min,用枪头小心吸出上层液体,保留沉淀。
(8)沉淀在15~30℃晾干2-3min,加入30-100μl无rnase的双蒸水,充分溶解沉淀后,溶解后的即为该样品的总rna。
三.cdna第一链的合成
(1)将模板rna在冰上解冻;5×gdnabuffer、fq-rtprimermix、10×fastrtbuffer、rnase-freeddh2o在室温(15-25℃)解冻,解冻后迅速置于冰上。使用前将每种溶液涡旋振荡混匀,简短离心(转速6000rpm,30s)以收集残留在管壁的液体。为了保证反应液配制的准确性,进行各项反应时,先配制成mix,然后再分装到每个反应管中。
(2)按照以下体系进行rna中的gdna去除体系配制混合液,彻底混匀。简短离心(转速6000rpm,30s),并置于42℃,孵育3min。然后置于冰上放置。
gdna去除反应体系:
5×gdnabuffer2μl
totalrna2μl
rnase-freeddh2o补足到10μl。
(3)按照以下体系的反转录反应体系配制混合液:
反转录反应体系:
(4)将反转录反应中的mix,加到gdna去除步骤的反应液中,充分混匀。42℃,孵育15min,95℃,孵育3min之后放于冰上,得到cdna用于后续实验,或低温-20℃保存。
四、斑茅野生种受干旱胁迫表达的基因sawrky的扩增
以步骤三(4)反转录获得的cdna作为pcr反应的模板,以步骤一中设计的专用引物作为pcr反应引物,扩增斑茅90-14叶片中受干旱胁迫表达的基因sawrky全长(见图1),pcr反应体系:template1μl;上游引物gp-f1μl;下游引物gp-r1μl;buffer2μl;dntp2μl;pfu酶0.5μl;ddh2o补足到20μl,总体积为20μl。pcr反应程序为:95℃预变性2min;95℃变性30s,60℃退火30s72℃延伸2min,35个循环;72℃,6min,后4℃保存。
五、目的基因的回收(用百泰克生物公司提供的多功能dna纯化回收试剂盒回收目的基因)
pcr产物经1%琼脂糖凝胶电泳,将凝胶中的目的条带进行胶回收,胶回收使用天根的胶回收试剂盒进行,包括步骤如下:
(1)在紫外灯下将目的条带胶块切下,尽量将不含dna片段的空白凝胶去掉后放入1.5ml离心管中。
(2)按每100μl胶块加入500μl溶胶液db的比例向胶块中加入溶胶液,置60℃溶胶约10min,期间不断摇动。
(3)胶块完全溶解后将溶胶液转移到吸附柱中,18~22℃,12000rpm离心30s,去掉废液。
(4)向吸附柱中加入500μl漂洗液wb,18~22℃,12000rpm离心30s,倒掉废液。
(5)重复步骤(4),倒掉废液后的离心管12000rpm离心2min完全去掉废液,保留吸附柱。
(6)将吸附柱移至干净的1.5ml的离心管中,18~22℃放置2min使其残存于漂洗液中乙醇的挥发干。
(7)向吸附柱膜中央加入30μl-50μl的洗脱缓冲液,18~22℃放置1-2min,12000rpm离心2min洗脱dna,离心管内收集的从吸附柱膜上洗脱的溶液即是目的片段的纯化产物回收液。
另外,还设置了两个不同退火温度的实验,该两个实验除上述步骤四中pcr反应程序中的退火温度分别为:57℃、58℃外,其余步骤均与上述步骤相同。
扩增结果如图1所示,以干旱处理后的斑茅野生种斑茅90-14的cdna为模板,其在退火温度为60℃时,扩增效果最好,无杂带产生。对扩增片段进行切胶回收后,经测序该回收片段序列与转录组获得的unigen序列一致,即该回收产物为斑茅野生种叶片受干旱胁迫表达的基因sawrky,该回收产物的测序结果如序列表中seqidno:1所示。
实施例2本发明所提供的一种检测基因sawrky在斑茅野生种中受干旱胁迫的差异表达方法,包括以下步骤:
一、干旱胁迫处理:
将斑茅90-14和云南82-53两种斑茅材料的植株分别按常规种植于各花盆,每种材料分为对照组和处理组,对照组和处理组的每种材料均设三个重复。对照组按常规浇水,处理组干旱胁迫8d,所述干旱胁迫8d是:先与对照组相同按常规浇水,当种植的材料进入伸长期时连续8d不浇水,后采集其两种斑茅野生种植株的叶片,同时采集两个对照组斑茅野生种植株的叶片,采样时间均为上午8:30-9:30。采集的各份材料的叶片均按下述方法进行。所述伸长期是指蔗株自开始拔节至伸长基本停止。当处理组干旱胁迫8d时,花盆内的土壤含水量下降了20%,认为达到了重度干旱胁迫。
二、总rna的提取
(1)将采集的叶片置于研钵中加液氮快速磨碎,每100mg样品加入1mltrizol提取液,涡旋振荡15s。每个样品在15~30℃放置5min;加入氯仿,氯仿的用量为每使用1mltrizol加入200μl氯仿,盖好管盖,涡旋振荡15s,15~30℃放置3min;4℃,12000rpm离心15min,此时溶液分为三层:黄色的是有机相,中间层和上层无色的是水相,rna主要存在水相中,把水相转移至另一新的无rnase离心管中。
(2)向得到的水相中加入等体积的异丙醇,混匀,15~30℃放置20-30min;4℃,12000rpm离心10min,弃上清。
(3)加入用rnase-freeddh2o配制的体积分数为75%的乙醇洗涤沉淀,用量为每使用1mltrizol用1mlrnase-freeddh2o配制的体积分数为75%的乙醇;4℃,5000rpm离心3min,用枪头小心吸出上层液体,保留沉淀。
(4)沉淀在15~30℃晾干2-3min,加入30-100μl无rnase的双蒸水,充分溶解沉淀后,溶解后的即为该样品的总rna于-70℃保存。
三.cdna第一链的合成
(1)将模板rna在冰上解冻;5×gdnabuffer、fq-rtprimermix、10×fastrtbuffer、rnase-freeddh2o在室温(15-25℃)解冻,解冻后迅速置于冰上。使用前将每种溶液涡旋振荡混匀,简短离心(转速6000rpm,30s)以收集残留在管壁的液体。为了保证反应液配制的准确性,进行各项反应时,先配制成mix,然后再分装到每个反应管中。
(2)按照以下体系进行rna中的gdna去除体系配制混合液,彻底混匀。简短离心(转速6000rpm,30s),并置于42℃,孵育3min。然后置于冰上放置。
gdna去除反应体系:
5×gdnabuffer2μl
totalrna2μl
rnase-freeddh2o补足到10μl。
(3)按照以下体系的反转录反应体系配制混合液:
反转录反应体系:
(4)将反转录反应中的mix,加到gdna去除步骤的反应液中,充分混匀。42℃,孵育15min,95℃,孵育3min之后放于冰上,得到cdna用于后续实验,或低温-20℃保存。
四、相对定量rt-pcr技术检测基因sawrky在斑茅野生种中受干旱胁迫的差异表达情况,实验在abi公司7500荧光量pcr仪上进行,对处理组前后的基因表达情况进行分析(见图2)。
(1)相对定量rt-pcr反应体系:
基因sawrky的相对定量rt-pcr反应体系的配置:
上游引物qf的碱基序列如seqidno:4所示,下游引物qr的碱基序列如seqidno:5所示。
内参基因25srrna的rt-qpcr反应体系的配置:
上游引物25s-f的碱基序列如seqidno:6所示,下游引物25s-r的碱基序列如seqidno:7所示。
(2)相对定量rt-pcr反应程序:95℃预变性15min,95℃变性10s,60℃退火32s,40个循环。试验数据在abi公司7500荧光定量pcr仪上进行分析。
另设以处理组的斑茅90-14的cdna模板在rt-pcr反应程序中仅退火温度分别为57℃、58℃、60℃,特异引物为上游引物qf和下游引物qr,其余操作步骤与本实施例1对应的步骤相同的实验,发现该特异引物为上游引物qf和下游引物qr具有特异性(见图3)。
结果分析:相对定量rt-pcr检测基因sawrky在没有干旱胁迫的情况下在斑茅中少量表达,在经过干旱胁迫处理后在斑茅野生种中的表达量均为对照的4倍以上,说明该基因sawrky在斑茅野生种受到干旱胁迫后表达量上升,且抗旱性强的斑茅野生种表达量处理前后均高于抗旱性较弱的斑茅野生种,基因sawrky属于受干旱胁迫表达的诱导型表达基因,表明基因sawrky在斑茅野生种中受到干旱胁迫后能迅速的参与干旱胁迫响应过程,该基因sawrky通过表达量的上调从而调控斑茅野生种的抗旱机制。
序列表
<110>云南农业大学
<120>斑茅野生种受干旱胁迫表达的基因sawrky
<160>7
<170>siposequencelisting1.0
<210>1
<211>1221
<212>dna
<213>斑茅(erianthusarundinaceus(retz.)jeswiet)
<400>1
tacgaggcgctgcggagccagtacacggagatggtggccgcgggcacgacgggcgggaac60
aacccgtcgtccacgtcggagggcgggtccgtgtcgccgtcgcggaagcgcaagagcgag120
agcatggacaccgcgccggcgccggccccggccccgggcgccgcgcagcaccctggcacg180
cacccgcacccgcacccggcggtgccggaccagacggagtgcacctccggcgagccgtgc240
aagcgcatccgggaggagtgcaagcccaaggtgtcgaagctgtacgtgcacgcggacccc300
gccgacctcagcctggtggtgaaggacggctaccagtggcgcaagtacgggcagaaggtg360
accaaggacaacccctgcccgagggcatacttccgctgctccttcgccccggcctgcccc420
gtcaagaagaaggtgcagcggagcgccgacgacacctccatcctcgtggccacgtacgag480
ggcgagcacaaccacggccagcccccgccggcgccggcgcaggcgcacgacggctcgggc540
gccagcaagaacgcctccgccgcgaagccgccgtcgccgccgaggccagccgctgccgcc600
gccccggcgccgcaccacccgcagctccaccaacaccaccgccaacagcagcagcagcaa660
gacgctgtcgcgatgaacggcgagcccgtgggcgcggcggccgcggcggcgtcggagatg720
atccggcggaacctcgcggagcagatggcgatgacgctgacgcgggaccccagcttcaag780
gcggcgctcgtcaccgcgctgtccggccggatcctcgagctgtcgccgaccaaagattga840
cagacgcatcggaacgggtcgattggcaccacacgcacacgagattcttgctcagattgt900
catgcacgcacgcacgcggcaatggtcaacttcgcttggccttccacagttccactgctg960
gctgcctcccctgttcactgatcactgttagagcgaaacagcgataacagaacaagacac1020
gagggtctgcagttctgcttctgcacgaggaggaacagagcgcggccgggcatggcgtgg1080
accagagatcatcacgccggggccgaaatactagcacaggaaaacaacatgaaattgcac1140
aatcccttgtactgttgtagttgtaggcgaacttgttcatccaattgatcaaatgaaatc1200
attataatttttttctccgtt1221
<210>2
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>2
gagccagtacacggagat18
<210>3
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>3
cttgttctgttatcgctgtt20
<210>4
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>4
tcaacttcgcttggccttcc20
<210>5
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>5
atgatctctggtccacgcca20
<210>6
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>6
ataaccgcatcaggtctccaag22
<210>7
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>7
cctcagagccaatccttttcc21
- 还没有人留言评论。精彩留言会获得点赞!