白花蛇舌草多糖在制备肠道菌群调节药物中的应用的制作方法
本发明涉及肠道菌群调节药物领域,具体涉及白花蛇舌草多糖提取物在制备肠道菌群调节药物及在制备黄酮类抗肿瘤药物辅助药物方面的应用。
背景技术
白花蛇舌草为茜草科植物耳草属的一年生披散草本植物,《中华人民共和国药典》(2015版)一部附录中描述其为茜草科植物白花蛇舌oldenlandiadiffusa(willd.)roxb的干燥全草。其味苦、甘,性寒,归心、肝、脾经,具有清热解毒,利尿消肿,抗癌止痛的功效。
黄酮类成分是白花蛇舌草中含量较高的有效提取部位,研究认为其抗肿瘤作用机制与干扰肿瘤细胞能量代谢,诱导肿瘤细胞凋亡等有关。周忆新等研究表明白花蛇舌草总黄酮对人肝癌细胞hepg-2有抑制增殖作用。杨娴等研究表明fod(白花蛇舌草总黄酮)能有效抑制黑色素瘤a375和b16细胞增殖,诱导细胞凋亡。张硕等采用mtt法表明fod在体外、体内均具有抑制肝癌细胞的作用。邓雪清等研究表明fod对鼻咽癌细胞株cne1具有抑制增殖作用,其作用机制可能与诱导细胞凋亡有关。除抗肿瘤作用之外,白花蛇舌草黄酮抗氧化功能机免疫功能等,李明通过体外实验研究表明白花蛇舌草多糖有良好的清除氧自由基和羟自由基的能力而具有体外抗氧化活性。王转子等研究表明白花蛇舌草多糖通过提高sod活力和对负氧自由基的清除作用及抗脂质过氧化作用来抵抗衰老。蒋剑平等通过dpph清除率、总的抗氧化活性和还原能力测定等体外抗氧化试验表明白花蛇舌草多糖对体外有较强的抗氧化能力,对自由基有较好的清除作用。王宇翎等通过实验表明白花蛇舌草总黄酮有增强机体特异性免疫功能和非特异性免疫功能的作用。杨培民研究认为多糖成分可提供肠道菌群所需糖源,恢复肠道益生菌数量和活力,可增强机体的全身免疫反应,提高机体免疫系统功能。
黄酮类化合物对癌症、心脏病、中风等疾病的治疗起着十分重要的作用。黄酮类物质常与糖结合成苷类,仅有小部分以游离形式存在,其口服生物利用度低,在肠道内滞留时间长,绝大多数需经肠道细菌酶分解为次生苷、苷元或其他代谢产物而发挥疗效。
临床上白花蛇舌草主要用于抗肿瘤、抗菌消炎作用,其多糖和黄酮类物质均为发挥药效作用的活性成分,通过集中探索二者单体成分的研究成果,发现其在药效发挥上具有不同程度的一致性,而大量研究只针对白花蛇舌草黄酮和多糖的单体成分,对二者间是否存在相互作用的报导寥寥无几。
技术实现要素:
针对现有技术中的问题,本发明针对白花蛇舌草多糖与白黄蛇舌草黄酮提取物之间的作用关系进行了研究。通过药代动力学实验表明,白花蛇舌草多糖对荷瘤大鼠的肠道菌群具有调节作用,能够帮助疾病状态的大鼠增强对黄酮苷类物质的吸收,可用于制备肠道菌群调节药物或黄酮苷类抗肿瘤药物的辅助用药。为了实现以上目的,本发明提供以下方案:
本发明的第一方面,提供一种白花蛇舌草多糖的提取方法,步骤如下:
(1)将白花蛇舌草加水浸泡一段时间后,加热至一定温度回流提取,将提取液合并过滤离心,取上清液减压浓缩。
(2)向上清液中加入乙醇使溶液中的醇达到一定浓度,静置一段时间离心将滤液浓缩,继续加醇使滤液中的醇含量升高,静置后离心取沉淀部分,经冷冻干燥得到白花蛇舌草多糖粗品。
(3)向白花蛇舌草多糖粗品中加入鞣酸沉淀后再加入活性炭升温脱色,以除去蛋白质和色素等杂质。通过超滤技术截留一定分子量的多糖,然后采用deae-32离子交换层析和superdex30凝胶层析去除无机盐和小分子糖等杂质,制得白花蛇舌草多糖。
优选的,上述提取方法中,步骤(1)中白花蛇舌草加入10-20倍体积的水浸泡1-3h,加热至70-90℃,提取1-5次,每次1-3h,过滤离心,取上清液减压浓缩。
优选的,步骤(2)中向浓缩后的上清液中加入无水乙醇至溶液中的乙醇含量达到30-50%,静置10-14h,离心后取滤液部分浓缩,继续加入乙醇至醇含量达到70-90%,静置10-14h,离心后保留沉淀部分,通过冷冻干燥得到白花蛇舌草多糖粗品。
优选的,步骤(3)中向得到的白花蛇舌草多糖粗品中加入1%的鞣酸除去蛋白质沉淀,并加入0.5%(g·ml-1)活性炭升温至70-90℃保温脱色。脱色完成后过滤将滤液转移至超滤罐中,截留分子量<10k的多糖。
本发明第二方面,提供上述制备方法得到的白花蛇舌草多糖。
本发明第三方面,提供一种白花蛇舌草黄酮苷的提取方法,步骤如下:将白花蛇舌草干品加入乙醇溶液回流提取。优选的,将白花蛇舌草干品加入12-16倍量的乙醇溶液回流提取1-3次,每次2-4h。其中,乙醇溶液的浓度为73%。
本发明第四方面,提供上述白花蛇舌草黄酮提取方法得到的白花蛇舌草黄酮苷。其中,芦丁、异槲皮苷、槲皮苷平均提取量分别为2.529,0.435,0.215mg·g-1。
本发明的第五方面,提供上述白花蛇舌草多糖在制备调节肠道菌群药物中的应用。优选的,上述肠道菌群药物为针对肿瘤患者的肠道菌群药物。
本发明的第六方面,提供上述白花蛇舌草多糖在制备抗肿瘤药物辅助药物方面的应用。
优选的,上述抗肿瘤药物为黄酮苷类药物。
优选的,上述辅助药物为帮助抗肿瘤药物吸收的药物。
本发明的第七方面,提供上述白花蛇舌草多糖与白花蛇舌草黄酮苷联用在制备抗肿瘤药物、抗炎药物、抗氧化药物方面的应用。本领域公知,白花蛇舌草黄酮苷具有抗肿瘤、消炎抗氧化提高免疫力等多重功效,本发明研究发现白花蛇舌草多糖干预后,机体对黄酮苷类成分的吸收出现了显著提高。本领域技术人员毫无疑问可以将两者联合进行用药,实现药效的提高。
优选的,上述白花蛇舌草多糖与白花蛇舌草黄酮苷的给药剂量为20mg/kg。
本发明的有益效果
本发明通过研究首次发现了白花蛇舌草多糖对白花蛇舌草黄酮苷类的物质的促进吸收作用。通过对大鼠肠道菌群lefse分析及大鼠药物代谢动力学的研究发现,与荷瘤大鼠相比,经白花蛇舌草多糖干预后肠道菌群差异主要集中在厚壁菌门、疣微菌门两大菌门以及其他纲、目、科、属下菌群变化,并在一定程度上可使荷瘤大鼠丰富度下降的肠道菌群提高,或降低荷瘤大鼠因病理状态而上调的肠道菌群丰富度,揭示多糖类成分对肿瘤病理状态发生变化的肠道菌群具有一定程度的改善作用。
附图说明
构成本申请的一部分的说明书附图用来提供对本申请的进一步理解,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。
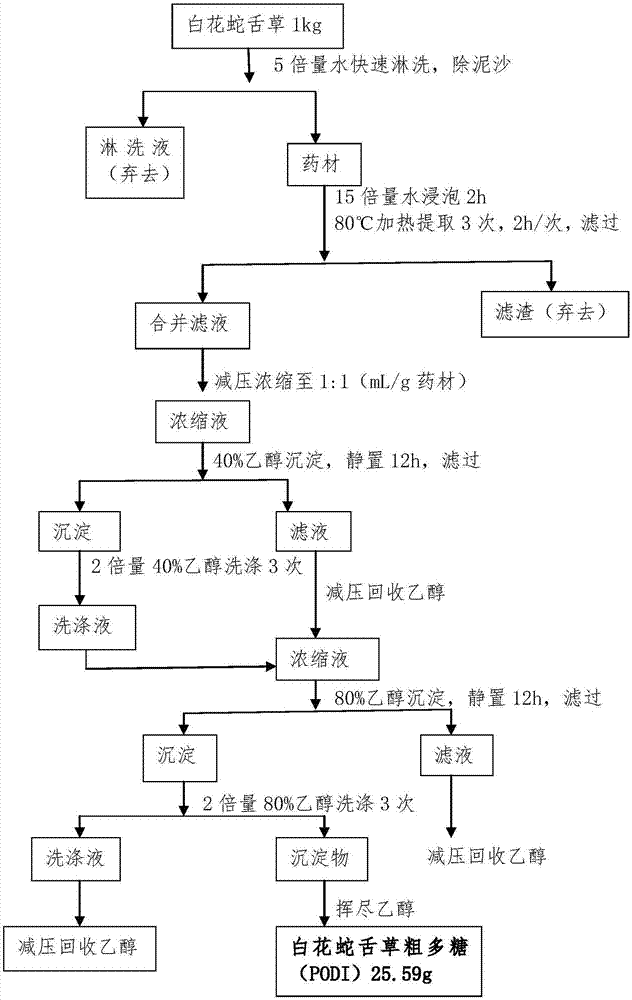
图1白花蛇舌草多糖提取工艺流程图;
图2白花蛇舌草多糖精制工艺流程图;
图3正常大鼠、荷瘤大鼠及经多糖干预后的荷瘤大鼠灌胃白花蛇舌草总黄酮提取物体内芦丁、槲皮苷、异槲皮苷浓度-时间曲线图;
其中图3a为正常大鼠、荷瘤大鼠及多糖干预后的大鼠体内芦丁代谢变化图,图3b为正常大鼠、荷瘤大鼠及多糖干预后的大鼠体内槲皮苷代谢变化图,图3c为正常大鼠、荷瘤大鼠及多糖干预后的大鼠体内异槲皮苷代谢变化图。
图4荷瘤大鼠与经多糖干预后荷瘤大鼠肠道菌群lefse树形图;
图5荷瘤大鼠与经多糖干预后荷瘤大鼠肠道菌群lda条形图;
图6荷瘤大鼠与经多糖干预后荷瘤大鼠肠道菌群otu分析柱形图;
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
正如背景技术所介绍的,现有技术中关于白花蛇舌草多糖与白花蛇舌草黄酮类之间的作用关系的研究还处于空白,针对如上的技术问题,本发明对上述两者的关系进行了研究,申请提出了白花蛇舌草多糖在制备黄酮苷类抗肿瘤药物辅助药物中的应用。
为了使得本领域技术人员能够更加清楚地了解本申请的技术方案,以下将结合具体的实施例与对比例详细说明本申请的技术方案。
实施例1白花蛇舌草多糖的制备
白花蛇舌草多糖干品1kg加5倍量的水快速淋洗,除去泥沙。之后加入15倍量水浸泡2h,加热至80℃,提取3次,每次2h;滤过,离心,上清液减压浓缩药材体积一倍量,加乙醇使含醇量达40%洗涤两次,静置12h,离心,滤液浓缩,加乙醇使含醇量达80%,静置12h,离心取沉淀,冷冻干燥得白花蛇舌草多糖粗品。然后以1%鞣酸沉淀法和0.5%(g·ml-1)活性炭(80℃保温,脱色3次,0.5h/次)吸附法去除蛋白质和色素等杂质,通过超滤技术截留分子量<10k的多糖,采用deae-32离子交换层析和superdex30凝胶层析去除无机盐和小分子糖等杂志,最终得高纯度精制多糖1.9g(图1、2)。
实施例2白花蛇舌草黄酮提取物的制备
白花蛇舌草干品加入14倍量73%乙醇回流提取2次,每次1.50h;芦丁、异槲皮苷、槲皮苷平均提取量分别为2.529,0.435,0.215mg·g-1。
实施例3荷瘤大鼠及多糖干预后黄酮苷体内药代动力学研究
1.sd大鼠walker-256皮下肿瘤模型建立
1.1实验瘤株和动物
细胞株来源:walker-256肿瘤细胞,来源于中国典型培养物保藏中心。
动物来源:sd大鼠,雄性,spf级,体重(70±20)g,济南朋悦实验动物繁育有限公司,动物许可证号:scxk(鲁)20140007。于山东中医药大学附属医院清洁级动物实验室喂养。动物室室温(25±2)℃、相对湿度55%及12h昼夜交替节律环境下分笼饲养,自由饮水、进食。
1.2皮下瘤模型制作
取40只sd大鼠,70±20g,均以大鼠右下腹股沟处皮肤为肿瘤接种部位,于大鼠左下腹皮肤消毒,腹腔注射10%水合氯醛0.2~0.3ml麻醉。将备用的腹水瘤细胞用pbs清洗一次,离心,1000r·min-1,10min,弃上清液,计数活细胞,加入pbs调整细胞悬液密度至1×107,用lmlbd注射器抽取细胞悬液0.2~0.4ml,放入装有冰袋的塑料保鲜盒中,备用。于sd大鼠消毒后的右下腹股沟处,缓慢注入细胞悬液,并压迫注射针孔处,防止细胞悬液漏出。正常饲养sd大鼠,观察肿瘤生长状况及大鼠形态。
2.白花蛇舌草黄酮苷在荷瘤大鼠体内药代动力学研究
取6只皮下肿瘤大鼠(编号z1-z6),于实验前12h禁食不禁水。灌胃白花蛇舌草总黄酮提取物,剂量20mg/kg。给药前取空白血,并分别于给药后0.083、0.25、0.5、0.75、1、1.5、2、4、6、8、12、24h眼内眦取血,每次约0.8ml,置于预先肝素化的1.5mlep离心管中,经4500r·min-1高速离心10min后分离血浆,分取100μl置于1.5mlep离心管中,于-80℃冷冻储藏。处理血浆样品,并建立随行标曲,所得数据采用das2.0软件,以非房室模型计算拟合药代动力学参数,并于正常大鼠比较各参数差异。结果见表1。
表1荷瘤大鼠灌胃白花蛇舌草总黄酮提取物体内芦丁、槲皮苷、异槲皮苷主要药代动力学参数(n=6)
与正常大鼠黄酮苷药代动力学参数比较,荷瘤大鼠灌胃相同剂量白花蛇舌草总黄酮提取物后,其药物最大浓度(cmax)、曲线下面积(auc0-∞)均明显降低,半衰期(t1/2z)延长,且三种成分在24h后仍能检测到,代谢时间延长,揭示病理状态下对黄酮苷药代动力学特征造成的影响。
3.白花蛇舌草黄酮苷在经多糖干预后荷瘤大鼠体内药代动力学研究
取12只皮下肿瘤大鼠,灌胃白花蛇舌草多糖干预15天后,取其中6只(编号zd1-zd6),于实验前12h禁食不禁水。灌胃总黄酮提取物,剂量20mg/kg,给药前取空白血,并分别于给药后0.083、0.25、0.5、0.75、1、1.5、2、4、6、8、12、24h眼内眦取血,每次约0.8ml,置于预先肝素化的1.5mlep离心管中,经4500r/min高速离心10min后分离血浆,分取100μl置于1.5mlep离心管中,于-80℃冷冻储藏。处理血浆样品,并建立随行标曲,所得数据采用das2.0软件,以非房室模型计算拟合药代动力学参数,并与荷瘤大鼠比较各参数差异。结果见表2。
表2经多糖干预后的荷瘤大鼠灌胃白花蛇舌草总黄酮提取物体内芦丁、槲皮苷、异槲皮苷主要药代动力学参数(n=6)
与荷瘤大鼠黄酮苷药代动力学参数比较,经多糖干预后的荷瘤大鼠灌胃相同剂量白花蛇舌草总黄酮提取物后,其药物最大浓度(cmax)、曲线下面积(auc0-∞)均有一定程度的增长,但半衰期变化不明显,三种成分在24h后仍能检测到,代谢时间长,揭示多糖可能对黄酮苷药代动力学参数有一定影响。
4.白花蛇舌草总黄酮提取物芦丁、槲皮苷、异槲皮苷在正常大鼠、荷瘤大鼠、经多糖干预后的荷瘤大鼠体内药代动力学特征比较
白花蛇舌草三种黄酮苷物质在荷瘤大鼠体内代谢药时曲线下面积、达峰浓度均小于正常大鼠,半衰期、清除率均高于正常大鼠,揭示荷瘤大鼠肠道菌群失衡黄酮苷药代动力学特征的影响;经白花蛇舌草多糖灌胃一段时间后,荷瘤大鼠的黄酮苷物质在体内代谢药时曲线下面积、达峰浓度有一定程度增高,揭示荷瘤大鼠经多糖灌胃调节后,可能在一定程度上改善肠道菌群功能,从而提高黄酮苷代谢吸收能力(图3)。
实施例4荷瘤状态及白花蛇舌草多糖对大鼠肠道菌群影响研究
1.实验材料
实验动物及分组:将同一批sd大鼠分为两组,分别为荷瘤大鼠组(6只,编号为z1-z6);经多糖灌胃后的荷瘤大鼠组(6只,编号为zd1-zd6)。荷瘤大鼠造模方法同上,待荷瘤大鼠造模成功后,分别灌胃荷瘤大鼠组z2ml生理盐水,经多糖干预后的荷瘤大鼠组zd灌胃2ml白花蛇舌草多糖(剂量为20mg/kg),均连续灌胃15天。
2.动物粪便的采集
待两组大鼠灌胃15天后,采用拎尾法对所有大鼠采集新鲜粪便,每个样本重量需>1g,并迅速转移至无菌粪便采集管中,分别编号记录,冻存于-80℃备用。3.多糖干预荷瘤大鼠后肠道菌群差异分析
3.1多糖干预荷瘤大鼠后肠道菌群lefse分析
如图4,z代表肿瘤大鼠,zd代表经多糖干预后的荷瘤大鼠菌群分布,经多糖干预后的荷瘤大鼠肠道菌群物种有少部分恢复,即多糖可一定程度上调节因病理状态造成的肠道菌群改变,如图4所示。
3.2多糖干预荷瘤大鼠后肠道菌群metastats差异分析
相比于荷瘤大鼠,比较多糖干预后肠道菌群的变化,结果显示,荷瘤大鼠经多糖干预后菌群在门、纲、目、科、属、种各水平上均有一定程度的变化,揭示多糖对肠道菌群具有一定的调节作用。具体分析如图5、6所示。
通过对经多糖干预后的荷瘤大鼠肠道菌群差异分析后得出结论,主要是厚壁菌门、疣微菌门两大菌门以及其他纲、目、科、属下菌群变化,具体菌群如下:
注:*代表有显著性差异的菌群,**代表新增的显著性差异的菌群
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!