一种嵌合共刺激转换受体、编码基因、重组表达载体、抗肿瘤NK细胞及其制备方法、应用与流程
本发明涉及一种嵌合共刺激转换受体、编码基因、重组表达载体、抗肿瘤nk细胞及其制备方法、应用,属于肿瘤免疫细胞治疗技术领域。
背景技术
近年来,肿瘤免疫细胞治疗因其显著的疗效而在肿瘤治疗中大放异彩,特别是基于嵌合抗原受体改造的t细胞(car-t),在血液系统恶性肿瘤的临床治疗中展现出良好的靶向性、杀伤力和持久性,其为肿瘤免疫治疗领域最令人信服的突破,为攻克肿瘤打开了新的希望之门。尽管car-t技术研发不断取得进步,但却依然面临着诸多挑战。主要障碍之一为:car-t虽然具备强大杀死癌细胞的能力,但其本身所引起的过强免疫应答反应潜在威胁患者生命。并且无论car-t或是tcr-t等免疫细胞技术,迄今为止对实体瘤的治疗鲜有奏效,而治疗实体瘤恰是抗肿瘤的真正主战场。因此,如何克服car-t技术的弊端以及如何能赋予免疫细胞对实体瘤细胞的精准识别与特异杀伤,成为免疫细胞治疗亟待实现的新突破和新跨越。
nk细胞是机体重要的免疫细胞,约占健康人外周血淋巴细胞总数的10%。nk细胞在实体瘤发生发展的早期免疫反应和免疫监视过程中发挥重要作用,为机体抵抗肿瘤的第一道防线,利用nk细胞进行临床治疗已有较长历史。与t细胞相比,nk细胞具有许多自身的免疫特性和优势:一是它具有不受hla限制的非特异性肿瘤细胞杀伤作用,主要是通过表面细胞毒受体,触发穿孔素和颗粒酶的释放,产生细胞毒因子和tnf等细胞因子,而不产生il-2等细胞因子,避免造成致死性细胞因子风暴;二是nk细胞还可通过cd16与抗体fc片段结合,诱发adcc特异性杀伤作用;三是nk细胞的杀伤作用具有连续性,可从一个目标移向另一个目标,杀死多达7-10个肿瘤细胞,而t细胞缺乏这种连续杀伤性;四是因为nk细胞寿命短暂,发挥功效后很快会消失,勿需更多考虑类似car-t细胞需要自杀基因来限制其持久副作用,这显然要优于t细胞。由于这些有利因素,nk细胞用于患者治疗时有效并且安全。利用nk92而不是t细胞作为宿主细胞,使car-nk相比car-t,具有更高的安全性和可控性。
免疫检查点是指一类免疫抑制性分子,通过共抑制或共刺激信号一系列途径来调节免疫细胞活性,防止过度免疫激活和确保自身耐受,从而避免正常组织损伤和破坏。程序性死亡受体(programmeddeath1,pd1)是其中一个主要的抑制分子,它具有一个itsm结构,在与配体pd-l1结合后能够磷酸化,并招募酪氨酸磷酸酶shp-2,引发抗原受体复合体的去磷酸化,从而抑制通路下游的激活信号,使免疫细胞活化受阻,发挥对免疫细胞活性的负向调控作用。大量研究证据表明,pd1主要表达于活化的免疫细胞表面,其配体pd-l1在正常组织中表达有限,但在大部分实体瘤细胞和免疫抑制细胞中的表达显著增加,肿瘤利用pd1/pd-l1负调控机制实现对抗肿瘤免疫反应的逃逸。目前多项临床前研究和临床试验均指出,采用pd-l1或pd1阻断抗体来增强癌症患者的抗肿瘤免疫应答可作为一种新型的肿瘤免疫治疗手段,并且能够获得持续性的临床应答。更有意义的是,研究发现利用pd1细胞外段和cd28跨膜段及胞内段构建一个嵌合共刺激开关受体,将其引入针对实体瘤靶抗原的car-t细胞,相比现在单独使用pd1抗体治疗或car-t细胞治疗都有更多更好的效果。
申请公布号为cn107974433a的中国发明专利申请中公开了一种增强型抗肿瘤nk细胞,其为经双重靶向嵌合受体改造的nk细胞,所述的双重靶向嵌合受体由pd1胞外段、nkg2d全长段,以及共刺激分子41bb胞内段组成;该抗肿瘤nk细胞用于杀死h1299肺癌细胞时,其细胞毒性较低,仅为亲本nk92的3-4倍,不能满足实体肿瘤的治疗需求。
技术实现要素:
本发明的目的是提供一种嵌合共刺激转换受体,该受体对于nk92细胞具有高激活效应。
本发明还提供了上述嵌合共刺激转换受体的编码基因,可以表达出上述的嵌合共刺激转换受体。
本发明还提供了包含上述嵌合共刺激转换受体编码基因的重组表达载体,可以表达出上述的嵌合共刺激转换受体。
本发明还提供了上述重组表达载体的制备方法,可以制备得到上述的重组表达载体。
本发明还提供了一种高细胞毒性的抗肿瘤nk细胞,该抗肿瘤nk细胞经嵌合共刺激转换受体改造,具有极高的细胞毒性。
本发明还提供了上述抗肿瘤nk细胞的制备方法,可以制备得到上述的抗肿瘤nk细胞。
本发明还提供了上述嵌合共刺激转换受体、编码基因、重组表达载体以及抗肿瘤nk细胞的应用,可以有效的治疗肿瘤。
为了实现上述目的,本发明所采用的技术方案是:
一种嵌合共刺激转换受体,其氨基酸序列如seqidno.1所示。该嵌合共刺激转换受体是由pd1胞外段(1-170aa),dap10胞外、跨膜及胞内段(19-93aa)以及共刺激分子41bb胞内段(214-255aa)组成。
nk细胞免疫监视功能取决于表面抑制性受体和活化性受体所传递信号的整合。dap10为一个i型跨膜蛋白,以同源二聚体形式与nkg2d分子相连,组成活化性受体,而且dap10胞外域含有糖基化位点,能够招募游离的nkg2d,大大增强了nk细胞的激活。dap10的胞质段不含itam(immunoreceptortyrosineactivationmotif)基序5-7,而含有与cd28胞质段相似的yxxm基序(即sh2样功能区),此功能区可以与pi-3激酶的p85亚基结合,通过pi-3激酶最终导致erk信号激活,产生细胞毒作用,从而增强了nk细胞的激活。
本发明中采用全基因合成技术获得一种融合受体,即采用pd1胞外段(1-170aa),dap10胞外、跨膜及胞内段(19-93aa)以及共刺激分子41bb胞内段(214-255aa)。利用这一嵌合分子模块,一方面通过pd1结合肿瘤细胞pd-l1,既发挥靶向肿瘤细胞的功能,又避免了pd1/pd-l1免疫负调控机制;另一方面通过dap10与共刺激因子41bb的共同作用,增强nk92细胞的激活效应。
本发明中的嵌合共刺激转换受体,采用了含有第1-20aa的pd1胞外段,其中pd1(1-20),是其信号肽区域,有助于pd1在分泌过程中出膜。dap10(19-93aa)是去掉了前段的本身含有的信号肽,在前期的研究中发现,加上信号肽后导致外端pd1不能正常跨膜,膜外检测不到,因此进行了修改去除了前端的信号肽。pd1为一型跨膜蛋白,dap10也为一型跨膜蛋白,dap10与pd1结合,更有利于分子在膜上的稳定,并且不对细胞造成损伤;且dap10有助于招募细胞中游离的nkg2d,可以增强nk92的激活。
一种嵌合共刺激转换受体的编码基因,所述编码基因编码的氨基酸序列如seqidno.1所示。
本发明的编码基因可以编码嵌合共刺激转换受体,该受体可以增强nk细胞抗肿瘤免疫效应。
优选的,嵌合共刺激转换受体的编码基因的核苷酸序列如seqidno.2所示。该核苷酸序列符合人体内密码子偏好性,能够更好的在人体内表达。
一种包含嵌合共刺激转换受体编码基因的重组表达载体,所述重组表达载体包含嵌合共刺激转换受体编码基因,所述嵌合共刺激转换受体编码基因编码的氨基酸序列如seqidno.1所示。
本发明的重组表达载体可以表达嵌合共刺激转换受体,该受体可以增强nk细胞抗肿瘤免疫效应。
上述的重组表达载体的制备方法,包括如下步骤:1)合成所述嵌合共刺激转换受体编码基因;2)将所述嵌合共刺激转换受体编码基因连接到慢病毒表达载体上,即得。
通过本申请的重组表达载体的制备方法可以获得上述的包含嵌合共刺激转换受体编码基因的重组表达载体。
一种高细胞毒性的抗肿瘤nk细胞,其为经嵌合共刺激转换受体改造的nk细胞,所述嵌合共刺激转换受体的氨基酸序列如seqidno.1所示。
本发明抗肿瘤nk细胞不仅可以靶向肿瘤细胞,而且具有极强的细胞毒性,与car-nk针对某一种抗原的靶向作用相比,ha-cccr-nk92细胞通过pd1/pd-l1通路来识别肿瘤细胞,因大多数肿瘤均表达pd-l1,使得ha-cccr-nk92对肿瘤细胞的靶向作用更具广谱性,而不仅仅局限于一种或几种特异性抗原靶标。
而且改造后的ha-cccr-nk92抗肿瘤nk细胞与nk92相比,对于a549细胞的细胞毒性增加了约4倍,对于u-2os细胞的细胞毒性增加了约10倍,对于h1299细胞的杀伤增加了约40倍,具有极强的细胞毒性。
上述的抗肿瘤nk细胞的制备方法,包括如下步骤:1)合成所述嵌合共刺激转换受体编码基因;2)将所述嵌合共刺激转换受体编码基因连接到慢病毒表达载体上,得重组慢病毒表达载体;3)包装所述重组慢病毒表达载体,表达出携带目的质粒的病毒;4)将所述携带目的质粒的病毒侵染nk92细胞,即得。
通过本申请的抗肿瘤nk细胞的制备方法可以得到细胞毒性强的抗肿瘤nk细胞。
上述的嵌合共刺激转换受体在制备抗肿瘤药物中的应用。上述的编码基因在制备抗肿瘤药物中的应用。具体的,嵌合共刺激转换受体及其编码基因可以通过刺激nk细胞的活性,间接提高抗肿瘤效果。
上述的重组表达载体在制备抗肿瘤药物中的应用。重组表达载体也可以通过刺激nk细胞的活性,间接提高抗肿瘤效果。
上述的抗肿瘤nk细胞在制备抗肿瘤药物中的应用。具体的,抗肿瘤nk细胞可以与药学上可接受的载体共同作为抗肿瘤药物组合物使用,实现对肿瘤细胞,特别是实体瘤细胞的靶向特异性治疗。
本发明的抗肿瘤nk细胞可以进行异体回输,且对正常细胞的伤害小,不会引起机体过激的免疫应答反应,并能实现对实体瘤细胞的精准识别与特异杀伤,细胞毒性更强,对于肿瘤的治疗效果更好。
附图说明
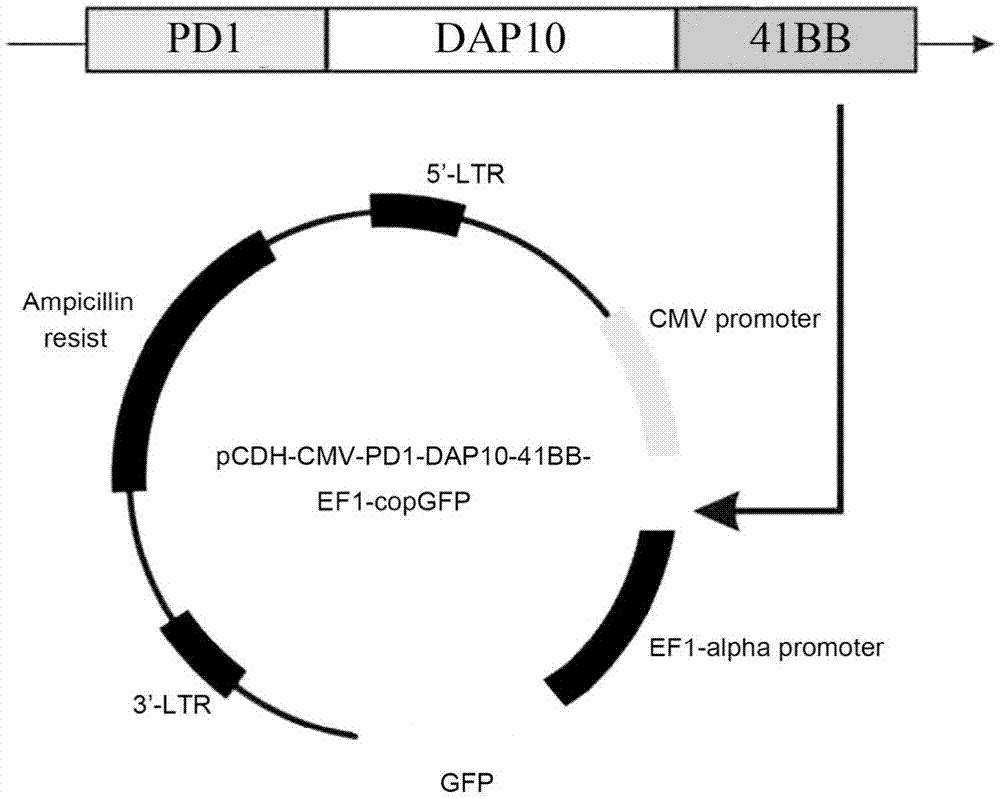
图1为本发明包含嵌合共刺激转换受体编码基因的重组慢病毒载体pd1-dap10-41bb-pcdh的结构示意图;
图2为本发明高细胞毒性的抗肿瘤nk细胞的制备方法中质粒转染293t细胞72h后显微观察图;图中,a为白光图,b为荧光图;
图3为本发明高细胞毒性的抗肿瘤nk细胞的制备方法中慢病毒转染后nk92细胞72h后荧光观察图;图中,a为白光图,b为荧光图,c为叠加图;
图4为本发明试验例1中慢病毒转染nk92和ha-cccrpd1流式表达示意图;图中,a为nk92细胞,b为ha-cccr-nk92细胞;
图5为本发明试验例1中慢病毒转染nk92后nkg2d流式mean值示意图;
图6为本发明试验例1中慢病毒转染nk92后分子模块pd1的mrna水平表达示意图;
图7为本发明试验例2中nk92与ha-cccr-nk92细胞对a549、u-2os、h1299肿瘤细胞的杀伤效果对比图;图中,a为a549细胞,b为u-2os细胞,c为h1299细胞。
具体实施方式
下面结合具体实施例对本发明做进一步的详细说明。除特殊说明的之外,各实施例及试验例中所用的设备和试剂均可从商业途径得到。
嵌合共刺激转换受体的实施例1
本实施例中嵌合共刺激转换受体的氨基酸序列,如seqidno.1所示,是由pd1胞外段(1-170aa),dap10胞外、跨膜及胞内段(19-93aa)以及共刺激分子41bb胞内段(214-255aa)组成。
嵌合共刺激转换受体的编码基因的实施例1
本实施例中嵌合共刺激转换受体的编码基因核苷酸序列如seqidno.2所示。
通过全基因合成的方法在武汉天一辉远生物科技有限公司合成了含有pd1胞外段(1-170aa)的510bp核苷酸片段、dap10胞外、跨膜及胞内段(19-93aa)的225bp核苷酸片段以及共刺激分子41bb胞内段(214-255aa)的126bp核苷酸片段,将它们串联在一起,得到了pd1-dap10-41bb片段,全长861bp。
包含嵌合共刺激转换受体编码基因的重组表达载体的实施例1
本实施例中重组表达载体包含嵌合共刺激转换受体编码基因,所述嵌合共刺激转换受体编码基因编码的氨基酸序列如seqidno.1所示。
包含嵌合共刺激转换受体编码基因的重组表达载体的制备方法的实施例1
本实施例中重组表达载体的制备方法,包括如下步骤:将嵌合共刺激转换受体的编码基因中的pd1-dap10-41bb片段,经酶切、连接到pcdh-cmv-mcs-ef1-copgfp慢病毒载体上,获得重组慢病毒载体pd1-dap10-41bb-pcdh,其结构如图1所示。
高细胞毒性的抗肿瘤nk细胞的实施例1
本实施例中高细胞毒性的抗肿瘤nk细胞为经嵌合共刺激转换受体改造的nk细胞,所述嵌合共刺激转换受体的氨基酸序列如seqidno.1所示。
高细胞毒性的抗肿瘤nk细胞的制备方法的实施例1
本实施例中高细胞毒性的抗肿瘤nk细胞的制备包括如下步骤:
(一)慢病毒包装
1、慢病毒包装质粒及目的质粒的提取
1.1质粒转化
取出stbl3感受态细胞(transgenbiotech,货号cd521-01)和大肠杆菌top10感受态细胞;向stbl3感受态中加入1μg目的质粒(pd1-dap10-41bb-pcdh),top10感受态中分别加入慢病毒包装辅助质粒(pspax2、pmd2g)1μg,充分混匀,冰上孵育30min,立即放入42℃水浴锅中热击90s,再冰浴放置2min,充分混匀。
之后置于37℃恒温振荡培养箱中,180rpm/min,振荡培养1h,取100μl涂布到lb固态培养基上(含有氨苄抗生素ampicillin,amp,浓度为50μg/ml,按照1:1000的比例加入),37℃恒温培养箱培养12h。
1.2质粒提取
1)小摇:分别挑取上述培养板中的单克隆菌落,接种于5ml新鲜的lb培养基中(含有amp,浓度为50μg/ml,按照1:1000的比例加入),置于37℃摇床,220rpm/min,恒温振荡12h;
2)大摇,取200μl菌液接种到200ml的lb培养基中(含amp200μl),置于37℃摇床,220rpm/min,恒温振荡12h-16h;
3)按照omega无内毒素质粒大量提取试剂盒(美国omegabio-tek公司,产品货号为d6926-03)进行质粒抽提,用nanodrop超微量分光光度计(美国热电(上海)科技仪器有限公司,型号:nanodrop2000)测取质粒浓度和纯度后,置于-20℃冰箱保存。
2、慢病毒包装过程
培养293t细胞至密度达到70%-80%时,提前1h更换10ml新鲜的含有6%fbs(bi,货号为04-001-1acs)的不含青霉素与链霉素的dmem培养基(hyclone,货号为sh30022.01),继续置于培养箱中进行培养,1h后进行病毒包装。采用磷酸钙试剂盒(碧云天,货号为c0508)进行包装,包装步骤:将目的质粒pd1-dap10-41bb-pcdh,辅助质粒pspax2、pmd2g按照4:3:1比例混匀,将混合质粒加入cacl2溶液(试剂盒提供)中,吹打混匀,将混合溶液逐滴加入bbs中,吹打混匀,室温孵育30min,可见浑浊,但此时无白色沉淀生成,将上述混合液加入293t细胞中,混匀,放入培养箱继续培养4-16h,然后去除上清,pbs轻柔的洗一遍,更换15ml新鲜的含有10%fbs的dmem培养基,48h、72h后收集病毒。
293t细胞培养72h后荧光显微镜检测结果如图2所示,a为白光图,b为荧光图,从图中可以看到病毒包装的效率大约为80%,说明包装成功。
3、慢病毒的浓缩
将收集的病毒上清,离心去除细胞碎片,加入peg,放置12h以上,4℃离心,收集病毒颗粒,将浓缩获得的病毒颗粒用pbs重悬,分装保存于-80℃,避免反复冻融。
4、慢病毒滴度的测定
采用abm公司的qpcr慢病毒滴度试剂盒(货号为lv900)进行测定,本实施例中所得慢病毒滴度均为1×109。
(二)慢病毒转染nk92细胞
取1-5×105个/孔nk92细胞接种于24孔板中,加入浓缩过的pd1-dap10-41bb病毒液(moi=50-100),每孔加入终浓度为8μg/ml的聚凝胺(翊圣生物,货号40804es76),混匀,置于37℃培养箱中进行培养,12-15h后离心,去除病毒上清,更换新鲜的培养基,继续培养。侵染72h后,在荧光显微镜下观察gfp的表达以检测侵染效果如图3所示,a为白光图,b为荧光图,c为叠加图,从图中可以看出经过慢病毒侵染后的nk92细胞,细胞状态良好,侵染效率正常且侵染成功。侵染过的nk92细胞为ha-cccr-nk92细胞,在培养72h后,即可用于后续实验。
嵌合共刺激转换受体的应用的实施例1
上述的嵌合共刺激转换受体可以刺激nk细胞的活性,用于制备抗肿瘤药物。
嵌合共刺激转换受体的编码基因的应用的实施例1
上述的嵌合共刺激转换受体的编码基因可以刺激nk细胞的活性,用于制备抗肿瘤药物。
包含嵌合共刺激转换受体编码基因的重组表达载体的应用的实施例1
上述的包含嵌合共刺激转换受体编码基因的重组表达载体也可以刺激nk细胞的活性,用于制备抗肿瘤药物。
高细胞毒性的抗肿瘤nk细胞的应用的实施例1
上述的抗肿瘤nk细胞可以与药学上可接受的载体共同作为抗肿瘤药物组合物使用,实现对肿瘤细胞,特别是实体瘤细胞的靶向特异性治疗。
试验例1流式细胞术检测目的基因pd1、nkg2d的表达
取慢病毒侵染72h后的nk92细胞(ha-cccr-nk92)、pcdh(空载)、nk92细胞。300g,离心5min,计数细胞1×106,用含1%fbs的pbs(以下简称washbuffer)洗涤1-2次,在100μl体系下加入apc标记的小鼠抗人pd1单抗(bd公司,货号558694),冰上避光孵育30min,用washbuffer洗涤2-3次。最后加入400μl的pbs液重悬细胞,用流式细胞仪(型号bdfacscantoii)进行检测分析。
结果如图4、图5所示。图4中a为nk92细胞,b为ha-cccr-nk92细胞,q1+q2为pd1的表达量,可见ha-cccr-nk92中pd1的表达率为70%左右;从图5中可见nkg2d表达的mean值是亲本nk92的2倍,说明本申请中的dap10胞外域含有的糖基化位点,能够招募更多游离的nkg2d。
对ha-cccr-nk92、pcdh和nk92细胞mrna水平pd1进行检测,结果如图6所示,从图中可以看出ha-cccr-nk92细胞pd1的mrna表达水平较pcdh和nk92细胞有很大的提高。
试验例2ha-cccr-nk92体外细胞毒性实验
1、细胞准备
取转入荧光素酶完成后的对数生长期的u-2os骨肉瘤细胞、h1299肺癌细胞、a549肺癌细胞,接种于96孔板中,保证每孔3×104个细胞,每种细胞设置3个副孔,置于5%co2,37℃培养箱中过夜培养。
2、实验设计
设置实验组为3组,每一组根据不同的效应细胞(ha-cccr-nk92细胞、pcdh和nk-92),又分为四小组,效靶比分别为0.5:1、2.5:1、5:1、10:1。同时设置3组对照,靶细胞对照孔、样品最大酶活性对照孔(未加效应细胞处理的用于后续裂解的靶细胞孔),未转入荧光素酶的空白细胞对照孔,每孔总体积100μl。
3、荧光素酶检测
本实验采用one-glotmluciferaseassaysystempromega进行检测。效应细胞与靶细胞置于5%co2、37℃培养箱中共孵育12h。在预定的时间检测点前1h,从细胞培养箱中取出96孔板,在“样品最大酶活性对照孔”中加入lysissolution(10×),加入量为原有培养液体积的10%。加入lysissolution后,反复吹打混匀,然后继续放入培养箱中培养。达到共孵育时间后,加入检测液,在酶标仪上进行检测。
细胞毒性(%)=(rlumin–rlusample)/(rlumin–rlumax)×100。计算得到的结果发现,在不同的效靶比例下,ha-cccr-nk92的细胞毒性均高于pcdh(空载)或者亲本nk92,而在5:1的比例下的结果如图7所示,a为a549细胞,b为u-2os细胞,c为h1299细胞,可以看出在5:1的比例下ha-cccr-nk92的细胞毒性更是强于nk92,对于a549细胞的细胞毒性增加了约4倍,对于u-2os细胞的细胞毒性增加了约10倍,对于h1299细胞的细胞毒性增加了约40倍,说明改造后的ha-cccr-nk92,其细胞毒性大大增加。
<110>新乡医学院
<120>一种嵌合共刺激转换受体、编码基因、重组表达载体、抗肿瘤nk细胞及其制备方法、应用
<160>2
<170>siposequencelisting1.0
<211>287
<212>prt
<213>人工序列
<221>pd1-dap10-41bb受体
<400>1
metglnileproglnalaprotrpprovalvaltrpalavalleu
151015
glnleuglytrpargproglytrppheleuaspserproasparg
202530
protrpasnproprothrpheserproalaleuleuvalvalthr
354045
gluglyaspasnalathrphethrcysserpheserasnthrser
505560
gluserphevalleuasntrptyrargmetserproserasngln
657075
thrasplysleualaalapheprogluaspargserglnprogly
808590
glnaspcysargpheargvalthrglnleuproasnglyargasp
95100105
phehismetservalvalargalaargargasnaspserglythr
110115120
tyrleucysglyalaileserleualaprolysalaglnilelys
125130135
gluserleuargalagluleuargvalthrgluargargalaglu
140145150
valprothralahisproserproserproargproalaglygln
155160165
pheglnthrleuvalglnthrthrproglygluargserserleu
170175180
proalaphetyrproglythrserglysercysserglycysgly
185190195
serleuserleuproleuleualaglyleuvalalaalaaspala
200205210
valalaserleuleuilevalglyalavalpheleucysalaarg
215220225
proargargserproalaglngluaspglylysvaltyrileasn
230235240
metproglyargglylysargglyarglyslysleuleutyrile
245250255
phelysglnprophemetargprovalglnthrthrglngluglu
260265270
aspglycyssercysargpheproglugluglugluglyglycys
275280285
gluleu
287
<211>861
<212>dna
<213>人工序列
<221>pd1-dap10-41bb编码基因
<400>2
atgcagatcccacaggcgccctggccagtcgtctgggcggtgctacaactgggctggcgg60
ccaggatggttcttagactccccagacaggccctggaacccccccaccttctccccagcc120
ctgctcgtggtgaccgaaggggacaacgccaccttcacctgcagcttctccaacacatcg180
gagagcttcgtgctaaactggtaccgcatgagccccagcaaccagacggacaagctggcc240
gccttccccgaggaccgcagccagcccggccaggactgccgcttccgtgtcacacaactg300
cccaacgggcgtgacttccacatgagcgtggtcagggcccggcgcaatgacagcggcacc360
tacctctgtggggccatctccctggcccccaaggcgcagatcaaagagagcctgcgggca420
gagctcagggtgacagagagaagggcagaagtgcccacagcccaccccagcccctcaccc480
aggccagccggccagttccaaaccctggtgcagacgactccaggagagagatcatcactc540
cctgccttttaccctggcacttcaggctcttgttccggatgtgggtccctctctctgccg600
ctcctggcaggcctcgtggctgctgatgcggtggcatcgctgctcatcgtgggggcggtg660
ttcctgtgcgcacgcccacgccgcagccccgcccaagaagatggcaaagtctacatcaac720
atgccaggcaggggcaaacggggcagaaagaaactcctgtatatattcaaacaaccattt780
atgagaccagtacaaactactcaagaggaagatggctgtagctgccgatttccagaagaa840
gaagaaggaggatgtgaactg861
- 还没有人留言评论。精彩留言会获得点赞!