一种新型的CCR2拮抗剂及其用途的制作方法
本申请涉及一种新型的ccr2拮抗剂及其用途。
背景技术:
如cn103328479a中所述,趋化因子受体ccr2见于单核细胞、巨噬细胞、b细胞、活化的t细胞、树突细胞、内皮细胞和肿瘤细胞的表面上。它是多种趋化因子配体(包括mcp-1、mcp-2、mcp-3和mcp-4)的受体。其中,mcp-1(单核细胞趋化蛋白-1,也称为ccl2)似乎仅与ccr2相互作用,而不与迄今为止鉴定的任何其他趋化因子受体相互作用。mcp-1由心肌细胞、血管内皮细胞、成纤维细胞、软骨细胞、平滑肌细胞、系膜细胞、肺泡细胞、t淋巴细胞、巨噬细胞等表达。在被其mcp-1活化后,ccr2受体信号级联放大涉及磷脂酶、蛋白激酶和脂质激酶的活化。
ccr2介导的单核细胞募集是导致发生动脉粥样硬化的最早期步骤之一。在动脉粥样硬化的实验模型中,动脉斑块形成依赖于ccr2和mcp-1的完整性。
慢性炎性疾病的动物模型研究已证明,通过拮抗剂抑制mcp-1与ccr2之间的结合抑制了炎性应答。已表明抑制发生关节炎、哮喘和葡萄膜炎的mcp-1拮抗剂抑制单核细胞迁移。mcp-1和ccr2二者敲除小鼠已证明,单核细胞向炎性病变中的浸润显著降低。单核细胞的ccr2介导性迁移被认为是人多发性硬化(ms)的致病原因,因为在ms患者的脑脊液中观察到了ccr2和mcp-1表达。在人ms的小鼠模型中,ccr2或mcp-1缺陷预防eae的发生。在类风湿性关节炎和克罗恩病中用tnf-α拮抗剂治疗期间观察到的改善还与mcp-1表达和浸润性巨噬细胞数目的降低相关。另外,最近有人提出了ccr2影响肥胖和相关脂肪组织炎症和全身胰岛素抗性的发生,并且在一旦确立肥胖及其代谢结果后在维持脂肪组织巨噬细胞和胰岛素抗性中发挥作用。此外,ccr2信号传导可在神经性疼痛中发挥致病作用。还表明缺乏ccr2使小鼠疼痛模型中的炎性和神经性疼痛降低,表明神经组织中巨噬细胞和小胶质细胞的募集和活化在疼痛状态中发挥重要作用。
已将mcp-1与ccr2之间的相互作用与炎性疾病的病理学联系起来,所述疾病例如银屑病、葡萄膜炎、动脉粥样硬化、类风湿性关节炎、多发性硬化、克罗恩病、炎性肠病、肾炎、器官同种异体移植排斥、纤维化肺、肾功能不全、肾纤维化、糖尿病和糖尿病并发症、糖尿病性肾病、糖尿病性视网膜病、糖尿病性视网膜炎、糖尿病性微血管病、肥胖、神经性疼痛(包括与糖尿病相关的神经性疼痛)、结核病、结节病、侵袭性葡萄球菌感染、白内障手术后炎症、变应性鼻炎、变应性结膜炎、慢性荨麻疹、慢性阻塞性肺病(copd)、变应性哮喘、hiv相关痴呆症、牙周病、牙周炎、牙龈炎、齿龈病、舒张性心肌病、心肌梗死、心肌炎、慢性心力衰竭、血管狭窄、再狭窄、再灌注障碍、肾小球肾炎、实体瘤和癌症、慢性淋巴细胞性白血病、慢性髓细胞性白血病、多发性骨髓瘤、恶性骨髓瘤、霍奇金病、以及膀胱癌、乳腺癌、子宫颈癌、结肠癌、直肠癌、肺癌、前列腺癌和胃癌(参见,例如rollins,mol.med.today,2:198-204(1996);dawson等,expertopin.ther.targets,7(1):35-48,(2003)),connor等,gut,153:1287-1294;ali-osmanjr等,j.surg.res.,144:350-351(2008);cid等,rheumatology,45(11):1356-1363(2006);wada等,inflammationandregeneration,23(5):567-572(2004)。
ccr2和mcp-1与多种癌症的生长、确立和转移扩散密切相关(yoshie等,2001)。一般而言,认为ccr2介导的巨噬细胞和免疫抑制性骨髓细胞对肿瘤和转移细胞的吸引是所涉及的主要机制,但是多种骨髓祖细胞的活动化也可发挥作用。特别有趣的是,在许多肿瘤类型中,mcp-1水平与侵袭、巨噬细胞含量和血管发生相关联。血浆ccl2水平在癌症患者中倾向于升高并且与乳腺癌(dwyer等,2007)、卵巢癌(hefler等,1999)和肺癌(cai等,2009)患者的肿瘤阶段相关。
ccr2受体和mcp-1/ccl2的多态性与人的癌症发生率显著相关,包括膀胱癌和子宫颈癌(zafiropoulos等,2004;coelho等,2005;narter等,2010)。其中与mcp-1和ccr2相关的癌症包括黑素瘤(graves等,1992;koga等2008;zheng等,1999,)、卵巢癌(negus等,1995)、乳腺癌(saji等,2001;soria等,2008;soria和benbaruch2008;mestdagt等2004;chavey等,2007;valkovic等,1998;ueno等,2000;valkovic等,2005;salcedo等,2000)、食管癌(ohta等,2002;koide等,2004)、胃癌(ohta等,2003;kuroda等,2005;futagami等,2008)、肾细胞癌(lukesova等,2008)、肺癌(cai等,2009;wong等,2008;niiya等,2003)、结肠癌(bailey等,2007)、甲状腺癌(tanaka等,2009)、白血病(mazur等,2007)、多发性骨髓瘤(arendt等,2002;johrer等,2004;vandebroeke等,2003;pellegrino等,2005)和前列腺癌(lu等,2007a)。
mcp-1促进前破骨细胞融合,导致形成破骨细胞(lu等,2007b),并且还参与促进cd11b+细胞分化为破骨细胞(mizutani等,2009)。数种癌主要转移至骨,包括肺癌、乳腺癌、肾癌、甲状腺癌和多发性骨髓瘤(参见craig和loberg,2006)。多于90%的晚期前列腺癌患者表现出骨转移的迹象(shah等,2004)。
mcp-1在骨定向转移的发生中发挥核心作用。lu和kang(2009)表明,使用提高mcp-1表达的人乳腺肿瘤系促进了肺转移和骨转移以及继发性肿瘤的后续生长。
肝是结直肠癌转移的主要部位。然而,肝切除术很少有疗效,有60~70%的病例发生复发。mcp-1可在肝转移中高度表达,并且高的水平与不良预后相关,mcp-1表达随癌症分期而明显升高(bailey等,2007;yoshimode等,2009)。
与肝肿瘤相关的成纤维细胞和正常成纤维细胞在tnfα的影响下均表达mcp-1(muller等,2007,2010),表明与肿瘤相关的成纤维细胞来自炎性条件下的正常肝基质。
因此,大量证据证明,mcp-1和ccr2参与癌症的生长和发展,特别是癌症相关细胞(如巨噬细胞)的募集。因此,ccr2拮抗剂应可用于治疗癌症,尤其是用于限制癌细胞转移扩散,并且降低巨噬细胞和骨髓细胞向原发性肿瘤的募集,从而降低肿瘤生长和血管形成。特别是,ccr2拮抗剂应可用于抑制转移性肿瘤细胞从原发性肿瘤部位的扩散。
技术实现要素:
本发明第一方面提供下式i所示的化合物或其药学上可接受的盐在制备药物中的用途,尤其是在制备用于治疗或预防ccr2介导的疾病的药物中的用途:
式中,
r1、r2、r3和r4各自独立为oh或-oc(o)r5,其中,r5选自c1-c4烷基;
a、b、c和d各自独立为0、1、2或3的整数。
在一个或多个实施方案中,r1、r2、r3和r4各自独立为oh。
在一个或多个实施例中,a为2,b、c和d为1。
在一个或多个实施方案中,b、c和d为1,r2、r3和r4各自独立地位于对位或间位上。
在一个或多个实施方案中,式i化合物具有下式ii所示的结构:
式中,a、b、c、d、r1、r2、r3和r4各自如前文所述。
在一个或多个实施方案中,式ii化合物中,a为2,b、c和d为1,两个r1分别位于5和7位,r2、r3和r4各自独立地位于对位上。
在一个或多个实施方案中,式i化合物为下式化合物:
在一个或多个实施方案中,所述ccr2介导的疾病包括但不限于疼痛、炎性疾病、癌症、癌细胞转移扩散等。
在一个或多个实施方案中,所述ccr2介导的疾病包括但不限于银屑病、葡萄膜炎、动脉粥样硬化、类风湿性关节炎、多发性硬化、克罗恩病、炎性肠病、肾炎、器官同种异体移植排斥、纤维化肺、肾功能不全、肾纤维化、糖尿病和糖尿病并发症、糖尿病性肾病、糖尿病性视网膜病、糖尿病性视网膜炎、糖尿病性微血管病、肥胖、神经性疼痛(包括与糖尿病相关的神经性疼痛)、结核病、结节病、侵袭性葡萄球菌感染、白内障手术后炎症、变应性鼻炎、变应性结膜炎、慢性荨麻疹、慢性阻塞性肺病、变应性哮喘、hiv相关痴呆症、牙周病(牙周炎、牙龈炎、齿龈病)、舒张性心肌病、心肌梗死、心肌炎、慢性心力衰竭、血管狭窄、再狭窄、再灌注障碍、肾小球肾炎、实体瘤和癌症、慢性淋巴细胞性白血病、慢性髓细胞性白血病、多发性骨髓瘤、恶性骨髓瘤和霍奇金病。
在一个或多个实施方案中,所述ccr2介导的疾病包括但不限于膀胱癌、子宫颈癌、黑素瘤、卵巢癌、乳腺癌、食管癌、胃癌、肾细胞癌、肺癌、结肠癌、直肠癌、甲状腺癌、白血病、多发性骨髓瘤、肝癌和前列腺癌。
在一个或多个实施方案中,所述ccr2介导的疾病包括转移性肿瘤细胞从原发性肿瘤部位的扩散,例如,肺癌、乳腺癌、肾癌、甲状腺癌和多发性骨髓瘤的癌细胞向骨的转移,乳腺癌细胞向肺的转移,结肠癌、直肠癌细胞向肝的转移。
在一个或多个实施方案中,所述药物还包括一种或多种已知的抗癌药物。
在一个或多个实施方案中,所述已知的抗癌药物选自:白消安、马法兰、苯丁酸氮芥、环磷酰胺、异环磷酰胺、替莫唑胺、苯达莫司汀、顺铂、丝裂霉素c、博莱霉素、卡铂、喜树碱、伊立替康、托泊替康、阿霉素、表阿霉素、阿克拉霉素、米托蒽醌、甲基羟基玫瑰树碱、5-氮杂胞苷、吉西他滨、5-氟尿嘧啶、5-氟-2'-去氧尿苷、氟达拉滨、奈拉滨、长春新碱、长春瑞滨、紫杉醇、伊沙匹隆、卡巴他赛、多西他赛、帕尼单抗、阿瓦斯丁、赫赛汀、美罗华、伊马替尼、吉非替尼、埃罗替尼、拉帕替尼、甲苯磺酸索拉非尼、舒尼替尼、尼罗替尼、达沙替尼、帕唑帕尼、依维莫司、他莫昔芬、来曲唑、氟维司群和米托胍腙。
在一个或多个实施方案中,所述已知的抗癌药物为甲苯磺酸索拉非尼。
本发明还提供式i所示的化合物或其药学上可接受的盐在制备用于在需要的对象中调节肿瘤微环境、降低巨噬细胞和骨髓细胞向原发性肿瘤的募集、抑制肿瘤生长、抑制血管形成、和/或增加cd8t细胞的药物或试剂中的用途。
在一个或多个实施方案中,所述用途包括制备用于下述任意一种或多种目的药物或试剂的用途:
抑制ccr2介导的细胞迁移,包括但不限于抑制thp-1的迁移能力,或抑制巨噬细胞的招募;
抑制ccl2-ccr2引起的钙流;
解除巨噬细胞对cd8t细胞的抑制作用;和
使巨噬细胞从免疫抑制型(m2)向免疫促进型(m1)偏移。
本发明还提供式i所示的化合物或其药学上可接受的盐在制备用于抑制ccr2或ccl2-ccr2通路的药物或试剂中的用途。
附图说明
图1:不同浓度747药物对于ccl2-ccr2介导的thp-1迁移能力的影响。
图2:10μm747与其他ccr2拮抗剂对thp1-gcamp6钙流影响。
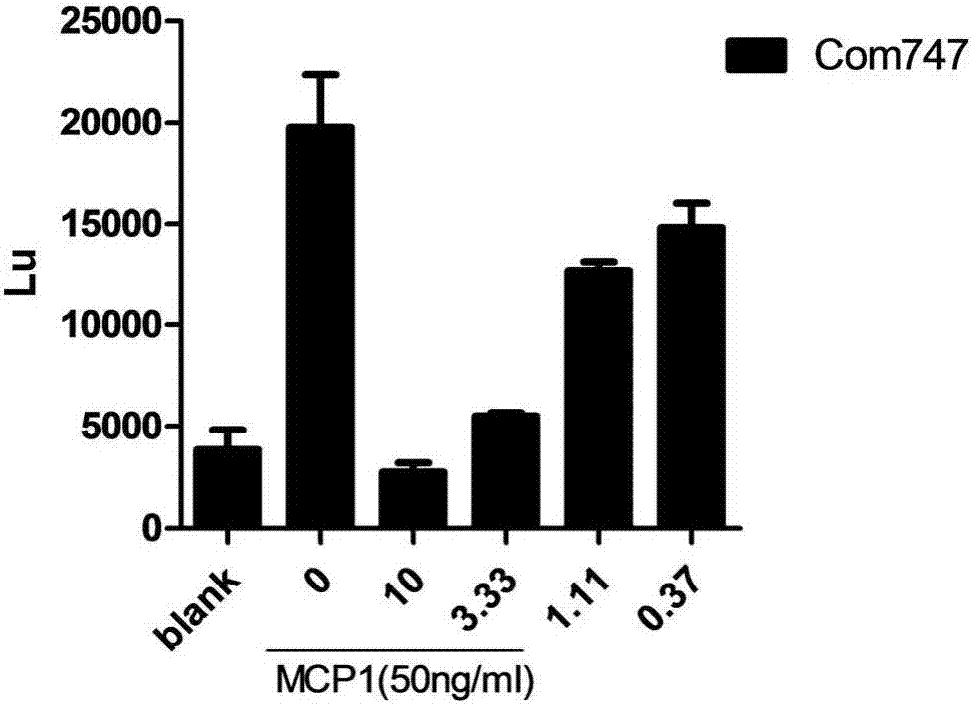
图3:不同浓度747对293ft-gcamp6-ccr2钙流影响。
图4:不同浓度747对人与鼠的i125mcp1-ccr2的抑制能力。
图5:不同浓度747对人与鼠的i125mip1a-ccr5的抑制能力。
图6:747对tg腹膜炎诱导的腹腔巨噬细胞数量影响。
图7:747对于多种肝癌细胞系体外增殖影响(48小时)。
图8:747与sorafenib对于hepa1-6小鼠肝原位肿瘤治疗活体成像追踪。
图9:747与sorafenib治疗后hepa1-6肝原位肿瘤生长结果。
图10:747与sorafenib治疗hepa1-6肝原位肿瘤小鼠体重变化追踪。
图11:747对hepa1-6肝原位肿瘤微环境中cd8t细胞与cd4t细胞比例影响。
图12:747、巨噬细胞敲除、cd8t细胞敲除对hepa1-6小鼠肝癌皮下肿瘤治疗结果。
图13:747、巨噬细胞敲除、cd8t细胞敲除对hepa1-6小鼠肝癌皮下肿瘤生长变化。
图14:747对hepa1-6小鼠肝癌皮下肿瘤微环境cd4t细胞与cd8t细胞比例影响。
图15:747对hepa1-6小鼠肝癌皮下肿瘤微环境巨噬细胞比例影响。
图16:747、sorafenib各组对lpc小鼠皮下肝癌治疗结果。
图17:747、sorafenib各组对lpc小鼠肝癌皮下肿瘤生长变化追踪。
图18:747、sorafenib治疗lpc小鼠肝癌皮下肿瘤后肿瘤重量。
图19:747对lpc小鼠肝癌皮下肿瘤微环境cd8t细胞与cd4t细胞比例影响。
图20:747、sorafenib对lpc小鼠肝癌皮下肿瘤微环境巨噬细胞的细胞比例。
图21:lpc小鼠皮下肿瘤微环境的巨噬细胞中ccr2阳性细胞的各组比例。
图22:lpc小鼠皮下肿瘤微环境的巨噬细胞中m2-免疫抑制性巨噬细胞的各组比例。
图23:化合物747的hplc-uv检测(a)和ms(+/-)(b)。该化合物该化合物在负模式下离子化好;正模式下离子化差。
具体实施方案
本文提供一类新的ccr2拮抗剂,其结构如前文所述的式i所示。优选的,式i化合物具有式ii所示的结构。
在优选的式i和ii化合物中,r1、r2、r3和r4各自独立为oh;和/或,a为2,b、c和d为1;和/或,r2、r3和r4各自独立地位于对位或间位上。
在某些优选的式i和ii化合物中,b、c和d为1,r2、r3和r4各自独立为oh,且位于对位上;a为2。
在其它实施方案中,式i和ii化合物中,a为2,b、c和d为1,两个r1分别位于5和7位,r2、r3和r4各自独立地位于对位上。
更优选的,式i化合物为本文所述的编号为747的化合物(山奈酚3-(2,4-二-e-p-香豆酰基鼠李糖苷):
一些化合物可能作为立体异构体,包括旋光异构体存在。本申请包括所有立体异构体和这样的立体异构体的外消旋混合物,以及可以根据本领域技术人员众所周知的方法分离出来的单独的对映体。
本文中,化合物747可从长苞冷杉中提取获得。例如,在一个具体的提取方法中,将长苞冷杉干燥的地上部分粉碎成粗粉,用乙醇回流提取数次后,合并提取液,减压浓缩成稠浸膏。浸膏加水稀释后分别以氯仿、乙酸乙酯和正丁醇依次萃取,收集各萃取部分,分别浓缩成浸膏。其中乙酸乙酯萃取部分的浸膏,以甲醇溶解过滤后进行硅胶柱色谱分离,可获得化合物747。
色谱分离时,可使用氯仿-甲醇(例如2:1的氯仿:甲醇)洗脱,用薄层色谱检查洗脱流分,得流分1到10,其中流分1经进一步硅胶色谱纯化,得到黄色无定形粉末,该粉末即为化合物747。
获得化合物747后,可将其制备成相应的衍生物,例如,可采用本领域周知的方法将其制备成其药学上可接受的盐或酯。
本文中,药学上可接受的盐的例子包括但不限于无机和有机酸盐,例如盐酸盐、氢溴酸盐、磷酸盐、硫酸盐、柠檬酸盐、乳酸盐、酒石酸盐、马来酸盐、富马酸盐、扁桃酸盐和草酸盐;以及与碱例如钠羟基、三(羟基甲基)胺基甲烷(tris,胺丁三醇)和n-甲基葡糖胺形成的无机和有机碱盐。
本文中,药学上可接受的酯包括依据本领域已知方法通过使式i化合物上的羟基与c1-4羧酸、c3-6二酸或其酸酐例如琥珀酸酐和富马酸酐缩合而获得的酯。
作为ccr2拮抗剂,本发明式i化合物或其药学上可接受的盐可用于治疗或预防ccr2介导的各种疾病,包括但不限于疼痛、炎性疾病、癌症和癌细胞转移扩散等。
举例而言,ccr2介导的疾病包括但不限于银屑病、葡萄膜炎、动脉粥样硬化、类风湿性关节炎、多发性硬化、克罗恩病、炎性肠病、肾炎、器官同种异体移植排斥、纤维化肺、肾功能不全、肾纤维化、糖尿病和糖尿病并发症、糖尿病性肾病、糖尿病性视网膜病、糖尿病性视网膜炎、糖尿病性微血管病、肥胖、神经性疼痛(包括与糖尿病相关的神经性疼痛)、结核病、结节病、侵袭性葡萄球菌感染、白内障手术后炎症、变应性鼻炎、变应性结膜炎、慢性荨麻疹、慢性阻塞性肺病、变应性哮喘、hiv相关痴呆症、牙周病(牙周炎、牙龈炎、齿龈病)、舒张性心肌病、心肌梗死、心肌炎、慢性心力衰竭、血管狭窄、再狭窄、再灌注障碍、肾小球肾炎、实体瘤和癌症、慢性淋巴细胞性白血病、慢性髓细胞性白血病、多发性骨髓瘤、恶性骨髓瘤、癌细胞转移扩散和霍奇金病。
就癌症的治疗和预防而言,本申请式i化合物通过ccr2这一免疫靶点调节了肿瘤微环境,减少了肿瘤巨噬细胞的浸润,增加了cd8t细胞,从而达到治疗肿瘤的效果。因此,本申请包括式i化合物或其药学上可接受的盐用于下述任意一种或多种目的的用途或方法(包括制备用于下述一种或多种目的的药物组合物/试剂的用途):
调节肿瘤微环境;
减少肿瘤巨噬细胞浸润;和
增加cd8t细胞。
更具体而言,本申请包括式i化合物或其药学上可接受的盐用于下述任意一种或多种目的的用途或方法(包括制备用于下述一种或多种目的的药物组合物/试剂的用途):
抑制ccr2介导的细胞迁移,包括但不限于抑制thp-1的迁移能力,或抑制巨噬细胞的招募;
抑制ccl2-ccr2引起的钙流;
解除巨噬细胞对cd8t细胞的抑制作用;和
使巨噬细胞从免疫抑制型(m2)向免疫促进型(m1)偏移。
本文中,ccr2介导的癌症包括但不限于膀胱癌、子宫颈癌、黑素瘤、卵巢癌、乳腺癌、食管癌、胃癌、肾细胞癌、肺癌、结肠癌、直肠癌、甲状腺癌、白血病、多发性骨髓瘤、肝癌和前列腺癌。
本文中,癌细胞转移扩散包括但不限于转移性肿瘤细胞从原发性肿瘤部位的扩散,例如,肺癌、乳腺癌、肾癌、甲状腺癌和多发性骨髓瘤向骨的转移,乳腺癌细胞向肺的转移,结肠癌、直肠癌细胞向肝的转移。
本申请式i化合物或其药学上可接受的盐也可用于降低巨噬细胞和骨髓细胞向原发性肿瘤的募集、抑制肿瘤生长和/或抑制血管形成,因此,本申请也包括式i化合物或其药学上可接受的盐在制备用于降低巨噬细胞和骨髓细胞向原发性肿瘤的募集、抑制肿瘤生长和/或抑制血管形成的药物组合物或试剂中的用途。
本申请特别包括化合物747及其药学上可接受的盐在制备治疗或预防ccr2介导的癌症以及癌细胞转移扩散的药物中的用途,尤其是在制备治疗或预防肝癌(如ccr2介导的肝癌)的药物中的用途。
本申请还包括用于治疗或预防上述疾病的本申请式i化合物,尤其是式ii化合物和化合物747。
因此,本申请也包括上述疾病的治疗或预防方法,所述方法包括给予需要的对象治疗或预防有效量的本申请式i化合物。尤其是,本申请包括肝癌(如ccr2介导的肝癌)的治疗或预防方法,上述方法包括给予需要的对象治疗或预防有效量的化合物747。
本文中,治疗或预防有效量可由本领域技术人员根据本领域常规的方法容易地确定。例如,一般情况下,式i化合物或其药学上可接受的盐对哺乳动物每天口服给药,药量可按照约0.0025到50毫克/公斤体重。单位口服剂量可以包括约0.01到50毫克式i化合物。单位剂量可给予一次或多次,每天为一片或多片,每片含有约0.1到50毫克。
对于上述用途或方法而言,本申请式i化合物可以药物组合物或试剂的方式给予或施用。
药物组合物中通常含有本领域常规施用的药学上可接受的载体。药学上可接受的载体包括药学上可接受的赋形剂和稀释剂。载体可为惰性的或者其本身可具有药物益处。载体的类别包括但不限于粘合剂、缓冲剂、着色剂、稀释剂、崩解剂、乳化剂、调味剂、流平剂、润滑剂、防腐剂、稳定剂、表面活性剂、制片剂、延迟释放剂和湿润剂等。稀释剂可以是惰性稀释剂,例如碳酸钙、磷酸钙或乳糖。崩解剂可以是玉米淀粉或海藻酸。粘合剂可以是淀粉或明胶。润滑剂可以是硬脂酸镁、滑石、硬脂酸和十二烷基硫酸钠。延迟释放剂可以是例如羧甲基纤维素、邻苯二甲酸乙酸纤维素或聚乙酸乙烯酯。调味剂可以是甜味剂,甜味剂,例如糖精、环己烷氨基磺酸盐、甘油或糖;和味道增强剂,例如香兰素或橙提取物。防腐剂可以是对羟基苯甲酸酯。乳化剂可以是木质素、亚硫酸废液、甲基纤维素、淀粉和聚乙烯基吡咯烷酮等。
例示性药学上可接受的载体包括糖、淀粉、纤维素、粉状黄蓍胶、麦芽、明胶、滑石粉和植物油。
可将本发明的药物组合物制成各种适合给药的剂型,包括但不限于片剂、胶囊、溶液、糖浆、乳液等。
因此,可以本领域周知的各种给药方式给予本发明的药物组合物,包括但不限于肠外、皮下、静脉、肌肉、腹腔内、透皮、口腔、鞘内、颅内、鼻腔或外用途径给药。作为替代或并行地,可以通过口服给药。药的剂量将根据病人的年龄、健康与体重、并行治疗的种类、治疗的频率、以及所需治疗效益来决定。
本申请的剂型可用已知的方式制备。例如,由传统的混合、制粒、制锭、溶解、或冷冻干燥过程制造。制造口服制剂时,可结合固体辅料和活性化合物,选择性研磨混合物。如果需要或必要时加入适量助剂后,加工颗粒混合物,获得片剂或锭剂芯。
本申请的试剂可含有前文所述的药学上可接受的载体。当然,也可含有本领域体外实验常规的各种载体,例如水或能溶解本申请式i化合物的各种无机或有机溶剂。因此,应理解的是,本申请前文所述的各种用途和方法包括体内和体外用途和方法。
本申请的式i化合物或其药学上可接受的盐可与其它已知的抗癌药物一起施用。这类已知的抗癌药物包括但不限于:白消安、马法兰、苯丁酸氮芥、环磷酰胺、异环磷酰胺、替莫唑胺、苯达莫司汀、顺铂、丝裂霉素c、博莱霉素、卡铂、喜树碱、伊立替康、托泊替康、阿霉素、表阿霉素、阿克拉霉素、米托蒽醌、甲基羟基玫瑰树碱、5-氮杂胞苷、吉西他滨、5-氟尿嘧啶、5-氟-2'-去氧尿苷、氟达拉滨、奈拉滨、长春新碱、长春瑞滨、紫杉醇、伊沙匹隆、卡巴他赛、多西他赛、帕尼单抗、阿瓦斯丁、赫赛汀、美罗华、伊马替尼、吉非替尼、埃罗替尼、拉帕替尼、甲苯磺酸索拉非尼、舒尼替尼、尼罗替尼、达沙替尼、帕唑帕尼、依维莫司、他莫昔芬、来曲唑、氟维司群和米托胍腙等。尤其优选的是,本申请式i化合物或其药学上可接受的盐可与甲苯磺酸索拉非尼一起施用。
当使用已知的抗癌药物时,这类已知的抗癌药物可以其常规的用量给予,或者以较低的剂量给予。
因此,在某些实施方案中,本申请还包括本申请式i化合物与已知抗癌药物(尤其是治疗肝癌的药物)在制备治疗或预防癌症(尤其是肝癌)的药物中的应用。
在其它实施方案中,本申请提供一种药物组合物,该药物组合物含有本申请式i化合物或其药学上可接受的盐与一种或多种已知的抗癌药物。所述药物组合物中本申请式i化合物或其药学上可接受的盐与已知的抗癌药物分别提供,或以两者的混合物的形式提供。药物组合物中,所述已知的抗癌药物的剂量可为该抗癌药物常规使用时的剂量,或者可以较低的剂量使用或含于本申请的药物组合物中。在优选的实施方案中,所述抗癌药物是治疗肝癌的药物,例如甲苯磺酸索拉非尼。在某些实施方案中,该药物组合物中,甲苯磺酸索拉非尼的单位剂量要低于其常规的用于治疗肝癌时的单位剂量。
本申请的药物组合物可以给予任何哺乳动物对象,优选的,所述哺乳动物是人。
下列实施例是举例说明,而不是限制本发明的方法和制剂。其他对于本领域技术人员来说是显而易见的,和在临床治疗中通常会遇到的对各种条件和参数的适当修改和改进,都在本发明的精神和范围内。
实施例1:化合物747的制备
将长苞冷杉干燥的地上部分22kg粉碎成粗粉,用200l的80%乙醇回流提取3次,每次3小时,合并提取液,减压浓缩成25l稠浸膏。浸膏加10l水稀释后分别以氯仿、乙酸乙酯和正丁醇依次萃取,收集各萃取部分,分别浓缩成浸膏。其中乙酸乙酯萃取部分的浸膏300g,以甲醇溶解过滤后进行硅胶柱色谱,以氯仿-甲醇2:1洗脱,用薄层色谱检查洗脱流分,具有相同单一斑点的流分合并,浓缩,得流分1-10,其中第1流分经进一步硅胶色谱纯化,得到黄色无定形粉末,结构鉴定为stenopalustrosided,即山奈酚3-(2,4-二-e-p-香豆酰基鼠李糖苷),共58mg。该化合物结构如下所示,本文命名为化合物747:
化合物747的分子量为724,黄色粉末,极易溶于甲醇、乙醇,易溶于乙酸乙酯、dmso,不溶于水。化合物747的hplc-uv检测和ms(+/-)分别如图23的a和b所示。
核磁数据:
无定形粉末;1hnmr(cd3od,600mhz)δ7.76(2h,d,j=9.0hz,h-2′,6′),7.66(1h,d,j=15.6hz,h-7′″),7.57(1h,d,j=15.6hz,h-7″″),7.48(2h,d,j=8.4hz,h-2′″,6′″),7.43(2h,d,j=9.0hz,h-2″″,6″″),7.02(2h,d,j=8.4hz,h-3′,5′),6.81(2h,d,j=8.4hz,h-3′″,5′″),6.78(2h,d,j=8.0hz,h-3′″,5′″),6.38(1h,d,j=15.6hz,h-8′″),6.32(1h,d,j=1.8hz,h-8),6.29(1h,d,j=15.6hz,h-8″″),6.17(1h,d,j=1.8hz,h-6),5.74(1h,d,j=1.8hz,h-1″),5.61(1h,m,h-2″),5.01(1h,t,j=9.6hz,h-4″),4.22(1h,dd,j=9.6,3.6hz,h-3″),3.33(1h,m,h-5″),0.88(3h,d,j=6.0hz,h3-6″);
13cnmr(cdcl3,150mhz),见表1;
esims(positive)m/z747[m+na]+;esims(negative)m/z723[m-h]-,759[m+cl]-。
表1:化合物747的13cnmr光谱数据
实施例2:化合物747的活性测试
1.实验步骤
1.1细胞迁移
人单核细胞系thp-1(ccr2高表达),96孔transwell(corning3788),hccl2(peprotech),thp-1细胞与药物共孵育30分钟后,取1x105thp-1细胞/孔,下层培养基加入hccl250ng/ml诱导其迁移,6小时后
1.2钙流实验
thp-1细胞稳转钙流指示蛋白gcamp6获得稳转株thp-1gcamp6,thp-1细胞与药物共孵育30分钟后,取1x106thp-1细胞/孔并加入mg2+:2mm,ca2+:2mm,hccl2100ng/ml(peprotech)记录数据(488nm,520nm)。
293ft细胞稳转钙流指示蛋白gcamp6获得稳转株293ft-gcamp6,lipo2000瞬转pcdnatm3.1/v5-hisa-hccr2,48h后,与药物共孵育37度,3h,取1x106细胞/孔,加入mg2+:2mm,ca2+:2mm,hccl2100ng/ml(peprotech),记录数据(488nm,520nm)。
1.3同位素实验
pcdnatm3.1/v5-hisa-hccr2;hccr5;mccr2;mccr5(h:hμman,m:mouse);lipo2000瞬转96孔板chok1.1,3500细胞/孔,同位素配体[125i]mcp-1(nex332,pe),[125i]m-ip-1a(nex298,pe)与药物和细胞共孵育3小时后,加闪烁液,上机记录数据。
1.4腹膜炎实验
4%巯基乙酸盐(sigma),6-8周雄性小鼠腹腔注射1ml,药物组每天给予相应剂量的腹腔注射,对照组每天打等量的注射液。3天后取腹水细胞,记数,流式分析。
1.5小鼠肝癌肿瘤治疗实验与肝癌微环境细胞
小鼠与人肝癌细胞系hepa1-6、lpc,7404,7702,hepg2等实验细胞系均来自上海生科院细胞库或atcc,c57/bl6,balb/c裸鼠(上海斯莱克公司)饲养与spf级动物房内。皮下肿瘤模型接种4周c57/bl6雄性小鼠腹股沟150μl1.5x106细胞/只,肿瘤生长至100mm3左右大小进行分组给药治疗,并追踪肿瘤大小与小鼠体重。巨噬细胞清除剂氯膦酸二钠脂质体(formμmax)清除小鼠体内巨噬细胞,每三天腹腔1次,每次150μl/只。cd8中和性抗体(ebioscience)清除小鼠体内cd8t细胞,每三天1次,每次150μl/只。
原位肿瘤模型将hepa1-6稳定标记荧光素酶后,在c57/bl6小鼠肝脏原位注射100μl1x106细胞,xenogen活体成像系统(perkin-elmer)使用前小鼠注射d-luciferin(alameda,ca,usa)用于荷瘤小鼠活体成像,分组给药治疗并追踪肿瘤进展。所有动物实验用药均由0.5%羟甲基纤维素与0.2%tween-20配置。新鲜的小鼠肿瘤组织分离消化成单细胞(miltenyibiotec),红细胞裂解液去除血红细胞,重悬于facs溶液并抗鼠cd16/32去除非特异性结合,流式抗体对细胞进行染色(4度避光,45分钟),bdariaii上机检测并记录。实验所使用的流式抗体以及溶液购自ebioscience,biolegend,r&d公司。
2.实验结果
在体外实验中,图1显示本发明中747药物能够抑制ccl2-ccr2介导的thp-1迁移能力,并呈现一定的剂量依赖。
图2显示,与现有的ccr2拮抗剂rdc和rs相比,747药物在同浓度10μm能够明显抑制ccl2-ccr2引起的钙流。
图3显示,747在浓度低至100nm依旧展现很好的抑制钙流能力。
由于ccr2与ccr5序列有接近70%相似性,因此是现在开发ccr2专一性拮抗剂的一个难点。但图4和图5显示,在同位素的结合抑制实验中,本发明中的747药物对于ccl2-人ccr2,ccl2-鼠ccr2的半数抑制浓度分别为167.2nm与177.8nm,而对于人ccr5的半数抑制浓度为16547nm,对鼠ccr5并没有展现出抑制能力,这说明747药物能够直接抑制ccr2这一受体并发挥功能,抑制ccr2介导的细胞迁移以及钙流,而对于ccr5的抑制能力则很差,展现了很好的选择性以及敏感性。
体内实验中,图6显示在ccr2介导腹膜炎的巨噬细胞招募的模型中,747也展现了良好的抑制巨噬细胞招募的能力,并呈现一定的剂量依赖。
以上的实验结果说明在体内外747药物都对ccr2有良好的拮抗作用,并能抑制ccr2相关功能,具有很好的选择性以及敏感性的一类新的ccr2拮抗剂。
ccl2-ccr2这一信号通路在肝脏炎症-肝癌的过程被激活并与肝癌的预后也有一定关系。图7显示747对于肝癌细胞系在体外并无明显的细胞毒杀伤作用,而在图8和图9的c57/bl6小鼠的hepa1-6原位肝癌模型中展现出了很好的抑制肿瘤能力,图11中显示肿瘤微环境中杀伤性cd8t细胞明显增多,cd4t细胞没有明显变化。因为ccr2主要表达在巨噬细胞里,少量表达于其他细胞,巨噬细胞在肿瘤微环境中通常发挥免疫抑制功能来促进肿瘤,我们认为这一现象表明,747药物发挥抑制肿瘤的能力不是直接杀伤肿瘤,而是通过抑制ccr2这一靶点来解除微环境中肿瘤巨噬细胞的免疫抑制能力,调动激活cd8t细胞来完成。图10中相对于sorafenib组小鼠体重没有降低,表示747药物该剂量下并没有明显毒性。
为了研究747药物是否通过解除巨噬细胞对cd8t细胞的抑制来发挥抗肝癌的功能,分别使用了巨噬细胞清除剂和cd8中和性抗体来进行研究,在图12中,747治疗组与巨噬细胞清除组展现了相似的肿瘤抑制能力,并且在巨噬细胞清除组747没有明显治疗效果,并且这一治疗效果依赖cd8t细胞,cd8t细胞清除后,治疗效果随即消失。图13为各治疗组对hepa1-6小鼠肝癌皮下肿瘤生长变化测量追踪,图14和图15显示747治疗后hepa1-6小鼠肝癌皮下肿瘤微环境中cd8t细胞显著增多,巨噬细胞tam显著减少。
为了证实747对于肝癌的抑制能力并非hepa1-6细胞系依赖,采用了另一株小鼠肝癌细胞系lpc,构建皮下肿瘤治疗模型,并与现有肝癌临床一线用药sorafenib(甲苯磺酸索拉非尼,商品名:多吉美)联合使用,采用肿瘤靶向加免疫治疗双管齐下,图17为747,低剂量sorafenib,与747联合sorafenib分别治疗lpc小鼠皮下肝癌的结果,图17和图18分别为各组治疗过程肿瘤生长过程的追踪以及肿瘤最终重量。lpc皮下肝癌治疗结果显示低剂量的sorafenib抑制lpc皮下肝癌能力有限,与对照组无明显差异,747具有一定的治疗效果,两种药物联合使用后,能够显著抑制肿瘤生长,并且与对照组与747、sorafenib单独治疗组都有明显差异。图19和图20与显示747治疗lpc小鼠皮下肿瘤后,肿瘤微环境中cd8t细胞显著增多,cd4t细胞无明显变化,巨噬细胞tam显著减少,这一结果与hepa1-6皮下肿瘤结果相似。在图21中,747治疗以后ccr2阳性的细胞出现了显著的减少,与小鼠腹膜炎模型互相印证,说明了747在体内具有良好的ccr2拮抗活性,此外本发明发现747治疗以后微环境中的巨噬细胞数量明显减少后激活cd8t细胞杀伤肿瘤的同时,巨噬细胞的表型也有一定变化,图22显示从m2-免疫抑制型向m1-免疫促进型偏移,协助抑制杀伤肿瘤。
本发明开发了一种天然产物来源的新型的ccr2拮抗剂(实验代号747),通过各种模型认证其对于ccr2的体内体外的拮抗活性以及敏感性和选择性,本发明通过ccr2这一免疫靶点调节了肿瘤微环境,减少肿瘤巨噬细胞的浸润,增加了cd8t细胞达到治疗肿瘤的效果,使用本发明可以产生新的骨架结构的ccr2拮抗剂,可用于肝癌的免疫治疗。本化合物来源于天然产物本身毒性很低,联合现有肝癌一线临床用药sorafenib,利用小鼠肝癌模型进行联合治疗,利用低剂量sorafenib联合本化合物辅助免疫治疗展现了很好的治疗效果,对于现在临床的耐药以及高剂量抗肿瘤药带来毒副作用提供了新的临床应用前景,为临床治疗提供新的思路。
- 还没有人留言评论。精彩留言会获得点赞!