一种基于控酸发酵的红曲黄酒酿造方法与流程
本发明涉及红曲黄酒酿造技术领域,具体涉及一种基于控酸发酵的红曲黄酒酿造方法。
背景技术:
红曲黄酒是福建特产,它是以糯米为主要原料,添加红曲米糖化发酵,配以山泉水精酿而成。研究表明,红曲可代谢产生洛伐他汀、天然红曲红色素等特征性物质,具有降血压、降血脂、抗肿瘤等多种生理功能。近年来,红曲黄酒行业进入了蓬勃发展时期,到2014年,福建省红曲黄酒年生产能力已达12.50万千升,工业总产值达9.57亿元。酸类物质对酒的风味和陈化起重要作用,可作为一种缓冲剂,降低酒体甜味,增加醇厚感,并能协调其它风味物质,使黄酒具有丰富的味觉层次,但是黄酒中的总酸过高会使酒体入口酸刺激感突出,从而影响黄酒的口感和风味。研究表明,江浙一带的黄酒总酸多在5g/l以下,而福建红曲黄酒的酸度多在7g/l以上,有的企业甚至在11g/l以上。据调查,福建每年因黄酒的过度酸化甚至“酸败”而浪费的产品高达10-20%,严重影响了红曲黄酒的品质与消费市场,阻碍了产业的健康发展,成为红曲黄酒加工存在的亟需解决的主要科学问题之一。
红曲黄酒中乳酸占有机酸总量的70%以上,其酸化行为主要发生在发酵前期。在黄酒酿造过程,作用的微生物有曲霉、酵母及乳酸菌等细菌,三者间形成微生物生态环境,相互作用而影响着黄酒的酿造品质。曲霉的优良与否关系到液化和糖化的能力,直接表征为发酵基质中葡萄糖等还原糖含量的高低,从而影响到乳酸菌的生长及代谢;酵母优良与否关系到酒精的发酵力,将直接影响到发酵基质中酒精等浓度的高低,从而影响到乳酸菌的生长及代谢。曲霉、酵母在糖化及酒精的代谢过程虽然会伴随乳酸的产生,但产量较微,对红曲酒酸产量贡献不显著;酒醪中的乳酸主要由乳酸菌为代表的细菌代谢产生。因此,如何控制乳酸菌产乳酸是红曲黄酒酿造过程中控酸发酵的关键因素。
技术实现要素:
本发明的目的在于提供一种基于控酸发酵的红曲黄酒酿造方法。
为了实现上述目的,本发明采用以下技术方案:
一种基于控酸发酵的红曲黄酒酿造方法,原料包括糯米饭、红曲、酵母和水,在原料落缸时,往发酵缸中添加总酸调控因子和酒精度调控因子,使得物料总酸高于1.40g/l,且酒精度高于2.60%,然后酿造得到红曲黄酒。
所述总酸调控因子为黄酒基酒、乳酸、酒糟酶解液乳酸发酵液中的一种或几种的混合物,所述酒精度调控因子为黄酒基酒、酒糟蒸馏酒精中的一种或两种。其中,黄酒基酒是陈酿1-3年的黄酒初酿酒,添加黄酒基酒,可以同时提高酸度和酒精度;酒糟蒸馏酒精是以红曲黄酒糟为原料,添加糖化酶和酵母进行发酵,发酵结束后进行蒸馏得到的酒精,添加酒糟蒸馏酒精可以增加酒精度;乳酸是乳酸菌代谢主要产物,添加乳酸易形成产物抑制,抑制乳酸菌产乳酸;所述酒糟酶解液乳酸发酵液是将酒糟同时使用淀粉酶、糖化酶、纤维素酶、蛋白酶酶解,添加乳酸菌发酵成酒糟酶解液乳酸发酵液,添加酒糟酶解液乳酸发酵液,可以提高红曲黄酒酸度。本发明通过添加总酸调控因子和酒精度调控因子,增加落缸时酒醪的总酸和酒精度,从而抑制乳酸菌的生长,达到抑制过度酸化的目的。同时本发明利用红曲发酵副产物酒糟制备的酒糟蒸馏酒精及其酶解液乳酸发酵液,可实现酿造副产物的综合利用,还具有提高红曲黄酒综合利用率和高值化生产的有益效果。
所述酒糟酶解液乳酸发酵液的制备方法,具体如下:取200-600重量份的酒糟干粉或者取600-3000重量份的新鲜红曲酒糟、800-6000重量份的水、2-60重量份的纤维素酶混合均匀,在40℃-70℃酶解0.5小时-2小时;再向其中加入2-60重量份的α-淀粉酶和2-60重量份的糖化酶混合均匀,在30℃-100℃酶解0.5小时-8小时;再加入2-60重量份的中性蛋白酶混合均匀,制得酶解液,然后在酶解液中接入乳酸菌,15-35℃发酵至总酸达10g/l以上,制得酒糟酶解液乳酸发酵液。
优选的,所述酒糟酶解液乳酸发酵液的添加量占总酸调控因子总量的30-100%。
优选的,所述酒糟蒸馏酒精的添加量占酒精度调控因子总量的50-100%。
本发明所述基于控酸发酵的红曲黄酒酿造方法,包括以下步骤:
1)落缸:将糯米浸泡6-12小时后蒸熟成糯米饭,摊晾冷却,与总酸调控因子、酒精度调控因子、红曲、酵母和水一起加入发酵缸内,混合拌匀,物料总酸高于1.40g/l,且酒精度高于2.60%;
2)发酵:在发酵缸内发酵20-60天,发酵温度10-30℃,制得发酵酒醪,经压榨、除杂、过滤制得初酿酒;
3)压榨过滤:将初酿酒压榨过滤,得到澄清的初酿酒;
4)煎酒:将初酿酒在温度80-85℃下煎酒处理15-30分钟,再冷却至室温;
5)陈酿:将煎酒处理后的初酿酒装坛,密封,入库陈酿半年以上,得到红曲黄酒(干酒基)。
步骤1)中,所述糯米饭、红曲、酵母和水的重量比为100∶4-10∶4-8∶100-140,所述总酸调控因子和酒精度调控因子的添加总量为使得曲水的总酸高于1.40g/l,且酒精度高于2.60%。在本发明中,可以只添加黄酒基酒达到同时控制酸度和酒精度的目的。
步骤3)中,所述初酿酒的总酸<5.0g/l。
本发明基于红曲黄酒酿造过程的酸化问题,研究黄酒酿造过程关键产酸菌与影响产酸菌生长及酸代谢密切相关的糖、酸、初始酒度、发酵温度等条件,通过大量试验证实了乳酸菌为红曲黄酒酿造过程的生长及产酸优势细菌菌群,而酒精度和乳酸添加量是影响乳酸菌生长和产酸的关键因素。因此,本发明在红曲黄酒的酿造过程中,通过调控起始的曲水总酸度及酒精度,达到抑制红曲黄酒产酸的作用,以实现控酸发酵,抑制黄酒酸败。
本发明对提高红曲黄酒的品质和附加值、扩大红曲黄酒市场占有率及推动红曲黄酒产业的发展具有重要的意义,应用前景广阔。
附图说明
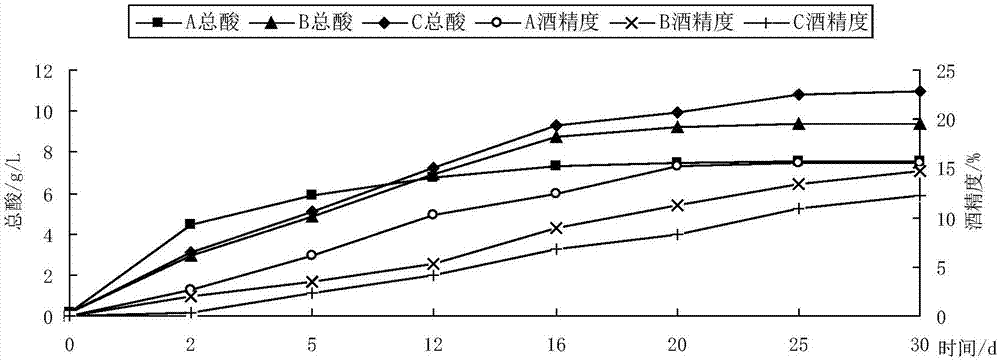
图1为红曲黄酒发酵过程总酸及酒精度的变化;
图2为属水平下红曲黄酒酿造过程细菌菌群丰度的变化;
图3添加基酒共发酵对古田红曲黄酒总酸的影响;
图4添加基酒共发酵对乌衣红曲黄酒总酸的影响;
图5添加基酒共发酵对古田红曲黄酒酒精度的影响;
图6添加基酒共发酵对乌衣红曲黄酒酒精度的影响。
具体实施方式
实施例1红曲黄酒酿造过程产酸关键菌解析
1材料
大米:永安圆糯米,市购。
酿酒红曲米:选取产酸能力具有显著差异的酿酒红曲米样品3份,编号分别为10-3#、16#、12#。
2方法及结果
2.1红曲黄酒发酵过程的菌群变化
在前期试验基础上,采用高液化糖化高出酒率红曲米10-3#(a)、低液化糖化高出酒率红曲米16#(b)、高液化糖化低出酒率红曲米12#(c)为研究对象发酵红曲黄酒,发酵第0、2、5、12、16、20、25、30d取样检测发酵液总酸和酒精度,收集0、2、5、16d发酵液10g至于-80℃冰箱冻藏,发酵结束后统一送上海派森诺生物有限公司检测其细菌菌群结构,研究目标发酵液在发酵过程中乳酸菌菌群组成及其结构特征,明确生长优势菌。每处理平行3次。
(1)红曲黄酒发酵过程总酸及酒精度的变化
红曲黄酒发酵过程总酸及酒精度的变化如图所示,由图1可见,各红曲米在发酵过程中发酵液总酸呈先快速增加,当酒度达到10%以上后趋于平缓的趋势;红曲米间产酸水平存在差异,发酵结束后试验组a产酸水平最低,其次为试验组b,试验组c的产酸水平最高,各处理间的差异达极显著水平(p<0.01)。在发酵过程中发酵液酒精度呈上升趋势,红曲米间酒精发酵水平存在差异,试验组a的酒精发酵速率最快且产酒精水平最高,其次为试验组b,试验组c的酒精发酵速率最低且产酒精水平最低,差异达极显著水平(p<0.01)。红曲黄酒30天的产酸水平(y)与发酵前期(前16d)的酒精发酵速率(x)呈线性负相关关系(y=-0.9604x+14.915,r2达0.991)。酒精发酵速率越大,产酸水平赿低。
(2)酿造过程细菌菌群丰度的变化
目水平下红曲黄酒酿造过程细菌菌群丰度的变化见表1、图2。红曲米的细菌菌群主要有乳酸菌(lactobacillales)、芽孢杆菌(bacillales)、红螺菌(rhodospirillales)、伯克霍尔德氏菌(burkholderiales)、放线菌(actinomycetales)等,由于不同地域和企业生产工艺和环境上的差异,各试验组红曲米的细菌菌群丰度存在差异。在红曲黄酒发酵过程中,在短期内,乳酸菌得以快速繁殖,各试验组的乳酸菌丰度均最高,平均在80%以上,而其他细菌受到乳酸菌生长的抑制,菌群丰度快速下降至10%以下,说明乳酸菌为红曲黄酒酿造过程的生长及产酸优势细菌菌群。随着发酵过程发酵液中酒精度的提高,乳酸菌的生长和产酸水平逐渐受到抑制,其菌群丰度和产酸能力逐渐下降。结果表明,红曲黄酒酿造过程的产酸关键菌群为乳酸菌。
表1目水平下红曲黄酒酿造过程细菌菌群丰度的变化
(3)红曲黄酒酿造过程乳酸菌菌群丰度的变化
从发酵过程,乳酸菌丰度的变化可以看出(表2),红曲黄酒酿造过程优势乳酸菌群主要有四种即:leuconostocaceaeunclassified(明串珠菌科未知属)、pediococcus(片球菌属)、lactobacillaceaeunclassified(乳杆菌科未知属)和lactobacillus(乳杆菌属)。不同地域和企业制备的红曲米发酵剂存在微生物多样性差异,在发酵过程优势乳酸菌也存在差异,而随着发酵过程发酵液中酸和酒精度的提高,发酵不同时期其优势乳酸菌也会出现变化。发酵前期的酒精度较低,优势乳酸菌群为leuconostocaceaeunclassified(a、b、c)、pediococcus(a、c)和lactobacillus(b)。随着发酵酒精度和酸的增加,因乳酸菌的耐酒精及酸水平存在差异,leuconostocaceaeunclassified和lactobacillus首先被抑制,菌群丰度逐渐下降,而pediococcus(a、c)和lactobacillaceaeunclassified(a、b)酒精和酸的耐受性相对更强,为发酵后期的优势乳酸菌群。
表2红曲黄酒酿造过程乳酸菌菌群丰度的变化
综上可知,乳酸菌为红曲黄酒酿造过程的生长及产酸优势细菌菌群,发酵不同时期的优势乳酸菌群有所不同,后续对优势乳酸菌进行分离、纯化及产酸能力的检验。
2.2优势乳酸菌的分离、纯化、验证
采用tja、mrs培养基(加0.5g/ll-盐酸半胱氨酸和50mg/l放线菌酮),通过纯培养法对各处理发酵不同时期的优势乳酸菌进行分离纯化,共分离出乳酸菌22株。采用16srrna基因测序鉴定进一步分析,这些乳酸菌被分别鉴定为leuconostocmesenteroidessubsp.mesenteroides(肠膜明串珠菌肠膜亚种,3株)、lactobacillusplantarum(植物乳杆菌,5株)、lactobacillusfermentum(发酵乳杆菌,7株)、pediococcuspentosaceus(戊糖片球菌,2株)和pediococcusacidilactici(乳酸片球菌,5株)。这些菌均属于2.1分析出的红曲黄酒酿造过程优势乳酸菌群,即leuconostocaceaeunclassified(明串珠菌科未知属)、pediococcus(片球菌属)、lactobacillaceaeunclassified(乳杆菌科未知属)和lactobacillus(乳杆菌属)。
2.3优势乳酸菌产酸能力检验
将2.2分离出的乳酸菌菌株接入mrs培养基活化24h后,以1%的接种量接入糯米糖化液中,发酵24h检测其产酸及产酶水平,对各优势乳酸菌的产酸能力进行检验。
试验结果如表3所示,不同种乳酸菌、同种不同菌株的乳酸菌产酸水平均存在差异(p<0.01)。lactobacillusplantarum、lactobacillusfermentum、pediococcuspentosaceus和pediococcusacidilactici均具有较强的产酸能力,其中,lactobacillusplantaruml34、lactobacillusfermentumt44、pediococcuspentosaceuss18及pediococcusacidilacticit24的产酸能力均高于同种其他菌株,差异达极显著水平(p<0.01)。3株leuconostocmesenteroidessubsp.mesenteroides的产酸能力均较弱,这可能与其耐酸水平较低有关。
表3各菌株的产酸能力(g/l)
本实施例在前期试验基础上,采用不同产酸水平的红曲米为研究对象发酵红曲黄酒,采用宏基因组学技术解析目标发酵液在发酵过程中菌群组成及其结构特征,明确了红曲黄酒酿造过程的产酸关键菌群为乳酸菌,然后结合纯培养法分离获得生长优势乳酸菌并检验其产酸能力,结果表明,在红曲黄酒酿造过程中,leuconostocmesenteroidessubsp.mesenteroidesl16、lactobacillusplantaruml34、lactobacillusfermentumt44、pediococcuspentosaceuss18和pediococcusacidilacticit24具有较高的产酸水平,可作为产酸关键乳酸菌代表菌株进行后续试验。
实施例2红曲黄酒酿造过程酸化行为机制研究
1材料
1.1试验菌株
(1)酵母菌:
酿酒酵母jh301:由福建省农产品(食品)加工重点实验室选育并保存。
(2)乳酸菌:
leuconostocmesenteroidessubsp.mesenteroidesl16、lactobacillusplantaruml34、lactobacillusfermentumt44、pediococcuspentosaceuss18及pediococcusacidilacticit24:由福建省农产品(食品)加工重点实验室选育并保存。
1.2培养基
(1)大米糖化液培养基:
按米饭与水比例为1:1和1:10,按淀粉酶、糖化酶用量分别为每g米饭70u、560u添加α-淀粉酶和糖化酶,60℃酶解2h,冷却,备用。酶解后基质固形物3.5%-35%、总酸0.23g/l、ph值6.0。
(2)乳酸菌培养基:
改良mrs培养基:酵母膏0.5%,牛肉膏1%,胰蛋白胨1.5%,乙酸钠0.5%,柠檬酸铵0.2%,mnso40.005%,mgso40.02%,葡萄糖2%,tween-800.1%(体积分数),番茄汁10%(体积分数),ph4.8。同时添加加0.5g/ll-盐酸半胱氨酸和50mg/l放线菌酮抑制酵母菌的生长。
2方法与结果
考察环境干预条件对产酸关键乳酸菌生长及产酸的影响
以leuconostocmesenteroidessubsp.mesenteroidesl16、lactobacillusplantaruml34、lactobacillusfermentumt44、pediococcuspentosaceuss18及pediococcusacidilacticit24及其混菌为目标菌,采用u18(95×61)(5因素9水平+1因素6水平)均匀设计试验,考察可溶性固形物x1(5、8、11、14、17、20、23、26、29%)、酒精度x2(0、1、2、3、4、5、6、7、8%)、酿酒酵母jh301添加量x3(0、1、2、3、4、5、6、7、8%)、乳酸添加量x4(0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0g/l)、、绿茶提取物x5(0、0.25、0.5、0.75、1.0、1.25、1.5、1.75、2.0%)温度x6(15、20、25、30、35、40℃)等因素对乳酸菌生长、产酸的影响,因素水平见表4,明确抑制乳酸菌产酸的主要影响因子。
总酸测定方法:参照gb/t13662-2008《黄酒》进行,指示计法,以乳酸计。
乳酸菌菌落总数测定方法:gb/t4789.35-2003[食品卫生微生物学检验—乳酸菌饮料中乳酸菌检验],平板菌落计数法。
表4因素水平表
(1)环境条件对乳酸菌产酸的影响
表5环境条件对乳酸菌产酸的影响(g/l)
对均匀设计结果进行二次多项式回归分析,剔除不显著项后,得到环境因素对各菌株生长能力的影响的二次多项式回归方程为:
l34:y=8.725-1.477x3-0.203x22-0.541x62;
t44:y=11.738-0.358x3-0.0659x22-0.131x62;
t24:y=13.262-1.561x3-0.0646x22-0.110x62;
s18:y=10.923-0.278x3-0.073x22-0.110x62;
l16:y=11.566-0.896x2-0.244x3-0.482x6-0.0247x42。
结果表明,l34、t44、t24和s18的生长与x2(酒精度)、x6(发酵温度)和x3(jh301添加量)呈显著负相关关系。l16的生长与x2(酒精度)、x6(发酵温度)、x3(jh301添加量)、x4(乳酸添加量)呈显著负相关关系。这可能与l16耐酸水平较低有关。
(2)环境条件对乳酸菌菌量的影响
表6环境条件对乳酸菌菌量的影响(logcfu/kg)
对均匀设计结果进行二次多项式回归分析,剔除不显著项后,得到环境因素对各菌株产酸能力的影响的二次多项式回归方程为:
l34:y=2.276+2.512x6-0.0634x22-0.0195x42-0.380x62;
t44:y=4.884-0.660x2+2.508x6-0.0210x42-0.387x62;
t24:y=4.400-0.563x2+1.133x6-0.0139x42-0.187x62;
s18:y=2.781+2.487x6-0.0678x22-0.0226x42-0.383x62;
l16:y=3.182-0.513x2+1.385x6-0.0139x42-0.211x62
结果表明,l34、t44、t24、s18和l16的产酸水平与x2(酒精度)、和x4(乳酸添加量)呈显著负相关关系,与x6(发酵温度)呈先上升后下降的关系,差异达显著水平。
由本实施例可知,酒精度和乳酸添加量是影响乳酸菌生长和产酸的关键因素。因此,在红曲黄酒的酿造过程中可通过调控起始的酒度及酸度,可以达到抑制红曲黄酒产酸菌的作用,以实现控酸发酵,抑制黄酒酸败。
实施例3
根据前期研究初步表明,通过调控起始的酒度及酸度,可以达到抑制红曲黄酒产酸菌的作用,以实现调控发酵红曲控酸发酵,抑制黄酒酸败。本实施例通过添加黄酒基酒以达到控制酸度和酒精度的目的。
1材料
大米:永安圆糯米,市购。
红曲米:宁德市古田红曲米、乌衣红曲米:市购。
发酵用水:宁德市蕉城区洋中天湖凤尾山泉水。
初酿酒基酒:宁德市黄家酒业有限公司2017年制备红曲黄酒初酿酒基酒,总酸为7.26g/l,ph值4.00,酒精度15.1%。
2控酸发酵工艺与结果
按表1方案分别添加糯米饭、水、红曲米及初酿酒基酒共发酵,于20±2℃条件下发酵5、15、40、60d后取样检测红曲黄酒总酸及酒精度的变化,发酵结束后检测红曲黄酒总糖及非糖可溶性固形物含量,考察控酸发酵技术对红曲黄酒品质的影响。
酒精度、总酸、总糖及非糖可溶性固形物含量的测定:按照gb/t13662—2008黄酒进行。
表7红曲黄酒陶缸发酵配料表
2.1添加基酒共发酵对红曲黄酒总酸的影响
由图3、4可知,添加一定量基酒共发酵对红曲黄酒总酸的增加起到了显著的抑制作用。发酵40d后,在古田红曲组,基酒添加量达20%、30%的黄酒总酸分别较传统工艺红曲黄酒gck低了42.69%、42.24%,差异均达极显著水平(p<0.01);基酒添加量为5%、10%的黄酒与gck的差异并不显著(p>0.05)。在乌衣红曲组,基酒添加量达20%的黄酒总酸较传统工艺红曲黄酒wck低了36.99%,差异达极显著水平(p<0.01);基酒添加量为10%的黄酒与wck的差异并不显著(p>0.05)。
因此,在落缸时,控制总酸和酒精度可显著抑制黄酒酸化行为,使总酸降低,初酿酒基酒适宜的添加量为20%。此时古田红曲组、乌衣红曲组的初始物料总酸为1.45、1.41g/l,酒精度为2.73%、2.61%,说明当总物料起始总酸高于1.40g/l,起始酒精度高于2.60%时,可达到控制总酸增加的目的。
2.2添加基酒共发酵对红曲黄酒酒精度的影响
由图5、6、表8可知,发酵40d后,不论是古田红曲组还是乌衣红曲组,添加基酒的处理酒精度和总糖含量均于传统红曲黄酒对照无显著差异(p>0.05),说明在落缸时,控制酸度和酒精度并不会影响酵母菌的产酒能力。
表8添加基酒共发酵对红曲黄酒总糖的影响
实施例4
一种基于控酸发酵的红曲黄酒酿造方法,包括以下步骤:
1)落缸:将糯米浸泡8小时后蒸熟成糯米饭,摊晾冷却,与黄酒基酒、糟烧酒、乳酸、红曲、酵母和水一起加入发酵缸内,混合拌匀;
其中,糯米饭、红曲、酵母和水的重量比为100∶6∶6∶120,黄酒基酒、糟烧酒、乳酸的添加总量为使得物料的总酸为1.40g/l,且酒精度为2.6%;
2)发酵:在发酵缸内发酵40天,发酵温度20℃,制得发酵酒醪,经压榨、除杂、过滤制得初酿酒,其总酸为4.9g/l;
3)压榨过滤:将初酿酒压榨过滤,得到澄清的初酿酒;
4)煎酒:将初酿酒在温度83℃下煎酒处理20分钟,再冷却至室温;
5)陈酿:将煎酒处理后的初酿酒装坛,密封,入库陈酿半年以上,得到红曲黄酒。
实施例5
一种基于控酸发酵的红曲黄酒酿造方法,包括以下步骤:
1)落缸:将糯米浸泡6小时后蒸熟成糯米饭,摊晾冷却,与黄酒基酒、糟烧酒、红曲、酵母和水一起加入发酵缸内,混合拌匀;
其中,糯米饭、红曲、酵母和水的重量比为100∶4∶4∶100,黄酒基酒、糟烧酒的添加总量为使得物料的总酸为1.65g/l,且酒精度为3.1%;
2)发酵:在发酵缸内发酵20天,发酵温度30℃,制得发酵酒醪,经压榨、除杂、过滤制得初酿酒,其总酸为4.73g/l;
3)压榨过滤:将初酿酒压榨过滤,得到澄清的初酿酒;
4)煎酒:将初酿酒在温度80℃下煎酒处理30分钟,再冷却至室温;
5)陈酿:将煎酒处理后的初酿酒装坛,密封,入库陈酿半年以上,得到红曲黄酒。
实施例6
一种基于控酸发酵的红曲黄酒酿造方法,包括以下步骤:
1)落缸:将糯米浸泡12小时后蒸熟成糯米饭,摊晾冷却,与黄酒基酒、乳酸、红曲、酵母和水一起加入发酵缸内,混合拌匀,
其中,所述糯米饭、红曲、酵母和水的重量比为100∶10∶8∶140,黄酒基酒与乳酸的添加总量为使得物料的总酸为1.83g/l,且酒精度为4.0%;
2)发酵:在发酵缸内发酵60天,发酵温度10℃,制得发酵酒醪,经压榨、除杂、过滤制得初酿酒,其总酸为4.45g/l;;
3)压榨过滤:将初酿酒压榨过滤,得到澄清的初酿酒;
4)煎酒:将初酿酒在温度85℃下煎酒处理15分钟,再冷却至室温;
5)陈酿:将煎酒处理后的初酿酒装坛,密封,入库陈酿半年以上,得到红曲黄酒。
实施例7
一种基于控酸发酵的红曲黄酒酿造方法,包括以下步骤:
1)落缸:将糯米浸泡10小时后蒸熟成糯米饭,摊晾冷却,与黄酒基酒、酒糟酶解液乳酸发酵液、红曲、酵母和水一起加入发酵缸内,混合拌匀,
其中,糯米饭、红曲、酵母和水的重量比为100∶8∶6∶125,黄酒基酒和酒糟酶解液乳酸发酵液的添加总量为使得物料的总酸为2.0g/l,且酒精度为5.1%;
2)发酵:在发酵缸内发酵45天,发酵温度25℃,制得发酵酒醪,经压榨、除杂、过滤制得初酿酒,其总酸为4.0g/l;;
3)压榨过滤:将初酿酒压榨过滤,得到澄清的初酿酒;
4)煎酒:将初酿酒在温度80℃下煎酒处理25分钟,再冷却至室温;
5)陈酿:将煎酒处理后的初酿酒装坛,密封,入库陈酿半年以上,得到红曲黄酒。
实施例8
一种基于控酸发酵的红曲黄酒酿造方法,包括以下步骤:
1)落缸:将糯米浸泡6小时后蒸熟成糯米饭,摊晾冷却,与酒糟酶解液乳酸发酵液、酒糟蒸馏酒精、红曲、酵母和水一起加入发酵缸内,混合拌匀;
其中,糯米饭、红曲、酵母和水的重量比为100∶5∶5∶100,酒糟酶解液乳酸发酵液、酒糟蒸馏酒精的添加总量为使得物料的总酸为1.67g/l,且酒精度为3.5%;
2)发酵:在发酵缸内发酵20天,发酵温度30℃,制得发酵酒醪,经压榨、除杂、过滤制得初酿酒,其总酸为4.71g/l;
3)压榨过滤:将初酿酒压榨过滤,得到澄清的初酿酒;
4)煎酒:将初酿酒在温度85℃下煎酒处理30分钟,再冷却至室温;
5)陈酿:将煎酒处理后的初酿酒装坛,密封,入库陈酿半年以上,得到红曲黄酒。
实施例9
一种基于控酸发酵的红曲黄酒酿造方法,包括以下步骤:
1)落缸:将糯米浸泡12小时后蒸熟成糯米饭,摊晾冷却,与乳酸、酒糟酶解液乳酸发酵液、酒糟蒸馏酒精、红曲、酵母和水一起加入发酵缸内,混合拌匀,
其中,所述糯米饭、红曲、酵母和水的重量比为100∶8∶8∶140,乳酸、酒糟酶解液乳酸发酵液、酒糟蒸馏酒精的添加总量为使得物料的总酸为1.85g/l,且酒精度为4.2%;
作为酸度调控因子的乳酸、酒糟酶解液乳酸发酵液的用量比为7:3;
2)发酵:在发酵缸内发酵60天,发酵温度15℃,制得发酵酒醪,经压榨、除杂、过滤制得初酿酒,其总酸为4.43g/l;;
3)压榨过滤:将初酿酒压榨过滤,得到澄清的初酿酒;
4)煎酒:将初酿酒在温度85℃下煎酒处理15分钟,再冷却至室温;
5)陈酿:将煎酒处理后的初酿酒装坛,密封,入库陈酿半年以上,得到红曲黄酒。
实施例10
一种基于控酸发酵的红曲黄酒酿造方法,包括以下步骤:
1)落缸:将糯米浸泡10小时后蒸熟成糯米饭,摊晾冷却,与酒糟酶解液乳酸发酵液、酒糟蒸馏酒精、黄酒基酒、红曲、酵母和水一起加入发酵缸内,混合拌匀,
其中,糯米饭、红曲、酵母和水的重量比为100∶10∶8∶125,酒糟酶解液乳酸发酵液、酒糟蒸馏酒精、黄酒基酒的添加总量为使得物料的总酸为2.0g/l,且酒精度为5.1%;
作为酒精度调控因子的酒糟蒸馏酒精、黄酒基酒的用量比为1:1;
2)发酵:在发酵缸内发酵45天,发酵温度25℃,制得发酵酒醪,经压榨、除杂、过滤制得初酿酒,其总酸为4.0g/l;;
3)压榨过滤:将初酿酒压榨过滤,得到澄清的初酿酒;
4)煎酒:将初酿酒在温度80℃下煎酒处理25分钟,再冷却至室温;
5)陈酿:将煎酒处理后的初酿酒装坛,密封,入库陈酿半年以上,得到红曲黄酒。
实施例11
一种基于控酸发酵的红曲黄酒酿造方法,包括以下步骤:
1)落缸:将糯米浸泡10小时后蒸熟成糯米饭,摊晾冷却,与乳酸酒糟酶解液乳酸发酵液、酒糟蒸馏酒精、黄酒基酒、红曲、酵母和水一起加入发酵缸内,混合拌匀,
其中,糯米饭、红曲、酵母和水的重量比为100∶8∶6∶125,酒糟酶解液乳酸发酵液、酒糟蒸馏酒精、黄酒基酒的添加总量为使得物料的总酸为2.0g/l,且酒精度为5.1%;
其中乳酸、酒糟酶解液乳酸发酵液的用量比为3:7,酒糟蒸馏酒精、黄酒基酒的用量比为8:2;
2)发酵:在发酵缸内发酵45天,发酵温度25℃,制得发酵酒醪,经压榨、除杂、过滤制得初酿酒,其总酸为4.0g/l;;
3)压榨过滤:将初酿酒压榨过滤,得到澄清的初酿酒;
4)煎酒:将初酿酒在温度80℃下煎酒处理25分钟,再冷却至室温;
5)陈酿:将煎酒处理后的初酿酒装坛,密封,入库陈酿半年以上,得到红曲黄酒。
实施例12
本发明使用的酒糟酶解液乳酸发酵液是将酒糟同时使用淀粉酶、糖化酶、纤维素酶、蛋白酶酶解,添加乳酸菌发酵而成的,具体制备方法如下:
取200-600重量份的酒糟干粉或者取600-3000重量份的新鲜红曲酒糟、800-6000重量份的水、2-60重量份的纤维素酶混合均匀,在40℃-70℃酶解0.5小时-2小时;再向其中加入2-60重量份的α-淀粉酶和2-60重量份的糖化酶混合均匀,在30℃-100℃酶解0.5小时-8小时;再加入2-60重量份的中性蛋白酶混合均匀,制得酶解液,在酶解液中以106cfu/ml的接种量接入乳酸菌,15-35℃发酵至总酸达10g/l以上,制得酒糟酶解液乳酸发酵液。
- 还没有人留言评论。精彩留言会获得点赞!