一种高产凝乳酶的方法及其所产凝乳酶与流程
本发明属于生物工程
技术领域:
,特别涉及一种高产凝乳酶的方法及其所产凝乳酶。
背景技术:
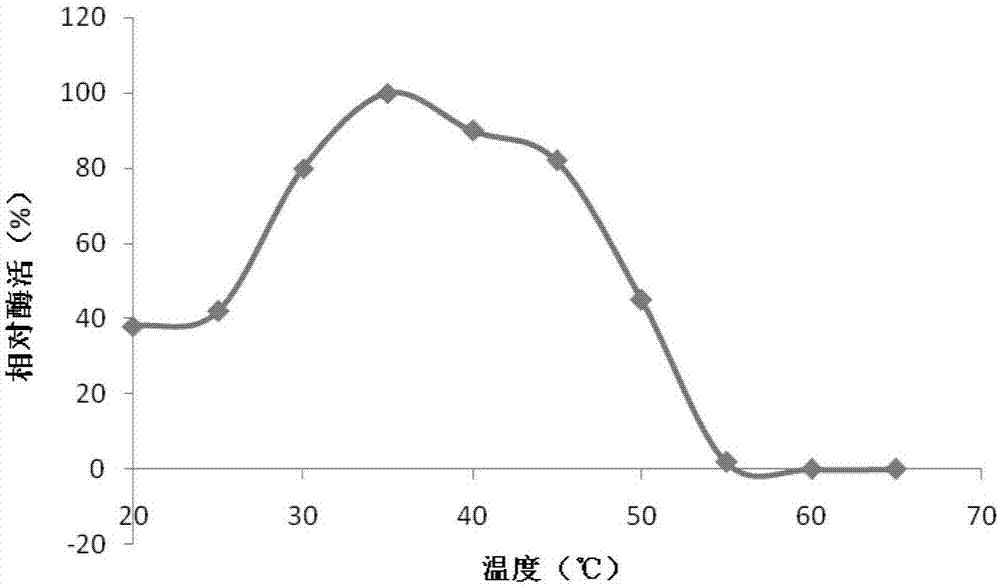
:凝乳酶是干酪制作过程中起凝乳作用的关键性酶,是一种最早在未断奶的小牛胃中发现的天门冬氨酸蛋白酶,可专一地切割乳中κ-酪蛋白的phe105-met106之间的肽键,破坏酪蛋白胶束使牛奶凝结,凝乳酶的凝乳能力及蛋白水解能力使其成为干酪生产中形成质构和特殊风味的关键性酶,被广泛地应用于奶酪和酸奶的制作。传统生产主要是利用牛犊第四胃的皱胃酶提取制作凝乳酶,近来凝乳酶的来源不断扩大,目前包括三类:动物性凝乳酶,来源于牛胃、猪胃和羊胃;植物性凝乳酶,来源于无花果树液和菠萝果实;微生物凝乳酶,来源于霉菌和酵母菌。由于微生物具有生长繁殖速度快,来源广等特点使之成为凝乳酶的主要来源。凝乳酶是奶酪生产中首要的催化剂,并且高的凝乳酶活性(mca)会伴随着较低的蛋白酶活性,这样,会使得奶酪生产更高效,高质。但是,微生物生产的凝乳酶存在蛋白水解能力高,特异性不强等缺点。我们需要利用一些生物技术,对菌种进行优化选育和改良,提高产品产量和质量。近年来国内外多位学者对凝乳酶的作用机理、酶学性质、酶固定化、基因克隆表达等方面做了大量工作取得了明显进展。近几年随着我国液体乳的快速发展,越来越多的企业及科研单位开始重视奶酪的开发,奶酪的制作工艺在国内已经广为传之。然而,奶酪的味道并不能为大部分人所接受,这是制约奶酪在国内市场发展的重要因素之一。因此从各个方面了解奶酪的成熟机理,改善优化奶酪的口味,使之为我国人民所接受有着重要的意义。与此同时,我们知道发酵食品的风味与微生物有着不可分割的关系,所以微生物在奶酪发酵成熟的作用是现在也应该是未来我们所关注的一个方向。技术实现要素:本发明的目的在于提供一种高产凝乳酶的方法及其所产凝乳酶。本实验室经物理诱变和化学复合诱变后得到一株凝乳酶高产突变菌株ghm356,经鉴定其属于微小毛霉(mucorpusillus),该菌株已于2017年7月13日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmccno.14136。该菌株是由微小毛霉h23经常温常压等离子体诱变和亚硝基胍复合诱变选育获得。微小毛霉h23摇瓶凝乳酶发酵最高酶活为3500u/ml,发酵过程中孢子量多,菌丝结球,发酵液较为粘稠不利于传质。该菌株经诱变后孢子产量减少,菌丝不宜结球,摇瓶最高凝乳酶活为26530u/ml。该突变株在工业放大生产时,通过补料条件优化使微小毛霉突变菌株ghm356的发酵酶活达到272000u/ml以上。除此之外,该突变菌株的蛋白酶活力显著降低,因此,使得该突变菌株产生的酶稳定性较好、专一性强,用其制备的奶酪的口感和品质较好。本发明所述微小毛霉突变株ghm356液体发酵技术主要包括如下步骤:培养条件与方法:发酵罐培养:将种子罐中的种子液按照接种量7%的比例接入发酵罐培养基,培养条件为初始ph5.5、37℃、300-800rpm,当溶氧降至最低再升至20%时,开始补料,控制溶氧在20%-30%;发酵至菌体自溶严重,酶活无明显提高时放罐;发酵周期为120h左右;进一步地,种子罐培养方法如下:将摇瓶发酵后的种子液按照接种量5%的比例接入种子罐培养基,在初始ph5.5、37℃、转速300-800rpm条件下培养36h;所述凝乳酶的提取与精制方法如下:按发酵液体积加入3%珍珠岩助滤剂,进行板框压滤;用超滤膜对澄清压滤酶液进行超滤浓缩;在浓缩液中加入稳定剂8%葡萄糖、氯化钠10%,防腐剂0.15%山梨酸钾,然后用硅藻土进行过滤除菌,即得到凝乳酶成品酶制剂。所述凝乳酶的酶学性质如下:温度:最适反应温度为35℃;35℃条件下保温1h仍能保持90%以上的活性,当温度升至40℃时,酶活随着保温时间的延长酶活下降为75%左右,45℃时其热稳定性明显减弱。ph:最适ph为4.0;在ph1.0-8.0的条件下24h后,相对酶活力仍然保持在75%以上。有益效果:1、本发明首先提供了一株高产凝乳酶的微小毛霉突变菌株,利用该菌株进行工业化发酵生产的发酵酶活水平可达到272000u/ml以上,大大降低了生产成本,有利于凝乳酶的大规模应用,节能减排。2、该突变菌株所产的凝乳酶特征是最适反应温度为35℃,在40℃条件下保温1h仍能保持90%以上的活性;最适反应ph为3.5,在ph3.0-7.0的条件下24h后,相对酶活力仍然保持在85%以上,可以广泛的应用于奶酪制作行业。3、诱变菌株ghm356的mca/pa为31.0,是出发菌株的10.6倍,可见诱变菌株ghm356所产凝乳酶具有较好的特异性。附图说明:图1本发明凝乳酶最适反应温度曲线;图2本发明凝乳酶热稳定性曲线;图3本发明凝乳酶最适反应ph曲线;图4本发明凝乳酶ph稳定性曲线。具体实施方式:以下通过具体实施例对本发明做更详细的说明,具体实施案例仅为举例说明,不作为对本发明实施范围的限定。本发明实施例所用培养基如下(如未特别说明,“%”指质量体积百分比):1)斜面培养基配制如下:麦芽汁40培养基,琼脂1.5%,121℃灭菌20min,备用。2)筛选平板培养基配制如下:蔗糖30g,蛋白胨10g,牛肉膏5g,淀粉10g,脱脂奶粉20g,琼脂20g,水1000ml;调ph6.0,121℃灭菌20min,备用;3)种子培养基配方:葡萄糖4%、酵母粉2.5%、nano30.4%、kcl0.15%;ph自然。4)摇瓶发酵培养基配方为:小麦淀粉3.6%,酵母粉3.2%,蛋白胨2.5%,葡萄糖2.8%,麸皮2.5%,cmc1.6%,kh2po40.15%,cacl20.005%,调ph6.0,121℃灭菌20min;5)种子罐培养基配方为:葡萄糖2%,酵母膏1%,糊精5%,大豆分离蛋白1.3%,磷酸氢二钾0.2%,硫酸铵0.1%,玉米浆1.5%,ph5.5,121-123℃灭菌30-40min;6)发酵罐培养基配方为:小麦淀粉2.3%,大豆分离蛋白3.5%,黄豆粉3.2%,甘油3.2%,磷酸二氢钾2.1%,硫酸镁0.2%,其余为水,ph5.5,121-123℃灭菌30-40min;7)补料培养基配方为:玉米淀粉25%,豆饼粉5.2%,玉米浆2.3%,硫酸铵0.5%,磷酸二氢钾0.2%,其余为水,ph5.5。实施例1菌株的诱变选育1)原生质体的制备取一株出发菌株微小毛霉h23的新鲜培养斜面,用无菌生理盐水洗脱菌体,转移至装有玻璃珠的三角瓶中,置于摇床振荡30min使菌体分散,用无菌脱脂棉过滤,收集单孢子,用生理盐水调整单孢子浓度为106个/ml左右,将孢子悬液接种到菌丝液体生长培养基中。收集长至对数生长期的菌丝体,用0.6m山梨醇渗透压稳定剂(0.1m柠檬酸缓冲+0.6m山梨醇+0.01medta)悬浮,离心洗涤后收集菌丝体,用渗透压稳定剂悬浮,置冰中备用。然后加入溶壁酶1%、蜗牛酶1%、纤维素酶2%、溶菌酶0.5%,在37℃条件下进行酶解1.5-2h,期间随时取样镜检原生质体的制备情况,选择合适的酶解时间,制得原生质体备用,其中原生质体制备率和再生率的计算方法如下:在普通培养基培养并计菌落数为a;将原生质体悬浮液稀释一定倍数,在普通培养基培养并计菌落数为b;在高渗再生培养基培养并计菌落数为c。原生质体制备率=(a-b)/a╳100%原生质体再生率=(c-b)/(a-b)╳100%普通培养基:蔗糖30g,蛋白胨10g,牛肉膏5g,淀粉10g,琼脂20g,水1000ml;再生培养基:蔗糖30g,蛋白胨10g,牛肉膏5g,淀粉10g,1.2m山梨醇,50mm氯化钙,琼脂20g,水1000ml。2)常温常压等离子体诱变开启常温常压等离子体诱变系统,以酒精棉擦拭操作室内外,并开启紫外灯灭菌30min。灭菌结束后取10μl制备好的原生质体点于载片的粗糙面,并在无菌条件下将载片以镊子转移至操作室台面上。开启氦气阀门,设定气流量和诱变时间进行诱变。诱变时间分别设定为20s、40s、60s、80s、100s。每次诱变结束后均将载片置于含990μl无菌生理盐水的ep管中,漩涡震荡1min。经适当稀释后涂布于筛选平板上,后置于37℃培养箱内培养3d,选择hc值(hc值=凝乳圈直径/菌落直径)较大的菌株进行摇瓶复筛。选择凝乳酶产量较高,并且能够稳定遗传3代以上的菌株,选择酶活提高最大的突变株作斜面保藏,并且作为进一步亚硝基胍诱变的出发菌株。3)亚硝基胍诱变按照表1加入制备好的原生质体悬液、ntg母液和tris缓冲液。然后将含有20ml诱变体系的摇管分别于37℃,100r/min往复震荡培养30min,转移至50ml具塞离心管中。5000r/min,10min离心分离菌体,将上清小心倒入碱水中。将菌体沉淀用tris缓冲液洗涤2-3次,重悬至10ml,即为诱变后菌悬液(ntg母液的浓度:0.01275g/10ml)。选择菌体生存率为1%-50%的剂量作为诱变剂量。重复上述步骤进行亚硝基胍诱变以及筛选,筛选出一株凝乳酶高产菌株ghm356。表1.ntg诱变体系0#1#2#3#原生质体/ml2222ntg母液/ml0123tris缓冲液/ml18171615总体积/ml202020204)凝乳酶高产菌株微小毛霉ghm356的稳定性传代实验将凝乳酶高产菌株微小毛霉ghm356培养好的新鲜斜面,用无菌铁铲取一接种环菌苔接种到发酵摇瓶中,37℃,240r/min培养4d,测定酶活。将该菌株连续传代10次的摇瓶结果如表2所示:表2.菌株ghm356稳定性检测结果摇瓶凝乳酶活力(u/ml)相对酶活力(%)f126645100f22652199.5f328753107.9f427482103.1f52559696.1f627583103.5f727765104.2f82664399.99f928324105.9f1028157105.7菌株ghm356生长速度较快,产孢子量少,菌落颜色为乳白色,在液体摇瓶中培养时菌丝球较少。将该突变菌株传代培养10代,实验结果由表2可以看出,该突变菌株的遗传稳定性好。实施例2出发菌株与诱变菌株凝乳酶活力及蛋白酶活力的比较将出发菌株h23与诱变菌株ghm356划线于筛选培养基平板上,选择长势较好且凝乳圈较大的菌落接种到液体种子培养基中,37℃复壮培养3代,使其达到正常的生长周期。分别将复壮好的液体种子接种到斜面培养基上,37℃培养7-10天。用无菌铁铲分别取新鲜培养好的出发菌株及诱变菌株菌苔接种到摇瓶发酵培养基中培养,37℃,240r/min培养4天,分别测定其凝乳酶活力及蛋白酶活力。出发菌株与诱变菌株的凝乳酶活力及蛋白酶活力见表3。表3.出发菌株与诱变菌株凝乳酶活力及蛋白酶活力比较测定诱变菌株ghm356的凝乳酶活力(mca)与蛋白酶活力(pa),与出发菌株相比,诱变菌株凝乳酶活力显著提高,比出发菌株提高了7.6倍,而蛋白酶水解活性大幅度下降。由于凝乳酶都有一定的特异性,其特异性主要通过凝乳酶活力/蛋白酶(mca/pa)的比值来体现,而mca/pa比值越大反应发酵液中凝乳酶的质量越好。由表3可以看出诱变菌株ghm356的mca/pa为31.0,是出发菌株的10.6倍,实施例3液体发酵生产凝乳酶及其提取斜面培养:将微小毛霉突变株ghm356取一接种环菌苔接种于pda固体斜面,37℃下恒温培养8d;摇瓶培养:将斜面培养得到的菌株取一接种环菌苔接入摇瓶发酵培养基中,在初始ph6.0、37℃、摇床转速240rpm条件下培养36h;种子罐培养:将种瓶中培养好的种子按5%的集中率接种到种子罐培养基中,在初始ph5.5,37℃,500r/min,发酵36h;发酵罐培养:将种子罐中的种子液按照接种量7%的比例接入发酵罐培养基,培养条件为初始ph5.5、37℃、500r/min,当溶氧降至最低再升至20%时,开始补料,控制溶氧在20%-30%;发酵至菌体自溶严重,酶活无明显提高时放罐;发酵周期为120h左右。提取与精制:按发酵液体积加入3%珍珠岩助滤剂,进行板框压滤;用超滤膜对澄清压滤酶液进行超滤浓缩;在浓缩液中加入稳定剂8%葡萄糖、氯化钠10%,防腐剂0.15%山梨酸钾,然后用硅藻土进行过滤除菌,即得到凝乳酶成品酶制剂。培养基质量体积百分比组成如下:应用上述微小毛霉突变菌株ghm356及培养基进行发酵,下表是进行6批发酵的发酵周期和凝乳酶发酵酶活力,平均发酵酶活力为:272470u/ml。批次发酵周期(h)发酵酶活力(u/ml)112027015121202737803120272916412027188451202729656120273125实施例4凝乳酶及蛋白酶酶活测定方法(1)凝乳酶测定方法:吸取在35℃下保温10min的复原脱脂乳液5ml入试管中,添加0.5ml在35℃保温10min的酶液,迅速摇匀并开始计时,当试管壁上出现凝集小颗粒即为计时终止,计时以秒为单位。在上述条件下,40min凝集lmll0%脱脂奶粉的酶量定义为一个活力单位u。凝乳活力(u)=(供试乳体积/凝乳酶体积)*2400/t*n式中:2400—40min转化以秒为单位;n—稀释倍数;t—凝乳时间。(2)蛋白酶测定方法:采用福林-酚试剂法测定酶的蛋白水解活力,取5ml1.2%酪蛋白为底物,在ph7.2和35℃条件下,同1ml酶液反应10min后,加入5ml0.44mol/l的三氯乙酸终止酶促反应,经离心除去酪蛋白等沉淀后取上清液,用5ml0.55mol/l碳酸钠溶液碱化,再加入1ml福林-酚试剂显色,蓝色的深浅与上清液中酪氨酸含量成正比;酪氨酸含量用分光光度计在660nm处测定,从而计算出蛋白酶活力。每分钟催化酪蛋白水解生成1μg酪氨酸的酶量定义为1个酶活力单位。酶活=a/10×11×n式中:a-标准曲线测得的酪氨酸含量μg/l;10-反应时间10min;11-11ml反应液取出1ml测定;n-酶液稀释倍数。实施例5最适反应温度取凝乳酶成品,以正常条件ph7.0,分别在20、25、30、35、40、45、50、55、60、65℃条件下测定凝乳酶活力,计算相对酶活力。结果如图1所示,最适反应温度为35℃,由实验结果可知,该突变菌株所产凝乳酶的最适反应温度明显低于其他来源的凝乳酶,更加适合于干酪的生产。实施例6耐热性取凝乳酶成品,将凝乳酶分别置于25、30、35、40、45、50、55、60℃条件下保藏1h,冷却后用ph7.0缓冲液稀释至相应倍数,测定酶活力。测定结果如图2所示,在35℃条件下保温1h仍能保持90%以上的活性,当温度升至40℃时,酶活随着保温时间的延长酶活下降为75%左右,45℃时其热稳定性明显减弱。由于凝乳酶用于干酪生产时,大部分的凝乳酶会残留在乳清中,因此热稳定性比较好的凝乳酶会给乳清的再次利用造成困难。由于乳清的热稳定性较差,这就需要用低温(50-55℃)的方法使其中的凝乳酶失活,所以热稳定性较差的凝乳酶更适合于干酪的生产。实施例7最适反应ph取凝乳酶成品分别用0.1m的naoh或0.1m的hcl将脱脂乳的ph调整为3.5、4.0、4.5、5.0、6.0、6.5、7.0、7.5、8.0,分别测定不同ph条件下的凝乳酶活力。结果如图3所示,随着ph的升高,凝乳酶酶活力逐渐下降,当ph达到8.0时酶活基本上失活,所以该凝乳酶的最适ph在4.0。实施例8耐酸碱性取凝乳酶成品分别用0.1m的naoh或0.1m的hcl将凝乳酶液的ph调整为1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0,分别置于室温条件下静置24h后测定酶活力。测定结果如图4所示,在ph1.0-8.0的条件下24h后,相对酶活力仍然保持在75%以上。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1