一种在炎性环境下保持稳定的耐受性树突状细胞的制备方法及其应用与流程
本发明涉及细胞体外诱导培养技术领域,具体地说,是一种在炎性环境下保持稳定的耐受性树突状细胞的制备方法及其应用。
背景技术:
机体的免疫系统起着排除“非己”维持内环境稳定的重要作用,一旦发生免疫能力异常增强,在外源性或内源性的因素促发下,就会发生变态免疫反应性疾病,主要包括过敏性疾病(过敏性哮喘,过敏性紫癜等),自生免疫反应性(多发性硬化症,重症肌无力等)以及移植物抗宿主症(输血相关免疫反应,骨髓和器官移植相关gvhd)。轻者迁延不愈,重者威胁生命。这些患者自身的免疫细胞往往处于严重失调的状态,因此诱导过继性耐受细胞进行免疫治疗,即通过输注具有调节耐受效应的细胞,使患者体内的变态免疫性反应受到抑制,输入少量细胞即能调节整个机体免疫状态的作用,具有安全性高效性的特点,是现代比较前沿的治疗策略。
树突状细胞(dendriticcells,dc)是目前所知的惟一能激活未致敏初始型t细胞(
近年来发现中间发育状态的dc,也叫半成熟dc(semi-maturedc),这类细胞一般在未成熟dc(immaturedc,imdc)阶段接受特定抑制信号的诱导,在接受成熟刺激后,其成熟分子和细胞因子表达处于中间态或部分偏向成熟或未成熟dc,并表现为强耐受诱导能力而极具临床应用价值。这种具有耐受诱导能力的semi-maturedc和imdc统称为耐受性树突状细胞(tolerogenicdendriticcell,tdc)。这tdc原先是在肿瘤周边发现被利用来逃避机体免疫监视,在促进效应性t细胞凋亡或者调节性t细胞扩增后,有效诱导免疫不应答。
体外制备后回输tdc治疗自身免疫性疾病和移植排斥,因为能调控过高免疫反应的高效性,已被认为是一种极高潜力的免疫细胞疗法。但由于人体循环系统中天然存在的tdc数量极少(不到0.1%),目前制备tdc常用的方法是体外诱导dc的过程中添加tgf-β和/或il-10这类细胞因子。这些细胞因子通过特异性结合相关受体,通过调整dc的ido表达和下游细胞因子的表达,抑制活化信号,使dc大量下调成熟分子,成为耐受趋向性。使用tgf-β和/或il-10诱导方法具有如下缺点:1)细胞因子保存不易,效价不稳定,诱导的tdc的稳定性也因此得不到保证,该制备手段存在无法保证gmp认证产品重复性的可能性;2)市售的细胞因子主要依靠细菌重组蛋白表达提纯并且多数仅限试验用途,这也是阻碍该免疫细胞制品在未来应用于临床的瓶颈;3)dc是一类高分化要求的细胞制品,为了保证细胞制品的高度稳定性通常对衍生过程中接受的外界刺激和信号需要极高纯度来保证不被诱导成为别的细胞类型,也就是对于tgf-beta和il-10的纯度要求非常高,也由此导致了制备费用的提高,也就提高了产业化用途治疗细胞的成本;4)通过细胞因子诱导制备tdc,往往需要对dc处理3-7日,诱导过程耗时耗力,增加了细胞制品的不稳定性和标准化难度,由此会在未来增加gmp认证的难度;5)临床患者体内环境通常比较复杂,往往因为手术和院内环境而存在多重病原体感染,tdc这类耐受性细胞如何在被输注机体内复杂的感染性炎性环境下,依然保持高度耐受调节功能性是该细胞疗法实现临床价值的重大关键。而细胞因子制备而得的tdc在体内往往容易受到其他细胞因子的调控而改变细胞表型,无法保证耐受功能的稳定性。
中国专利2012105591988公开了一种免疫抑制剂体外诱导耐受性树突状细胞的方法,可从外周血中获得高纯度免疫抑制功能强的耐受性dc,在液氮中长期保存,能够满足临床对耐受性dc细胞制品的需求,用于预防和治疗自身免疫性疾病、移植物抗宿主病、器官移植排斥。该专利是从外周血中获得高纯度免疫抑制功能强的耐受性dc,用以在液氮中长期保存,能够满足临床对耐受性dc细胞制品的需求。中国专利2015800465656公开了一种用于制备树突状细胞的方法、由该方法制备的树突状细胞,包括用结合于具有细胞通透性的肽的抗原致敏经成熟因子处理和培养的树突状细胞,所述具有细胞通透性的肽包括细胞质转导肽(ctp),所述成熟因子选自下组中之一:包括mtor抑制剂。该专利是采用重组抗原致敏成熟期而非未成熟期的树突状细胞,使抗原与具有细胞膜通透性的功能肽结合,改善树突状细胞淋巴结迁移能力、t细胞增殖能力、细胞毒性t淋巴细胞诱导能力。然而现有技术中关于本发明在炎性环境下保持稳定的耐受性树突状细胞及其制备方法,目前还未见报道。
技术实现要素:
本发明针对现有技术的不足和未来临床中可能遇到的瓶颈问题,提供一种在炎性环境下保持稳定的耐受性树突状细胞的制备方法,该方法以临床级药用小分子调控mtor信号靶点,从而诱导临床应用级耐受性树突状细胞,满足该细胞制品的临床化的治疗应用。
本发明的第二个目的是针对现有技术中的不足,提供通过如上所述方法制备得到的树突状细胞。
本发明的第三个目的是针对现有技术中的不足,提供如上所述树突状细胞的用途。
为实现上述第一个目的,本发明采取的技术方案是:
一种在炎性环境下保持稳定的耐受性树突状细胞的制备方法,以mtor抑制剂对纯化的未成熟树突状细胞进行处理。
作为本发明的一个优选方案,所述耐受性树突状细胞的制备方法如下:
1)获取纯化的人未成熟树突状细胞;
2)将纯化的人未成熟树突状细胞悬于完全细胞培养基中;
3)调整细胞悬液浓度为5*104/ml-5*106/ml;
4)在培养体系中加入mtor抑制剂;
5)孵育20分钟-24小时。
作为本发明的一个优选方案,所述步骤1中通过流式细胞仪鉴定细胞纯度和未成熟度,确保纯化的人未成熟树突状细胞中cd1a+且cd83-细胞含量大于80%。
作为本发明的一个优选方案,步骤5中孵育所用的培养基为含10%fbs的rpmi-1640、或含1%-10%ab血清的rpmi-1640完全细胞培养基。
作为本发明的一个优选方案,所述mtor抑制剂选自:雷帕霉素rapamycin、替西罗莫司temsirolimus、依维莫司everolimus、ridaforolimus、nvp-bez235、sf-1126、xl-765、pki-587、pf-04691502、pki-402、osi-027、azd-8055、pp-242、pp-30、torin-1、wye-125132、way-600、wye-687、wye-354、ku-0063794或palomid-529。
作为本发明的一个优选方案,所述mtor抑制剂是具有mtor信号抑制能力的小分子化合物雷帕霉素(rapamycin)、替西罗莫司(temsirolimus)或依维莫司(everolimus)。
作为本发明的一个优选方案,所述步骤4中mtor抑制剂终浓度为0.1μm-10μm。
作为本发明的一个优选方案,所述步骤4中mtor抑制剂终浓度为0.1μm、0.5μm、1μm、2.5μm、5μm、10μm。
作为本发明的一个优选方案,孵育后,用pbs或培养基等无菌缓冲液,对细胞低速洗涤1-2次后待用。
作为本发明的一个优选方案,制备得到的所述耐受性树突状细胞凋亡率小于35%。
作为本发明的一个优选方案,制备得到的耐受性树突状细胞在炎性刺激下抑制cd83、cd80及cd86的表达。
作为本发明的一个优选方案,所述炎性环境是指机体内存在感染性炎性环境。
为实现上述第二个目的,本发明采取的技术方案是:
如上任一所述制备方法制备得到的耐受性树突状细胞,所述耐受性树突状细胞在炎性分子刺激时,依然保持稳定的耐受调节功能,
具体的,本发明所制备的耐受性树突状细胞在lps等的炎性环境刺激下维护成熟蛋白分子(cd83,cd80,cd86)的低表达,调控mtor信号磷酸化下调和ido上调,抑制t细胞的扩增。动物实验结果表明:输注本发明所制备的耐受性树突状细胞后,能有效抑制dnfb诱导发生变态免疫反应。
为实现上述第三个目的,本发明采取的技术方案是:
如上所述的耐受性树突状细胞在制备具有免疫耐受功能的树突状细胞制品中的应用,所述的树突状细胞制品是用于预防和/或治疗自身免疫性疾病、移植物抗宿主病、器官移植排斥的树突状细胞制品。
与现有技术采用细胞因子诱导的方法不同,本发明通过调控mtor信号靶点来诱导临床级tdc,因为mtor抑制剂已经是临床级药用小分子,效价稳定,制备纯度高,因此本发明是一种更便捷、经济、高效、易操作且稳定的技术手段。且本发明制备的tdc在炎症环境刺激后,依然保持耐受功能特质。
临床患者体内环境通常比较复杂,往往因为手术和院内环境而存在多重病原体感染,tdc这类耐受性细胞如何在被输注机体内复杂的感染性炎性环境下,依然保持高度耐受调节功能性是该细胞疗法实现临床价值的重大关键。本发明采用能靶向型抑制mtor信号通路蛋白磷酸化的单体结构化合物,对人树突状细胞进行体外耐受性短时诱导和培养。实验结果显示,本发明制备的tdc,在遭遇炎性分子刺激时,依旧保持稳定的耐受调节功能,因此本发明制备的tdc在炎性因子刺激时可在炎性环境刺激下依旧保持稳定的耐受性特质。
本发明建立了一种新的tdc的制备方法,通过调控mtor活化信号,在本发明限定的浓度和时间内,既保证细胞制品的存活率,又得到在炎性环境下依然稳定保持较强耐受功能的tdc细胞制品。本发明制备方法采用的原材料容易通过gmp认证,制备过程简单,便捷,经济,制备成品稳定,有效,易标准化。本发明可在将来用于过继性输注治疗多种变态免疫反应性疾病(输血反应,自身免疫性反应,移植排斥等),临床运用潜力巨大。
附图说明
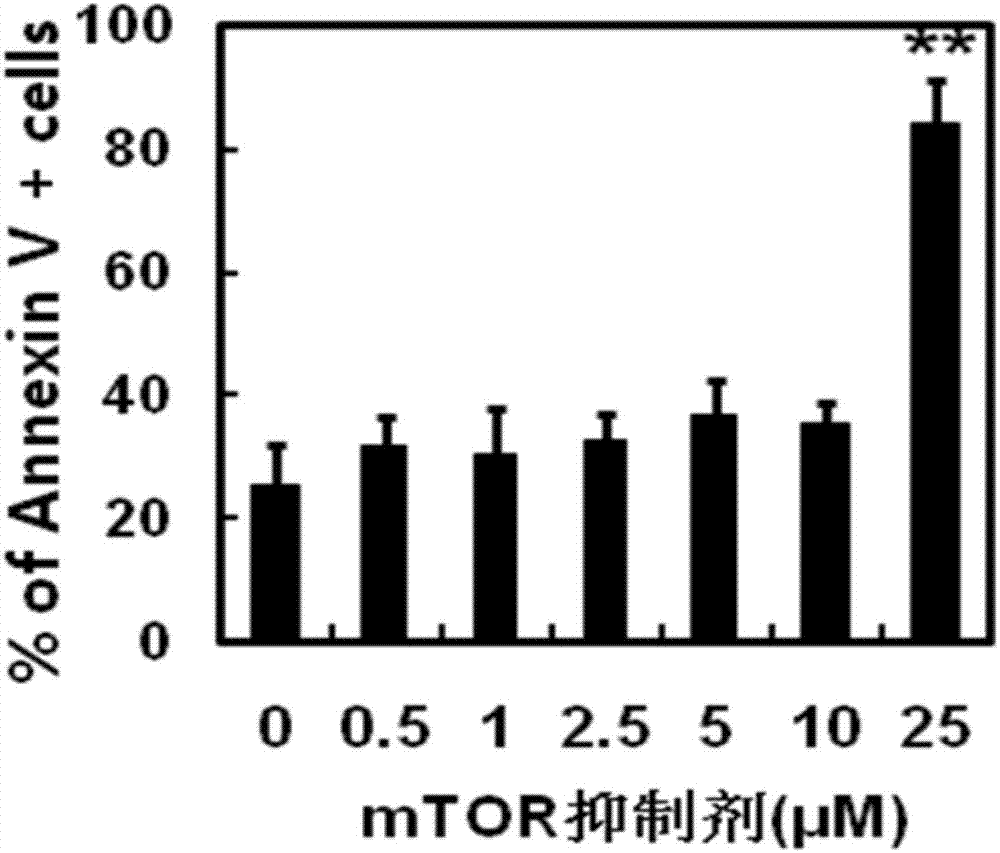
附图1为本发明不同浓度mtor抑制剂制备得到tdc凋亡率。
附图2为本发明mtor抑制剂诱导tdc遇到活化因子处理后的表面分子表达。
附图3为本发明tdc的mtor信号磷酸化被阻断,ido表达升高。
附图4为本发明tdc能有效抑制t细胞增殖。
附图5为本发明tdc能在体内模型中有效抑制变态免疫性疾病。
具体实施方式
下面结合具体实施方式,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明记载的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
与现有技术中采用细胞因子(tgf-β或il-10)诱导方法不同,本发明通过调控mtor信号靶点来诱导临床级tdc,因为mtor抑制剂已经是临床级药用小分子,效价稳定,制备纯度高,因此本发明是一种更便捷、经济、高效、易操作且稳定的技术手段。
临床患者体内环境通常比较复杂,往往因为手术和院内环境而存在多重病原体感染,tdc这类耐受性细胞如何在被输注机体内复杂的感染性炎性环境下,依然保持高度耐受调节功能性是该细胞疗法实现临床价值的重大关键。本发明采用能靶向型抑制mtor信号通路蛋白磷酸化的单体结构化合物,对人树突状细胞进行体外耐受性短时诱导和培养。实验结果显示,本发明制备的tdc,在遭遇炎性分子刺激时,依旧保持稳定的耐受调节功能,因此本发明制备的tdc在炎性因子刺激时可在炎性环境刺激下依旧保持稳定的耐受性特质。
本发明中,所述纯化的人未成熟树突状细胞(imdc)可使用本领域已知的方法获取,例如可通过纯化的人单核细胞用细胞因子诱导而得,或通过外周血直接纯化获得。
本发明中,所述完全培养基是指本领域已知的能保证原代细胞正常存活营养需求的完全细胞培养基,例如可以是含10%fbs的rpmi-1640、含1%-10%人ab血清的rpmi-1640,
本发明中,所述的mtor抑制剂可以是任何类型的抑制剂,包括直接结合mtorc以进行抑制,或者在mtorc的分解位点中与atp竞争性抑制的抑制剂,例如可以是选自下组的任一种:雷帕霉素(rapamycin)、西罗莫司(sirolimus)、依维莫司(everolimus)、替西罗莫司(temsirolimus)、ridaforolimus、nvp-bez235、sf-1126、xl-765、pki-587、pf-04691502、pki-402、osi-027、azd-8055、pp-242、pp-30、torin-1、wye-125132、way-600、wye-687、wye-354、ku-0063794或palomid-529。优选地,所述mtor抑制剂是具有mtor信号抑制能力的小分子化合物雷帕霉素(rapamycin)、替西罗莫司(temsirolimus)或依维莫司(everolimus)。
实施例1
一、材料
1.纯化的人未成熟树突状细胞(imdc)。
2.具有mtor信号抑制能力的小分子化合物。
3.完全细胞培养基。
二、方法
1.高纯度人树突状细胞的鉴定。
1.1.取得纯化的人单核细胞体外培养后衍生未成熟树突状细胞。
1.2.流式细胞仪鉴定细胞纯度和未成熟度,确保cd1a+cd83-细胞含量在80%及以上。
2.tdc的制备。
2.1.纯化的未成熟树突状细胞悬于能保证原代细胞正常存活营养需求的完全细胞培养基中(含10%fbs的rpmi-1640,含1%-10%人ab血清的rpmi-1640,以及其他适合dc培养无血清培养基)。
2.2.调整细胞悬液浓度为5*104/ml-5*106/ml。
2.3.在培养体系中加入具有mtor信号抑制能力的单分子化合物(rapamycin,temisirolimus,everolimus及其他),培养体系中化合物终浓度为0.1μm-10μm。
2.4.置于37℃、5%co2及饱和湿度的培养条件下孵育20分钟-24小时。
2.5.用pbs或培养基等无菌缓冲液,对细胞200g左右低速洗涤1-2次后待用。
3.tdc的生物学特征鉴定。
3.1.凋亡/死亡率检测:
3.1.1.使用annexinv-fitc抗体标记所得细胞
3.1.2.流式细胞仪检测细胞群annexinv阳性率在1%-35%。
3.2.体外检测耐受特质稳定性:
3.2.1.将收获的tdc悬于能保证原代细胞正常存活营养需求的完全细胞培养基中,调整细胞悬液浓度为5*104/ml-5*106/ml。
3.2.2.培养体系中加入lps之类(polyi:c,cpg等)活化tlr受体的炎性活性分子(终浓度为10ng/ml-10μg/ml)置于37℃、5%co2及饱和湿度的培养条件下处理20分钟-24小时。
3.2.3.lps处理后的tdc,用流式细胞仪鉴定分析细胞成熟相关分子表达,rt-pcr分析ido表达量,western-bloting分析mtor信号通路磷酸化情况,与t细胞混合培养鉴定耐受功能。
3.3.动物模型体内验证本技术的治疗效果
3.3.1.取用6-8wc57bl/6小鼠骨髓衍生imdc(rmgm-csf和rmil-4诱导8天),cd11c阳性分选纯化。
3.3.2.用mtor抑制剂处理后(同之前浓度和时间技术指标),加入dnfb激活,i.v.输注同型小鼠,细胞悬液浓度为5*104/ml-5*106/ml。同时,设置阴性对照和阳性对照。诱导免疫初始化5天。
3.3.3.dnfb涂抹小鼠耳后,处理48小时,取耳朵进行免疫组化和染色分析,通过耳朵肿胀程度和白细胞侵润量分析tdc细胞制品对特应性皮炎的控制程度。
三、结果
1.本发明的方法在诱导人dc耐受化过程所致细胞凋亡率在可控范围内。
本发明制备方法核心是利用可以抑制性调控mtor信号传递的小分子单体化合物对人imdc进行预处理,使之保持和维护其耐受特质。不同于其他对人dc功能的起到抑制作用的化合物,本发明的方法不会对被处理细胞造成大规模凋亡,并保证细胞的活力,这也是制备一款合格的细胞制品的必要条件。如图1所示,本发明的制备方法加入的mtor抑制剂浓度在0.1-10μm范围内时,所制备的tdc细胞凋亡率在35%以内,当mtor抑制剂浓度增加到25μm时,tdc细胞凋亡率约为80%。因此本发明的制备方法筛选mtor抑制剂适宜添加浓度,在上述适宜的浓度范围内采用mtor抑制剂对人dc进行诱导后,所制备的tdc细胞保持较低的凋亡率,且与细胞自然凋亡率无显著性差异。
2.本发明诱导的tdc在炎性刺激下依旧保持稳定的耐受性特质。
临床患者体内环境通常比较复杂,往往因为手术和院内环境而存在多重病原体感染,tdc这类耐受性细胞如何在被输注机体内复杂的感染性炎性环境下,依然保持高度耐受调节功能性是该细胞疗法实现临床价值的重大关键。而本发明所制备的tdc可以在炎性刺激下依旧保持低成熟蛋白分子表达的耐受性特质。
图2a为lps刺激imdc活化成熟,而有mtor抑制剂处理的imdc则能维护成熟蛋白分子(cd83,cd80,cd86)的低表达,而保持耐受态。图2b为遭遇其他炎性因子时,本发明制备tdc也同样能抵抗住活化成熟诱导。
3.本发明制备的人tdc机理性鉴定蛋白指标为mtor信号磷酸化下调和ido上调
由于本发明是通过调控树突状细胞mtor信号传导来制备所需的tdc。因此是否能有效控制mtor相关信号磷酸化是tdc细胞的机理性鉴定指标。s6k,s6和4ebp-1都是mtor下游信号蛋白,他们的磷酸化程度决定了信号通路传导的有效性。如图3a所示,lps炎性因子的存在,可以有效诱导这些信号蛋白的磷酸化,但是我们所选用的不同mtor抑制剂均能使人tdc的对lps炎性信号应答下调。
tdc的另一个机理性指标是ido,ido的表达高低是在髓性细胞内决定细胞耐受性功能的重要指标。如图3b所示,本发明诱导的tdc经处理后均能显著提高ido蛋白的转录表达。
4.体外培养体系模型验证tdc的细胞学功能。
dc的核心功能是对t细胞的抗原递呈和诱导扩增,并调控t细胞行使相关免疫学功能。我们将t细胞进行cfse荧光标记,然后将制备的tdc与标记的t细胞进行混合培养,并设置阴性对照和阳性对照。如图4所示,本发明制备的tdc在接受lps活化信号后,仍然能有效抑制t细胞的扩增。
5.chs体内模型验证本发明制备tdc的治疗变态反应性疾病可能性。
是否能实现体内抑制变态免疫反应,是耐受性细胞制品的最主要治疗诉求。chs是特应性皮炎的体内模型,其致病机理是被dnfb诱导发生变态免疫反应,导致皮肤肿胀。如图5所示,本发明制备的tdc,有效控制了dnfb诱导的肿胀发生,也减少了炎性细胞在组织内的浸润。
实施例2
纯化的未成熟树突状细胞悬于含10%fbs的rpmi-1640培养基中,调整细胞悬液浓度为5*104/ml-5*106/ml。在培养体系中加入rapamycin,调整rapamycin终浓度为5μm,置于37℃、5%co2及饱和湿度的培养条件下孵育4小时。加入dnfb激活,i.v.输注同型小鼠。同时设置dnfb对照组,诱导免疫初始化5天。dnfb涂抹小鼠耳后,处理48小时,取耳朵进行免疫组化和染色分析,通过耳朵肿胀程度分析tdc细胞制品对特应性皮炎的控制程度。结果显示dnfb+rapamycin组小鼠耳朵肿胀程度较dnfb对照组降低48%。
实施例3
纯化的未成熟树突状细胞悬于含10%fbs的rpmi-1640培养基中,调整细胞悬液浓度为5*104/ml-5*106/ml。在培养体系中加入temisirolimus,调整temisirolimus终浓度为10μm,置于37℃、5%co2及饱和湿度的培养条件下孵育6小时。加入dnfb激活,i.v.输注同型小鼠。同时设置dnfb对照组,诱导免疫初始化5天。dnfb涂抹小鼠耳后,处理48小时,取耳朵进行免疫组化和染色分析,通过耳朵肿胀程度分析tdc细胞制品对特应性皮炎的控制程度。结果显示dnfb+temisirolimus组小鼠耳朵肿胀程度较dnfb对照组降低46%。
实施例4
纯化的未成熟树突状细胞悬于含10%fbs的rpmi-1640培养基中,调整细胞悬液浓度为5*104/ml-5*106/ml。在培养体系中加入everolimus,调整everolimus终浓度为1μm,置于37℃、5%co2及饱和湿度的培养条件下孵育12小时。加入dnfb激活,i.v.输注同型小鼠。同时设置dnfb对照组,诱导免疫初始化5天。dnfb涂抹小鼠耳后,处理48小时,取耳朵进行免疫组化和染色分析,通过耳朵肿胀程度分析tdc细胞制品对特应性皮炎的控制程度。结果显示dnfb+everolimus组小鼠耳朵肿胀程度较dnfb对照组降低52%。
实施例5
纯化的未成熟树突状细胞悬于含10%fbs的rpmi-1640培养基中,调整细胞悬液浓度为5*104/ml-5*106/ml。在培养体系中加入everolimus,调整everolimus终浓度为0.5μm,置于37℃、5%co2及饱和湿度的培养条件下孵育20分钟。加入dnfb激活,i.v.输注同型小鼠。同时设置dnfb对照组,诱导免疫初始化5天。dnfb涂抹小鼠耳后,处理48小时,取耳朵进行免疫组化和染色分析,通过耳朵肿胀程度分析tdc细胞制品对特应性皮炎的控制程度。结果显示dnfb+everolimus组小鼠耳朵肿胀程度较dnfb对照组降低46%。
实施例6
纯化的未成熟树突状细胞悬于含10%fbs的rpmi-1640培养基中,调整细胞悬液浓度为5*104/ml-5*106/ml。在培养体系中加入rapamycin,调整rapamycin终浓度为5μm,置于37℃、5%co2及饱和湿度的培养条件下孵育18小时。加入dnfb激活,i.v.输注同型小鼠。同时设置dnfb对照组,诱导免疫初始化5天。dnfb涂抹小鼠耳后,处理48小时,取耳朵进行免疫组化和染色分析,通过耳朵肿胀程度分析tdc细胞制品对特应性皮炎的控制程度。结果显示dnfb+rapamycin组小鼠耳朵肿胀程度较dnfb对照组降低48%。
实施例7
纯化的未成熟树突状细胞悬于含10%fbs的rpmi-1640培养基中,调整细胞悬液浓度为5*104/ml-5*106/ml。在培养体系中加入rapamycin,调整rapamycin终浓度为0.1μm,置于37℃、5%co2及饱和湿度的培养条件下孵育24小时。加入dnfb激活,i.v.输注同型小鼠。同时设置dnfb对照组,诱导免疫初始化5天。dnfb涂抹小鼠耳后,处理48小时,取耳朵进行免疫组化和染色分析,通过耳朵肿胀程度分析tdc细胞制品对特应性皮炎的控制程度。结果显示dnfb+rapamycin组小鼠耳朵肿胀程度较dnfb对照组降低46%。
实施例8
纯化的未成熟树突状细胞悬于含10%fbs的rpmi-1640培养基中,调整细胞悬液浓度为5*104/ml-5*106/ml。在培养体系中加入rapamycin,调整rapamycin终浓度为0.05μm,置于37℃、5%co2及饱和湿度的培养条件下孵育36小时。加入dnfb激活,i.v.输注同型小鼠。同时设置dnfb对照组,诱导免疫初始化5天。dnfb涂抹小鼠耳后,处理48小时,取耳朵进行免疫组化和染色分析,通过耳朵肿胀程度分析tdc细胞制品对特应性皮炎的控制程度。结果显示dnfb+rapamycin组小鼠耳朵肿胀程度较dnfb对照组降低22%。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!