用于细胞侵袭、迁移能力无标记检测的太赫兹超材料芯片的制作方法
本发明属于太赫兹测量技术领域,涉及一种用于细胞侵袭、迁移能力无标记检测的太赫兹超材料芯片。
背景技术:
侵袭和转移是恶性肿瘤最主要的生物学特征,其表现为从肿瘤原发部位的恶性细胞脱离病灶,突破基底膜向周围间质浸润性生长,并且进入血液或淋巴液在远端器官黏附、增殖,形成肿瘤细胞转移灶;这也是导致恶性肿瘤患者死亡的重要原因。准确评价肿瘤细胞的侵袭运动能力对于肿瘤转移机制的研究和抗肿瘤药物的研发至关重要。
目前体外评估细胞侵袭运动能力的实验方法主要有:
1.划痕实验,其原理为获得融合紧密的单细胞层,并在单细胞层中间人为制造空白区域,称之为“划痕”,随着培养进行,划痕边缘的细胞会逐渐迁移使空白区域融合,可模拟体内细胞迁移、侵袭过程。该方法操作简便,但重复性差,且在划出痕迹过程中会导致细胞损伤、破碎,残片会阻止边缘细胞的迁移,进而影响实验结果。
2.transwell细胞实验,是目前应用广泛的方法,其依赖表面分布孔径的薄膜,统计从薄膜上层覆盖的基质(matrigel)表面穿越转移到薄膜下层的细胞数,评估细胞的迁移能力。此方法常借助染色后光镜下随机视野计数,或者读取细胞裂解液吸光度值进行计数;但此方法操作复杂,染色耗时较长,难以满足无标记、原位高通量筛选需求。
太赫兹(terahertz,thz)波在电磁波频段中处于微波和红外波之间,频率通常为0.1-10thz。太赫兹技术具备应用于细胞检测的独特优势:1thz振荡频率对应0.16皮秒转动,太赫兹技术将传统方法在飞秒尺度上检测水分子运动提升至皮秒及亚皮秒尺度,可以更为精确、实时反应胞内自由水和结合水的水化动力学。然而,传统研究细胞内水化动力学方法包括磁共振、准弹性中子散射和非相干中子散射是无法在空间上严格区分胞内水和胞外水,且需要氢氘置换或低温冷却;无法反应自然状态下细胞内部的水动力学。基于传统透射式太赫兹波谱的细胞检测受限于培养基环境强吸收干扰和检测波长与单细胞层厚度失匹配的制约,较难实现对溶液中活细胞的准确定量和定性评估。太赫兹衰减全反射技术利用太赫兹波在棱镜表面发生全反射时产生的与细胞层厚度相匹配的倏逝波进行贴壁细胞检测,是目前研究活细胞太赫兹介电特性的有效手段;但其光路搭建较为复杂,且棱镜及附属机械结构较大,较难进行微型化或芯片化以整合入现有细胞培养检测体系。
太赫兹超材料传感技术为开发小型化细胞检测芯片提供新思路,其主要利用在硅、石英或其他介质膜上加工周期性排布的亚波长金属结构,形成局域表面等离子共振,以增强待检物质与太赫兹波的相互作用。太赫兹超材料具备应用于细胞无标记检测的独特优势:1.尺寸小巧,易于整合,常规厚度仅约500微米;2.检测灵敏度高,可使狭缝间隙内介质生物分子光谱吸收横截面增加103-105倍以上,吸收系数也极端增加至106-107cm-1;3.有效响应区域匹配,其表面激发局域等离子体共振的电场分布范围在数微米级别,与单个细胞厚度相匹配,可完整获得细胞的响应信息。但现有透射式太赫兹超材料的细胞检测芯片,常需要拭去细胞胞外水,且依赖于将单细胞层生长于超材料表面,只能检测静态贴壁细胞对药物诱导凋亡的响应,难以评估测量活细胞的迁移、侵袭等运动行为。
技术实现要素:
有鉴于此,本发明的目的在于提供一种用于细胞侵袭、迁移能力无标记检测的太赫兹超材料芯片。
为达到上述目的,本发明提供如下技术方案:
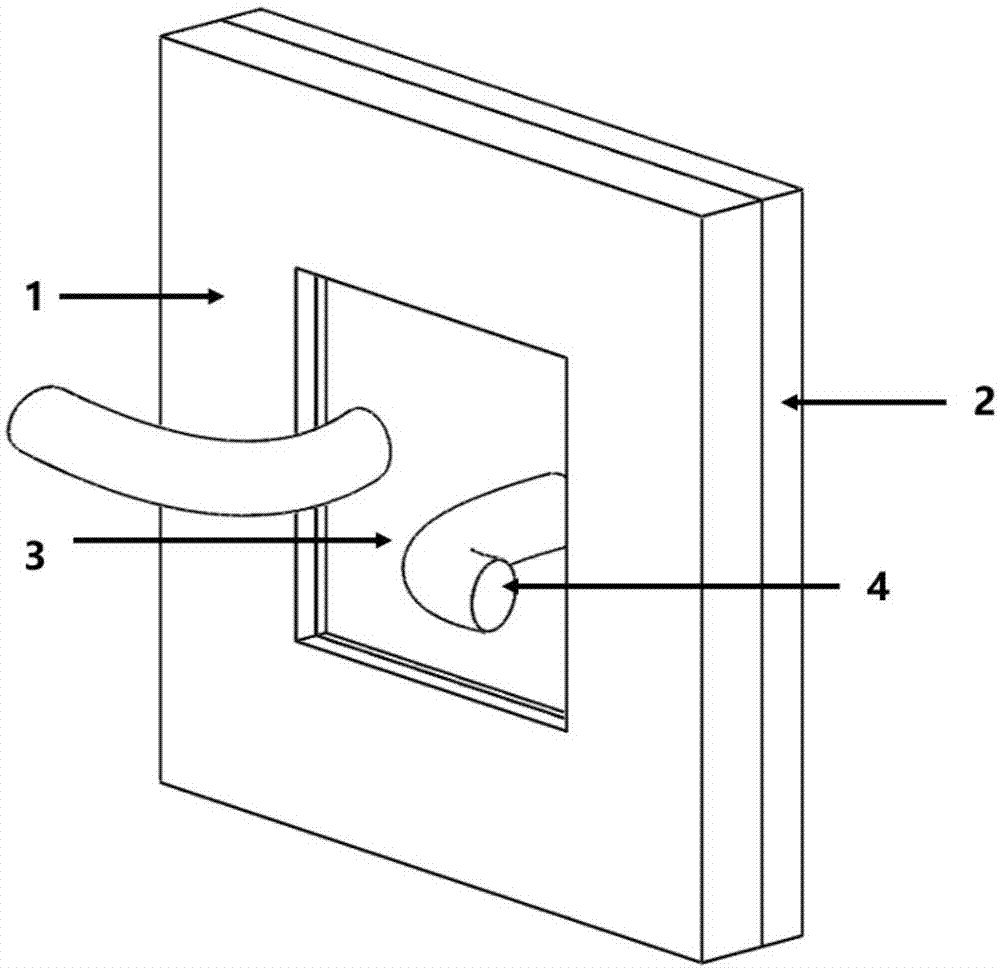
用于细胞侵袭、迁移能力无标记检测的太赫兹超材料芯片,包括上下设置的细胞培养室和超材料芯片层,两者均为设有一个开口的方形凹槽,它们的开口侧相对扣合构成密闭空间,在细胞培养室和超材料芯片层之间紧压一层多孔薄膜,所述多孔薄膜在密闭空间内的部分,其上表面涂布有基质层;在超材料芯片层的凹槽底部设有谐振环,谐振环的上表面粘附有细胞层。
优选的,所述细胞培养室的材质为pdms(聚二甲基硅氧烷),多孔薄膜的材质为聚碳酸酯膜、聚四氟乙烯膜或聚酯膜,进一步优选为聚碳酸酯膜。
优选的,多孔薄膜的整体尺寸与细胞培养室一致,厚度为7~11μm,孔径为8μm。
优选的,所述细胞培养室与超材料芯片层紧密夹持于尼龙夹具内。
优选的,所述细胞培养室与超材料芯片层的外部尺寸及凹槽尺寸均相同。
优选的,所述细胞培养室设有与其内部连通的进样软管道和出样软管道。
优选的,所述基质层为matrigel基质层。
优选的,所述超材料芯片层包括谐振环以及方形凹槽结构的基底两部分,所述谐振环是光刻于基底凹槽底部的周期性亚波长金属结构,基底的材质选自高阻硅或石英,谐振环的材质选自金、银、铜、铝、镍和铬。
进一步优选的,所述高阻硅的厚度为500μm,电阻率大于10000ω·cm。
进一步优选的,所述谐振环分为上层和下层,它们的材质分别为金和铬。
优选的,所述谐振环为周期70μm、边长66μm、金属线框宽2μm、开口缝隙宽4μm的正方形中央四开口的周期结构。
进一步优选的,所述正方形中央四开口的具体结构是:在正方形每个边长的中间位置设有开口。
上述太赫兹超材料芯片的制作方法,具体步骤如下:
(1)将多孔薄膜在洁净的石英载玻片ⅰ表面铺平贴紧,在洁净的石英载玻片ⅱ上旋涂质量比5:1的聚二甲基硅氧烷和甲苯混合而成的预聚合溶液,细胞培养室的开口一侧采用微印章方法蘸取预聚合溶液,然后对准多孔薄膜后压紧,烘烤,使得细胞培养室与多孔薄膜紧密贴合,形成开口侧贴合多孔薄膜的细胞培养室;向细胞培养室内注入基质胶,在多孔薄膜的上表面形成基质层;
(2)将步骤(1)所得开口侧贴合多孔薄膜的细胞培养室与超材料芯片的开口侧相对扣合压紧;
(3)向细胞培养室内注入待检细胞悬液,其中的细胞沉积于基质层表面,随着培养时间的延长,细胞穿越基质层和多孔薄膜,最终粘附于周期性亚波长金属结构的上表面,形成细胞层。
优选的,步骤(1)中,细胞培养室的制作方法如下:通过复制压模/成形的软刻蚀技术制备内部具有正方形凹槽的细胞培养室。
进一步优选的,所述凹槽的深度为2mm。
优选的,步骤(1)中,烘烤的工艺条件为:120℃烘烤1小时。
优选的,步骤(2)中,超材料芯片的制作方法如下:通过深硅刻蚀的方法在基底中央区域刻蚀出一个正方形的凹槽,然后在凹槽底部镀上金属层,通过光刻技术在凹槽底部制备正方形中央四开口结构。
进一步优选的,所述凹槽的深度为10μm。
进一步优选的,在凹槽底部依次镀上20nm铬、180nm金。
优选的,步骤(2)中,利用尼龙夹具夹持开口侧贴合多孔薄膜的细胞培养室与超材料芯片,使得两者紧密扣合。
上述太赫兹超材料芯片的使用方法,使用反射式太赫兹时域光谱平台(爱德万测试,tas7500sp),在光路中空气湿度为3%以下时进行检测,平均2048次光谱采样并保存反射光谱信号。
优选的,在注入待检细胞悬液前,先采用反射式太赫兹时域光谱平台(爱德万测试,tas7500sp),光路中空气湿度为3%以下,测量太赫兹超材料芯片的背景信号。
本发明的有益效果在于:
本发明集成了细胞培养室、多孔薄膜及超材料芯片层,利用太赫兹超材料在垂直方向微米级别分布的局域增强电场,对穿过多孔薄膜的细胞数量进行原位、无标记检测,以评估细胞侵袭及迁移等运动行为。整套装置结构简单,组装便捷,体积小巧,易于整合,可重复使用。具体如下:
1、本发明所构建太赫兹超材料细胞芯片,利用其表面形成垂直方向分布的数微米级别共振电场对附近等效折射率改变(即物质分布情况)高度敏感的特性,实现对跨膜细胞分布密度的高敏检测,不依赖任何染料,优于传统染色、光镜下计数等标记方法,是真正意义的无标记分析。
2、本发明整合多孔薄膜和超材料芯片,其中多孔薄膜作为细胞穿越运动的介质,达到多孔薄膜有效支撑基质胶平面、利于物质交换和细胞趋化等良好效果;克服现有太赫兹超材料细胞芯片无法进行运动侵袭能力评估,仅能观测静态药物效应(如粘附生长在芯片表面的单细胞层对药物诱导凋亡的响应)的局限,通过通透性多孔薄膜将超材料敏感响应区域阻隔分离,可实现对薄膜上层肿瘤细胞侵袭进入下层敏感响应区域的原位、无标记检测。
3、本发明拆卸便捷,可重复使用。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图进行说明:
图1为太赫兹超材料芯片装置图;
图2-a和图2-b为太赫兹超材料芯片检测细胞侵袭力的原理图;
图3为光镜下超材料结构图;
图4为fdtd模拟分析超材料谐振环狭缝处电场分布图(z轴向);
图5为不同浓度吉非替尼作用下太赫兹超材料芯片的响应图;
图6为太赫兹超材料芯片反射谐振峰值与单谐振环细胞平均数目线性拟合图;
其中,1为细胞培养室,2为超材料芯片层,3为多孔薄膜,4为进样软管道,5为细胞层,6为谐振环。
具体实施方式
下面将结合附图,对本发明的优选实施例进行详细的描述。
实施例:
如图1和图2-a、图2-b所示,用于细胞侵袭、迁移能力无标记检测的太赫兹超材料芯片,包括上下设置的细胞培养室1和超材料芯片层2,两者均为设有一个开口的方形凹槽,它们的开口侧相对扣合构成密闭空间,在细胞培养室1和超材料芯片层2之间紧压一层多孔薄膜3,多孔薄膜3在密闭空间内的部分,其上表面涂布有matrigel基质层;在超材料芯片层2的凹槽底部设有谐振环6,谐振环6的上表面粘附有细胞层5。
细胞培养室1的材质为pdms(聚二甲基硅氧烷),多孔薄膜3的材质为聚碳酸酯膜。多孔薄膜3的整体尺寸与细胞培养室一致,厚度为10μm,孔径为8μm。
细胞培养室1与超材料芯片层2紧密夹持于尼龙夹具内。细胞培养室1与超材料芯片层2的外部尺寸及凹槽尺寸均相同。
细胞培养室1设有与其内部连通的进样软管道4和出样软管道,用于培养基的注入和流出。
超材料芯片层2包括谐振环6以及方形凹槽结构的基底两部分,谐振环6是光刻于基底凹槽底部的周期性亚波长金属结构(图3),基底的材质为高阻硅,高阻硅的厚度为500μm,电阻率大于10000ω·cm。谐振环分为上层和下层,它们的材质分别为金和铬,厚度分别为180nm和20nm。谐振环为周期70μm、边长66μm、金属线框宽2μm、开口缝隙宽4μm的正方形中央四开口的周期结构。正方形中央四开口的具体结构是:在正方形每个边长的中间位置设有开口。
上述太赫兹超材料芯片的制作方法,具体步骤如下:
(1)将多孔薄膜3在洁净的石英载玻片ⅰ表面铺平贴紧,在洁净的石英载玻片ⅱ上旋涂质量比5:1的聚二甲基硅氧烷和甲苯混合而成的预聚合溶液,细胞培养室1的开口一侧采用微印章方法蘸取预聚合溶液,然后对准多孔薄膜后压紧,烘烤,使得细胞培养室1与多孔薄膜3紧密贴合,形成开口侧贴合多孔薄膜3的细胞培养室1;向细胞培养室1内注入matrigel基质,在多孔薄膜3的上表面形成matrigel基质层;
(2)将步骤(1)所得开口侧贴合多孔薄膜3的细胞培养室1与超材料芯片2的开口侧相对扣合压紧;
(3)向细胞培养室1内注入待检细胞悬液,其中的细胞沉积于matrigel基质层表面,随着培养时间的延长,细胞穿越matrigel基质层和多孔薄膜3,最终粘附于周期性亚波长金属结构的上表面,形成细胞层5。
步骤(1)中,细胞培养室1的制作方法如下:通过复制压模/成形的软刻蚀技术制备内部具有正方形凹槽的细胞培养室1。凹槽的深度为2mm。
步骤(1)中,烘烤的工艺条件为:120℃烘烤1小时。
步骤(2)中,超材料芯片的制作方法如下:通过深硅刻蚀的方法在基底中央区域刻蚀出一个正方形的凹槽,然后在凹槽底部依次镀上20nm铬、180nm金,通过光刻技术在凹槽底部制备正方形中央四开口结构。凹槽的深度为10μm。。
步骤(2)中,利用尼龙夹具夹持开口侧贴合多孔薄膜3的细胞培养室1与超材料芯片2,使得两者紧密扣合。
上述太赫兹超材料芯片的使用方法,使用反射式太赫兹时域光谱平台(爱德万测试,tas7500sp),在光路中空气湿度为3%以下时进行检测,平均2048次光谱采样并保存反射光谱信号。在注入待检细胞悬液前,先采用反射式太赫兹时域光谱平台(爱德万测试,tas7500sp),光路中空气湿度为3%以下,测量太赫兹超材料芯片的背景信号。
f=(lc)-1/2(1)
其中,f为超材料低频共振模式的频率,l为超材料整体电感,c为超材料整体电容。
c=c基底+c基底-谐振环+c谐振环+c谐振环-样本(2)
其中,c为整体电容,c基度-谐振环为基底和超材料表面金属谐振环间电容,c谐振环为超材料金属谐振环自身电容,c谐振环-样本为超材料金属谐振环与样本间电容。
由公式(1)可知,超材料芯片低频共振模式可理解为电容电感耦合的共振模型,其共振频率f由其整体电感和电容共同决定。在超材料结构尺寸确定情况下,其整体电感l不发生改变;而其整体电容c则主要受超材料表面环境介电常数和电场分布的影响。由公式(2)可得,在c基度、c谐振环、c基底-谐振环均确定情况下,超材料整体电容的改变主要受到其表面所覆盖待检样本数量分布的影响,即随着待检样本数量增多,谐振环与样本间电容改变增大,导致超材料整体电容增大,进而共振频率减小(红移)。
通过时域有限差分模拟法(fdtd)模拟太赫兹超材料表面电场分布结果如图4所示,超材料谐振环狭缝处呈现局域共振电场增强,在z轴方向上电场增强分布范围在10μm以内。本发明所提供超材料细胞芯片装置,谐振环表面距离聚碳酸酯膜底面为10μm(即深硅刻蚀所形成凹槽深度),可对穿越基底的肿瘤细胞的数量密度分布进行高灵敏响应,进而实现对肿瘤细胞侵袭能力的无标记评估。
以表皮生长因子受体(epidermalgrowthfactorreceptor,egfr)酪氨酸激酶抑制剂吉非替尼对egfr高度表达的三阴性乳腺癌细胞mda-mb-231的侵袭能力影响评估为例,使用本发明所提供超材料细胞芯片装置进行无标记检测,其应用还可扩展至细胞侵袭或迁移等实验中,检测具体步骤如下:
1、细胞培养:mda-mb-231细胞(
2、接种细胞与太赫兹检测:准备五份同批制作的超材料细胞芯片装置,用丙酮、无水乙醇及超纯水依次清洗超材料芯片表面和细胞培养室,氮气吹干后,将超材料芯片与细胞培养室放于细胞培养皿中,置于紫外灯下消毒1小时。将不含胎牛血清的dmem培养基与matrigel胶(50mg/l)按体积比3:1进行稀释;通过细胞培养室进样孔在培养室中加入50μl稀释好的matrigel胶,无菌条件下过夜,确保胶完全聚合。向超材料芯片凹槽内部充满完全培养基,在细胞培养室上层加入50μl不含胎牛血清的培养基润湿,而后用尼龙夹具将其与细胞培养室密闭组装好,使用反射式太赫兹时域光谱平台(爱德万测试,tas7500sp),光路中空气湿度为3%以下,测量不同组的背景信号。待不同浓度吉非替尼处理后的mda-mb-231细胞融合度达到85%左右时,以1ml0.25%胰蛋白酶-edta消化2分钟,待细胞呈流沙状逐渐脱落,加入完全培养基终止消化,吹打并吸出细胞悬液,离心后用不含胎牛血清的dmem培养基重悬配置成浓度为2×105个细胞/ml悬液。按不同分组向超材料细胞芯片装置中分布加入100μl对应细胞悬液,并使用不含胎牛血清的dmem培养基补充满。在细胞培养箱中培养约24小时后,使用反射式太赫兹时域光谱平台(tas7500sp),在光路中空气湿度为3%以下时进行检测,平均2048次光谱采样并保存对应分组的反射光谱信号,最后测量并保存无谐振环结构的相同硅片的反射光谱信号作为参考。
3、光镜下细胞计数:移去检测后的超材料细胞芯片装置中的培养基,拆除尼龙夹具并取下超材料芯片。每片超材料芯片在光镜下随机选取10个视野,统计并计算单个谐振环上的平均细胞数目。
4、结果分析:将获得不同浓度药物作用后超材料细胞芯片装置的反射时域光谱信号中第二个峰(代表超材料表面谐振环所反射的峰),进行快速傅里叶变换,获得频域强度值信号,将其与硅片反射峰的频域强度值相除并与对应背景信号为参考进行归一化处理。由于在太赫兹波段,细胞和水的复介电常数差异主要在虚部,如图5所示,随着药物浓度的升高,mda-mb-231细胞的侵袭力会逐渐下降,穿越基质和多孔薄膜层到达超材料表面的细胞数量密度会减少,故反射谐振峰的幅度值逐渐下降(接近培养基水溶液的吸收)。随机视野法统计单个谐振环上平均细胞个数,可较好反应谐振环上细胞的数量密度分布;通过提取不同药物浓度作用的反射谐振峰值,与其进行线性拟合,结果如图6所示,线性相关性较好,说明超材料芯片可对表面细胞数量分布产生有效响应。综上,构建的超材料细胞芯片装置可以无标记、原位分析由药物作用导致的肿瘤细胞侵袭能力变化。
最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!