(3Z,6Z)-9,10-环氧-十八碳二烯的合成方法与流程
本发明涉及一种天然产物性信息素成分的新型合成方法,具体涉及一种(3z,6z)-9,10-环氧-十八碳二烯的合成方法,属于药物合成领域。
背景技术:
我国茶区幅员辽阔,各区生态特点不同,茶树害虫种类很多,其中茶尺蠖是茶园尺蠖中发生最普遍、危害最严重的种类之一。茶尺蠖的泛滥,给茶叶生产带来了很大的损失。之前,茶尺蠖的防治主要是使用有机磷农药毒杀,但由于农药的大量使用,害虫已产生抗药性,再则化学农药对环境产生的污染和茶叶中农药的残留也令人担忧。近年来,随着生产力的迅速提高,生活条件的不断改善,人们对饮食质量的要求也越来越高,无论在国外,还是在国内,更加强调无农药、无重金属污染。因此,利用昆虫性信息素来防治茶园害虫茶尺蠖,提高茶叶的品质,具有较好的经济效益和生态效益。
鉴定茶尺蠖性信息素的尝试在30多年前已经开始。du(1978–1981)研究茶尺蠖的性信息素并鉴定了多种可能的成分,但是并没有报道这些成分的化学结构(日期未发表)。li等人(1988)把(z,z,z)-3,6,9-十八碳三烯基乙酸酯,(z,z,z)-3,6,9-十八碳三烯和(z,z,z)-3,6,9-十九碳三烯认定为茶尺蠖的性信息素(lietal.1988)。yao等人(1991)通过气相色谱-质谱分析法(gc-ms)推断(z,z,z)-3,6,9-十八碳三烯和6,7-环氧-(z,z)-3,9-十八碳二烯是这种害虫的性信息素。在2017年我们课题组等人用全合成的方法经过十步反应合成了6,7-环氧-(z,z)-3,9-十八碳二烯,并对此化合物做了田间试验。但是发现该化合物的生物活性很差,甚至没有生物活性。为了进一步验证具体是哪种组分具有较好的生物活性。我们课题组对其另外的组分进行了合成研究。通过田间试验,(3z,6z)-9,10-环氧-十八碳二烯的生物活性较好,但是其在较短的时间内失活。我们课题组在进一步对茶尺蠖信息素组分进行更深入的研究。
然而,在最近30年以来,合成茶尺蠖性信息素组分的方法很少,且合成方法各自具有局限性。因此,合成具有高纯度的茶尺蠖性信息素组分,对实现茶园害虫的绿色防控具有重要意义。
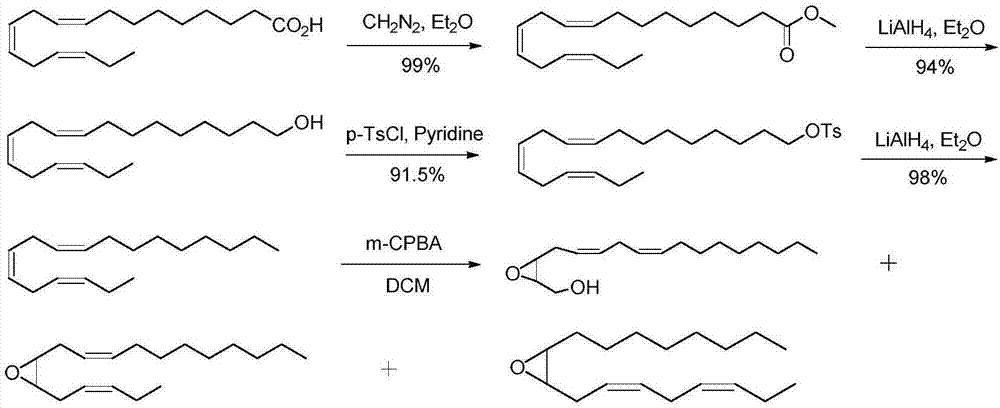
1986年,刘天麟等人以天然亚麻酸当做起始原料,与重氮甲烷酯化后,经氢化铝锂还原,对甲苯磺酰氯磺酰化,再经氢化铝锂还原,最后经过间氯过氧苯甲酸反应得到产物。该方法合成了茶尺蠖信息素组分(3z,6z)-9,10-环氧-十八碳二烯。其合成路线如图1所示。其缺点在于,天然亚麻酸价格昂贵,不适合规模制备。
技术实现要素:
本发明为了克服现有技术中的不足,提出了一种改良的茶尺蠖性信息素合成新方法,该方法具有操作简便、成本较低、原料廉价易得等优点。
上述茶尺蠖性信息素组分为(3z,6z)-9,10-环氧-十八碳二烯。本发明的合成路线如图2所示。
为实现上述目的,本发明采用的技术方案如下:
一种(3z,6z)-9,10-环氧-十八碳二烯的合成方法,按照下述步骤进行:
(1)在低温、氮气保护和碱的作用条件下,丙炔醇和溴辛烷在四氢呋喃溶液中反应过夜,生成产物十一碳-2-炔-1-醇;
(2)将十一碳-2-炔-1-醇溶于有机溶剂中,在催化剂和氢气存在的条件下,经催化氢化4-6小时,经过抽滤、洗涤、干燥、柱层析纯化后,得到顺-十一碳-2烯-1-醇;
(3)在酸性条件下,将顺-十一碳-2烯-1-醇溶在有机溶剂中,室温搅拌过夜,经过抽滤、洗涤、干燥、柱层析纯化后,得到十一碳-2,3-环氧-1-醇;
(4)在碱性条件下,将十一碳-2,3-环氧-1-醇和甲基磺酰氯溶于有机溶剂中反应0.5-1.5小时,然后经过萃取、洗涤、干燥、柱层析纯化后,得到环氧乙烷-3-辛基-甲磺酸盐;
(5)在碱性条件下,将环氧乙烷-3-辛基-甲磺酸盐和n-氯代丁二酰亚胺以及三叔丁基膦溶于有机溶剂中加热回流7-9小时,然后经过萃取、洗涤、干燥、柱层析纯化后,得到3-氯-2-羟基十一烷基甲磺酸盐;
(6)在碱性条件下,将3-氯-2-羟基十一烷基甲磺酸盐溶于有机溶剂中反应4-6小时,然后经过萃取、洗涤、干燥、柱层析纯化后,得到3-氯-1,2-环氧十一烷;
(7)在低温、氮气保护和碱性条件下,将3-氯-1,2-环氧十一烷和三氟化硼乙醚和三甲基硅基乙炔溶于有机溶剂中反应过夜,然后经过萃取、洗涤、干燥、柱层析纯化后,得到5-氯-1-(三甲基甲硅烷)十三碳-1-炔-4-醇;
(8)在碱性条件下,将5-氯-1-(三甲基甲硅烷)十三碳-1-炔-4-醇溶于有机溶剂中反应4-6小时,然后经过萃取、洗涤、干燥、柱层析纯化后,得到2-辛基-3-(丙-2-炔-1-基)环氧乙烷;
(9)在碱和碘代试剂的条件下,将2-辛基-3-(丙-2-炔-1-基)环氧乙烷和2-炔基戊甲磺酸酯在有机溶剂中,室温搅拌过夜,经过抽滤、洗涤、干燥、柱层析纯化后,得到2-(辛烷-2,5-二炔-1-基)-3-辛基环氧乙烷;
(10)将2-(辛烷-2,5-二炔-1-基)-3-辛基环氧乙烷溶于有机溶剂中,在催化剂和氢气存在的条件下,经催化氢化3-5小时,经过抽滤、洗涤、干燥、柱层析纯化后,得到(3z,6z)-9,10-环氧-十八碳二烯。
步骤(1)中所述的低温为-78~0℃;所述的碱为正丁基锂;所述的丙炔醇和溴乙烷的摩尔比为1:1~4,优选为1:1.1。
步骤(2)中所述的有机溶剂为甲醇、乙醇或四氢呋喃,优选为甲醇;所述催化剂为p-2镍催化剂或lindlar催化剂。
步骤(3)中所述的有机溶剂为二氯甲烷;所述的酸为间氯过氧苯甲酸;所述的十一碳-2-炔-1-醇和间氯过氧苯甲酸摩尔比为1:1~3,优选为1:2。
步骤(4)中所述的碱为三乙胺、吡啶或氢氧化钠,优选为三乙胺;所述的有机溶剂为二氯甲烷;所述的十一碳-2,3-环氧-1-醇和甲基磺酰氯的摩尔比为1:1~3,优选为1:1.5;所述的十一碳-2,3-环氧-1-醇与碱的摩尔比为1:1~3,优选为1:1.5。
步骤(5)中所述的碱为n-氯代丁二酰亚胺和三叔丁基膦;所述的有机溶剂为甲苯;所述的环氧乙烷-3-辛基-甲磺酸盐、n-氯代丁二酰亚胺和三叔丁基膦的摩尔比为1:3:1~4,优选为1:3:3。
步骤(6)中所述的碱为碳酸钾、碳酸钠、氢化钠或氢氧化钠,优选为碳酸钾;所述的有机溶剂为乙醇或甲醇,优选为甲醇;所述的3-氯-2-羟基十一烷基甲磺酸盐和碱的摩尔比为1:1~7,优选为1:5。
步骤(7)中所述的低温为-78~0℃;所述的碱为正丁基锂、氢氧化钾、碳酸钾或氢化钠,优选为正丁基锂;所述的有机溶剂为四氢呋喃或乙醚,优选为四氢呋喃;所述的3-氯-1,2-环氧十一烷与碱的摩尔比为1:1~3,优选1:2。
步骤(8)中所述的碱为碳酸钾、碳酸钠、氢化钠或氢氧化钠,优选为碳酸钾;所述的有机溶剂为甲醇或乙醇,优选为甲醇;所述的5-氯-1-(三甲基甲硅烷)十三碳-1-炔-4-醇和碱的摩尔比为1:1~7,优选1:5。
步骤(9)中所述的碱为碳酸钾、碳酸铯或氢氧化钠,优选为碳酸钾;所述的碘代试剂为碘化亚铜和碘化钠;所述的有机溶剂为n,n-二甲基甲酰胺;所述的2-辛基-3-(丙-2-炔-1-基)环氧乙烷和2-炔基戊甲磺酸酯的摩尔比为1:1~5,优选为1:3。
步骤(10)中所述的有机溶剂为甲醇、乙醇或四氢呋喃,优选为甲醇;所述的催化剂为p-2镍催化剂或lindlar催化剂。
本发明的有益效果:
本发明以廉价易得的丙炔醇作为反应的起始原料,以构建环氧中心和碘代试剂催化的偶联反应作为关键步骤,经过十步反应,顺利合成了茶尺蠖性信息素(3z,6z)-9,10-环氧-十八碳二烯,该方法操作简便,成本较低,原料廉价易得,反应条件温和,收率高,适合规模制备。
附图说明
图1为现有技术的(3z,6z)-9,10-环氧-十八碳二烯合成路线图。
图2为本发明的(3z,6z)-9,10-环氧-十八碳二烯合成路线图;其中1为丙炔醇,2为十一碳-2-炔-1-醇,3为顺-十一碳-2烯-1-醇,4为十一碳-2,3-环氧-1-醇,5为环氧乙烷-3-辛基-甲磺酸盐,6为3-氯-1,2-环氧十一烷,7为三甲基硅基乙炔,8为2-辛基-3-(丙-2-炔-1-基)环氧乙烷,9为2-(辛烷-2,5-二炔-1-基)-3-辛基环氧乙烷,10为(3z,6z)-9,10-环氧-十八碳二烯。
具体实施方式
以下结合实施例对本发明进行详细阐述,但本发明不局限于这些实施例。
以下结合实施例对本发明进行详细阐述,但本发明不局限于这些实施例。
实施例1
步骤1:十一碳-2-炔-1-醇的制备
实施例1:将丙炔醇(2g,35.7mmol)和六甲基磷酰三胺(21ml,107mmol)加入到无水四氢呋喃(100ml)中,在n2保护下,降温至-78℃,缓慢加入正丁基锂(28.6ml,71.4mmol,2.5minhexane),搅10min,随后加入溴辛烷(7.5g,39.3mmol),在室温条件下搅拌过夜。待反应完全后,在0℃下加入10ml稀盐酸淬灭。用10%盐酸和甲基叔丁基醚(mtbe)萃取,饱和食盐水洗涤,收集有机相,用无水硫酸钠干燥,柱层析纯化后得4.1g(产率68%)棕色油状液体十一碳-2-炔-1-醇。1hnmr(300mhz,cdcl3):δ0.85(t,j=6.9hz,3h),1.24-1.36(m,10h),1.43-1.50(m,2h),2.15-2.21(m,3h),4.21-4.23(m,2h);13cnmr(75mhz,cdcl3):δ14.2,18.8,22.7,28.7,28.9,29.2,29.3,31.9,51.3,78.4,86.6.
实施例2:将丙炔醇(2g,35.7mmol)和六甲基磷酰三胺(21ml,107mmol)加入到无水四氢呋喃(100ml)中,在n2保护下,降温至-10℃,缓慢加入正丁基锂(28.6ml,71.4mmol,2.5minhexane),搅拌10min,随后加入溴辛烷(7.5g,39.3mmol),在室温条件下搅拌过夜。待反应完全后,在0℃下加入10ml稀盐酸淬灭。用10%盐酸和甲基叔丁基醚(mtbe)萃取,饱和食盐水洗涤,收集有机相,用无水硫酸钠干燥,柱层析纯化后得3g(产率50%)棕色油状液体十一碳-2-炔-1-醇。与实施例1相比,改变反应温度,其他条件不变。产物的1hnmr和13cnmr与实施例1完全一致。
步骤2:顺-十一碳-2烯-1-醇的制备
实施例3:将ni(oac)·4h2o(6.4g,25.9mmol)溶解在60ml甲醇中,在n2保护下,将温度冷却至0℃,加入硼氢化钠(0.98g,25.9mmol),室温反应20分钟,再加入1,2-乙二胺(3.2g,51.8mmol),再将十一碳-2-炔-1-醇(8.7g,51.8mmol)加入到反应液,在氢气条件下,反应5小时。待到反应完全后,用硅藻土抽滤除去不溶物,滤液用乙酸乙酯和水萃取,收集有机相,用无水硫酸钠干燥。旋干得到得到淡黄色液体7.9g(产率90%)顺-十一碳-2烯-1-醇。1hnmr(300mhz,cdcl3):δ0.87(t,j=6.9hz,3h),1.26-1.37(m,13h),2.02-2.10(m,4h),2.02-2.09(m,2h),4.12-4.19(m,2h),5.49-5.63(m,2h);13cnmr(75mhz,cdcl3):δ14.2,22.8,27.5,29.3,29.4,29.6,29.7,31.9,58.6,128.5,133.2.
实施例4:将ni(oac)·4h2o(73.6mg,0.3mmol)溶解在10ml甲醇中,在n2保护下,将温度冷却至0℃,加入硼氢化钠(11.5mg,0.3mmol),室温反应20分钟,再加入1,2-乙二胺(37.2mg,1.2mmol),再将十一碳-2-炔-1-醇(0.2g,1.2mmol)加入到反应液,在氢气条件下,反应5小时。待到反应完全后,用硅藻土抽滤除去不溶物,滤液用乙酸乙酯和水萃取,收集有机相,用无水硫酸钠干燥。旋干得到得到淡黄色液体170mg(产率84%)顺-十一碳-2烯-1-醇。与实施例3相比,改变催化剂当量比,其他条件不变。产物的1hnmr和13cnmr与实施例3完全一致。
实施例5:将ni(oac)·4h2o(1.5g,5.9mmol)溶解在20ml乙醇中,在n2保护下,将温度冷却至0℃,加入硼氢化钠(0.23g,5.9mmol),室温反应20分钟,再加入1,2-乙二胺(740mg,11.9mmol),再将十一碳-2-炔-1-醇(2.0g,11.9mmol)加入到反应液,在氢气条件下,反应5小时。待到反应完全后,用硅藻土抽滤除去不溶物,滤液用乙酸乙酯和水萃取,收集有机相,用无水硫酸钠干燥。旋干得到得到淡黄色液体1.7g(产率85%)顺-十一碳-2烯-1-醇。与实施例3相比,改变反应溶剂,其他条件不变。产物的1hnmr和13cnmr与实施例3完全一致。
步骤3:十一碳-2,3-环氧-1-醇的制备
实施例6:将原料顺-十一碳-2烯-1-醇(5.8g,34.1mmol)溶解在200ml二氯甲烷中,将温度冷却至0℃,加入间氯过氧苯甲酸(11.8g,68.2mmol),室温反应过夜。待到反应完全后,用硫代硫酸钠淬灭反应,滤液用二氯甲烷和饱和碳酸氢钠萃取,收集有机相,用无水硫酸钠干燥。柱层析纯化后得5.6g(产率87%)十一碳-2,3-环氧-1-醇。产物为白色固体。1hnmr(300mhz,cdcl3):δ0.86(t,j=6.9hz,3h),1.22-1.55(m,14h),2.5(s,1h),2.99-3.04(m,1h),3.12-3.17(m,1h),3.64(dd,j1=7.2hz,j2=12.2hz1h),3.84(dd,j1=3.9hz,j2=12.0hz1h);13cnmr(100mhz,cdcl3):δ14.2,22.8,26.7,28.1,29.3,29.5,29.6,31.9,57.1,57.5,61.0.
实施例7:将原料顺-十一碳-2烯-1-醇(5.8g,34.1mmol)溶解在200ml二氯甲烷中,将温度冷却至0℃,加入间氯过氧苯甲酸(8.9g,51.2mmol),室温反应过夜。待到反应完全后,用硫代硫酸钠淬灭反应,滤液用二氯甲烷和饱和碳酸氢钠萃取,收集有机相,用无水硫酸钠干燥。柱层析纯化后得4.7g(产率75%)十一碳-2,3-环氧-1-醇。产物为白色固体。与实施例6相比,改变间氯过氧苯甲酸当量比,其他条件不变。产物的1hnmr和13cnmr与实施例6完全一致。
步骤4:环氧乙烷-3-辛基-甲磺酸盐的制备
实施例8:将十一碳-2,3-环氧-1-醇(5.3g,28.5mmol)和甲基磺酰氯(6.4g,42.7mmol)加入到无水二氯甲烷(100ml),将温度冷却至0℃,将三乙胺(4.5g,42.7mmol)加入反应,在0℃下反应1小时。待到体系反应完全后,用二氯甲烷和水萃取,收集有机相,用无水硫酸钠干燥,柱层析纯化后得到7.2g(产率95%)环氧乙烷-3-辛基-甲磺酸盐。产物是淡黄色液体。1hnmr(400mhz,cdcl3):δ0.86(t,j=6.8hz,3h),1.25-1.54(m,14h),3.04-3.06(m,1h),3.08(m,3h),3.22-3.27(m,1h),4.20(dd,j1=7.2hz,j2=12.0hz1h),4.44(dd,j1=4.0hz,j2=11.6hz1h);13cnmr(100mhz,cdcl3):δ14.2,22.7,26.7,28.0,29.2,29.4,29.5,31.9,37.9,53.5,56.9,68.4.
实施例8:将十一碳-2,3-环氧-1-醇(0.3g,1.6mmol)和甲基磺酰氯(184mg,1.6mmol)加入到无水二氯甲烷(10ml),将温度冷却至0℃,将三乙胺(255mg,2.4mmol)加入反应,在0℃下反应1小时。待到体系反应完全后,用二氯甲烷和水萃取,收集有机相,用无水硫酸钠干燥,柱层析纯化后得到340mg(产率80%)环氧乙烷-3-辛基-甲磺酸盐。产物是淡黄色液体。与实施例7相比,改变甲基磺酰氯当量比,其他条件不变。产物的1hnmr和13cnmr与实施例7完全一致。
实施例9:将十一碳-2,3-环氧-1-醇(2g,10.8mmol)和甲基磺酰氯(2.3g,16.1mmol)加入到无水二氯甲烷(30ml),将温度冷却至0℃,将吡啶(1.7g,22mmol)加入反应,在0℃下反应1小时。待到体系反应完全后,用二氯甲烷和水萃取,收集有机相,用无水硫酸钠干燥,柱层析纯化后得到2.1g(产率75%)环氧乙烷-3-辛基-甲磺酸盐。产物是淡黄色液体。与实施例7相比,将碱三乙胺换成吡啶,其他条件不变。产物的1hnmr和13cnmr与实施例7完全一致。
步骤5:3-氯-1,2-环氧十一烷的制备
实施例10:将环氧乙烷-3-辛基-甲磺酸盐(500mg,1.9mmol)溶于20ml无水甲苯中,然后加入n-氯代丁二酰亚胺(761mg,5.7mmol)和三叔丁基膦(11ml,5.7mmol,10%intoluene),加热回流8小时,等反应完全后,用水和乙酸乙酯萃取,洗涤,干燥和柱层析纯化后等步骤,得到产物558mg(产率98%)3-氯-2-羟基十一烷基甲磺酸盐。产物是棕褐色液体。
将上步所得的3-氯-2-羟基十一烷基甲磺酸盐(480mg,1.6mmol)溶于20ml甲醇中,然后加入碳酸钾(1g,8.0mmol),在室温下反应5小时。等到反应完全后。在0℃冰浴条件下,用1n稀盐酸淬灭反应。然后用水和乙酸乙酯萃取,洗涤,干燥和柱层析纯化后等步骤,得到产物180mg(产率54%)3-氯-1,2-环氧十一烷。产物是无色液体。1hnmr(400mhz,cdcl3):δ0.88(t,j=6.8hz,3h),1.27-1.57(m,12h),1.76-1.84(m,2h),2.72(q,j=2.4hz1h),2.89-2.90(m,1h),3.12-3.14(m,1h),3.57-3.62(m,1h);13cnmr(100mhz,cdcl3):δ14.2,22.8,26.3,29.2,29.3,29.5,31.9,34.9,47.2,55.5,63.5.
实施例11:将环氧乙烷-3-辛基-甲磺酸盐(500mg,1.9mmol)溶于20ml无水甲苯中,然后加入n-氯代丁二酰亚胺(761mg,5.7mmol)和三叔丁基膦(7.5ml,3.8mmol,10%intoluene),加热回流8小时,等反应完全后,用水和乙酸乙酯萃取,洗涤,干燥和柱层析纯化后等步骤,得到产物480mg(产率80%)3-氯-2-羟基十一烷基甲磺酸盐。产物是棕褐色液体。降低三叔丁基膦当量比,其他条件不变。
将上步所得的3-氯-2-羟基十一烷基甲磺酸盐(550mg,1.8mmol)溶于20ml甲醇中,然后加入碳酸钾(660mg,3.6mmol),在室温下反应5小时。等到反应完全后。在0℃冰浴条件下,用1n稀盐酸淬灭反应。然后用水和乙酸乙酯萃取,洗涤,干燥和柱层析纯化后等步骤,得到产物168mg(产率45%)3-氯-1,2-环氧十一烷。产物是无色液体。与实施例10相比,改变碳酸钾的当量比,其他条件不变。产物的1hnmr和13cnmr与实施例10完全一致。
实施例12:将环氧乙烷-3-辛基-甲磺酸盐(264mg,1.0mmol)溶于20ml无水甲苯中,然后加入n-氯代丁二酰亚胺(402mg,3.0mmol)和三叔丁基膦(5.8ml,3.0mmol,10%intoluene),加热回流8小时,等反应完全后,用水和乙酸乙酯萃取,洗涤,干燥和柱层析纯化后等步骤,得到产物294mg(产率98%)3-氯-2-羟基十一烷基甲磺酸盐。产物是棕褐色液体。
将上步所得的3-氯-2-羟基十一烷基甲磺酸盐(350mg,1.2mmol)溶于20ml甲醇中,然后加入氢氧化钠(233mg,6.0mmol),在室温下反应5小时。等到反应完全后。在0℃冰浴条件下,用1n稀盐酸淬灭反应。然后用水和乙酸乙酯萃取,洗涤,干燥和柱层析纯化后等步骤,得到产物86mg(产率36%)3-氯-1,2-环氧十一烷。产物是无色液体。与实施例10相比,将碱碳酸钾变成氢氧化钠,其他条件不变。产物的1hnmr和13cnmr与实施例10完全一致。
步骤6:2-辛基-3-(丙-2-炔-1-基)环氧乙烷的制备
实施例13:将三甲基硅基乙炔(0.5ml,3.6mmol)溶于无水四氢呋喃15ml,在n2保护下,降温至-78℃,缓慢滴加正丁基锂(1.7ml,4.2mmol),反应15min,然后加入三氟化硼乙醚(0.85ml,3.6mmol),反应10min后,将3-氯-1,2-环氧十一烷(430mg,2.1mmol)加入反应体系,在-78℃条件下反应过夜。等到反应完全后。在-78℃冰浴条件下,加入5ml饱和的氯化铵水溶液淬灭反应。然后用水和乙酸乙酯萃取,洗涤,干燥和柱层析纯化后等步骤,得到产物477mg(产率75%)5-氯-1-(三甲基甲硅烷)十三碳-1-炔-4-醇。产物是棕褐色液体。
将上述步骤所得的5-氯-1-(三甲基甲硅烷)十三碳-1-炔-4-醇(1g,3.3mmol)溶于无水甲醇20ml,将温度降至0℃,将碳酸钾(2.3g,16.5mmol)缓慢加入反应体系,反应5小时。等到反应完全后。在0℃冰浴条件下,加入5ml稀盐酸淬灭反应。然后用水和乙酸乙酯萃取,洗涤,干燥和柱层析纯化后等步骤,得到产物570mg(产率89%)2-辛基-3-(丙-2-炔-1-基)环氧乙烷。产物是淡黄色液体。1hnmr(400mhz,cdcl3):δ0.87(t,j=6.8hz,3h),1.27-1.52(m,14h),1.76-1.84(m,2h),2.03-2.05(m,1h),2.24-2.31(m,1h),2.54-2.61(m,1h),2.95-2.98(m,1h),3.12-3.16(m,1h);13cnmr(100mhz,cdcl3):δ14.2,18.6,22.8,26.6,27.6,29.3,29.6,31.9,54.9,57.1,70.4,79.6.
实施例14:将三甲基硅基乙炔(0.14ml,1.0mmol)溶于无水四氢呋喃15ml,在n2保护下,降温至-78℃,缓慢滴加正丁基锂(0.47ml,1.2mmol),反应15min,然后加入三氟化硼乙醚(0.12ml,3.6mmol),反应10min后,将3-氯-1,2-环氧十一烷(430mg,1.0mmol)加入反应体系,在-78℃条件下反应过夜。等到反应完全后。在-78℃冰浴条件下,加入5ml饱和的氯化铵水溶液淬灭反应。然后用水和乙酸乙酯萃取,洗涤,干燥和柱层析纯化后等步骤,得到产物133mg(产率75%)5-氯-1-(三甲基甲硅烷)十三碳-1-炔-4-醇。产物是棕褐色液体。
将上述步骤所得的5-氯-1-(三甲基甲硅烷)十三碳-1-炔-4-醇(286mg,0.95mmol)溶于无水甲醇10ml,将温度降至0℃,将氢氧化钠(189mg,4.75mmol)缓慢加入反应体系,反应5小时。等到反应完全后。在0℃冰浴条件下,加入5ml稀盐酸淬灭反应。然后用水和乙酸乙酯萃取,洗涤,干燥和柱层析纯化后等步骤,得到产物129mg(产率70%)2-辛基-3-(丙-2-炔-1-基)环氧乙烷。产物是淡黄色液体。与实施例13相比,将碱碳酸钾变成氢氧化钠,其他条件不变。产物的1hnmr和13cnmr与实施例13完全一致。
实施例15:将三甲基硅基乙炔(0.14ml,1.0mmol)溶于无水四氢呋喃15ml,在n2保护下,降温至-78℃,缓慢滴加正丁基锂(0.47ml,1.2mmol),反应15min,然后加入三氟化硼乙醚(0.12ml,3.6mmol),反应10min后,将3-氯-1,2-环氧十一烷(430mg,1.0mmol)加入反应体系,在-78℃条件下反应过夜。等到反应完全后。在-78℃冰浴条件下,加入5ml饱和的氯化铵水溶液淬灭反应。然后用水和乙酸乙酯萃取,洗涤,干燥和柱层析纯化后等步骤,得到产物133mg(产率75%)5-氯-1-(三甲基甲硅烷)十三碳-1-炔-4-醇。产物是棕褐色液体。
将上述步骤所得的5-氯-1-(三甲基甲硅烷)十三碳-1-炔-4-醇(286mg,0.95mmol)溶于无水乙醇10ml,将温度降至0℃,将氢氧化钠(189mg,4.75mmol)缓慢加入反应体系,反应5小时。等到反应完全后。在0℃冰浴条件下,加入5ml稀盐酸淬灭反应。然后用水和乙酸乙酯萃取,洗涤,干燥和柱层析纯化后等步骤,得到产物147mg(产率80%)2-辛基-3-(丙-2-炔-1-基)环氧乙烷。产物是淡黄色液体。与实施例13相比,将溶剂无水甲醇变成无水乙醇,其他条件不变。产物的1hnmr和13cnmr与实施例13完全一致。
步骤7:2-(辛烷-2,5-二炔-1-基)-3-辛基环氧乙烷的制备
实施例16:将碳酸钾(1.04g,7.5mmol),碘化钠(1.11g,7.5mmol)和碘化亚铜(1.4g,7.5mmol)加入到30ml的n,n-二甲基甲酰胺中,在n2保护下,将温度冷却至0℃,再慢慢加入2-辛基-3-(丙-2-炔-1-基)环氧乙烷(0.69g,3.6mmol)和2-炔基戊甲磺酸酯(1.7g,10.8mmol)然后在室温下反应过夜。待到反应完全后,抽滤除去不溶物,滤液用乙酸乙酯和水萃取,收集有机相,用无水硫酸钠干燥。柱层析纯化后得0.74g(产率80%)2-(辛烷-2,5-二炔-1-基)-3-辛基环氧乙烷。产物是棕黄色液体。1hnmr(400mhz,cdcl3):δ0.87(t,j=6.8hz,3h),1.1(t,j=7.6hz,3h),1.26-1.32(m,12h),1.42-1.54(m,4h),2.15(qt,j1=2.4hz,j2=7.6hz2h),2.22-2.30(m,1h),2.52-2.58(m,1h),2.91-2.95(m,1h),3.09-3.14(m,3h);13cnmr(100mhz,cdcl3):δ9.9,12.5,14.0,14.2,18.9,22.8,26.6,27.7,29.3,29.6,31.9,55.2,57.2,73.4,75.5,82.2.
实施例17:将碳酸铯(2.7g,8.5mmol),碘化钠(1.3g,8.5mmol)和碘化亚铜(1.6g,8.5mmol)加入到30ml的n,n-二甲基甲酰胺中,在n2保护下,将温度冷却至0℃,再慢慢加入2-辛基-3-(丙-2-炔-1-基)环氧乙烷(0.82g,4.25mmol)和2-炔基戊甲磺酸酯(2.05g,12.7mmol)然后在室温下反应过夜。待到反应完全后,抽滤除去不溶物,滤液用乙酸乙酯和水萃取,收集有机相,用无水硫酸钠干燥。柱层析纯化后得0.82g(产率75%)2-(辛烷-2,5-二炔-1-基)-3-辛基环氧乙烷。产物是棕黄色液体。与实施例16相比,将碱碳酸钾变成碳酸铯,其他条件不变。产物的1hnmr和13cnmr与实施例16完全一致。
实施例18:将碳酸钾(0.5g,3.75mmol),碘化钠(0.56g,3.75mmol)和碘化亚铜(0.7g,3.75mmol)加入到30ml的n,n-二甲基甲酰胺中,在n2保护下,将温度冷却至0℃,再慢慢加入2-辛基-3-(丙-2-炔-1-基)环氧乙烷(0.35g,1.8mmol)和2-炔基戊甲磺酸酯(0.43g,2.7mmol)然后在室温下反应过夜。待到反应完全后,抽滤除去不溶物,滤液用乙酸乙酯和水萃取,收集有机相,用无水硫酸钠干燥。柱层析纯化后得0.32g(产率77%)2-(辛烷-2,5-二炔-1-基)-3-辛基环氧乙烷。产物是棕黄色液体。与实施例16相比,将2-炔基戊甲磺酸酯的当量比减半,其他条件不变。产物的1hnmr和13cnmr与实施例16完全一致。
步骤8:(3z,6z)-9,10-环氧-十八碳二烯的制备
实施例19:将ni(oac)·4h2o(486mg,1.95mmol)溶解在100ml甲醇中,在n2保护下,将温度冷却至0℃,加入硼氢化钠(74.6mg,1.95mmol),室温反应20分钟,再加入1,2-乙二胺(0.26ml,3.9mmol),再将2-(辛烷-2,5-二炔-1-基)-3-辛基环氧乙烷(1.02g,3.9mmol)加入到反应液,在氢气条件下,反应4小时。待到反应完全后,用硅藻土抽滤除去不溶物,滤液用乙酸乙酯和水萃取,收集有机相,用无水硫酸钠干燥。柱层析纯化后得到885g(产率85%)(3z,6z)-9,10-环氧-十八碳二烯。产物是淡黄色液体。1hnmr(400mhz,cdcl3):δ0.88(t,j=6.8hz,3h),0.97(t,j=7.6hz,3h),1.27-1.39(m,12h),1.42-1.58(m,4h),2.03-2.10(m,2h),2.18-2.25(m,1h),2.37-2.44(m,1h),2.79-2.82(m,2h),2.92-2.95(m,2h),5.27-5.54(m,4h);13cnmr(100mhz,cdcl3):δ14.2,14.4,20.7,22.8,25.8,26.4,26.7,27.9,29.4,29.6,29.7,32.0,56.5,57.3,124.3,126.8,130.9,132.3.
实施例20:将ni(oac)·4h2o(71.8mg,0.29mmol)溶解在15ml甲醇中,在n2保护下,将温度冷却至0℃,加入硼氢化钠(11mg,0.29mmol),室温反应20分钟,再加入1,2-乙二胺(34.6ml,0.58mmol),再将2-(辛烷-2,5-二炔-1-基)-3-辛基环氧乙烷(0.3g,1.15mmol)加入到反应液,在氢气条件下,反应4小时。待到反应完全后,用硅藻土抽滤除去不溶物,滤液用乙酸乙酯和水萃取,收集有机相,用无水硫酸钠干燥。柱层析纯化后得到244mg(产率80%)(3z,6z)-9,10-环氧-十八碳二烯。产物是无色液体。与实施例19相比,改变催化剂的当量比,其他条件不变。产物的1hnmr和13cnmr与实施例19完全一致。
实施例21:取2-(辛烷-2,5-二炔-1-基)-3-辛基环氧乙烷(300mg,1.15mmol)于甲醇(10ml)中溶解,0℃下加入lindlar催化剂(30mg),在氢气环境下反应50min。gc检测,待反应完全后,用硅藻土抽滤,滤饼用甲醇洗涤,收集母液,旋干,得到(238mg,产率78%)淡黄色液体(3z,6z)-9,10-环氧-十八碳二烯。与实施例19相比,改变催化剂,其他条件不变。产物的1hnmr和13cnmr与实施例19完全一致。
- 还没有人留言评论。精彩留言会获得点赞!