一种改性磁珠、制备方法及其应用与流程
本发明属于食品微生物检测
技术领域:
,具体涉及一种富集高蛋白样品中革兰氏阴性菌的改性磁珠、制备方法及其应用。
背景技术:
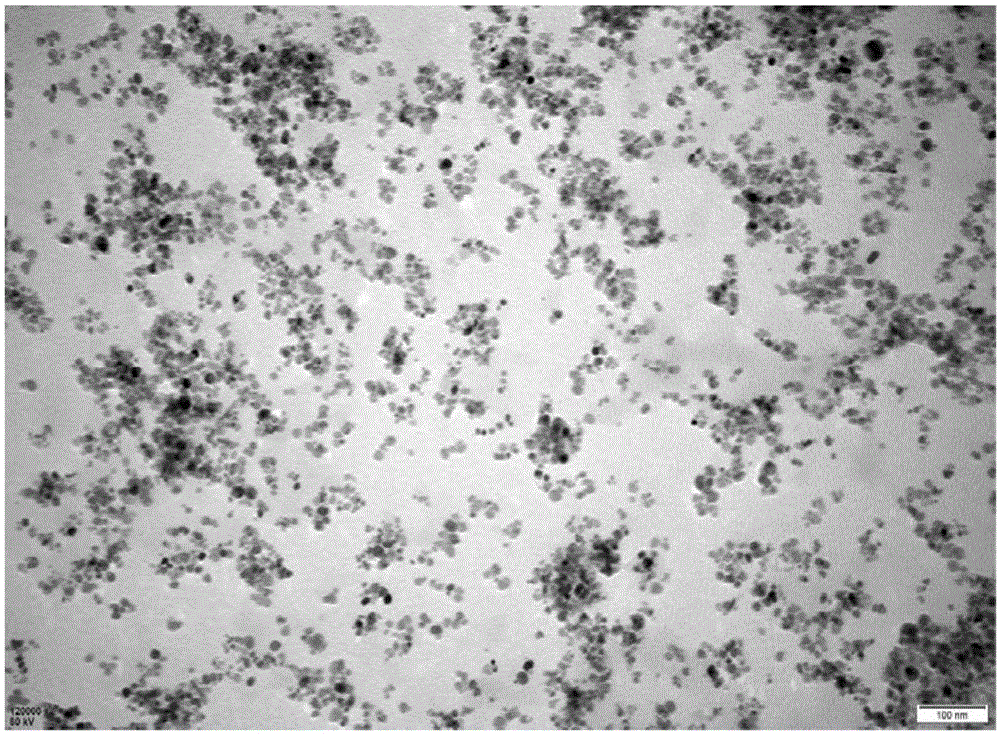
:食品安全问题是人类广泛关注的重要问题。而在诸多食品安全问题中,细菌性污染由于具有种类多、分布广、爆发周期短、具有可传染性等特征,已成为影响食品安全的主要因素。我国现有《食品安全国家标准》gb4789中关于食品微生物学检验,主要采用选择性培养基或生化试验进行鉴定。这些方法是目前我国食品微生物学检验的金标准,具有检测重复性高、可操作性强等优点。但是,该方法检测时间长、靶向性差、易造成二次交叉污染,仅限于专业检验机构实验室进行检测,无法对食品加工、运输、存储等环节的微生物进行及时、现场检测。目前常用于富集细菌的方法有传统增菌培养法、免疫磁珠法、改性磁珠法(如硅羟基化、羧基化、氨基化、油酸改性等)。传统增菌培养法是通过处理食品样品,在一定条件(如培养基、温度等)下培养24-96h,离心、过滤,洗涤实现细菌与样品分离的过程。虽然传统方法在细菌富集中具有一定的优势,但其操作繁琐,易污染、耗时且浓缩效率低。免疫磁珠法是一种基于抗原-抗体特异性结合反应原理的微生物快速分离富集技术,以其高度的靶标特异性在食品微生物快速检测中得到广泛应用。缩短了常规检测所需的增菌时间。但在吸附高蛋白含量样品时,存在以下问题:一方面,样品中含有的蛋白质会封闭抗体的结合位点,而降低吸附效率;另一方面,会作为“抗原”与抗体发生反应,造成假阳性结果。改性磁珠法是一种包被化学活性基团的功能化载体,基于磁珠与细菌之间形成静电吸附作用的微生物富集技术,具有良好的生物相容性,应用广泛。但由于在制备过程中存在尺寸不均、分散性差,功能化程度偏低等缺点,使其在富集高蛋白含量食品中痕量革兰氏阴性菌时吸附效率及回收率较低,限制了改性磁珠在食品安全领域快速检测方面的应用。技术实现要素:针对目前常用方法在食品安全微生物快速检测中存在的局限性,本发明的目的是提供一种改性磁珠、制备方法及其应用,解决现有的方法制备的磁珠需要微生物高浓度才能形成聚集体的问题。为了实现上述目的,本发明采用如下技术方案予以实现:一种改性磁珠,包括fe3o4纳米磁珠以及包覆在fe3o4纳米磁珠表面的双子阳离子表面活性剂。优选的,所述的双子阳离子表面活性剂的烷基疏水链长度m为8c~18c,连接基团疏水性柔性链长度s为10c;所述的fe3o4纳米磁珠表面经过硅烷基改性或油酸改性。本发明还公开了一种改性磁珠的制备方法,包括:将fe3o4纳米磁珠与双子阳离子表面活性剂溶液在40~60℃下混合,并在混合过程中至少一次加入交联剂,得到双子阳离子表面活性剂包覆的fe3o4纳米磁珠,即改性磁珠。优选的,将fe3o4纳米磁珠置于分散液中,再加入双子阳离子表面活性剂溶液,超声分散5~15min,在40~60℃、300~500r/min的转速下搅拌0.5~2h,并在搅拌过程中每隔10~20min加入交联剂;其中,分散液由去离子水、无水乙醇和nh3·h2o按照体积比为1:(0.1~0.75):(0.5~1)的比例混合而成;fe3o4纳米磁珠与分散液的体积比为(0.5~1):(1~2)。具体的,将fe3o4纳米磁珠置于分散液中,在25~40℃、300~500r/min的转速下搅拌0.5~2h,在搅拌过程中每隔10~20min逐滴加入nano2作为保护液。具体的,所述的fe3o4纳米磁珠与双子阳离子表面活性剂的质量比为(5~25):1。具体的,双子阳离子表面活性剂溶液中双子阳离子表面活性剂的质量浓度为0.5%~2.5%;双子阳离子表面活性剂溶液为双子阳离子表面活性剂的醋酸溶液、甘氨酸-盐酸溶液或柠檬酸-柠檬酸钠溶液;所述的双子阳离子表面活性剂溶液的ph为2.5~5.0。具体的,所述的交联剂为戊二醛溶液或1,4-丁二醇二缩水甘油醚溶液。本发明还公开了上述改性磁珠用作高蛋白含量食品中革兰氏阴性菌的吸附的应用。具体的,取待测试食品样品加入ph为2~7的tris-hcl溶液中溶解,然后与改性磁珠溶液在30~60℃下混合20~50min,得到磁珠-细菌复合物;其中,改性磁珠溶液中改性磁珠的质量浓度为20~50mg/ml;最后,使用ph为2.5~4.5的pbs溶液洗涤磁珠-细菌复合物,取上清液测定细菌菌落数。与现有技术相比,本发明的有益效果是:(1)本发明利用双子阳离子表面活性剂修饰fe3o4纳米磁珠,获得改性磁珠,用于高蛋白含量的食品中革兰氏阴性菌的检测过程中,在细菌浓度低的情况下就能形成聚集体,解决了传统表面活性剂需要高浓度才能形成聚集体的问题。(2)本发明制备的改性磁珠颗粒分散均匀,颗粒形状规则,对高蛋白含量的食品中痕量革兰氏阴性菌也具有较强的吸附效果。(3)本发明制备的改性磁珠,相对于目前的免疫磁珠,避免了高蛋白样品中蛋白质对免疫磁珠的干扰,提高了细菌检测效率和灵敏度。(4)在本发明的改性磁珠的制备过程中,fe3o4纳米磁珠的分散液中巧妙的使用nh3·h2o和nano2作为保护液,nh3·h2o一方面可以调节分散液的ph值,另一方面与后期加入的nano2反应生成naoh和n2,naoh保持分散液的碱性,n2可以将水溶液溶解的氧气带走,防止磁珠氧化。附图说明图1是实施例1制备的改性磁珠的tem照片。图2是实施例1制备的改性磁珠吸附细菌后的tem照片。图3是细菌平板菌落计数培养,a-对照菌落,b-洗脱液菌落。图4是fe3o4分散液与双子阳离子表面活性剂溶液在不同混合工艺下制备的改性磁珠的粒径。图5是使用表面活性剂sds制备的磁珠的形貌图。图6是使用表面活性剂tritonx-100制备的磁珠的形貌图。图7是使用表面活性剂ctab制备的磁珠的形貌图。图8是四种不同表面活性剂在不同的质量浓度和加入体积下的吸附率。图9是geminis表面活性剂烷基疏水链长度不同时的吸附率。图10是geminis表面活性剂接基团疏水性柔性连长度不同时的吸附率。图11是表2中纳米磁珠与分散液的混合工艺获得的fe3o4@sio2纳米磁珠的粒径。图12是本发明的改性磁珠与样品溶液在不同工艺下混合后的吸附率。以下结合说明书附图和具体实施方式对本发明做具体说明。具体实施方式本发明中使用的fe3o4纳米磁珠是一种新型功能材料,具有生物相容性好、表面易于修饰改性等特点,在生物医学领域中应用广泛。双子阳离子表面活性剂(geminis)是一类含有双亲油基和双亲水基的两亲物,相比于传统的单头(单亲水基)单尾(单疏水基)的单链表面活性剂,双子表面活性剂具有很低的临界胶团浓度、更高的表面活性、较大的温度适用范围。本发明在fe3o4纳米磁珠表面修饰双子阳离子表面活性剂,制备一种用于快速富集高蛋白含量样品中革兰氏阴性菌的磁珠。解决了传统方法高蛋白样品细菌富集效率低、过程繁琐等问题,同时成本低廉,易于工业化生产。本发明中的fe3o4纳米磁珠可以是裸磁珠或表面经过硅烷基改性、油酸改性、柠檬酸改性、羧基改性的磁珠,优选硅烷基改性或油酸改性。本发明中的双子阳离子表面活性剂为m-s-m结构。本发明中的改性磁珠,包括fe3o4纳米磁珠以及包覆在fe3o4纳米磁珠表面的双子阳离子表面活性剂。优选的,双子阳离子表面活性剂的烷基疏水链长度m为8c~18c,连接基团疏水性柔性链长度s为10c,其中,8c是指8个碳原子,18c指18个碳原子,10c指10个碳原子。本发明的改性磁珠通过下述方法制备:将fe3o4纳米磁珠与双子阳离子表面活性剂溶液在40~60℃下混合,并在混合过程中加入交联剂,得到双子阳离子表面活性剂纳米颗粒包覆的fe3o4纳米磁珠,最后使用乙醇溶液和去离子水交替洗涤,去除残留的表面活性剂,即可得改性磁珠。其中,fe3o4纳米磁珠与双子阳离子表面活性剂的质量比为(5~25):1。fe3o4纳米磁珠与分散液的体积比为(0.5~1):(1~2)。为了增加的分散性,将fe3o4纳米磁珠置于分散液中,在25~40℃、350~500r/min的转速下搅拌0.5~2h,在搅拌过程中每隔10~20min逐滴加入nano2作为保护液,避免磁珠氧化;再加入双子阳离子表面活性剂溶液,然后超声分散5~15min,最后在40~60℃、300~500r/min的转速下搅拌0.5~2h,并在搅拌过程中每隔10~20min加入交联剂。其中对于500ml烧杯,搅拌桨直径优选50mm~100mm,以达到充分的搅拌。其中,分散液由去离子水、无水乙醇和nh3·h2o按照体积比为1:(0.1~0.75):(0.5~1)的比例组成。本发明的分散液可以分散fe3o4纳米磁珠,增加其与双子阳离子表面活性剂混合均匀性,其中,nh3·h2o一方面可以调节分散液的ph值,另一方面与后期加入的nano2反应生成naoh和n2,naoh保持分散液的碱性,n2可以将水溶液溶解的氧气带走,防止磁珠氧化。为了增加双子阳离子表面活性剂的分散性和均匀性,将其配置为溶液,溶液中双子阳离子表面活性剂的质量浓度为0.5%~2.5%;其中,双子阳离子表面活性剂溶液为双子阳离子表面活性剂的醋酸溶液、甘氨酸-盐酸溶液或柠檬酸-柠檬酸钠溶液;双子阳离子表面活性剂溶液的ph为2.5~5.0。本发明中的交联剂选用戊二醛溶液或1,4-丁二醇二缩水甘油醚溶液。本发明制备的改性磁珠可用作高蛋白含量食品中革兰氏阴性菌的吸附,具体的细菌吸附过程为:将本发明制备的改性磁珠制成溶液,并通过控制溶液的ph值,使改性磁珠与细菌之间形成静电吸附作用,对高蛋白质含量样品,如液体乳、酸乳、乳粉、炼乳、干酪等各种乳制品中的革兰氏阴性菌进行吸附富集和初步分离。首先,吸附富集过程为:取待吸附样品加入ph为2~7的tris-hcl溶液中溶解样品,将改性磁珠溶液加入至样品溶液中,在转速20~50r/min,30~60℃下吸附时间20~50min,得到磁珠-细菌复合物。其中,改性磁珠溶液与样品溶液的体积比为1:(500~1000);改性磁珠溶液中改性磁珠的质量浓度为20~50mg/ml。优选的,tris-hcl溶液的ph=5.8,改性磁珠溶液中改性磁珠的浓度为50mg/ml、加入量为30μl,吸附温度为50℃,时间为20min。然后,初步分离:使用ph为2.5~4.5的pbs溶液洗涤磁珠-细菌复合物,将磁珠与吸附的细菌分离,一般洗涤5次左右;然后取洗涤后的上清液,涂平板试验,测定细菌菌落数。优选ph=3.5的0.05mpbs缓冲液。本发明中使用的fe3o4纳米磁珠以及双子阳离子表面活性剂均为市售。以下给出本发明的具体实施例,需要说明的是本发明并不局限于以下具体实施例中,凡在本申请技术方案基础上做的等同变换均落入本发明的保护范围。实施例1取1ml35mg/ml的fe3o4@sio2(即硅烷基改性)纳米磁珠置于分散液中,分散液由去离子水、无水乙醇、nh3·h2o溶液按照体积比为1:0.1:0.5混合而成,在30℃、500r/min转速下电动搅拌1h,每隔20min逐滴加入5mnano21ml作为保护液;配制质量浓度为1%的双子阳离子表面活性剂醋酸溶液,其中双子阳离子表面活性剂(geminis)的烷基疏水链长度m为8c~18c,连接基团疏水性柔性连长度s为10c;将经过上述处理的fe3o4@sio2磁珠分散液加入表面活性剂醋酸溶液中,其中,fe3o4@sio2纳米磁珠与双子阳离子表面活性剂的质量比为25:1。超声5min分散至均匀,分别在40℃,500r/min、搅拌桨直径100mm条件下持续搅拌0.5~2h,并每隔20min加入1ml5%戊二醛交联剂,修饰fe3o4@sio2纳米磁珠。用20%乙醇溶液、去离子水交替洗涤纳米磁珠5次,去除残留的表面活性剂,即得改性磁珠。如图1所示,可以看出,获得的改性磁珠颗粒大小较均匀,改性磁珠的粒径为75±5nm;改性磁珠表面的包裹的是双子阳离子表面活性剂。将本实施例制备的改性磁珠用于高蛋白样品中革兰氏阴性菌吸附处理实验:吸附过程:称1g液体乳,置于50ml离心管中,加入25mlph=5.8的tris-hcl溶液溶解样品,涡旋混匀,得到样品溶液。取30μl质量浓度50mg/ml的改性磁珠,加入至样品溶液中,转速50rpm,吸附温度50℃,吸附时间20min条件下处理,得到磁珠-细菌复合物,其中,改性磁珠溶液与样品溶液的体积比为1:25。每隔5min涡旋一次,最后用并用70%乙醇和去离子水交替洗涤磁珠-细菌复合物溶液5次,洗至中性,磁分离至上清液澄清,弃去上清液,得到洗脱液,图2所示为洗脱液中的磁珠-细菌复合物。分离过程:使用ph为3.5的pbs溶液洗涤洗脱液中的磁珠-细菌复合物,将磁珠与吸附的细菌分离,洗涤5次;然后取洗涤后的上清液,涂平板试验,测定细菌菌落数,如图3(a)所示与图3(b)中的对照组的细菌菌落数很接近,样品洗脱液中的细菌越多,说明洗脱的越彻底,同时也说明磁珠的吸附效率越高,可以看出,本实施例制备的改性磁珠的吸附率几乎达到99%±1%。实施例2本实施例与实施例1的区别在于:fe3o4@sio2磁珠分散液与表面活性剂醋酸溶液的混合温度为50℃。本实施例制备的改性磁珠的粒径为300±20nm,该磁珠用于高蛋白样品中革兰氏阴性菌吸附处理实验,最终测得的细菌菌落数为600cfu,吸附效率为60%±5%。实施例3本实施例与实施例1的区别在于:fe3o4@sio2磁珠分散液与表面活性剂醋酸溶液的混合温度为60℃。本实施例制备的改性磁珠的粒径为350±10nm,该磁珠用于高蛋白样品中革兰氏阴性菌吸附处理实验,最终测得的细菌菌落数为600cfu,吸附效率为60%±5%。下表1为含有fe3o4@sio2分散液与双子阳离子表面活性剂溶液不同的混合参数实验。表1实施例1至实施例3的工艺参数因素温度(℃)转速(r/min)搅拌时间(h)实验1403000.5实验2404001实验3405002实验4503002实验5504000.5实验6505001.5实验7603001.5实验8604002实验9605000.5图4为fe3o4@sio2分散液与双子阳离子表面活性剂溶液在不同混合工艺下,获得的改性磁珠的粒径。一般粒径越小,说明颗粒的在分散液中的分散性和均匀性越好,吸附效率越高。从图4可以看出,fe3o4@sio2纳米磁珠与双子阳离子表面活性剂溶液在40℃、500r/min条件下机械搅拌2小时后,得到的分散液中fe3o4@sio2纳米磁珠的平均粒径约最小,为75±5nm。实施例4本实施例与实施例1的区别在于:fe3o4@sio2纳米磁珠与双子阳离子表面活性剂的质量比为5:1。将本实施例制备的改性磁珠用于高蛋白样品中革兰氏阴性菌吸附处理实验,最终测得的细菌菌落数为500cfu。实施例5本实施例与实施例1的区别在于:fe3o4@sio2纳米磁珠与双子阳离子表面活性剂的质量比为25:1。将本实施例制备的改性磁珠用于高蛋白样品中革兰氏阴性菌吸附处理实验,最终测得的细菌菌落数为970cfu。实施例6本实施例与实施例1的区别在于:本实施例中选用双子阳离子表面活性剂的甘氨酸-盐酸溶液。将本实施例制备的改性磁珠用于高蛋白样品中革兰氏阴性菌吸附处理实验,最终测得的细菌菌落数与实施例1相同。实施例7本实施例与实施例1的区别在于:本实施例中选用双子阳离子表面活性剂的柠檬酸-柠檬酸钠溶液。将本实施例制备的改性磁珠用于高蛋白样品中革兰氏阴性菌吸附处理实验,最终测得的细菌菌落数与实施例1相同。实施例8本实施例与实施例1的区别在于:本实施例中的交联剂为1,4-丁二醇二缩水甘油醚溶液。将本实施例制备的改性磁珠用于高蛋白样品中革兰氏阴性菌吸附处理实验,最终测得的细菌菌落数与实施例1相同。实施例9本实施例与实施例1的区别在于:本实施例中使用的fe3o4磁珠表面经过油酸改性。将本实施例制备的改性磁珠用于高蛋白样品中革兰氏阴性菌吸附处理实验,最终测得的细菌菌落数与实施例1相同。实施例10本实施例与实施例1的区别在于:本实施例中使用的fe3o4磁珠表面不经过改性。将本实施例制备的改性磁珠用于高蛋白样品中革兰氏阴性菌吸附处理实验,最终测得的细菌菌落数与实施例1相同。但不经过改性处理的裸磁珠包覆双子阳离子表面活性剂后保存时间较短。对比例1本对比例与实施例1的区别在于:分散液中不包含nh3·h2o和nano2。将本对比例与实施例1制备的改性磁珠在常温下放置15天,用于高蛋白样品中革兰氏阴性菌吸附处理实验,最终测得的细菌吸附率为20%±5%。对比例2本对比例与实施例1的区别在于:本对比例使用的表面活性剂为亲水基表面活性剂sds。本对比例制备的改性磁珠形貌如图5所示,可以看出,磁珠团聚严重。将本对比例制备的改性磁珠高蛋白样品中革兰氏阴性菌吸附处理实验,最终测得的细菌菌落数为50cfu,吸附效率为5%±1%。对比例3本对比例与实施例1的区别在于:本对比例使用的表面活性剂为非离子型表面活性剂tritonx-100。本对比例制备的改性磁珠形貌如图6所示,可以看出,磁珠团聚严重。将本对比例制备的改性磁珠高蛋白样品中革兰氏阴性菌吸附处理实验,最终测得的细菌菌落数为400cfu,吸附效率为40%±1%。对比例4本对比例与实施例1的区别在于:本对比例使用的表面活性剂为阴离子表面活性剂ctab。本对比例制备的改性磁珠形貌图7所示,可以看出,磁珠团聚严重,且磁珠形状不规则。将本对比例制备的改性磁珠高蛋白样品中革兰氏阴性菌吸附处理实验,最终测得的细菌菌落数为680cfu,吸附效率为68%±1%。下表2所示为本发明使用的不同的表面活性剂的实验参数:表2:不同的表面活性剂的实验参数图8为表1中四种不同表面活性剂在不同的质量浓度和加入体积下的吸附效率。从图8可以看出,质量浓度为1%、加入体积为1ml的geminis阳离子表面活性剂吸附效率最高。根据上述实施例1过程,本发明还对烷基疏水链长度分别为m<8c、m>18c、m=8c~18c,以及连接基团疏水性柔性连长度分别为s<10c、s=10c、s>10c时的geminis表面活性剂制备的改性磁珠进行吸附效率测试,以103cfu/ml细菌菌落数为标准实验,获得烷基疏水链m、连接基团s不同碳原子数时的吸附率,结果见图9和图10所示。从图9和图10可以看出,烷基疏水链长度m为8~18个碳原子数时,吸附率随碳原子数增加平稳,当碳原子数大于18时,吸附率随碳原子数增加而降低。连接基团疏水性柔性链长度s为10个碳原子数时,吸附率最高,当碳原子数大于10时,吸附率随碳原子数增加而降低。根据上述实施例1的过程,本发明还对不同组合浓度的分散液以及分散液与fe3o4@sio2纳米磁珠的混合工艺进行实验,如表3所示:表3fe3o4@sio2纳米磁珠与分散液的混合实验因素温度(℃)转速(r/min)分散液组成比例搅拌时间(h)实验26253501:0.1:0.50.5实验27254001:0.2:0.51实验28255001:0.5:12实验29303501:0.2:0.52实验30304001:0.5:10.5实验31305001:0.1:0.51实验32403501:0.5:11实验33404001:0.1:0.52实验34405001:0.2:0.50.5图11为表3中纳米磁珠与分散液不同混合工艺下,获得的fe3o4@sio2纳米磁珠的粒径。一般粒径越小,说明颗粒的在分散液中的分散性和均匀性越好。从图7可以看出,分散液由去离子水、无水乙醇和nh3·h2o按照体积比1:0.1:0.5混合而成,fe3o4@sio2纳米磁珠与分散液在30℃、500r/min条件下机械搅拌1小时后,得到的分散液中fe3o4@sio2纳米磁珠的平均粒径约为30±5nm,fe3o4@sio2颗粒在分散液中的分散性最好。根据上述实施例过程,本发明还分别对ph为3.5、4.5、6.8的tris-hcl溶液以及ph为2.5、4.5的pbs溶液进行实验,如下表4所示。表4不同工艺下改性磁珠与样品溶液的混合参数图12为表4中改性磁珠与样品溶液在不同工艺下混合后的吸附效率。从图12可以看出,通过控制缓冲液的ph值,本发明的改性磁珠与细菌之间形成静电吸附作用。因此,样品制备、细菌吸附的最佳条件为tris-hcl缓冲液(乙酸调节ph至5.8)、改性磁珠质量浓度为50mg/ml、加入量为30μl、吸附时间20min、吸附温度50℃。综上,本发明制备改性磁珠颗粒分散均匀,颗粒形状规则,对高蛋白含量的食品中的革兰氏阴性菌也具有较强的吸附效果。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1