用于检测传染性脾肾坏死病毒与鳜鱼弹状病毒的引物组及试剂盒的制作方法
本发明属于水产病害微生物检测技术领域,具体涉及用于检测传染性脾肾坏死病毒与鳜鱼弹状病毒的引物组及试剂盒。
背景技术:
传染性脾肾坏死病毒(infectiousspleenandkidneynecrosisvirus,isknv)和鳜鱼弹状病毒(sinipercachuatsirhabdovirus,scrv)是近年来影响鳜鱼养殖业的主要病毒性病原,该两种病毒所引起的鱼病有高发病率,高传染性和高致死率的后果,给养殖业带来巨大的经济损失。
传染性脾肾坏死病毒(isknv)属于虹彩病毒科肿大细胞属,为双链dna病毒。isknv主要在石斑鱼和鳜鱼等海淡水养殖鱼类中流行,其中对鳜鱼致死率可高达100%。鳜弹状病毒(scrv)由张奇亚等通过电镜观察在患病鳜鱼组织中发现,该病表现为内脏器官和表皮出血的临床症状,致死率可达到90-100%。
目前,对于传染性脾肾坏死病毒和鳜弹状病毒的诊断方法有很多种,包括病毒分离、电镜观察、核酸带型分析等,但都存在耗时长、操作复杂等弊端,不利于isknv和scrv的调查研究。
聚合酶链式反应(polymerasechainreaction,pcr)能将微量的dna在短时间内大幅增加,具有特异性强、灵敏度高、快速简单的特点。isknv和scrv的pcr检测方法已经较广泛建立起来,但是一般的pcr反应一次只能检测一种对应的致病病毒,而鱼类通常会出现两种病毒混合感染的现象而需要通过多次检测和测序才能确定毒株类型,使得检测时间延长,费用增加,延误鳜鱼isknv和scrv的防治。
因此建立isknv和scrv双重pcr,同时检测出isknv和scrv,能缩短检测时间,降低成本,对鳜鱼isknv和scrv的防治具有重要意义。
技术实现要素:
为解决上述问题,本发明提供了用于检测传染性脾肾坏死病毒与鳜鱼弹状病毒的引物组,其特征在于,所述引物组包含两对引物,所述第一对引物的序列如seqidno:3、seqidno:4,所述第二对引物序列如seqidno:7、seqidno:8所示。
本发明还提供一种如上所述的引物组在制备用于检测传染性脾肾坏死病毒与鳜鱼弹状病毒的试剂盒中的应用,每25μl反应体系具有以下浓度的组分:cdna模板1μl、阳性标准品1μl、10μmol/l第一对引物0.5μl、10μmol/l第二对引物1μl、pcr预混液10μl,余量为无菌蒸馏水;所述第一对引物的序列如seqidno.3、seqidno.4所示,所述第二对引物的序列如seqidno:7、seqidno:8所示,所述阳性标准品为含有鳜传染性脾肾坏死病毒和鳜鱼弹状病毒dna的两种质粒。
本发明的另一目的在于还一种用于检测传染性脾肾坏死病毒与鳜鱼弹状病毒的试剂盒,包括如权利要求1所述的引物组。
优选地,所述试剂盒还包括第三对引物和第四对引物,所述第三对引物的序列如seqidno:1、seqidno:2,所述第四对引物序列如seqidno:5、seqidno:6所示。
表1:本发明中的引物序列如下所示:
优选地,第一对引物、第二对引物、第三对引物、第四对引物的体积均为0.5~1.5μl。
优选地,第一对引物、第二对引物、第三对引物、第四对引物的体积均为0.5μl。
本发明的有益效果在于:本发明可同时对染性脾肾坏死病毒与鳜鱼弹状病毒进行快速检测,而且可以简化操作程序、节约成本,对染性脾肾坏死病毒与鳜鱼传染性脾肾坏死病毒病的流行病学调查、病原监测及早期预警都具有重要的意义。
附图说明
图1为单一和双重pcr电泳图(图中1表示只加入质粒p-n,引物scrv-280-f/r后的扩增产物;2表示只加入质粒p-mcp,引物isknv-550-f/r后的扩增产物;3表示加入两种质粒p-n、p-mcp及两种引物scrv-280-f/r、isknv-550-f/r后的扩增产物;4表示阴性对照);
图2为scrv标准质粒电泳图(图中1表示加入质粒p-n,引物scrv-qy-n-f/r后的扩增产物;2表示阴性对照);
图3为isknv标准质粒电泳图(图中1表示加入质粒p-mcp,引物isknv-1300mcp-f/r后的扩增产物;2表示阴性对照);
图4为不同退火温度对双重pcr反应的影响电泳图(图中1~12表示退火温度分别为54℃~65℃;13表示阴性对照);
图5为两种特异性引物不同体积比对双重pcr反应的影响电泳图(图中1表示引物比例0.5:0.5;2表示引物比例0.5:1;3表示引物比例0.5:1.5;4表示引物比例1:0.5;5表示引物比例1:1;6表示引物比例1:1.5;7表示引物比例1.5:0.5;8表示引物比例1.5:1;9表示引物比例1.5:1.5;10表示阴性对照);
图6为双重pcr敏感性试验电泳图(图中1表示混合p-n、p-mcp原液;2~9:稀释倍数为10-1~10-8的混合质粒模板;10表示阴性对照);
图7为双重pcr特异性实验电泳图(图中1表示病毒gcrv;2表示病毒khv;3表示病毒nnv;4表示病毒svcv;5表示病毒sgiv;6表示病毒tilv;7表示病毒isknv;8表示病毒scrv;9表示混合p-n、p-mcp为模板的阳性对照;10为阴性对照)。
图8为scrv单一pcr检测结果的电泳图(图中1~20为临床样品;21为阳性对照;22为阴性对照);
图9为isknv单一pcr检测结果的电泳图(图中1~20为临床样品;21为阳性对照;22为阴性对照);
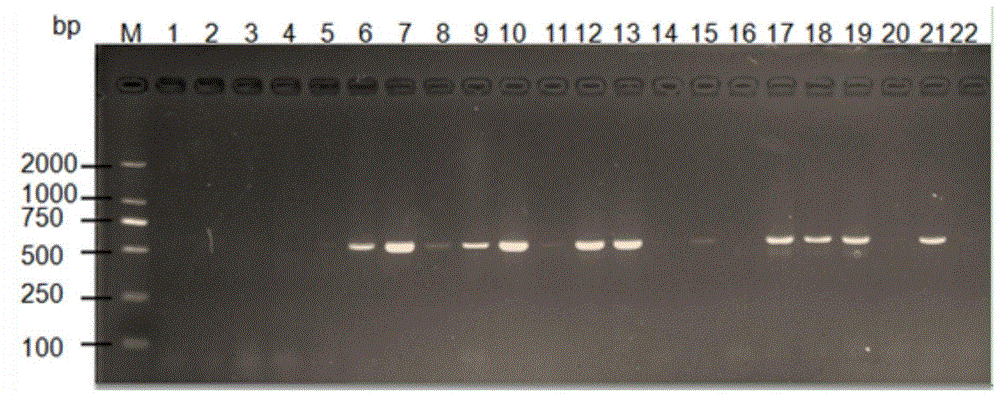
图10为scrv与isknv双重pcr检测结果的电泳图(图中1~20为临床样品;21为阳性对照;22为阴性对照)。
具体实施方式
为了更加简洁明了的展示本发明的技术方案、目的和优点,下面结合具体实施例及附图对本发明做进一步的详细描述。
实施例1
1、引物的设计
分析genbank中isknv的mcp基因和scrv的n基因的序列,针对isknv的mcp基因设计第一对引物isknv-1300mcp-f/r;针对isknv的mcp基因的保守区域设计第二对引物isknv-550-f/r,序列长度550bp;针对scrv的n基因设计第三对引物scrv-qy-n-f/r,序列长度1290bp;针对scrv的n基因的保守区域设计第四对引物scrv-280-f/r,序列长度280bp。引物由广州擎科生物科技有限公司合成,序列如下所述:
引物合成后,分别采用单一pcr和混合两种质粒模板、两对根据保守区域设计引物的双重pcr扩增来验证引物的特异性。pcr反应体系25μl:分别取p-n0.5μl、p-mcp1μl、混合p-n0.5μl和p-mcp1μl为模板,12.5μl2×easytaqpcrsupermix,上、下游引物scrv-280-f/r、isknv-550-f/r各1μl(10μmol/μl),其余用ddh2o补全。设立阴性对照,反应参数为94℃预变性5min,94℃30s,60℃30s,72℃30s,共35个循环,72℃终延伸8min。pcr产物进行1%琼脂糖凝胶进行电泳检测。
结果如图1所示,当只含有质粒p-n时,pcr只能扩出280bp片段;当只含有质粒p-mcp时,pcr只能扩出550bp片段;当混合质粒p-n和p-mcp为模板时,双重pcr能同时扩出280bp及550bp片段,当无质粒模板时,pcr无条带扩增。
2isknv和scrv标准质粒的制备
用毒株scrv感染scc,待细胞出现病变后收集细胞病毒,提取病毒scrv总rna,进行反转录得到cdna。以获得的cdna为模板,scrv-qy-n-f、scrv-qy-n-r为引物进行pcr扩增。反应参数为94℃预变性5min,94℃30s,61℃30s,72℃1min30s,共35个循环,72℃终延伸8min。同时设立无模板的阴性对照。反应产物用1%琼脂糖凝胶电泳检测。扩增产物经胶回收纯化后与simpleblunt载体(takara)连接,转化到大肠杆菌dh5α感受态细胞中,提取质粒、酶切及电泳检测正确后送广州擎科生物科技有限公司测序。测序正确的重组质粒经测定在260和280nm处的吸光度后,得出重组质粒的浓度。
用毒株isknv感染scc,待细胞出现病变后收集细胞病毒,利用tiangendna提取试剂盒提取病毒dna。以获得的dna为模板,isknv-1300mcp-f、isknv-1300mcp-r为引物进行pcr扩增。反应参数为94℃预变性5min,94℃30s,55℃30s,72℃1min30s,共35个循环,72℃终延伸8min。同时设立无模板的阴性对照。反应产物用1%琼脂糖凝胶电泳检测。扩增产物经胶回收纯化后与simpleblunt载体(takara)连接,转化到大肠杆菌dh5α感受态细胞中,提取质粒、酶切及电泳检测正确后送广州擎科生物科技有限公司测序。测序正确的重组质粒经测定在260和280nm处的吸光度后,得出重组中质粒的浓度。
蛋白编码基因的pcr扩增和克隆病毒核酸反转录后采用引物scrv-qy-n-f、scrv-qy-n-r进行扩增n基因的orf,获得1290bp左右的片段(如图2所示),将该片段连接到克隆载体,经pcr扩增、测序分析证实与预期插入片段相同,说明成功构建了标准重组质粒p-n。
经dna提取得到毒株isknv的dna,采用isknv-1300mcp-f、isknv-1300mcp-r进行扩增isknvmcp基因的orf,获得1300bp左右的片段(如图3所示),该片段连接到克隆载体,经pcr扩增、测序分析证实与预期插入片段相同,说明成功构建了标准重组质粒p-mcp。
3双重pcr扩增条件优化
分别设计不同退火温度和引物比例进行双重pcr扩增体系参数优化试验。退火温度依次为54℃、55℃、56℃、57℃、58℃、59℃、60℃、61℃、62℃、63℃、64℃、65℃,设立阴性对照。试验得到最佳退火温度后进行引物比例试验,两种引物比例scrv-280-f/r:isknv-550-f/r分别为0.5:0.5、0.5:1、0.5:1.5、1:0.5、1:1、1:1.5、1.5:0.5、1.5:1、1.5(μl):1.5(μl),设立阴性对照。pcr25μl体系包括0.5μlp-n及1μlp-mcp混合模板,12.5μl2×easytaqpcrsupermix,其余用ddh2o补全。最终pcr产物用1%琼脂糖凝胶进行电泳检测。
结果如图4、图5所示,试验的12个退火温度扩增结果中,有10个退火温度均能扩增出目的条带(图4),其中62℃为最佳退火温度。在试验的9个引物比例中,引物比例scrv-280-f/r:isknv-550-f/r为0.5:0.5、0.5:1、0.5:1.5、1:0.5、1:1、1:1.5时,双重pcr都能成功扩增出明显的目的条带(图5),本着以实验成本低、效果明显的可操作性原则,选择以scrv-280-f/r:isknv-550-f/r为0.5:0.5(μl)为最佳引物比例。因此最终双重pcr的优化反应程序如下:12.5μl2×easytaqpcrsupermix、scrv-280-f/r及isknv-550-f/r各0.5μl、模板p-n0.5μl、模板p-mcp1μl、9μlddh2o。反应条件如下:94℃5min,94℃30s,62℃30s,72℃30s,5个循环,72℃8min
4双重pcr敏感性检测
用紫外分光光度计测定质粒p-n和p-mcp的浓度后,将已知质粒p-n和p-mcp按1:2的比例混合,用ddh2o将混合模板进行10倍系列稀释,以稀释倍数10-1~10-8为模板,使用前面试验获得最佳pcr退火温度及引物比例进行扩增,设立阴性对照,探讨该方法可检测的dna最低量。
经紫外分光光度计测定得到质粒p-n的浓度为9.63ng/μl,质粒p-mcp的浓度为4.71ng/μl。将两种模板按1:2的比例混合进行10倍系列稀释。对10-1~10-8不同浓度的混合模板进行双重pcr扩增,图6显示,在稀释倍数为10-3时仍能观察到明显的两段特异性条带,说明双重pcr能检测到scrv的最低dna含量为0.963ng,isknv的最低dna含量为0.471ng。
5双重pcr特异性检测
以优化的参数对8株不同病毒进行双重pcr扩增。分别取isknv、scrv、gcrv、nnv、svcv、tilv的核酸产物1μl作为模板,设立以混合p-n和p-mcp模板为阳性对照,以不加模板为阴性对照。分析本方法对鱼类其他病毒和isknv、scrv的检测情况。
利用优化后双重pcr反应条件试验,以鱼类其他常见病毒的核酸为模板不能扩出目的条带,而以isknv和scrv的核酸为模板均能扩出目的条带(如图7所示)。
实施例2双重pcr鉴定方法应用
利用本实验室在2018年间于佛山、东莞等鳜鱼主要养殖场采集并保存的20份疑似isknv和scrv的样品,利用前述已建立的双重pcr方法进行检测。
对实验室保存的20份疑似isknv和scrv的样品同时采用isknv单一pcr、scrv单一pcr、isknv和scrv双重pcr检测,比较本发明建立的双重pcr与单一pcr检测方法的效果。
结果如图8-10所示,图8中scrv检测出阳性为3份,阳性率为15%;图9中isknv检测出阳性为11份,阳性率为55%;图10中scrv和isknv混合感染阳性为2份,阳性率为10%。
可见单一的pcr检测方法只能检测出一种病毒,而本发明的双重pcr由于含有双重特异性引物能同时检测出isknv和scrv病毒,且其敏感性较高,能检测到scrv,isknv的最低dna含量为0.01ng。
以上所述实施方式仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
sequencelisting
<110>中国水产科学研究院珠江水产研究所
<120>用于检测传染性脾肾坏死病毒与鳜鱼弹状病毒的引物组及试剂盒
<130>1.23
<160>8
<170>patentinversion3.3
<210>1
<211>25
<212>dna
<213>人工合成
<400>1
atgtctgcaatctcaggtgcaaacg25
<210>2
<211>25
<212>dna
<213>人工合成
<400>2
ttacagagggaagcctgcggcgccg25
<210>3
<211>25
<212>dna
<213>人工合成
<400>3
ccttaatttgcccattcccctcttc25
<210>4
<211>25
<212>dna
<213>人工合成
<400>4
agtagtctactcccatctggtggag25
<210>5
<211>38
<212>dna
<213>人工合成
<400>5
gtagctagcgccaccatggaaaaccaaatcatcaagag38
<210>6
<211>35
<212>dna
<213>人工合成
<400>6
gtagcgccgcatttcacaaagcttggtgtttcagc35
<210>7
<211>24
<212>dna
<213>人工合成
<400>7
gtggcagcaattgacatgttcttc24
<210>8
<211>23
<212>dna
<213>人工合成
<400>8
gatactttggacaatcccatgtc23
- 还没有人留言评论。精彩留言会获得点赞!