一种基于血糖仪检测的免标记、免分离便携式基因检测方法与流程
本发明涉及一种基因检测方法,具体涉及一种基于血糖仪检测的免标记、免分离便携式基因检测方法。
背景技术:
随着核酸分子领域的发展,利用核酸快速准确地诊断多种疾病已成为可能。然而,这些检测方法通常需要复杂的仪器,不利于实现便携式的疾病诊断。市面上仅有的少数便携式诊断商品对于建立和开展新的便携诊断方法是非常具有参考价值的,例如葡萄糖检测仪(血糖仪)。目前,已有相关文献报道将血糖仪用于基因的检测(angew.chem.int.ed.2018,57,1-6;analchem,2015,87,7676-7682;anal.chem.,2014,86,3869-3875;natchem,2011,3,697-703)。这些方法首先需要将蔗糖酶进行大量表达,然后经过复杂的分离纯化过程后,将其与核酸分子相连接,带有蔗糖酶的核酸分子再与另一条带有磁球标记的核酸链杂交。当待测目标基因存在时,通过核酸链置换反应,将原本的带有蔗糖酶的杂交核酸链替换下来,游离到溶液中。利用磁铁将未与磁珠标记核酸链相杂交的蔗糖酶标记核酸链分离开来,最后加入底物蔗糖进行酶催化反应,利用血糖仪进行检测。这种方法的缺陷在于:1.蔗糖酶在反应过程中始终存在于检测溶液中,因此在不存在待测基因的情况下,未与磁球稳定结合的蔗糖酶易游离到溶液中,造成检测体系具有较高的背景泄露,即没有待测基因时,仍具有较高的血糖仪读数;2.蔗糖酶前期表达纯化以及与dna连接和dna与磁球连接过程复杂,不易操作;3.无法实现免标记和免分离的检测。
随着合成生物学的发展,学者们逐渐将合成生物学应用于基因的检测。合成生物学检测方法相对于现有的基因分析技术在于可以实现“现场表达”报告基因的免标记,免分离的基因检测。其检测体系主要由启动子和报告基因组成,当目标基因存在时,可引发报告基因的表达。美国哈佛大学collins课题组曾设计出一种通过立足点介导引发的基因检测技术,其中报告基因为β半乳糖苷酶、荧光蛋白、乙醇乙酰转移酶、转肽酶等,可通过比色反应、荧光读数、气味对比或生成水凝胶等方法进行表征(cell,2014,159,940-954;cell,2014,159,925-939;cell,2016,165,1-12;sciadv,2018,4,eaat5105)。
基于合成生物学方法的免标记检测手段在没有待测基因的情况下,蔗糖酶不表达;只有加入待测基因后,才能够引发报告基因蔗糖酶的表达,因此可以解决上述检测方法中的高背景泄露问题;而且相比于提前表达和标记蔗糖酶的方法,将合成生物学方法配合无细胞表达系统,能够使检测操作更简便。目前已报道的利用合成生物学实现基因检测的方法中,立足点介导的基因表达最为简单,最有可能实现便携式基因诊断。但目前的检测方法在应用中存在两个弊端:(1)使用的报告基因为β半乳糖苷酶、荧光蛋白、乙醇乙酰转移酶、转肽酶等;通过待测基因引发报告基因表达,从而可以通过比色反应、荧光读数、气味对比或生成水凝胶等方法进行表征。上述表征方法在不加入恒温扩增反应时检测限仅能达到30nm。(2)在对新的待测基因进行检测时,由于新的待测基因序列不同,所结合的立足点不同,为了使检测传感器具有较高的信号比,往往需要重新设计整个传感器序列,设计过程十分复杂。
技术实现要素:
本发明要解决现有技术中的技术问题,提供一种更具有普适性和高灵敏度的基于血糖仪检测的免标记、免分离便携式基因检测方法。
为了解决上述技术问题,本发明的技术方案具体如下:
一种基于血糖仪检测的免标记、免分离便携式基因检测方法,包括以下步骤:
步骤1、检测载体的构建
所述检测载体包括传感器序列和蔗糖酶序列;
所述传感器序列为:
tttcgctctattctcatcagtttcatgtcctgtgtcggactttagaacagaggagataaagatggacacaggacacaacctggcggcagcgcaaaagatgcgtaaa;
所述蔗糖酶序列是由蔗糖酶的氨基酸序列经密码子优化得到;其中蔗糖酶为耐高温蔗糖酶;
将所述传感器序列和蔗糖酶序列相连接,共同导入pet-21a载体中,完成检测载体的构建;
步骤2、对待测基因进行检测
对待测基因进行扩增反应,然后将待测基因扩增产物加入到含有步骤1构建的检测载体的无细胞检测体系中进行反应,反应结束后取反应液与蔗糖混合后继续反应,分别在不同反应时间点,取反应液以血糖仪进行检测,即可检测到低至单分子拷贝数的待测基因,完成待测基因的检测。
在上述技术方案中,可以对待测基因的nasba扩增产物和lamp扩增产物进行检测。
在上述技术方案中,通过在检测体系中添加中转探针实现对其他待测基因的检测,具体为:
将原本的待测基因拆分成两部分序列,这两部分序列可以分别与另外两条毫不相关的序列部分互补杂交,将另外两条链在空间上无限拉近,形成一种四通复合物;形成的复合物中游离出的两条单链末端可以作为复合引发链引发下游的基因表达,行使与原本的单链引发剂序列相同的功能。
在上述技术方案中,当待测基因为肠道细菌阪崎肠杆菌ompa基因时,所述中转探针序列为:
ompa-bm-zikvsensor序列:gacacaggacatgaaactgttcgcccagctggcttt;
ompa-th-zikvsensor序列:gtaaccaccgaacgcgcctggagaatagagcgaaa。
本发明的有益效果是:
本发明提供的基于血糖仪检测的免标记、免分离便携式基因检测方法与传统使用蔗糖酶作为标记检测目标基因相比,本方法不需要进行前期的纯化和标记过程,操作过程简单;此外蔗糖酶本身不存在检测体系中,与传统方法相比背景泄露相对较低。与原始立足点介导的基因表达检测方式相比,以耐高温蔗糖酶代替β半乳糖苷酶、荧光蛋白、乙醇乙酰转移酶、转肽酶等,利用商品化的血糖仪进行检测,更具便携性,同时能够检测更低的基因浓度。
用本发明提供的基于血糖仪检测的免标记、免分离便携式基因检测方法检测其他待测基因时,通过添加万能中转探针,不需要改变设计困难的传感器序列,通过中转便可直接用于检测其他待测基因。
附图说明
下面结合附图和具体实施方式对本发明作进一步详细说明。
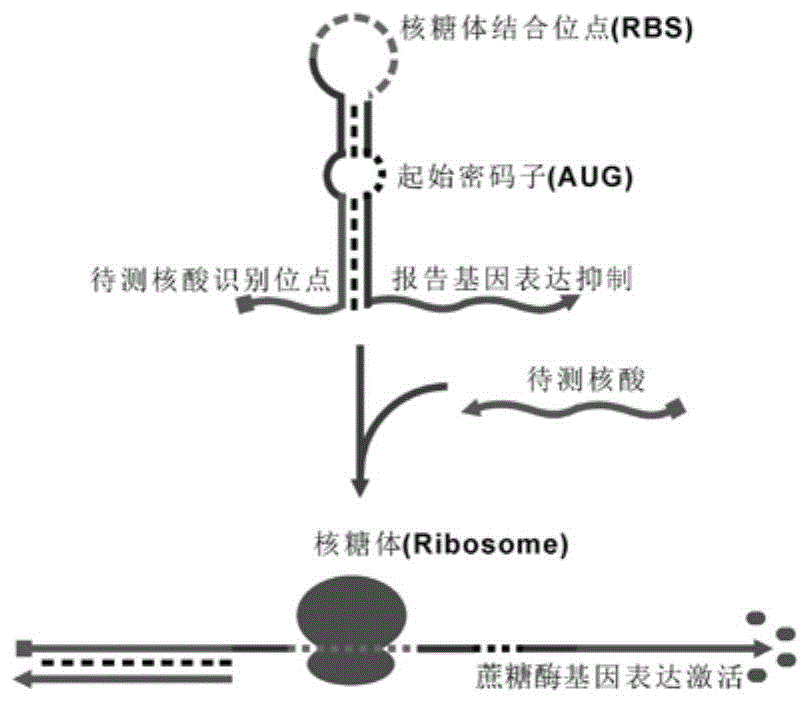
图1为本发明的基于血糖仪检测的免标记、免分离便携式基因检测方法的原理图。
图2为本发明的基因检测方法所用的检测载体的构建示意图。
图3为用本发明的基因检测方法对zika病毒的模拟rna片段序列进行无细胞检测的蔗糖酶催化动力学曲线图。
图4为用本发明的基因检测方法检测不同浓度的zika病毒的反转录单链dna序列的检测结果图。
图5为用本发明的基因检测方法在检测体系中添加中转探针检测其他待测基因的示意图。
图6为用本发明的基因检测方法在本发明的检测体系中添加中转探针后对于不同浓度的ompamimic检测的动力学曲线及终点检测图。
图7为用本发明的基因检测方法对痕量的zika病毒的恒温nasba扩增产物进行检测的动力学曲线和终点检测图。
图8为用本发明的基因检测方法通过在检测体系中添加中转探针检测痕量的阪崎肠杆菌的ompa基因的恒温lamp扩增产物的动力学曲线和终点检测图。
具体实施方式
本发明的发明思想为:本发明的基因检测方法首先需要构建用于检测的质粒载体,由传感器部分和蔗糖酶部分组成,没有引发基因存在时蔗糖酶的起始密码子被封闭,不表达;当加入引发基因后,通过立足点介导的链置换反应打开原本被封闭的起始密码子,蔗糖酶表达(见图1)。
本发明所用传感器序列:
tttcgctctattctcatcagtttcatgtcctgtgtcggactttagaacagaggagataaagatggacacaggacacaacctggcggcagcgcaaaagatgcgtaaa。
本发明所用到的蔗糖酶基因的核酸序列经密码子优化,其原始氨基酸序列可查阅ncbi数据库(genbank#aad36485.1)。将传感器序列与蔗糖酶序列相连接,共同导入pet-21a载体中,完成检测质粒pet-21a-sensor-invertase构建(见图2)。
所述蔗糖酶为耐高温蔗糖酶,该耐高温蔗糖酶的获得可参见(asweetspotformoleculardiagnostics:couplingisothermalamplificationandstrandexchangecircuitstoglucometers,08june2015,scientificreports,doi:10.1038/srep11039)。
本发明的基因检测方法接着用上述构建的检测载体对待测基因进行检测,具体步骤如下:
对待测基因进行扩增,然后将待测基因扩增产物加入到带有步骤1构建的检测载体的无细胞检测体系中进行反应,反应结束后取反应液与蔗糖混合后继续反应,分别在不同反应时间点,取反应液以血糖仪进行检测,即可检测到单分子拷贝数的待测基因,完成待测基因的检测。
上述方法可以对待测基因的nasba扩增产物和lamp扩增产物进行检测。
为了验证该检测方法的可行性,先利用检测质粒对zika病毒的模拟rna片段序列进行无细胞检测,zika病毒模拟rna片段序列如下:
gggccagcacagugggaugaucguuaaugacacaggacaugaaacugaugagaauagagcgaaaguugagauaacgcccaauucaccaagagccgaagccacccuggggggguuuggaagccuaggacuugauugugaaccgaggacagg。
反应体系如下:solutiona40%,solutionb30%,rnaseinhibitor0.5%,detectionplasmid24%,rnatrigger24%;最终反应中组分浓度如下:[detectionplamed]=2nm,[rnatrigger]=0/500nm。将上述反应液于37℃反应2h,反应完成后于冰上静置以终止反应。取反应液与500mm蔗糖以1:1体积比混合于55℃反应,分别在0min、5min、10min、20min时间点,取1.5μl以拜耳contournext血糖仪检测。
由图3中所示的蔗糖酶催化动力学曲线图可以看出,在加入500nmrna待测物引发蔗糖酶表达后,将表达产物与蔗糖孵育仅需5min便可观测与阴性对照明显的葡萄糖度数差异,且表达出的蔗糖酶催化底物所产生的葡萄糖值随着孵育时间的增加呈现明显的线性关系。但是,实验结果中的阴性对照随着时间增加也呈现了小幅度的度数增加现象,这可能是由于无细胞表达体系中质粒浓度过高所导致的背景泄露现象,需要进一步优化表达质粒的浓度。
该方法还可用于检测dna序列,以zika病毒的反转录单链dna,序列如下:tcgttaatgacacaggacatgaaactgatgagaatagagcgaaagttgagataacgcccaattcaccaagagccgaagccaccctgg。
检测dna序列的反应体系与rna相同,经过背景优化后无细胞表达体系中的质粒浓度降低至0.5nm,对于不同浓度dna序列的检测结果如图4所示,底物蔗糖浓度优化为1m,反应液与底物蔗糖的体积比为2:1。500nm的dna待测序列引发的蔗糖酶表达量在与底物蔗糖反应30min后得到的葡萄糖读数以明显的超出了血糖仪的最大检测阈值(图4a),因此我们检测了500nm以下的不同浓度的dna所引发的蔗糖酶表达量。根据终点检测结果发现,整个反应体系在优化后检测限可低至500pm(图4b)。
为了使检测更具有普适性,通过添加万能中转探针,不需要改变设计困难的传感器序列,通过中转便可直接用于检测其他待测基因(图5)。示意图中将原本的待测基因拆分成两部分序列,这两部分序列可以分别与另外两条毫不相关的序列部分互补杂交,将另外两条链在空间上无限拉近,形成一种四通复合物;形成的复合物中游离出的两条单链末端可以作为复合引发链引发下游的基因表达,行使与原本的单链引发剂序列相同的功能。
以肠道细菌阪崎肠杆菌ompa基因的检测为例,中转探针序列如下:
ompa-bm-zikvsensor序列:gacacaggacatgaaactgttcgcccagctggcttt;
ompa-th-zikvsensor序列:gtaaccaccgaacgcgcctggagaatagagcgaaa;
首先,利用该法检测ompa基因的模拟序列,以证明中转探针的可行性,
ompa基因模拟序列如下:ompa-mimic:aagccagctgggcgcaggcgcgttcggtggttac。
为了最终应用于lamp扩增反应检测,反应中模拟lamp反应缓冲液体系,中转探针及模拟序列以1×等温扩增缓冲液配置,反应过程如下:首先,配制ompa-th-bm混合液:ompa-th-zikvsensor,ompa-bm-zikvsensor,不同浓度ompa-mimic混合液于95℃退火5min后,以0.1℃/s降至室温。三者混合液中[ompa-th-zikvsensor]=208nm,[ompa-bm-zikvsensor]=251nm。随后将三者混合液加入无细胞表达反应体系中,solutiona40%,solutionb30%,rnaseinhibitor0.5%,detectionplasmid24%,ompa-th-bm混合液24%。反应最终各组分浓度如下:[ompa-th-zikvsensor]=50nm,[ompa-bm-zikvsensor]=40nm,[ompa-mimic]=0/2/5/10/20/50nm。将上述反应液于37℃反应2h,反应完成后于冰上静置以终止反应。取反应液与1m蔗糖以2:1体积比混合于55℃反应,分别在0min、20min、40min、60min时间点,取1.5μl以拜耳contournext血糖仪检测。图6a为加入中转探针后对于不同浓度的ompamimic检测的动力学曲线图,可以看出中转探针的加入对于反应的背景信号并无明显的影响,葡萄糖浓度随孵育时间的增加呈现线性增长趋势;图6b为反应的终点检测,其中由于反应中序列形成四通结构的效率不同,因此检测限会较比单链略差,可达2nm。
实施例
本发明的检测载体的构建:
所述传感器序列为:
tttcgctctattctcatcagtttcatgtcctgtgtcggactttagaacagaggagataaagatggacacaggacacaacctggcggcagcgcaaaagatgcgtaaa;
所述蔗糖酶序列是由耐高温蔗糖酶的氨基酸序列经密码子优化得到,优化后的基因为:
atgttcaaaccgaactaccacttcttcccgatcaccggttggatgaacgacccgaacggtctgatcttctggaaaggtaaataccacatgttctaccagtacaacccgcgtaaaccggaatggggtaacatctgctggggtcacgctgtttctgacgacctggttcactggcgtcacctgccggttgctctgtacccggacgacgaaacccacggtgttttctctggttctgctgttgaaaaagacggtaaaatgttcctggtttacacctactaccgtgacccgacccacaacaaaggtgaaaaagaaacccagtgcgttgctatgtctgaaaacggtctggacttcgttaaatacgacggtaacccggttatctctaaagcgccggaagaaggtacccacgctttccgtgacccgaaagttaaccgttctaacggtgaatggcgtatggttctgggttctggtaaagacgaaaaaatcggtcgtgttctgctgtacacctctgacgacctgttccactggaaatacgaaggtgttatcttcgaagacgaaaccaccaaagaaatcgaatgcccggacctggttcgtatcggtgaaaaagacatcctgatctactctatcacctctaccaactctgttctgttctctatgggtgaactgaaagaaggtaaactgaacgttgaaaaacgtggtctgctggaccacggtaccgacttctacgctgctcagaccttcttcggtaccgaccgtgttgttgttatcggttggctgcagtcttggctgcgtaccggtctgtacccgaccaaacgtgaaggttggaacggtgttatgtctctgccgcgtgaactgtacgttgaaaacaacgaactgaaagttaaaccggttgacgaactgctggctctgcgtaaacgtaaagttttcgaaaccgctaaatctggtaccttcctgctggacgttaaagaaaactcttacgaaatcgtttgcgaattctctggtgaaatcgaactgcgtatgggtaacgaatctgaagaagttgttatcaccaaatctcgtgacgaactgatcgttgacaccacccgttctggtgtttctggtggtgaagttcgtaaatctaccgttgaagacgaagctaccaaccgtatccgtgctttcctggactcttgctctgttgaattcttcttcaacgactctatcgctttctctttccgtatccacccggaaaacgtttacaacatcctgtctgttaaatctaaccaggttaaactggaagttttcgaactggaaaacatctggctgctcgag;
所述传感器序列和蔗糖酶序列相连接,共同导入pet-21a载体中,完成载体的构建。
利用上述构建的检测载体对痕量的zika病毒进行检测。首先利用nasba扩增反应对人工合成的zika病毒rna基因进行扩增,将扩增产物直接引发无细胞表达反应。
所用到的扩增引物如下:
zika-forwardprimer:
aattctaatacgactcactatagggagaagggcacagtgggatgatcgtta
zika-reverseprimer:
cctgtcctcggttcacaatcaa
反应体系如下:reactionbuffer33.5%,nucleotidemix16.5%,rnaseinhibitor0.5%,nasbaprimer12.5μm2%,nucleasefreewater2.5%,rnaamplicon20%;nasba扩增中,rnaamplicon的浓度分别为0/20/200/2,000/20,000个拷贝数。将上述反应混合液于65℃变性2min后于41℃孵育10min,随后加入enzymemix25%于41℃反应2h。反应后,将nasba产物加入无细胞检测(nebe6800)体系中,检测体系如下:solutiona40%,solutionb30%,rnaseinhibitor0.5%,detectionplasmid24%,nasbaproduct24%。将上述反应液于37℃反应2h,反应完成后于冰上静置以终止反应。取反应液与1m蔗糖以2:1体积比混合于55℃反应,分别在0min、20min、40min、60min时间点,取1.5μl以拜耳contournext血糖仪检测。
图7a为nasba产物引发无细胞表达后产生的蔗糖酶催化蔗糖底物的动力学曲线图,其中阴性对照为nasba反应中模板浓度为0个分子拷贝数,阳性对照为模板浓度为20,000个分子拷贝数。图7b为nasba反应中不同模板分子拷贝数所引起无细胞表达产生蔗糖酶催化蔗糖所产生的葡萄糖终点检测值。由这两个结果图可以看出,该法结合nasba恒温扩增反应可以有效的检测痕量的rna待测物,最低可至20个分子拷贝。
为了证明本方法的普适性,在本发明的检测载体中引入中转探针,检测痕量的阪崎肠杆菌的ompa基因。首先利用lamp等温扩增的方法对ompa基因进行扩增,将扩增产物中转后应用于无细胞表达体系。整个反应体系同ompa模拟基因检测,将ompa模拟基因最后以lamp产物替换(图8)。
阪崎肠杆菌ompa扩增探针序列如下:
ompa_f3的序列为:tggtcccagttccacgatac
ompa_b3的序列为:gtaacccagtttagcggtca
ompa_fip的序列为:ccaacgtacgggttaacctggtgacggtccgactcacgaa;
ompa_bip的序列为:tcgaaatgggctacgactggcttgtacgccctgagctttga
图8a为lamp产物中转无细胞表达后产生的蔗糖酶催化蔗糖底物的动力学曲线图,其中阴性对照为lamp中模板浓度为0个分子拷贝数,阳性对照为模板浓度为20,000个分子拷贝数。图7b为lamp反应中不同模板分子拷贝数所引起无细胞表达产生蔗糖酶催化蔗糖所产生的葡萄糖终点检测值,同时加入大肠杆菌malb的lamp扩增产物进行对照,发现该法能够特异性的检测ompa目标基因,即使在大量其他基因的lamp产物干扰下也不会产生误诊现象,可有效地排除lamp产物中的假阳性结果。由这两个结果图可以看出,该法可以有效的检测痕量的dna待测物,最低可至20个分子拷贝。
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
- 还没有人留言评论。精彩留言会获得点赞!