一种与鸡J亚群禽白血病抗性相关的分子标记及其应用的制作方法
本发明属于抗性品种选育技术领域,更具体地,涉及一种与鸡j亚群禽白血病抗性相关的分子标记及其应用。
背景技术:
禽白血病是由反转录病毒科、α反转录病毒属的禽白血病病毒(avianleukosisvirus,alv)及禽肉瘤病毒(rsv)等引起的鸡的不同组织、细胞的良性及恶性肿瘤性疾病。该病自1886年被报道以来,在世界各地均有发生,是威胁世界养禽业的主要疾病之一,给世界养禽业带来巨大损失。
j亚群禽白血病(avianleucosissubgroupj)是由j亚群禽白血病病毒(avianleukosisvirussubgroupj,alv-j)在临床上引起的,以造血细胞恶性增生为主的多种肿瘤性疾病。相比于其他亚型,alv-j传播速度更快,感染性更强,变异更快,而且具有较高的致死率。也正因如此,alv-j迅速席卷全世界,世界养禽业也因此受到重创。2008-2009年间,alv-j在我国大爆发,以血管瘤为主要特征的j亚群禽白血病对蛋鸡产业造成了巨大影响:因alv-j感染而淘汰的商品代蛋鸡就有6000万只。大量的血清学调查表明,alv-j已经成为危害我国养禽业的主要禽白血病病毒亚型。
目前,国际上尚无可有效防治j亚群禽白血病的药物和商品化疫苗,仅能通过淘汰阳性鸡、加强生物安全措施以达到控制的目的。但这种方法经常会出现假阴性或假阳性的结果,所以依然要通过抽检的方法对核心群进行监控,且各地方品种对alv的易感性不同,净化标准难以制定。
技术实现要素:
本发明针对于以上问题,提供一种与鸡j亚群禽白血病抗性相关的分子标记,所述分子标记包括鸡tgfb2基因启动子区genbank登录号为:x58071.1的甲基化状态或甲基化程度。
tgfb2属于转化生长因子家族成员,本发明发现tgfb2基因启动子甲基化状态或甲基化程度在易感鸡与抗性鸡中存在的差异,在j亚群禽白血病抗性鸡(阴性)中,tgfb2的启动子甲基化程度高于易感鸡(阳性),且tgfb2的基因表达情况明显低于易感鸡(阳性),推测tgfb2基因启动子dna甲基化可抑制tgfb2表达,进而产生对alv-j的抗性。
进一步,所述标记为tgfb2基因的启动子区的cpg岛上的甲基化状态或甲基化程度。
进一步,所述标记为tgfb2基因的启动子区域cpg岛上的位点甲基化。
cpg岛通常位于基因启动子、第一外显子和3’端区域,被认为是复制起始点。通常情况下,cpg岛中的cg位点处于非甲基化状态,而其甲基化状态发生改变,通常会引起基因的异常表达。
进一步,所述甲基化的位点位于tgfb2基因启动子区genbank登录号为:x58071.1的第486号位点,该位点同时位于鸡的第三号染色体的第18755007号,记为chr3:18755007。
本发明发现,在j亚群禽白血病抗性鸡(阴性)中,tgfb2的启动子的chr3:18755007位点甲基化,而在易感鸡(阳性)中,chr3:18755007位点为未甲基化状态,说明chr3:18755007位点的甲基化状态可作为鸡j亚群禽白血病相关的分子标记。
本发明还提供一种所述分子标记在辅助鸡抗病育种中的应用。
进一步,所述抗病育种是抗j亚群禽白血病育种。
本发明也提供一种所述分子标记在制备alv-j抗性鸡筛选试剂盒或检测芯片中的应用。
所述alv-j抗性鸡筛选试剂盒包括以下组分:基因组dna抽提试剂、dna浓度测定试剂、dna甲基化试剂、甲基化特异性pcr检测试剂(包括tgfb2基因启动子区的一对甲基化引物和一对非甲基化引物、阳性对照和阴性对照、重组酶等)。
所述alv-j抗性鸡检测芯片,包括特异性检测tgfb2基因甲基化状态或程度的探针。
本发明亦提供一种权利要求7所述试剂盒或检测芯片在辅助鸡抗病育种中的应用。
进一步,抗病育种为抗j亚群禽白血病育种。
本公开还保护一种快速筛选j亚群禽白血病抗性鸡的方法,所述方法包括如下步骤:
s1:提取待测鸡的基因组dna;
s2:将步骤s1所述基因组dna进行甲基化处理,之后再以甲基化后的dna为模板,seqidno:1所示序列为引物,进行pcr扩增,得扩增产物;
seqidno:1所示序列如下:
f:5′-gggtgtgtaaggttatttttgtagg-3′;
r:5′-tccaaaaaaaaacaaactcaactc-3′;
s3:收集纯化步骤s2所得扩增产物,并测序获得结果;
s4:结果判定,若测序结果中位点chr3:18755007甲基化,则为抗性鸡;若位点chr3:18755007未甲基化,则为易感鸡。
上述方法中,步骤s3中用于检测dna甲基化的方法是公知,传统的检测甲基化位点的方法是通过重亚硫酸盐处理,处理后原甲基化的胞嘧啶被保留,而非甲基化的胞嘧啶转变为胸腺嘧啶,然后进行测序。甲基化的胞嘧啶没有发生改变,因此通过测序很容易识别。
为了实现上述目的,本发明是通过以下方案予以实现的:
发明人通过bsp方法分别检测j亚群禽白血病易感鸡和抗性鸡的tgfb2基因启动子区chr3:18755007位点甲基化情况,具体过程跟原理如下:将基因组dna用重亚硫酸盐处理,基因组中未发生的甲基化的c转换为u,而已经甲基化的c不发生变化,然后将处理后的产物进行tgfb2基因启动子区特定区域pcr扩增(引物如seqidno:1所示,产物包含chr3:18755007位点),并对扩增产物进行测序,与未做处理的基因组dna进行比对。本发明同时也对易感鸡和抗性鸡tgfb2基因表达量进行了分析。
得到的结果是:易感鸡中chr3:18755007位点c均转变成t,说明chr3:18755007位点为未甲基化状态;而抗性鸡中chr3:18755007位点c不变,说明chr3:18755007位点为甲基化状态,并且抗性鸡tgfb2的基因表达情况明显低于易感鸡(阳性)。
由此推测鸡tgfb2基因启动子区chr3:18755007位点甲基化会影响tgfb2基因的表达,进而阻断了tgfb2表达产物对alv-j病毒复制的有利影响,从而对j亚群禽白血病产生抗性。
相对于现有技术,本发明具有如下的优点及效果:
1)本发明首次发现以dna甲基化的分子标记能够影响宿主对alv-j的感染的抗性,利用该标记能够简单、方便、快速、可靠、灵敏地检测鸡个体是否具有对j亚群禽白血病的抗性,从而区分易感鸡和抗性鸡,为筛选j亚群禽白血病抗性品种以及辅助传统的抗病杂交育种提供一条全新的途径,适于大规模推广应用。
2)将该分子标记应用到鸡的选育过程中,使整个选育过程具有以下优点:a:周期短,效率高,传统方法需要一直检测到鸡开产,甲基化检测,从拿到待检个体血样到选淘结果只需要1周时间,每人每天至少可以完成120个体的检测;b:操作简便,环节少,不易出错,准确率高。
附图说明
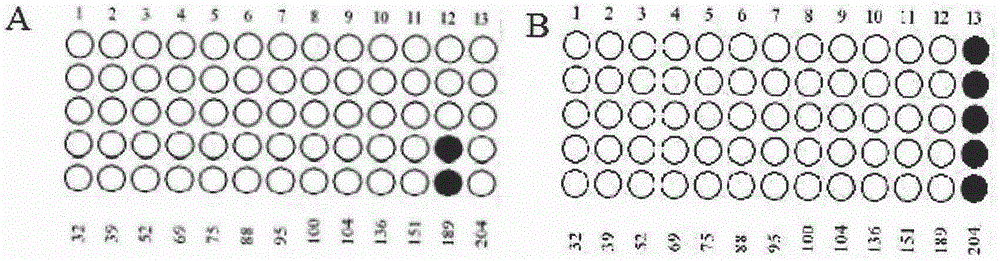
图1为易感鸡和抗性鸡tgfb2基因启动子区甲基化程度及位点chr3:18755007的甲基化状态差异性分析,其中,a为易感鸡样品,b为抗性鸡样品,实心为甲基化部位,空心为非甲基化部位。
图2为alv-j攻毒后细胞中tgfb2mrna水平表达差异。
图3为抑制tgfb2基因表达对alv-j病毒增殖的影响。
图4为抗性鸡和易感鸡的tgfb2基因表达情况分析。
具体实施方式
以下结合具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,本发明所用试剂和材料均为市购。
以下实施例中易感鸡指对病毒alv-j的感染无抗性,容易感染的鸡种,抗性鸡指对病毒alv-j的感染具有抗性,不能被感染的鸡种。本实施例中所涉及的易感鸡和抗性鸡是在本实验室前期的研究过程中,通过长期的检测、选育而来。
本领域的普通技术人员可以通过常规方法获得tgfb2基因(包括启动子区域)的核苷酸序列,例如从ncbi获取。
本领域的普通技术人员可以通过常规方法对tgfb2基因的甲基化水平或程度进行检测,在本发明的一个优选例中,包括步骤:基因组dna的提取、dna浓度的测定、dna亚硫酸氢盐转化、pcr扩增,pcr产物测序。
实施例1
易感鸡和抗性鸡中tgfb2基因启动子区甲基化程度差异分析以及chr3:18755007位点甲基化状态检测
方法如下:
1)分别采集1周龄待检鸡(分为易感鸡和抗性鸡)血样,提取基因组dna(按takara总dna提取试剂盒说明书提取)。
2)将易感鸡基因组dna和抗性鸡基因组dna分别用重亚硫酸盐处理和纯化。
将待测样品dna进行甲基化处理,反应体系:dna1000μg,protectbufferdna35μl,bisulfitesolution85μl,rnasefreeddh2o补至140μl;反应程序:95℃,5min,60℃,15min,95℃,5min,60℃,15min,30℃,10min。将甲基化处理后液体纯化处理,置于-20℃保存。
3)利用seqidno:1所示引物分别扩增易感鸡和抗性鸡基因组dna中chr3:18755007位点所在片段。
反应体系:2×mastermix25μl,mg2+4μl,seqidno:1所示引物各1μl,步骤2)纯化后的dna样本2μl,ddh2o补至50μl;
反应程序:95℃预变性10min;95℃变性30s,59℃复性30s,72℃延伸30s,35个循环;72℃后延伸10min。
4)将pcr纯化产物与载体连接获得重组质粒,参照takara公司pmd19-tvector的使用说明进行。
5)用质粒m13+/-引物对重组质粒进行测序。
结果显示如图1,易感鸡在tgfb2启动子区甲基化程度相比于抗性鸡样品低。抗性鸡中pcr产物中第204位(位于tgfb2基因启动子区的第486位)为甲基化状态,即位点chr3:18755007为甲基化;
易感鸡中pcr产物中第204位(位于tgfb2基因启动子区的第486位)为未甲基化状态,即位点chr3:18755007为未甲基化。
实施例2
tgfb2基因启动子区chr3:18755007位点发生甲基化对鸡感染alv-j抗性的研究
1)将待检鸡进行tgfb2基因启动子区chr3:18755007位点甲基化检测,按chr3:18755007位点不同甲基化状态(甲基化和未甲基化)将待测鸡分为a群和b群,chr3:18755007位点发生甲基化的鸡分为a群,随机再分成a1和a2两组,每组50只鸡;tgfb2基因启动子区chr3:18755007位点未发生甲基化的鸡分为b群,随机也分成b1和b2两组,每组50只鸡。
2)a1和b1组腹腔注射感染骨髓瘤型毒株nx0101(105tcid50/ml)0.2ml,a2和b2组腹腔注射感染血管瘤型毒株gd1109(105tcid50/ml)0.2ml,每周抽血用idexx试剂盒和病毒分离培养方法检查病毒血症情况,1个月后改为每个月抽血1次,直到6月截至。结果见表1。
表1:tgfb2基因启动子区域甲基化影响alv-j感染后病毒血症情况
结果显示:6个月内a1和a2组全程病毒血症为阴性,表明tgfb2基因启动子区chr3:18755007位点发生甲基化的鸡表现为对nx0101和gd1109均有抗性,为抗性鸡,而b1和b2两周后陆续出现病毒血症,表明tgfb2基因启动子区chr3:18755007位点未甲基化的鸡表现为为对nx0101和gd1109均无抗性,为易感鸡。
以上两个实施例结果显示,tgfb2基因启动子区chr3:18755007位点发生甲基化可作为一种分子标记用于鸡抗性鸡选择。
实施例3
一种快速筛选j亚群禽白血病抗性鸡的方法,所述方法包括如下步骤:
s1:在鸡场随机选取一只鸡,提取该鸡的全血基因组dna;
s2:将步骤s1所述全基因组dna按照实施例1中方法进行甲基化处理后作为模板,seqidno:1所示序列为引物,进行pcr扩增,得扩增产物;
s3:收集纯化步骤s2所得扩增产物,测序;
s4:结果判定,测序结果中位点chr3:18755007未甲基化,为易感鸡。
实验例1
alv-j对tgfb2表达的影响
实验方法如下:
分别对df-1细胞及hd-11细胞攻毒,并同时设立对照组。
1)培养df-1细胞(鸡成纤维细胞)和hd-11细胞(鸡巨噬细胞),待细胞密度达到70%左右时,吸干培养基并用pbs清洗后,分别接种gd1109毒株(一种alv-j病毒),孵育1h后弃掉病毒液,换成普通培养基继续培养。对照组一直在培养液中静置培养。
2)48h后,分别收取感染和对照组的df-1细胞和hd-11细胞,提取总rna,进行gdna(基因组dna)去除。(使用primescripttmrtreagentkitwithgdnaeraser(perfectrealtime)试剂盒,反应步骤按试剂盒说明书进行操作)
3)gdna(基因组dna)去除后,进行反转录。
反应体系及程序如下:混合物10μl,5×primescriptbuffer24μl,primescriptrtenzymemixi1μl,rtprimemix1μl,rnasefreeddh2o补至20μl。
反转录反应条件:37℃15min,85℃5s,最后降温到4℃,终止反应,产物即为cdna,保存于-20℃备用。
4)选取gapdh基因作为内参,根据tgfb2基因cds区设计定量引物,检测tgfb2的表达情况,每个样品设3个重复。所用引物如下:
引物f:cagtgggaagaccccacatc
引物r:acgcaggcagcaattatcct
反应体系如表2。
反应程序:95℃,10min;95℃,10s,60℃,1min,40个循环。
表2qrt-pcr反应体系
结果显示:相比对照组,感染alv-j之后的两种鸡源细胞,tgfb2基因的表达均增加(如图2)。
实验例2
干扰tgfb2基因表达对alv-j病毒增殖的影响
1)合成针对tgfb2的si-rna。基因序列如下:
sense:5’-gccaucccaccaagcuauutt3’;
antisense:5’-aauagcuuggugggauggctt3’。
2)取生长状态良好的df-1细胞按照每孔1×105个细胞接种于12孔板。待细胞密度达到70%左右时,利用jetprimeregent(转染试剂)进行si-rna转染,同时设置si-rna对照组和正常组细胞,每组三个重复,4h后换液。24h后接种nx0101毒株,孵育1h后弃掉病毒液。接种病毒后,每天定时收板,连续收集6天,用reed-muench方法检测病毒效价。
结果显示(见图3),当tgfb2的si-rna有效干扰tgfb2基因的表达后,df-1细胞中病毒增殖在每个时间点与空白组和阴性对照组相比均呈显著下降趋势。说明抑制tgfb2基因表达可抑制alv-j在df-1细胞中的增殖。
实验例3
抗性鸡和易感鸡的tgfb2基因表达情况分析
rna-seq法:按takara说明书提取抗性鸡和易感鸡的总rna,各设三个重复。以od260/od280值作为rna纯度指标,范围在1.8~2.1。按照illuminahiseq(illuninahiseq4000,美国)测序仪要求建立rna文库。
将10pm文库变性为单链dna分子,在illuminaflowcell(illumina,美国)上捕获,原位扩增为簇(cluster),并在illuminahiseq(illuninahiseq4000,美国)测序仪上采用双端模式(pemode)进行150个循环测序。
经过illuminahiseq4000测序仪测序后,获得原始数据。使用hisat2软件将cleanreads比对到鸡参考基因组(ucscgalgal4)上,在ensemblgtf基因注释文件指导下,使用cuffdiff软件获得基因水平mrnafpkm(fragmentsperkilobaseofexonpermillionfragmentsmapped)值,作为mrna的表达谱,并计算两个/组样品间的倍数变化和p-value,鉴定差异表达mrna。
表3抗性鸡和易感鸡的tgfb2基因表达情况分析
结果如表3显示,抗性鸡中tgfb2基因表达显著低于易感鸡。
qrt-pcr技术验证,按takara说明书提取抗性鸡和易感鸡的样品总rna各3个,选取gapdh基因作为内参,进行qrt-pcr反应,检测tgfb2基因的表达情况,每个样品设3个重复,使用实验例1中引物,反应体系如表2。反应程序如下:95℃,10min;95℃,10s,60℃,1min,40个循环。
结果显示(图4):抗性鸡中tgfb2基因表达显著低于易感鸡。推测tgfb2基因启动子区chr3:18755007位点甲基化显著抑制了tgfb2基因表达,与rna-seq测序分析结果相一致。
- 还没有人留言评论。精彩留言会获得点赞!