与黄萎病抗性相关的GhCML20基因及其应用的制作方法
本发明涉及生物领域,特别涉及与黄萎病抗性相关的ghcml20基因及其应用。
背景技术:
我国是世界上最大的产棉国之一,在国民经济中占有重要地位。由大丽轮枝菌(verticilliumdahliaekleb.)引起的棉花黄萎病是影响我国和世界棉花生产的最重要病害之一,被称为棉花的“癌症”。
大丽轮枝菌为重要的土壤习居性植物病原菌,其微菌核抗逆能力强,在土壤中可存活10年以上,在与寄主协同进化过程中,常受到病菌异核现象和环境条件的影响,导致病原菌致病力发生变化,产生新的生理类型,至今没有特效的化学防治药剂。因此,要实现对棉花黄萎病的有效防治,培育抗病品种是最有效的方法。
陆地棉抗黄萎病遗传资源匮乏,在棉花上还未克隆到主效的抗病基因,而且抗病基因所介导的抗性只对特定的病原菌小种有效,易因病原菌的变异而丧失抗性作用,导致病害的重新爆发和流行,给农业生产造成巨大损失。因此,开发和利用新型针对棉花黄萎病的抗病相关基因显得尤为迫切和重要。
技术实现要素:
为了弥补以上领域的不足,本发明提供了与黄萎病抗性相关的ghcml20基因及其应用。
本发明的一个目的是提供:如下1)~4)中任一所述的dna分子在增强或降低植物对黄萎病抗性中的应用:
1)其核苷酸序列如seqidno.1所示的dna分子;
2)其核苷酸序列如seqidno.3所示的dna分子;
3)其核苷酸序列如seqidno.4所示的dna分子;
4)其核苷酸序列如seqidno.5所示的dna分子。
所述黄萎病为由黄萎病强致病力落叶型菌株v991引起的黄萎病。
所述植物为棉花或拟南芥。
本发明的另一个目的是提供一种制备对黄萎病抗性增强的转基因拟南芥的方法。
本发明所提供的制备对黄萎病抗性增强的转基因拟南芥的方法,包括如下步骤:将核苷酸序列如seqidno.4所示的dna分子导入出发植物拟南芥中,得到转基因拟南芥;与出发植物拟南芥相比,转基因拟南芥对黄萎病抗性增强;
所述将核苷酸序列如seqidno.4所示的dna分子导入出发植物中是指将装载有所述如seqidno.4所示的dna分子的重组表达载体导入出发植物拟南芥中。
所述重组表达载体是将所述如seqidno.4所示的dna分子插入出发载体ppzp111-egfp的多克隆位点得到的。
所述黄萎病为由黄萎病强致病力落叶型菌株v991引起的黄萎病。
本发明的又一个目的是提供一种制备对黄萎病抗性降低的转基因棉花的方法。
本发明所提供的制备对黄萎病抗性降低的转基因棉花的方法,包括如下步骤:将连接有核苷酸序列如seqidno.5所示的dna分子的沉默载体导入到出发植物棉花中,得到转基因棉花;选出与出发植物棉花相比黄萎病抗性降低的转基因植物个体,即得到对黄萎病抗性降低的转基因棉花。
所述棉花为陆地棉中植棉kv3。
所示沉默载体的出发载体为棉花皱缩病毒沉默载体pclcrva。
所述黄萎病为由黄萎病强致病力落叶型菌株v991引起的黄萎病。
钙调蛋白类似蛋白(cml)是一类ca2+感受蛋白,在植物发育和抗病过程中起重要调控作用。研究棉花ghcml20基因在抗黄萎病中的作用,有利于陆地棉抗黄萎病基因工程育种的进一步开展,为黄萎病的预防和控制提供借鉴和参考。
附图说明
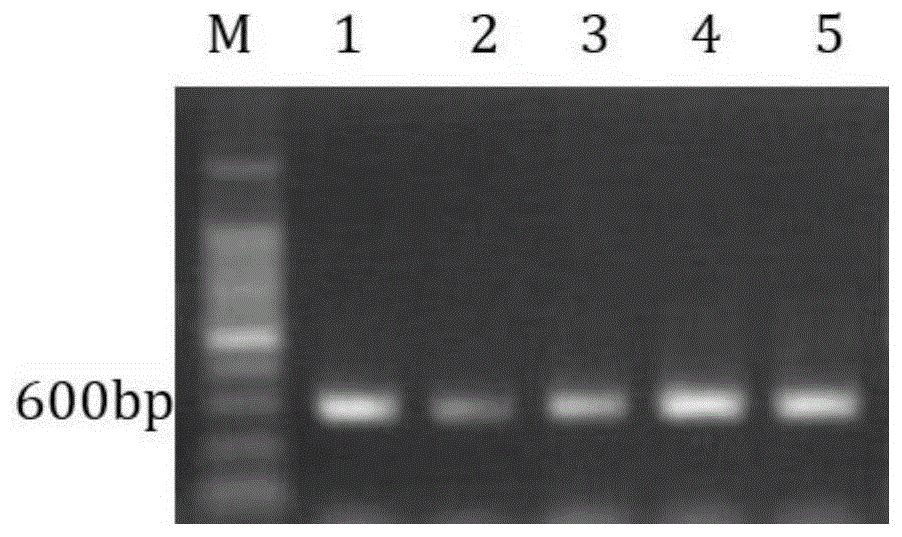
图1为ghcml20基因克隆、菌落pcr检测电泳图;其中,m:200bpmarker,1-2为ghcml20基因克隆结果,3-5为菌落pcr检测结果。
图2为ghcml20保守结构域。
图3为cml20多序列比对结果。
图4为cml20系统进化发育树。
图5为接种大丽轮枝菌v991:0、3、6、12、18、24、36、48、96、144h的中植棉kv3根部ghcml20基因的表达情况。
图6为中植棉kv3各组织中ghcml20表达量分析结果。
图7为ghcml20基因沉默载体构建,其中,泳道1为ghcml20基因沉默目的片段扩增;泳道2为中间载体peasy-t-ghcml20双酶切验证;泳道3为沉默载体pclcrva-ghcml20双酶切验证;泳道4为沉默载体pclcrva-ghcml20转化农杆菌菌落pcr验证。
图8为沉默ghcml20基因的中植棉kv3抗病性鉴定结果,其中,a,野生型棉株(中植棉kv3),b,中植棉kv3接种大丽轮枝菌v991,c,转化空载体(pclcrva+pclcrvb)的中植棉kv3接种大丽轮枝菌v991,d,沉默ghcml20基因的中植棉kv3接种大丽轮枝菌v991。
图9为超表达载体ppzp111-egfp-ghcml20酶切验证结果,m:200bpmarker,1,ppzp111-egfp-ghcml20质粒,ppzp111-egfp-ghcml20载体双酶切。
图10为转ghcml20基因拟南芥pcr验证结果,m,200bpmarker;1,野生型col-0;2-10为转ghcml20基因植株。
图11为转ghcml20基因拟南芥抗黄萎病鉴定结果,a,转化空载体ppzp111-egfp拟南芥未接种对照;b,转化空载体ppzp111-egfp拟南芥接种大丽轮枝菌v991;c,野生型拟南芥col-0未接种对照;d,野生型拟南芥col-0接种大丽轮枝菌v991;e,转化ppzp111-egfp-ghcml20拟南芥未接种对照;f,转化ppzp111-egfp-ghcml20拟南芥接种大丽轮枝菌v991。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的百分含量,如无特别说明,均为质量百分含量。
植物材料:
陆地棉高抗黄萎病新品系中植棉kv3,在文献“zhangw,zhangh,qif,jiang.generationoftranscriptomeprofilingandgenefunctionalanalysisingossypiumhirsutumuponverticilliumdahliaeinfection.biochemicalandbiophysicalresearchcommunications,2016,473:879-885”中公开过,公众可从中国农业科学院植物保护研究所获得。
拟南芥哥伦比亚型(col-0),在文献“szabadosl,kovácsi,oberschalla,abraháme,kerekesi,zsigmondl,nagyr,alvaradom,krasovskajai,gálm,berentea,rédeigp,haimab,konczc.distributionof1000sequencedt-dnatagsinthearabidopsisgenome.plantj.2002,32(2):233-42.”中公开过,公众可从中国农业科学院植物保护研究所获得。
载体和菌株:
peasy-t1simple载体购自于全式金生物公司;
棉花皱缩病毒沉默载体pclcrva和pclcrvb,在文献“guz,huangc,lif,zhouxp.aversatilesystemforfunctionalanalysisofgenesandmicrornasincotton.plantbiotechnologyjournal,2014,12:1-12.”中记载过,公众可从中国农业科学院植物保护研究所获得。
超表达载体ppzp111-egfp,为中科院微生物所夏桂先实验室馈赠,在文献“hajdukiewiczp,svabz,maligap.thesmall,versatileppzpfamilyofagrobacteriumbinaryvectorsforplanttransformation.plantmolecularbiology,1994,25,989-994.”中记载过,公众可从中国农业科学院植物保护研究所获得。
大肠杆菌dh5α购自于天根生化科技(北京)有限公司;
黄萎病强致病力落叶型菌株v991为本实验室保存,在文献“石磊岩,王莉梅。北方棉区棉花黄萎病菌rapd分析。植物保护,1997,5:3-7.”中公开过,公众可从中国农业科学院植物保护研究所获得。
农杆菌菌株eha105为本实验室保存,在文献“chengm,jarretrl,liz,xinga,demskijw.productionoffertiletransgenicpeanut(arachishypogaeal.)plantsusingagrobacteriumtumefaciens.plantcellrep.1996,15(9):653-657.”中公开过,公众可从中国农业科学院植物保护研究所获得。
实施例1、陆地棉ghcml20基因的获得及功能验证
一、陆地棉ghcml20基因的获得
1、棉花材料的种植:
棉花(棉花品种为中植棉kv3(来源见上),gossypiumhirsutuml.))种子用硫酸脱绒。挑选饱满的棉种,用70%的酒精浸泡5min,再用5%的h2o2浸泡2h,无菌水冲洗3遍后,用无菌水浸泡催芽5h。将种子种植到花盆中,供试土壤为灭菌蛭石。培养条件:26/20℃,光照16h,黑暗8h,待棉株长出子叶后,移至含1/3ms培养液(参见文献:murashigetandskoogf.arevisedmediumforrapidgrowthandbioassayswithtobaccotissuecultures.physiolplant,1962,15:473-497.)的大烧杯中培养,直至第二片真叶完全展开时进行病原菌接种。
2、病原菌的接种方法:
待棉苗第二片真叶完全展开时,进行病原菌接种。采用蘸根法接种大丽轮枝菌v991,孢子浓度为1.0×107个孢子/ml。分别于接种后3、6、12、18、24、36、48、96和144h取棉株幼根,同时取未接种黄萎病菌的棉株幼根作为对照,经液氮冷冻后,保存于-80℃冰箱。
3、总rna提取:
总rna提取参照tiangenrnapreppure多糖多酚植物总rna提取试剂盒说明书。微量分光光度计进行浓度和质量检测,-80℃保存备用。
4、ghcml20基因的克隆:
通过转录组测序筛选到ghcml20基因片段,得到部分序列,通过在线blast分析,查找陆地棉测序数据库中的同源序列,通过电子克隆,得到ghcml20基因全长片段。
4.1cdna合成:
提取棉花rna,反转录为cdna,依次加入下列试剂:
总rna,2μl;
randomprimer,1μl;
rnafreeh2o,7μl;
65℃,5min;冰浴1min
5×m-mlvbuffer,4μl;
dntp(10mm),1μl;
rnaseinhibitor,0.5μl;
m-mlvreversetranscriptase(200u),1μl;
rnafreeh2o,3.5μl
混匀后,42℃,1h;70℃,10min。反应完成后,保存于-20℃。
4.2引物设计:
ghcml20-f:5’-gggacttttctggaactgg-3’
ghcml20-r:5’-cgatcaaacactccctcc-3’
4.3pcr扩增:
以反转录cdna为模板,进行pcr扩增,获得ghcml20基因序列。
反应体系为:
cdna,1μl
10хextaqbuffer,2.5μl
10mmdntps,1μl
10μmghcml20-f,1μl
10μmghcml20-r,1μl
extaq,0.25μl
ddh2o,18.25μl
pcr扩增程序:94℃,3min;:94℃,30s;58℃,30s;72℃,1min,35个循环,72℃,10min。
4.4将获得的ghcml20基因与t载体连接
将上步获得的pcr产物与peasy-t1simple载体(全式金生物公司)连接,方法参见试剂盒说明书,转化dh5α(天根生化科技(北京)有限公司),进行菌落pcr检测,对阳性克隆进行测序验证(测序公司为上海生工)。
ghcml20基因的pcr扩增得到588bp片段,其中开放阅读框(orf)为510bp,编码169个氨基酸。pcr扩增结果如图1所示。由图1可见,pcr扩增得到588bp的目的条带,其核苷酸序列seqidno.4所示。
ghcml20基因的cdna如seqidno.1所示,其编码框为seqidno.3所示(即seqidno.1中自5’末端起第611位至第1120位核苷酸),其编码的ghcml20蛋白的氨基酸如seqidno.2所示。
4.5ghcml20序列生物信息学分析
通过ncbi在线orffinder程序查找ghcml20基因orf和编码的氨基酸,利用blast搜索和比对ghcml20的同源序列;利用mega软件构建不同物种ghcml20的系统发育树;利用expasy网站中的程序protparam分析ghcml20分子量、等电点信息;利用在线软件signalp和tmhmm预测该蛋白信号肽和蛋白序列跨膜区。
蛋白氨基酸序列分析、比对及进化树的构建结果如下:
利用protparam(http://web.expasy.org/protparam/)分析显示,ghcml20的理论分子量为19.35kd,理论等电点为4.83。ghcml20含有保守结构域ef-hand超家族结构域(图2)。利用ncbi在线blast搜索其他物种cml20氨基酸序列,并进行序列比对(图3)。通过mega软件采用邻接法bootstrap设为1000构建ghcml20的进化系统发育树(图4)。利用在线软件signalp4.1server(http://www.cbs.dtu.dk/services/signalp/)预测ghcml20信号肽,结果显示,ghcml20不含信号肽;利用tmhmmserverv.2.0(http://www.cbs.dtu.dk/services/tmhmm/)预测ghcml20跨膜区,结果显示,ghcml20不含跨膜结构。
二、陆地棉ghcml20基因功能验证
1、ghcml20基因表达谱分析:
将接种后0-144h的幼根(中植棉kv3)总rna反转录合成cdna(方法见前,promega公司),模板起始量均为100ng,陆地棉ubiquitin(genbank:eu604080)为内标。荧光定量pcr反应试剂盒为天根公司的superrealpremixplus(sybrgreen)试剂盒,反应在abi7500real-timepcrsystem荧光定量仪中进行,每种处理3次生物学重复,实验结果用相对定量2-δδct法计算ghcml20基因的表达量(livakandschmittgen,2001)。引物序列见表1。
反应体系:
反应程序:95℃,15min;40cycles:95℃,10sec,60℃,32sec
表1.荧光定量pcr引物
结果:在接种黄萎病强致病力落叶型菌株v991之后棉株根部ghcml20基因瞬时上调表达,接种后3h表达量最高,为未接种棉株的3.19倍,接种后6h到18h表达量一直维持在未接种棉株的2倍以上(图5)。
2、ghcml20组织特异性分析:
分别取中植棉kv3生长30d根、茎、叶和花,提取总rna,反转录成cdna,利用荧光定量技术检测不同组织基因的表达量(方法同上)。
结果:利用荧光定量pcr技术对ghcml20组织特异性进行分析,结果显示ghcml20在根、茎、叶和花均有表达,茎中表达量与根、叶、花相比,显著性升高(p<0.05),而根、叶和花中表达量没有显著性差异,表明ghcml20表达不具有组织特异性(图6)。
3、ghcml20基因沉默
3.1构建含有ghcml20基因的vigs载体
以陆地棉中植棉kv3cdna为模板扩增ghcml20基因片段,引物序列为:
v1ghcml20f:5’-ggactagtcagaagggaagacaccat3’
v1ghcml20r:5’-aaggcgcgccctcttctttagtgtccctc-3’
pcr产物是264bp的dna分子,该分子含有的核苷酸序列如seqidno.5所示(即开放阅读框5’末端起第40位至303位核苷酸)。
划线部分为酶切位点speⅰ:actagt,ascⅰ:ggcgcgcc。pcr产物连接到载体peasy-t1simple(载体购自全式金生物公司,产品目录号为:ct111-01)上,获得中间载体peasy-t-ghcml20。限制性内切酶spei和asci双酶切中间载体peasy-t-ghcml20,axygen公司的胶回收试剂盒回收ghcml20基因片段,连接到相同酶切的基因沉默载体pclcrva上,将沉默载体pclcrva-ghcml20转化至大肠杆菌dh5α,酶切及pcr验证后,转化至农杆菌eha105中。同时将沉默载体pclcrva和pclcrvb分别转化至农杆菌eha105中。
转化方法:冻融法将构建的vigs沉默载体pclcrva-ghcml20、pclcrva和pclcrvb分别转入农杆菌菌株eha105。方法如下:
制备农杆菌感受态细胞:挑取eha105单菌落,接种到含10mlyep液体培养基(10g/l蛋白胨,10g/l酵母提取物,5g/lnacl,15g/l琼脂)中,28℃,200rpm培养过夜。取0.5ml菌液加入50mlyep液体培养基中,28℃,200rpm培养至od600=0.5。将菌液倒入50ml离心管中,冰浴10min,4℃,5000rpm离心10min。弃上清,加入10ml冰预冷的0.1mol/lcacl2,轻轻悬浮沉淀。冰浴30min,4℃,5000rpm离心10min。弃上清,加入2ml冰预冷的0.1mol/lcacl2,轻轻悬浮沉淀,分装备用。
冻融法转化:感受态细胞中加入1-2μl沉默载体,轻轻混匀,置于冰上30min。液氮中速冻1min,37℃放置5min。加入400μlyep液体培养基,28℃,200rpm培养4h。将菌液涂布于yep固体培养基(50mg/lkan,50mg/lrif),28℃培养约36h。挑取单菌落,以特异性引物进行pcr鉴定,获得阳性转化子。
菌落pcr扩增体系(25μl)
反应程序:94℃3min,365cycles:94℃30s,58℃30s,72℃1min;72℃10min。
引物(clcrva,clcrvb),引物序列参见guetal文献:“guz,huangc,lif,zhouxp.aversatilesystemforfunctionalanalysisofgenesandmicrornasincotton.plantbiotechnologyjournal,2014,12:1-12.”)。
clcrvaf:gggagctccacttgggataggttaagaa;
clcrvar:ccatcgatgtcccttattaactttagggc
clcrvbf:gggccatagacatggtaatgttggactc
clcrvbr:gtcgctgcgcggccatatttctctatat
v2ghcml20f:5’-cagaagggaagacaccat-3’
v2ghcml20r:5’-ctcttctttagtgtccctc-3’
待陆地棉中植棉kv3棉苗子叶完全展开时进行接种。取含有pclcrva-ghcml20沉默载体的eha105菌株,28℃培养至对数生长期,8000rpm离心5min,收集菌体,再用乙酰丁香酮溶液(10mmol/lmes,200μmol/lacs,10mmol/lmgcl2)重悬菌体,并调整菌液浓度至od600=1.0–1.5。将它们分别与含pclcrvb的菌株1:1混合,室温静止放置3小时后用于植物接种。同时混合含pclcrva和pclcrvb的eha105菌株,作为空载体对照,用于植物接种。取一支1ml的一次性注射器,吸取菌液,在子叶背部注射接种。接种后植株置于培养箱中,25/20℃,光照16h,黑暗8h条件下,培养3周。采集叶片,提取总rna,利用荧光定量pcr技术,检测基因表达量。分别对野生型棉株、转化空载体的棉株和沉默ghcml20基因的棉株接种大丽轮枝菌v991,3周后调查发病情况,并计算病情指数。
病情指数=[∑(各级病株数×相应病级)/调查总株数×最高病级(4)]×100。
结果:利用clcrv沉默载体pclcrva构建了沉默ghcml20基因的沉默载体(图7)。将它们与pclcrvb共同接种棉花子叶,并以pclcrva和pclcrvb空载体接种棉花子叶作为对照。为检测沉默载体的沉默效率,在接种3周后,利用荧光定量pcr技术检测接种后中植棉kv3中ghcml20基因的表达量。发现相对于接种空载体的中植棉kv3,沉默ghcml20基因的植株中ghcml20基因的表达量下降了78%。
对野生型棉株、转化空载体棉株和基因沉默棉株接菌3周后调查结果显示:野生型棉株病情指数为17.28,转化空载体棉株病情指数为24.63,ghcml20基因沉默棉株病情指数为53.32,使中植棉kv3对黄萎病抗性丧失(图8)。
2、ghcml20基因超表达
扩增ghcml20基因全长片段(引物为pzp-ghcml20-f/pzp-ghcml20-r,反应程序同上),连接到载体peasy-t1simple上,获得中间载体,限制性内切酶speⅰ(actagt)和xbaⅰ(tctaga)双酶切中间载体,回收ghcml20全长片段,连接到相同酶切的超表达载体ppzp111-egfp上,转化至大肠杆菌dh5α,酶切及pcr验证后,将超表达质粒ppzp111-egfp-ghcml20转化至农杆菌eha105中(图9)。
pzp-ghcml20-f:ggactagtgggacttttctggaactgg
pzp-ghcml20-r:gctctagacgatcaaacactccctcc
构建好的超表达载体ppzp111-egfp-ghcml20采用花浸法转化拟南芥,以转化ppzp111-egfp空载体作为阴性对照。取含超表达载体的eha105菌株,28℃培养至对数生长期,转接到新鲜培养基(lb)中,待菌液浓度为od600=0.8-1.0时,5000rpm离心5min,收集菌体,侵染缓冲液重悬,使终浓度od600达到0.8。取3-4周龄拟南芥哥伦比亚型(col-0),剪掉已经开过的花,用滴管吸取菌液滴到即将开放的拟南芥花序上,确保液滴完全覆盖花序。将拟南芥转至黑暗中培养24h,转移到正常光照条件下,每隔5天重复侵染一次,侵染3-4次。将收获的t0代种子点种于含kan的筛选培养基(含卡那霉素的ms培养基)中,将叶色浓绿、根系发达和植株健壮的拟南芥移栽于花盆,利用plantleafdirectpcrkit(购自成都福际生物技术公司,产品目录号为tp-02111)筛选转基因阳性植株。
反应体系(20μl):
反应程序:
94℃,3min;94℃,30s;58℃,30s;72℃,1min,35个循环,72℃,10min。
用卡那霉素浓度为70mg/l的ms培养基初筛转基因阳性株,将叶片浓绿和植株健壮的拟南芥幼苗移栽于花盆中,通过叶片pcr技术扩增插入目的基因进一步筛选转基因单株(图10),获得t1代阳性株,收单株种子,继续筛选,获得t2代转基因系。
超表达植株抗病性鉴定:超表达植株采用蘸根法接种黄萎病菌v991,转化空载体和col-0型拟南芥接种v991分别作为阳性和阴性对照,2周后调查发病情况,并计算病情指数。
采用蘸根法接种黄萎病菌v991,2周后调查转化ppzp111-egfp-ghcml20、ppzp111-egfp和野生型植株发病情况(图11),统计病情指数。结果显示超表达ghcml20拟南芥的病情指数为10.23,野生型和转化空载体拟南芥植株病情指数分别为40.84和45.07,相比,转基因植株对黄萎病抗性显著增加(p<0.05),表明ghcml20在抗黄萎病过程中起重要作用,可进一步应用于基因工程技术转化陆地棉,获得抗黄萎病陆地棉材料。
sequencelisting
<110>中国农业科学院植物保护研究所
<120>与黄萎病抗性相关的ghcml20基因及其应用
<130>p190128/zwb
<160>5
<170>patentinversion3.5
<210>1
<211>1199
<212>dna
<213>棉花(gossypiumhirsutuml.)
<400>1
cccgagggaagttttccaggggggaaaccgcctgggtatctttaaaagccccgtcggggt60
ttcgcccacctttggaccttgagcggtcgattttttgtgatgcttgtccaggggggccgg120
accctatggaaaaacgcccagcaaaaccggcctttttacggttcctggccttttgctggc180
cttttgctcacatgttctttcctgcgttatcccctgattctgtggataaccgtattaccg240
cctttgagtgagctgataccgctcgccgcagccgaacgaccgagcgcagcgagtcagtga300
gcgaggaagcggaagagcgcccaatacgcaaaccgcctctccccgcgcgttggccgattc360
attaatgcagctggcacgacaggtttcccgactggaaagcgggcagtgagcgcaacgcaa420
ttaatgtgagttagctcactcattaggcaccccaggctttacactttatgcttccggctc480
gtatgttgtgtggaattgtgagcggataacaatttcacacaggaaacagctatgaccatg540
attacgccaagctgcccttggactagtgggacttttctggaactggtttaagatctcatc600
tcagtgaacaatggctagtctttacagaggggcatcaaggaaagacaagcagaagggaag660
acaccatggattaagccagcagaagaggcaagagattaaggaagcatttgaactgtttga720
cactgatggctcaggtaccattgatgccaaagagctgaatgttgctatgagggctcttgg780
tttcgaaatgacagaagagcaaatcaatcaaatgattgcggatgttgacaaggatggcag840
tggtgccattgactttgatgaatttgttcacatgatgactgccaagatcggggagaggga900
cactaaagaagagcttatgaaagcattccaaatcattgatcaagataacaatggaaagat960
atctgctgacgacgttaaacgcattgcaaaggagcttggtgaacacttctccgaaaaaga1020
tattcaggacatgattgaagaagcagaccgagatcatgacggggaggtaagtattgaaga1080
gttcatgaggatgatgaagaaaactacatatggctactagaagtttgacttatggccgga1140
gggagtgtttgatcgtctagagcaagggcagctcaatcgccctataggagtcgttcccc1199
<210>2
<211>169
<212>prt
<213>棉花(gossypiumhirsutuml.)
<400>2
metalaserleutyrargglyalaserarglysasplysglnlysgly
151015
arghishisglyleuserglnglnlysargglngluilelysgluala
202530
phegluleupheaspthraspglyserglythrileaspalalysglu
354045
leuasnvalalametargalaleuglypheglumetthrgluglugln
505560
ileasnglnmetilealaaspvalasplysaspglyserglyalaile
65707580
asppheaspgluphevalhismetmetthralalysileglygluarg
859095
aspthrlysglugluleumetlysalapheglnileileaspglnasp
100105110
asnasnglylysileseralaaspaspvallysargilealalysglu
115120125
leuglygluhispheserglulysaspileglnaspmetilegluglu
130135140
alaaspargasphisaspglygluvalserileglugluphemetarg
145150155160
metmetlyslysthrthrtyrglytyr
165
<210>3
<211>510
<212>dna
<213>棉花(gossypiumhirsutuml.)
<400>3
atggctagtctttacagaggggcatcaaggaaagacaagcagaagggaagacaccatgga60
ttaagccagcagaagaggcaagagattaaggaagcatttgaactgtttgacactgatggc120
tcaggtaccattgatgccaaagagctgaatgttgctatgagggctcttggtttcgaaatg180
acagaagagcaaatcaatcaaatgattgcggatgttgacaaggatggcagtggtgccatt240
gactttgatgaatttgttcacatgatgactgccaagatcggggagagggacactaaagaa300
gagcttatgaaagcattccaaatcattgatcaagataacaatggaaagatatctgctgac360
gacgttaaacgcattgcaaaggagcttggtgaacacttctccgaaaaagatattcaggac420
atgattgaagaagcagaccgagatcatgacggggaggtaagtattgaagagttcatgagg480
atgatgaagaaaactacatatggctactag510
<210>4
<211>588
<212>dna
<213>棉花(gossypiumhirsutuml.)
<400>4
gggacttttctggaactggtttaagatctcatctcagtgaacaatggctagtctttacag60
aggggcatcaaggaaagacaagcagaagggaagacaccatggattaagccagcagaagag120
gcaagagattaaggaagcatttgaactgtttgacactgatggctcaggtaccattgatgc180
caaagagctgaatgttgctatgagggctcttggtttcgaaatgacagaagagcaaatcaa240
tcaaatgattgcggatgttgacaaggatggcagtggtgccattgactttgatgaatttgt300
tcacatgatgactgccaagatcggggagagggacactaaagaagagcttatgaaagcatt360
ccaaatcattgatcaagataacaatggaaagatatctgctgacgacgttaaacgcattgc420
aaaggagcttggtgaacacttctccgaaaaagatattcaggacatgattgaagaagcaga480
ccgagatcatgacggggaggtaagtattgaagagttcatgaggatgatgaagaaaactac540
atatggctactagaagtttgacttatggccggagggagtgtttgatcg588
<210>5
<211>264
<212>dna
<213>棉花(gossypiumhirsutuml.)
<400>5
cagaagggaagacaccatggattaagccagcagaagaggcaagagattaaggaagcattt60
gaactgtttgacactgatggctcaggtaccattgatgccaaagagctgaatgttgctatg120
agggctcttggtttcgaaatgacagaagagcaaatcaatcaaatgattgcggatgttgac180
aaggatggcagtggtgccattgactttgatgaatttgttcacatgatgactgccaagatc240
ggggagagggacactaaagaagag264
- 还没有人留言评论。精彩留言会获得点赞!
- 小麦白粉病抗性基因PmR2及其克隆与应用的制造方法与工艺
- 一种受茉莉酸甲酯和白叶枯病菌诱导的启动子、其制备方法和重组表达载体与流程
- MALDI‑TOFMS技术鉴定临床感染猪肠球菌的方法与流程
- 一种稻瘟病抗性基因Pi2的功能性分子标记及其应用的制造方法与工艺
- 一种与白叶枯病抗性基因Xa7紧密连锁的SNP分子标记及其应用的制造方法与工艺
- 一种与白叶枯病抗性基因Xa7紧密连锁的SNP分子标记及其应用的制造方法与工艺
- 一种水稻穗瘟抗性基因的分子标记方法与制造工艺
- OsSAPK9蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种硫链丝菌素‑庆大霉素抗性基因体系及还有其的抗性表达盒和重组质粒的制造方法与工艺
- 含抗PD‑1基因和聚亚精胺的复合物及其在治疗肿瘤中的应用的制造方法与工艺