一种新的有效地激活和扩增T细胞的方法与流程
发明领域
本发明涉及t细胞免疫治疗领域。具体地说,本发明涉及一种新的有效地激活和扩增t细胞的方法。该方法不需要辅助细胞,不需要吸附抗体的固体介质和不需要使用偶联着抗体的细微珠粒。用该方法激活和扩增的t细胞可用于t细胞免疫治疗。
技术背景
t细胞免疫疗法是一种新兴的非常有前景的治疗疾病的方法(kamphorstao,2013)。例如,自体移植由基因工程改造的表达嵌合抗原受体(car)的t细胞,一种当前最热门的t细胞免疫疗法(cart免疫疗法),在前期临床研究中已显示出巨大的治疗慢性或急性淋巴细胞白血病的希望(kalos,m,2011;maus,m.v,2014)。t细胞免疫疗法通常涉及t细胞的离体激活和扩增。t细胞被激活是t细胞能被嵌合抗原受体(car)基因工程改造的的前提(xiuyanwang,2016)。但是,现有的激活和扩增t细胞的方法都存在这样或那样的缺点或限制。
目前有以下几种激活和扩增t细胞的方法:i)第一种方法是使用树突状细胞激活和扩增t细胞,这是一种基于细胞的t细胞激活和扩增方法。树突状细胞原本是t细胞的天然内源性激活剂(petrakleindienst,2003),但树突状细胞对t细胞的激活效力因个体不同而有很大的差异,这种特性极大地限制了树突状细胞在t细胞激活和扩增中的进一步应用;ii)第二种基于细胞的方法是通过制造出人工抗原递里细胞(artificialantigen-presentingcells,aapc)来激活和扩增t细胞,例如,通过基因工程的方法制造表达特定抗原的k562细胞,经过同位素辐射照射过的表达特定抗原的k562细胞便可以作为人工抗原递呈细胞来激活和扩增t细胞(tnumbenjapon,2006),然而,选择和生产hla亚型匹配的gmp级人工抗原递呈细胞是一个非常复杂的过程(singhh,2014);iii)用抗cd3抗体和抗cd28抗体包被的细胞培养皿也可以用来激活和扩增t细胞(walkermr,2003),然而,细胞培养皿的抗体包被效率在不同批次之间有很大差异,这种差异会进一步导致t细胞在激活和扩增上产生差异,这不利于这种方法应用于临床治疗;iv)一些生物技术公司研发出的细微珠粒也可用于t细胞的激活和扩增,这些细微珠粒表面偶联着抗cd3抗体和抗cd28抗体,市场上常见的细微珠粒包括gibcodynabeadshumant-activatorcd3/cd28(cat#111.61d,thermofisherscientific)细微珠粒和miltenyimacsgmptransactcd3/28细微珠粒(cat#130-020-008,miltenyibiotech),然而,使用gibcodynabeads激活和扩增的t细胞在输注患者之前需要分离和去除这些细微珠粒,常用的分离和去除细微珠粒方法虽然可以大大减少t细胞中残留的细微珠粒数量,但不能完全消除这些细微珠粒,这会导致一些残余的细微珠粒被输注到患者的体内,细微珠粒去除的过程也会减少可用于治疗的t细胞数量,因为许多t细胞在分离过程中仍然会与细微珠粒紧密粘在一起。miltenyitransactcd3/cd28细微珠粒是由可生物降解的材料制成,但是,可生物降解的gmp级细微珠粒的生产和选择是复杂且昂贵的过程,为了能应用于临床t细胞免疫治疗,复杂的制造过程必需进行必要的简化以促进生产标准化,此外,在病人体内使用可生物降解的transactcd3/28细微珠粒也将面临许多来自监管机构在安全方面的质询;v)美国专利申清(us20070036783a1)报道了使用可溶性复合物来激活和扩增t细胞,这种可溶性复合物是四聚体抗体复合物,四聚体抗体复合物的制备方法很复杂,四聚体抗体复合物的组分在不同生产批次中也必然会有差异。上述这些激活和扩增t细胞的方法都存在这样或那样的缺点或限制。
使用本发明的单体单链双特异性抗体来激活和扩增t细胞就可以克服上述这些缺点或限制。本发明的单体单链双特异性抗体通过同时提供主要刺激信号和辅助刺激信号来激活和扩增t细胞。本发明的单体单链双特异性抗体具有显著的优势:i)如本专利申请的附图1所示,单体单链双特异性抗体结构简单易于生产,而人工抗原递里细胞,gibcodynabeadshumant-activatorcd3/cd28细微珠粒和miltenyimacsgmptransactcd3/28细微珠粒的结构复杂不易于生产;ii)单体单链双特异性抗体是一种可溶性和具有固定细成成分的试剂,而人工抗原递呈细胞,gibcodynabeadshumant-activatorcd3/cd28细微珠粒和miltenyimacsgmptransactcd3/28细微珠粒的组成成分在个批次间均可能有差异;iii)单体单链双特异性抗体是一种单体试剂,而gibcodynabeadshumant-activatorcd3/cd28细微珠粒和miltenyimacsgmptransactcd3/28细微珠粒是复合体,复合体形式细微珠粒的生产成本明显高于单体单链双特异性抗体的生产成本;iv)单体单链双特异性抗体可以通过简单的过滤方式来进行无菌处理,而人工抗原递里细胞,gibcodynabeadshumant-activatorcd3/cd28细微珠粒和miltenyimacsgmptransactcd3/28细微珠粒不可以通过简单的过滤方式来进行无菌处理,它们的无菌处理工艺繁琐复杂;v)如本发明所公开,单体单链双特异性抗体激活和扩增的t细胞可以被慢病毒有效地转导,并且可以有效地实施在t细胞免疫治疗中起关键作用的抗原特异性细胞毒性作用。
技术实现要素:
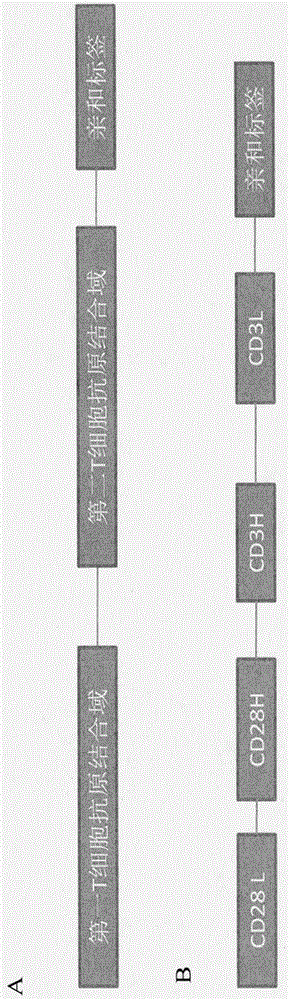
本发明公开了一种可有效地激活和扩增t细胞的双特异性抗体。这种双特异性抗体是一种单体单链形式的抗体(其结构详见附图1),它可以简单地通过5个氨基酸的间隔区把两个t细胞抗原结合域(如抗cd28抗体单链可变片段和抗cd3抗体单链可变片段)连接在一起而构成。本发明简化了t细胞激活和扩增的程序并可降低t细胞免疫治疗的费用。
附图说明
以下将结合附图对本发明的优选实施例进行详细的描述。应当理解,优选实施例仅为了说明本发明,而不是为了限制本发明的保护范围。
图1单体单链双特异性抗体结构。图1a单体单链双特异性抗体的一般性结构,它由第一t细胞抗原结合域,接头,第二t细胞抗原结合域,接头和亲和标签组成。图1b优选实施例抗cd28/cd3单体单链双特异性抗体的结构,本发明以它作为单体单链双特异性抗体的一个优选实施例。抗cd28/cd3单体单链双特异性抗体由抗cd28抗原的抗体轻链可变区(cd28l),接头,抗cd28抗原的抗体重链可变区(cd28h),接头,抗cd3抗原的抗体重链可变区(cd3h),接头,抗cd3抗原的抗体轻链可变区(cd3l)和亲和标签组成。h:抗体重链可变区;l:抗体轻链可变区;亲和标签:用于检测和纯化.
图2优选实施例抗cd28/cd3单体单链双特异性抗体的dna序列。
图3抗cd28ch2ch3抗体和抗cd3ch2ch3抗体的功能鉴定。图3证明抗cd28ch2ch3抗体和抗cd3ch2ch3抗体与相应抗原的结合活性。图中实线:jurkat细胞首先用抗cd28ch2ch3抗体或抗cd3ch2ch3抗体染色,然后用pe偶联的抗人iggfc抗体染色。图中虚线:jurkat细胞仅用pe偶联的抗人iggfc抗体染色。抗cd28ch2ch3抗体和抗cd3ch2ch3抗体被用来验证抗cd28/cd3单体单链双特异性抗体与cd28抗原和cd3抗原的双结合特异性。图3a表明抗cd28ch2ch3抗体是具有功能性的抗体。图3b表明抗cd3ch2ch3抗体是具有功能性的抗体。
图4优选实施例抗cd28/cd3单体单链双特异性抗体的功能鉴定。图4证明抗cd28/cd3单体单链双特异性抗体包含两个t细胞抗原结合域,一个结合t细胞cd28抗原,另一个结合t细胞cd3抗原。图中实线:首先用抗cd28ch2ch3抗体或抗cd3ch2ch3封闭jurkat细胞上的cd28抗原或cd3抗原结合位点,接着用抗cd28/cd3单体单链双特异性抗体染色jurkat细胞,然后用pe偶联的抗myc抗体染色jurkat细胞。图中虚线:jurkat细胞仅用pe偶联的抗myc抗体染色。图4a显示抗cd28/cd3单体单链双特异性抗体在用抗cd28ch2ch3抗体阻断jurkat细胞上的cd28抗原结合位点后,仍能可与jurkat细胞结合,这证明抗cd28/cd3单体单链双特异性抗体对jurkat细胞上的cd3抗原具有特异结合能力。图4b显示抗cd28/cd3单体单链双特异性抗体在用抗cd3ch2ch3抗体阻断jurkat细胞上的cd3抗原结合位点后,仍能可与jurkat细胞结合,这证明抗cd28/cd3单体单链双特异性抗体对jurkat细胞上的cd28抗原具有特异结合能力。
图5优选实施例抗cd28/cd3单体单链双特异性抗体激活t细胞。图5显示:依据t细胞被激活的标记物cd25抗原的表达结果,t细胞可被抗cd28/cd3单体单链双特异性抗体激活。t细胞先与抗cd28/cd3单体单链抗体一起温育15分钟,洗涤两次,然后培养三天,再被fitc偶联的抗cd25抗体或同种血清型fitc偶联的对照抗体染色。图5a显示用fitc偶联的对照抗体染色的t细胞流式细胞仪(facs)检测结果。图5b显示用fitc偶联的抗cd25抗原抗体(bdbiosciences,cat#555431)染色的t细胞流式细胞仪(facs)检测结果,经抗cd28/cd3单体单链双特异性抗体刺激后,87.1%的t细胞表达t细胞激活标记物cd25抗原。
图6抗cd28/cd3单体单链双特异性抗体有效地扩增t细胞。依据细胞数计数结果,t细胞可以被抗cd28/cd3单体单链双特异性抗体有效地扩增。图6横轴显示t细胞培养天数,纵轴显示活细胞数。
图7单体单链抗双特异性抗体激活的t细胞可以被rfp慢病毒有效地转导。图7显示由抗cd28/cd3单体单链双特异性抗体激活的t细胞可以被红色荧光蛋白(rfp)慢病毒有效地转导。用20ul,40ul,80ulrfp慢病毒上清液感染2x10e6经抗cd28/cd3单体单链抗体激活的t细胞,再通过facs分析感染效率。图7a显示了0ulrfp慢病毒转导t细胞的流式细胞仪(facs)检测结果。图7b显示了20ulrfp慢病毒转导t细胞的流式细胞仪(facs)检测结果。图7c显示了40ulrfp慢病毒转导t细胞的流式细胞仪(facs)检测结果。图7d显示了80ulrfp慢病毒转导t细胞的流式细胞仪(facs)检测结果。
图8细胞毒性测定。图8显示通过抗cd28/cd3单体单链双特异性抗体激活和扩增的t细胞,在携带抗egfr/cd3双特异性抗体的情况下能够发挥细胞毒作用。图8a显示通过抗cd28/cd3单体单链双特异性抗体激活和扩增的t细胞,携带抗egfr/cd3双特异性抗体时能杀死贴壁的hek293细胞。图8b显示对照试验结果:通过抗cd28/cd3单体单链双特异性抗体激活和扩增的t细胞,在不携带抗egfr/cd3双特异性抗体情况下,不能杀死贴壁的hek293细胞。
定义
除非另外定义,否则,本文所使用的所有技术和科学术语都具有本发明所属领域普通技术人员通常所理解的同样含义。在一些情况中,本文出于阐明和/或便于引用目的对具有常规理解含义的术语加以限定,本文包括此类限定不应理解为表示与本领域常规理解的有显著差异。
本文所用的术语“抗体”包含任意同种型的抗体或免疫球蛋白,包括但不限于fab、fv、scfv和fd片段,嵌合抗体,人源化抗体,单链抗体以及含有抗体和非抗体蛋白的抗原结合部分的融合蛋白。除非另外说明,术语“抗体”包括完整或全长抗体,包括任意类型或亚型的抗体,包括igg及其亚型,igm、ige、iga,和igd。
本文所用的术语“双特异性抗体”是指能够同时与两种类型不同的抗原或表位结合的抗体。
本文所用的术语“单链可变片段(scfv)”是指衍生自抗体的单链多肽,其保留结合抗原的能力。scfv的实例包括经重组dna技术形成的抗体多肽,并且其中免疫球蛋白重链可变区和轻链重链可变区片段经由间隔序列连接。改造scfv的各种方法为本领域技术人员所熟知。
本文所用的术语“抗原结合结构域”是指任何能与抗原结合的多肽。目前有多种形式的抗原结合结构域。抗原结合结构域可以是任何能结合抗原的结构域。在一些实施方案中,抗原结合结构域是单链fv(scfv)。在一些实施方案,抗原结合结构域是骆驼来源抗体的可变结构域和其人源化版本,ignarvh(鲨鱼抗体可变区)和其人源化版本,sdabvh(单结构域抗体可变结构域)和“骆驼化”版本。在一些实施方案中,基于t细胞受体(tcr)的识别结构域如单链tcr(sctv,含有v.alpha.v.beta的单链双结构域tcr)也适合作为抗原结合结构域。在一些实施方案中,抗原结合结构域可被选择以识别在与特定疾病状态有关的靶细胞上充当细胞表面标志物的靶抗原。在一些实施方案中,抗原结合结构域可以是本领域已知的用作结合的替代支架,例如重组的纤连蛋白结构域等。
本文所用的术语“t细胞”是指表达cd3的所有类型的免疫细胞,包括辅助t细胞,细胞毒性t细胞,调节t细胞和γ-δt细胞等。
具体实施方式
除非另有说明,本发明的实施采用细胞培养、分子生物学(包括重组技术),微生物学,细胞生物学,生物化学和免疫学的常规技术,它们均在本领域技术范围内。这些技术在文献中有充分解释,例如,《分子克隆:实验室手册》(molecularcloning:alaboratorymanual),第三版(sambrook等,2001)冷泉港出版社;《寡核苷酸合成》(oligonucleotidesynthesis)(p.herdewijn编,2004);《动物细胞培养》(animalcellculture)(r.i.freshney编,1987);《酶学方法》(methodsinenzymology)(学术出版公司);《实验免疫学手册》(handbookofexperimentalimmunology)(d.m.weir和c.blackwell编)《新编分子生物学方案》(currentprotocolsinmolecularbiology)(f.m.ausubel等编,1987);《pcr:聚合酶链反应》(pcr:thepolymerasechainreaction)(mullis等编,1994);《新编免疫学方案》(currentprotocolsinimmunology)(j.e.coligan等编,1991);《免疫化学方案》(immunochemicalprotocols)(j.pound编,2003);《生物化学实验手册:免疫学和生物技术》(labmanualinbiochemistry:immunologyandbiotechnology)(a.nigam和a.ayyagari编,2007);《免疫学方法手册:综合技术资料手册》(immunologymethodsmanual:thecomprehensivesourcebookoftechniques)(ivanlefkovits编,1996);《抗体使用:实验室手册》(usingantibodies:alaboratorymanual)(e.harlow和d.lane编,1988)等。
t细胞需要至少两个不同的激活信号(主要激活信号和辅助刺激信号)才能被完全激活(gepperttd,1990;petera.bretscher,1999;bretscherp,1970)。第一信号来自t细胞受体(tcr)与抗原肽-mhc分子复合物的结合所提供的主要激活信号,第二信号来自抗原呈递细胞(apc)所提供的辅助刺激信号。本发明提供了一种使用单体单链双特异性抗体激活和扩增t细胞的方法。本发明的单体单链双特异性抗体是包含两种抗原结合结构域的单链多肽,其中一个抗原结合结构域提供主要激活信号,另一个抗原结合域提供辅助刺激信号。单体单链双特异性抗体激活和扩增的t细胞中不包含像gibcotmdynabeadstmhumant-activatorcd3/cd28和miltenyimacsgmptransactcd3/28那样的细微珠粒,这消除了需要在输注到患者体内之前从t细胞中分离除去细微珠粒的过程。单体单链双特异性抗体包含两个能诱发t细胞激活信号的抗原结合结构域,这消除了将几种抗体涂覆到固体表面上来激活t细胞,或使用辅助细胞来激活t细胞的需要。
本发明的单体单链双特异性抗体是通过一个短的多肽链将两个抗原结合结构域连接一起而构成的单一构建体。本发明的单体单链双特异性抗体的结构显示在图1中。作为优选实施例,本发明所使用的抗cd28/cd3单体单链双特异性抗体的dna序列显示在图2中。
在一个实施方案中,单体单链双特异性抗体中的抗原结合结构域的成员是单链fv(scfv)。
在一个实施方案中,单体单链双特异性抗体中的抗原结合结构域的成员是单链tcr(sctv)。
在一个实施方案中,单体单链双特异性抗体中的抗原结合结构域的成员是受体或受体结合片段的配体。
在一个实施方案中,单体单链双特异性抗体中的抗原结合结构域的成员衍生自针对cd3的抗体或其cd3结合部分。这个抗原结合域提供t细胞的主要刺激信号。该抗原结合结构域可以来自杂交瘤克隆,也可以来自人源化形式的非人抗体。在一个实施例中,该抗原结合结构域衍生自抗cd3单克隆抗体okf3或g19-4或其cd3结合部分。
在一个实施方案中,单体单链双特异性抗体中的抗原结合结构域的成员衍生自针对cd2的抗体或其cd2结合部分。这个抗原结合域提供t细胞的主要刺激信号。该抗原结合结构域可以是来自杂交瘤克隆,并且可以是人源化形式的非人抗体。
在一个实施方案中,单体单链双特异性抗体中的抗原结合结构域的成员衍生自抗cd28抗体或其cd28结合部分。这个抗原结合域提供t细胞辅助刺激信号。该抗原结合结构域可以来自杂交瘤克隆,可以是人源化形式的非人抗体。在一个实施例中,该抗原结合结构域衍生自抗cd28单克隆抗体ex5.3d10或其cd28结合部分。
在一个实施方案中,单体单链双特异性抗体中的抗原结合结构域的成员衍生自抗cd9抗体或其cd9结合部分。这个抗原结合域提供t细胞辅助刺激信号。该抗原结合结构域可以来自杂交瘤克隆,可以是人源化形式的非人抗体。在一个实施例中,该抗原结合结构域衍生自抗cd9单克隆抗体es5.2d8或其cd9结合部分。
在一个实施方案中,单体单链双特异性抗体中的抗原结合结构域的成员衍生自针对cd137的抗体或其cd137结合部分。该抗原结合结构域提供t细胞辅助刺激信号。该抗原结合结构域可以是来自杂交瘤克隆,并且可以是人源化形式的非人抗体。
在一个实施方案中,单体单链双特异性抗体中的抗原结合结构域的成员衍生自针对icos的抗体或其icos结合部分。这个抗原结合域提供t细胞辅助刺激信号。该抗原结合结构域可以来自杂交瘤克隆,可以是人源化形式的非人抗体。
在一个实施方案中,单体单链双特异性抗体中的抗原结合结构域的成员衍生自针对cd40的抗体或其cd40结合部分。这个抗原结合域提供t细胞辅助刺激信号。该抗原结合结构域可以来自杂交瘤克隆,可以是人源化形式的非人抗体。
在一些实施方案中,单体单链双特异性抗体的抗原结合结构域的排列可以是:i)抗体蛋白n端-(提供主要刺激信号的抗原结合结构域)-(提供辅助刺激信号的抗原结合结构域)-抗体蛋白c端;ii)抗体蛋白n端-(提供辅助刺激信号的抗原结合结构域)-(提供主要刺激信号的抗原结合结构域)-抗体蛋白c端。在一个实施方案中,单体单链双特异性抗体的第一和/或第二抗原结合结构域可以独立地衍生自灵长类动物,啮齿动物或软骨鱼动物的抗体。在一个实施方案中,单体单链双特异性抗体的第一和/或第二抗原结合结构域可以是天然存在的或衍生自基因工程的抗体。
在一个实施方案中,单体单链双特异性抗体衍生自鼠源抗体或其片段。在另一个实施方案中,单体单链双特异性抗体衍生自人源化抗体或其片段。在另一个实施方案中,单体单链双特异性抗体衍生自完全的人抗体或其片段。在一些实施方式中,单体单链双特异性抗体的抗原结合片段是人抗体或其抗原结合片段。在一些实施方式中,单体单链双特异性抗体的抗原结合片段是人源化抗体。在一些实施方式中,单体单链双特异性抗体或其抗原结合片段是衍生自重组dna。在一些实施方式中,单体单链双特异性抗体或其抗原结合片段是单克隆来源。
在一些实施方案中,单体单链双特异性抗体的抗原结合结构域最好衍生自其最终将被应用的物种。例如,对于在人体中使用,单体单链双特异性抗体的抗原结合结构域最好来自人类。
在一些实施方案中,单体单链双特异性抗体施用于人的t细胞时,可以对抗体进行改变以使其免疫原性降低。本领域普通技术人员将理解如何改变,以及改变的程度。
在一些实施方案中,单体单链双特异性抗体构建体还包含一个促进其纯化和检测的亲和标签,例如:his亲和标签,ha亲和标签,gst亲和标签和myc亲和标签。在一些实施方式中,单体单链双特异性抗体的抗原结合结构域和亲和标签之间可以通过几个氨基酸序列连接,也可以直接连接。在一些实施方式中,单体单链双特异性抗体的抗原结合结构域和亲和标签之间可以通过包含有蛋白酶切割位点的序列连接,蛋白酶切割位点可用于随后去除亲和标签。示例性的切割序列包括烟草蚀刻病毒切割位点。在一些实施方式中,单体单链双特异性抗体的抗原结合缩构域和亲和标签之间可以通过与一个或多个标签和/或一个或多个蛋白酶切割序列连接。
在一些实施方案中,单体单链双特异性抗体可以被许多本领域熟知的技术纯化,例如反相色谱法,高性能液体色谱,离子交换色谱,尺寸排阻色谱,亲和力,色谱法,凝胶电泳等。用于纯化单体单链双特异性抗体的实际条件部分取决于生产策略和静电荷,疏水性,亲水性等因素,这对于本领域的普通技术人员来说将是显而易见的。对于亲和层析纯化,任何能特异性地与单体单链双特异性抗体或与其连接的亲和标签结合的抗体,都可以被用来分离和纯化单体单链双特异性抗体。
在一些实施方案中,被单体单链双特异性抗体激活和扩增的t细胞可源自t细胞谱系;被单体单链双特异性抗体激活和扩增的t细胞可源自成熟的t细胞;被单体单链双特异性抗体激活和扩增的t细胞可源自前体t细胞;被单体单链双特异性抗体激活和扩增的t细胞可源自细胞毒性t细胞;被单体单链双特异性抗体激活和扩增的t细胞可源自幼稚t细胞;被单体单链双特异性抗体激活和扩增的t细胞可源自记忆干细胞t细胞;被单体单链双特异性抗体激活和扩增的t细胞可源自中枢记忆t细胞;被单体单链双特异性抗体激活和扩增的t细胞可源自效应t细胞;被单体单链双特异性抗体激活和扩增的t细胞可源自cd4+t细胞;被单体单链双特异性抗体激活和扩增的t细胞可源自cd8+t细胞;被单体单链双特异性抗体激活和扩增的t细胞可源自cd4+和cd8+细胞;被单体单链双特异性抗体激活和扩增的t细胞可源自α-βt细胞;被单体单链双特异性抗体激活和扩增的t细胞可源自γ-detat细胞;被单体单链双特异性抗体激活和扩增的t细胞可源自天然杀伤t细胞;被单体单链双特异性抗体激活和扩增的t细胞可源自辅助t细胞;被单体单链双特异性抗体激活和扩增的t细胞可源自是调节性t细胞。
在一些实施方案中,被单体单链双特异性抗体激活和扩增的t细胞可以从患者获得,或者可以从现有的t细胞培养物中获得。在一些实施方案中,被单体单链双特异性抗体激活和扩增的t细胞可以分别从外周血,胎盘血,脐带血,骨髓,淋巴结组织,脾组织,肿瘤组织中获得。在一些实施方案中,被单体单链双特异性抗体激活和扩增的,来自外周血的t细胞可以通过白细胞去除术分离。在一些实施方案中,被单体单链双特异性抗体激活和扩增的特定亚群的t细胞,例如cd4+,cd8+或任何其它t细胞可以通过阳性和/或阴性选择技术从白细胞中分离群体。
在一些实施方案中,t细胞可以与单体单链双特异性抗体一起在无菌管中温育15分钟,经pbs洗涤两次,然后在非组织培养物处理的培养皿中培养。经单体单链双特异性抗体激活的t细胞可以培养1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25,26,27,28,29或30天或更长时间进行扩增。
在一个实施方案中,经单体单链双特异性抗体激活的t细胞被扩增到10倍至100倍。
本发明利用抗cd28/cd3单体单链双特异性抗体作为优选实施例子来显示非细微珠粒,非辅助细胞和非抗体涂层的方法激活和扩增t细胞。抗cd28/cd3单体单链双特异性抗体包含两个抗原结合结构域,其中一个抗原结合结构域能够结合人cd3表面抗原(主要刺激信号蛋白),另一个抗原结合结构域能够结合人cd28抗原(辅助刺激信号蛋白)。抗cd28/cd3单体单链双特异性抗体的结构显示在本发明的图1b中。抗cd28/cd3单体单链双特异性抗体的dna序列显示在本文的本发明的图2中。
使用单体单链双特异性抗体激活和扩增t细胞的优点包括但不限于:i)单体单链双特异性抗体易于使用,无需制备自体apc,无需制备辅助细胞或抗原,无需预先涂覆抗体于各种细微珠粒或组织培养板,无需将激活的t细胞与激活试剂分开(例如使用dynabeadshumant-activatorcd3/cd28细微珠粒激活t细胞的情况);ii)单体单链双特异性抗体通过同时提供主要刺激信号和辅助信号以生理性方式激活t细胞,这有利于被激活的t细胞在免疫治疗发挥最佳效能;iii)单体单链双特异性抗体的生产和制备程序简单,生产成本低。
优选实施例子
以下通过实施例来说明本发明的优选实施方案。本领域技术人员应理解,以下实施例中所公开的技术代表本发明人发现的在本发明的实践中能发挥良好作用的技术。然而,在所公开的具体实施方案中可以做出许多改变,并仍然获得相同或相似的结果,而不脱离本发明的精神和范围。
质粒dna构建体
抗cd28/cd3单体单链双特异性抗体的表达质粒dna构建体(命名为pcdna3anti-cd28/cd3)依据基因工程和分子克隆的一般技术而构建,详见alaboratorymanual,3rdedition,coldspringharbourlaboratorypress,coldspringharbour,n.y.(2001)。抗cd28/cd3单体单链双特异性抗体含有以下组成成分:抗人cd28抗原的抗体轻链可变区,5个氨基酸序列的接头,抗人cd28抗原的抗体重链可变区,5个氨基酸序列的接头,抗人cd3抗原的抗体重链可变区,18个氨基酸序列的间隔区,抗人cd3抗原的抗体轻链可变区,10个氨基酸序列的myc亲和标签。编码抗cd28/cd3单体单链双特异性抗体的核酸序列列于本发明的附图2中。编码抗cd28/cd3单体单链双特异性抗体的核酸序列先由idt生物公司合成,再克隆到质粒载体pcdna3.1+(v79020,invitrogen,carlsbad,ca)中。
抗cd28ch2ch3抗体的表达质粒dna构建体(命名为pcdna3anti-cd28ch2ch3)根据基因工程和分子克隆的一般技术进行而构建,详见alaboratorymanual,3rdedition,coldspringharbourlaboratorypress,coldspringharbour,n.y.(2001)。抗cd28ch2ch3抗体含有以下组成成分:抗人类cd28抗原的抗体轻链可变区,5个氨基酸序列的接头,抗人cd28抗原的抗体重链可变区,ch2ch3片段。ch2ch3片段是人igg1抗体的第二,第三重链恒定区,用作纯化和检测的标签。抗cd28的核酸序列衍自于抗cd28/cd3单体单链双特异性抗体的抗cd28抗体部分。编码抗cd28ch2ch3抗体的dna先由idt生物公司合成,再克隆到质粒载体pcdna3.1+(v79020,invitrogen,carlsbad,ca)中。抗cd28ch2ch3抗体被用作cd28抗原结合阻断剂,用于验证抗cd28/cd3单体单链双特异性抗体对另一个靶点,cd3抗原靶点,的特异结合活性。
抗cd3ch2ch3抗体的表达质粒dna构建体(命名为pcdna3anti-cd3ch2ch3)根据基因工程和分子克隆的一般技术进行构建,详见alaboratorymanual,3rdedition,coldspringharbourlaboratorypress,coldspringharbour,n.y.(2001)。抗cd3ch2ch3抗体含有以下组成成分:抗人cd3抗原的抗体重链可变区,18个氨基酸序列的间隔区,抗人cd3抗原的抗体轻链可变区,ch2ch3片段。ch2ch3片段是人igg1抗体的第二,第三重链恒定区,用作纯化和检测的标签。抗cd3的核酸序列衍自于抗cd28/cd3单体单链双特异性抗体的抗cd3抗体部分。编码抗cd3ch2ch3抗体的dna先由idt生物公司合成,再克隆到质粒载体pcdna3.1+(v79020,invitrogen,carlsbad,ca)中。抗cd3ch2ch3抗体被用作cd3抗原结合阻断剂,用于验证抗cd28/cd3单体单链双特异性抗体对另一个靶点,cd28抗原靶点,的特异结合活性。
蛋白质生产
本发明所使用的抗cd28/cd3单体单链双特异性抗体,抗cd28ch2ch3抗体和抗cd3ch2ch3抗体由freestyle293细胞(k900001,thermofisher)依据生产商提供的方案进行生产。简而言之,dna序列验证的质粒dna构建体(pcdna3anti-cd28/cd3或pcdna3anti-cd3ch2ch3或pcdna3anti-cd28ch2ch3)被用于转染悬浮的freestyle293细胞。转染的freestyle293细胞在无血清的freestyle293表达培养基(cat#12338018,thermofisher)中培养,培养箱的培养参数是37℃,95%湿度和8%co2。转染的freestyle293细胞在以135rpm旋转的轨道振荡器平台上孵育6至7天。依据生产商提供的方案,抗cd28ch2ch3抗体和抗cd3ch2ch3抗体通过蛋白a琼脂糖(cat#20333,thermofisher)进行纯化。抗cd28/cd3单体单链双特异性抗体则是通过直接收集过滤后的上清液收获,并将收获的上清液分装储存在-80℃的冰箱中。
抗cd28ch2ch3抗体和抗cd3ch2ch3抗体的功能鉴定
抗cd28ch2ch3抗体和抗cd3ch2ch3抗体的结合活性显示在图3中。2×10e6jurkat细胞(atcctib-152,一种在细胞表面上表达人cd28抗原和人cd3抗原的t淋巴细胞系)被50ng抗cd28ch2ch3抗体或50ng抗cd3ch2ch3抗体在facs(流式细胞术)缓冲液(含1%fbs的pbs)中染色20分钟,用facs缓冲液洗涤三次,再被pe-偶联的抗人iggfc抗体(fab110p-100,r&dsystems)在facs缓冲液中染色20分钟,最后用facs缓冲液洗涤三次后进行facs分析。用facs-calibur装置对染色和洗涤后的jurkat细胞进行流式细胞术分析。用cellquest软件获取流式细胞术数据(bdbiosciences,mountainview,ca)。用flowjo软件(treestar,sancarlos,ca)分析所有流式细胞术数据。如图3所示,抗cd28ch2ch3抗体和抗cd3ch2ch3抗体两者对jurkat细胞都具有强结合活性。
抗cd28/cd3单体单链双特异性抗体的功能鉴定
本发明通过对jurkat细胞的流式细胞术来鉴定抗cd28/cd3单体单链双特异性抗体与cd3抗原的结合特异性。先用2μg抗cd28ch2ch3抗体在facs缓冲液中封闭jurkat细胞上的cd28抗原30分钟,用facs缓冲液洗涤两次,用50μl抗cd28/cd3单体单链双特异性抗体染色jurkat细胞20分钟,用facs缓冲液洗涤jurkat细胞两次,然后用抗myc亲和标签的抗体(r&dsystem,cat#ic3696p)染色jurkat细胞20分钟,用facs缓冲液洗涤jurkat细胞三次,最后进行facs分析。用facs-calibur装置对染色和洗涤后的jurkat细胞进行流式细胞术分析。用cellquest软件获取流式细胞术数据(bdbiosciences,mountainview,ca)。用flowjo软件(treestar,sancarlos,ca)分析所有流式细胞术数据。如图4a所示,抗cd28/cd3单体单链双特异性抗体对cd3抗原具有特异性结合的活性。
本发明通过对jurkat细胞的流式细胞术来鉴定抗cd28/cd3单体单链双特异性抗体与cd28抗原的结合特异性。先用2μg抗cd3ch2ch3抗体在facs缓冲液中封闭jurkat细胞上的cd3抗原30分钟,facs缓冲液洗涤两次后,再用50μl抗cd28/cd3单体单链双特异性抗体染色jurkat细胞20分钟,用facs缓冲液洗涤jurkat细胞两次,然后用抗myc亲和标签的抗体(r&dsystem,cat#ic3696p)染色jurkat细胞20分钟,用facs缓冲液洗涤jurkat细胞三次,最后进行facs分析。用facs-calibur装置对染色和洗涤后的jurkat细胞进行流式细胞术分析。用cellquest软件获取流式细胞术数据(bdbiosciences,mountainview,ca)。用flowjo软件(treestar,sancarlos,ca)分析所有流式细胞术数据。如图4b所示,抗cd28/cd3单体单链双特异性抗体对cd28抗原具有特异性结合的活性。图4a和图4b证明抗cd28/cd3单体单链双特异性与cd28抗原和cd3抗原都能够结合,抗cd28/cd3单体单链抗体是能够结合俩种抗原的双特异性抗体。
使用抗cd28/cd3单体单链双特异性抗体激活和扩增t细胞
用ficoll(gehealthcarelifesciences)梯度离心的方法从健康人捐献的血中分离外周血t细胞。将分离的2x10e6t细胞与200ul抗cd28/cd3单体单链双特异性抗体上清液一起温育15分钟,用pbs洗涤两次,然后在rpmi1640培养液中(10%人血清,1%penstrep,300个国际单位il-2)培养3天。cd25是t细胞被激活的一种标记(shipkovam,2012)。本发明中的t细胞激活状态就是通过cd25的表达来检测。用抗cd25抗原的抗体(bdbiosciences,cat#555431)染色t细胞20分钟,用facs缓冲液洗涤t细胞三次,最后进行facs分析。用facs-calibur装置对染色和洗涤后的t细胞进行流式细胞术分析。用cellquest软件获取流式细胞术数据(bdbiosciences,mountainview,ca)。用flowjo软件(treestar,sancarlos,ca)分析所有流式细胞术数据。如图5所示,依据cd25表达状态,87.1%的t细胞被抗cd28/cd3单体单链双特异性抗体激活。
将分离的7x10e6t细胞与2ml抗cd28/cd3单体单链双特异性抗体上清液一起温育15分钟,用pbs洗涤两次,然后在rpmi1640培养液中(10%人血清,1%penstrep,300个国际单位il-2)培养16天。如图6所示,抗cd28/cd3单体单链双特异性抗体可以有效地扩增t细胞。
抗cd28/cd3单体单链双特异性抗体激活的t细胞可以有效地被慢病毒转导
将分离的2x10e6t细胞与200ul抗cd28/cd3单体单链双特异性抗体上清液一起温育15分钟,用pbs洗涤两次,然后在rpmi1640培养液中(10%人血清,1%penstrep,300个国际单位il-2)培养3天,再用不同量的rfp慢病毒(cat#plv-rp,biosettia,ca)转导被抗cd28/cd3单体单链双特异性抗体激活的t细胞。如图7所示,20ul未纯化的rfp慢病毒上清液即可有效地转导经抗cd28/cd3单体单链双特异性抗体激活的t细胞,这证明经抗cd28/cd3单体单链双特异性抗体激活的t细胞对慢病毒是高度可转导的。
t细胞细胞毒性测定
将分离的2x10e6t细胞与200ul抗cd28/cd3单体单链双特异性抗体上清液一起温育15分钟,用pbs洗涤两次,然后在rpmi1640培养液中(10%人血清,1%penstrep,300国际单位的il-2)培养16天。扩增后的2x10e7t细胞与500ng抗egfr/cd3双特异性抗体(cat#bite-l013,creativebiolabsinc)温育15分钟,用pbs洗涤两次,再与1x10e7hek293细胞(egfr阳性细胞)共培养4小时,然后移至显微镜下观察t细胞针对hek293细胞的毒性。结果如图8所示,抗cd28/cd3单体单链双特异性抗体扩增的t细胞,携带抗egfr/cd3双特异性抗体时,能够发挥细胞毒作用。在这个实验中,未加抗egfr/cd3双特异性抗体的t细胞被用作阴性实验对照。
- 还没有人留言评论。精彩留言会获得点赞!