一种提高病毒转染移植静脉组织效率的组合物及其转染方法与应用与流程
本发明属于基因工程技术领域,具体涉及一种提高病毒转染移植静脉组织效率的组合物及其转染方法与应用。
技术背景
随着人民生活水平的提高、饮食结构变化和人口老龄化的出现,冠状动脉硬化和周围动脉粥样硬化闭塞症已成为中老年人的常见病,严重者可危及生命或截肢致残,现已成为我国乃至全世界的主要致死原因。冠状动脉搭桥术(cabg)是目前治疗冠心病的最常用和最有效的办法之一。cabg术,俗称“冠脉搭桥心脏术”,是取病人本身的血管或者血管替代品将狭窄冠状动脉的远端和主动脉连接起来,让血液饶过狭窄的部分到达缺血的部位,改善心肌血液供应以缓解心绞痛症状,提高心功能,从而提高生活质量延长寿命。但移植静脉再狭窄是cabg术后最常见和最严重的问题,使cabg术后远期通畅率仅为40%~60%。目前,移植静脉再狭窄已成为困扰世界范围内血管外科的难题之一,常用的防止和治疗方法有以下几种:
1、口服及静脉用药。该方法已在许多专利中记载,如专利cn101969978公开一种预防或治疗再狭窄的口服药物,专利cn107485683a提供了防治心脏术后并发症的中西药复方颗粒剂等。目前搭桥术后病人口服阿司匹林和替格瑞洛双抗凝可以有效的提高搭桥术后通畅率,但移植静脉再狭窄的发生率依然高达10%以上,且无法对再狭窄的病因进行针对性治疗。对于血管条件较差或术中行冠脉内膜剥脱的病人,术后可以静脉注射肝素抑制桥血管内血栓形成,但术后静脉应用肝素只能抑制围术期血栓形成而无法抑制远期桥血管粥样硬化,且易导致术后出血性并发症。
2、改良扩张液。隐静脉离取后的扩张已经成为cabg术中的一项常规操作,目前常用的大隐静脉扩张液多为简单的肝素生理盐水,仅有简单的扩张作用。改良扩张液为gv扩张液,其主要的成分是三硝酸甘油和维拉帕米。该扩张液能更好的保护血管内皮细胞的功能,明显减少单位面积死亡的数量,从而在一定程度上提高静脉桥的远期通畅率,但同样gv扩张液的作用原理使其保护效果局限于术后短期,且扩张液无法避免使用者注射量过大引起的机械扩张损伤。
3、基因治疗。基因治疗是指将目的基因导入到病毒内制成复合体,再通过病毒将目的基因准确地转染至移植静脉组织内,使其有效表达,从而达到防治或减轻再狭窄的目的。随着人类基因图谱的揭示,基因治疗cabg术后移植静脉再狭窄成了一个炙手可热的话题,其优势在于可以在cabg术中从大隐静脉采集完成到开始移植吻合的窗口期内(约40-60分钟)只针对移植静脉血管进行局部基因治疗,而不会干扰其他器官以及整个循环系统。如专利cn106367417公开了一种特异性靶向孤儿核受体nur77基因(孤儿核受体nur77与血管再狭窄相关,可以以nur77基因作为标靶)的sirna分子,其可以阻断nur77基因的mrna转录,阻止基因的翻译,从而根本上抑制nur77的表达,最终达到抑制发生血管再狭窄的目的。
但基因治疗关键的环节之一就是如何高效率地将外源基因转染移植静脉组织内并使其稳定表达。虽然根据不同血清型aav对各组织器官细胞的亲和性不同,已有报道在心肌、肝脏、肺脏、眼、脑、肌肉等组织的有效转染,但目前尚缺乏在血管组织中高效转染的方法。尤其是血管组织的特殊性,不便于仿效其他组织所用的局部注射法转染,并且,因血管外膜结缔组织的屏障作用,使转病毒染效率大大降低,达不到足够的治疗效果。因此,如何将携带有目的基因的病毒表达载体高效、安全的转染移植静脉组织仍是移植静脉再狭窄基因治疗中一个尚未解决的重要技术难题。
技术实现要素:
为了解决上述技术问题,本发明提供了一种提高病毒转染移植静脉组织效率的组合物,该组合物包括温度敏感型原位凝胶。温度敏感型原位凝胶是依据温度变化而发生相转变的一种原位凝胶,具有低临界溶液温度(lcst),低温时可形成足够多的氢键而呈现自由流动的液体状态,随温度的升高,氢键数目减少到某一临界点,导致体系发生相变而形成凝胶。常见的温度敏感型原位凝胶有n-异丙基丙烯酰胺(nipa),木聚糖,乙基羟乙基纤维素(ehec),聚乙二醇/聚乳酸羟乙酸嵌段共聚物(peg/plga),聚氧乙烯/聚氧丙烯嵌段共聚物(peo/ppo)等。在转染移植静脉组织的过程中,包含温度敏感型原位凝胶和目的基因的病毒以凝胶状态包裹在血管组织周围,能够持续释放携带目的基因的病毒,增加术后移植静脉组织与病毒的接触时间,从而提高携带目的基因的病毒转染效率。
优选的,温度敏感型原位凝胶是质量分数大于15%的泊洛沙姆407溶液。泊洛沙姆407,英文名称为poloxamer-407,又称普朗尼可f127,英文名称pluronicf127。它是一种典型的温度敏感型原位凝胶,其相对分子量为9840~14600,包括70%的聚氧乙烯和30%的聚氧丙烯,在水、乙醇、异丙醇等溶剂中易溶。泊洛沙姆407在一定浓度范围内,非牛顿指数与黏度系数随着温度的升高分别呈现递减和递增的趋势,即温度的提高引起触变性的增强、黏度的变大。当泊洛沙姆407的质量分数大于15%时,低温时为自由流动的液体,温度升高时形成凝胶,因此本发明选择该质量分数范围内的泊洛沙姆407溶液。
优选的,组合物包括质量分数大于15%~30%的泊洛沙姆407溶液和胰蛋白酶。泊洛沙姆407的流变学性质与浓度有密切关系,当质量分数大于30%时,泊洛沙姆407在4℃冰箱中仍形成凝胶。为了使泊洛沙姆407溶液满足室温为液体便于应用、哺乳动物体内呈现凝胶便于持续释放携带目的基因的病毒的需求,因此选择质量分数在15%~30%之间的泊洛沙姆407溶液。并且,移植静脉组织中血管外膜组织致密,影响携带目的基因的病毒通过血管外膜到达血管组织内部,而胰蛋白酶可以增加血管的通透性,有利于病毒通过血管外膜进入血管组织,进一步提高携带目的基因的病毒的转染效率。
优选的,泊洛沙姆407溶液的质量分数为15.25%,16.00%,16.69%,18.00%,20.00%和25.00%中的一种或多种。经过大量的实验发现,当泊洛沙姆407溶液的质量分数为15.25%,16.00%,16.69%,18.00%,20.00%和25.00%时,在低于16℃~30℃时呈液体状态,高于35℃时呈凝胶状态。由于哺乳动物的体温均在37℃左右,这些浓度的泊洛沙姆407溶液能够满足哺乳动物体外为液体便于应用、体内呈现凝胶便于持续释放病毒的目的。优选的,胰蛋白酶的质量分数为0.1%~1.5%。经过大量试验不断优化,发现当胰蛋白酶的质量分数为0.1%~1.5%时,能够进一步提高病毒转染移植静脉组织的效率。
优选的,当温度敏感型原位凝胶是质量分数为20.00%的泊洛沙姆407溶液,胰蛋白酶的质量分数为0.1%~1.0%时,不仅能够显著高病毒转染移植静脉组织的效率,而且对移植静脉本身的生物学特性影响小。
优选的,当温度敏感型原位凝胶是质量分数为20.00%的泊洛沙姆407溶液,胰蛋白酶的质量分数为0.25%,不仅能够显著高病毒转染移植静脉组织的效率,而且基本不影响移植静脉本身的生物学特性,是本发明大量实验中得到的最优结果。
进一步的,本发明提到的病毒包括腺病毒、腺相关病毒、反转录病毒或单纯性疱疹病毒中的一种或多种。这些病毒都是作为病毒载体,将目的基因准确地转染至移植静脉组织内,并使其有效表达,从而达到防治或减轻移植静脉再狭窄的目的。
优选的,本发明提到的病毒为腺病毒或腺相关病毒。腺病毒是双链dna病毒,约36kb的一种大分子。经过改造的复制缺陷型腺病毒可以作为基因转移载体,通过受体介导的内吞作用进入细胞,其基因组被转移到细胞核中,保持在染色体内,而不整合到宿主细胞的基因组中。重组腺病毒作为基因转移载体具有多种优点,如病毒载体容量较大,不整合到染色体;与人类基因同源,具有非致病性,对宿主免疫原性弱;能转染分裂和非分裂细胞;能够长期稳定表达目的基因;导入基因效率高;对人体安全等。因而,腺病毒载体也经常用来作为携带目的基因的载体。腺相关病毒(aav)本身并不造成病症,安全性高,被广泛地应基础研究和临床试验中,已成为世界上最常用的基因治疗载体之一。因此,腺病毒和腺相关病毒是本发明优选的携带目的基因的病毒载体。
本发明还提供了一种提高病毒转染移植静脉组织效率的组合物的转染方法,包括如下步骤:
(1)采用冷溶法制备温度敏感型原位凝胶水溶液,具体为:在冷pbs溶液中加入温度敏感型原位凝胶搅拌均匀,将其放入冰箱中保存使其完全溶解,得到温度敏感型原位凝胶水溶液;
(2)在温度敏感型原位凝胶水溶液中分别加入携带目的基因的病毒液、转染液和胰蛋白酶,得到混合凝胶溶液;
(3)取下颈外静脉,应用微量注射器将病毒转染液注入移植静脉使其轻微扩张,再将其浸泡在携带目的基因的病毒液中,接着,采用血管端-端吻合术将移植静脉移植至颈动脉后,用生理盐水将吻合口周围冲洗干净,并用无菌纱布沾拭干血管吻合口周围,最后将混合凝胶溶液涂抹在移植静脉的血管外膜和吻合口周围,得到病毒转染效率提高的移植静脉组织。
优选的,上述步骤(3)中,用移液枪将混合凝胶溶液喷射涂抹在移植静脉的血管外膜和吻合口周围,尤其是吻合口周围。
经过大量的实验证明,本发明提供的组合物能够应用于移植静脉再狭窄局部基因治疗中,提高携带目的基因的病毒转染移植静脉组织的效率,完全可以达到移植静脉再狭窄基因治疗所要求的转染效率,并且,该组合物能够显著提高携带目的基因的腺相关病毒6血清型转染移植静脉血管组织的效率。
本发明的有益效果为:
1、本发明提供了一种提高病毒转染移植静脉组织效率的组合物,该组合物包括温度敏感型原位凝胶,低温时为自由流动的液体,温度升高时形成凝胶。包含温度敏感型原位凝胶和目的基因的病毒以凝胶状态包裹在血管组织周围,能够持续释放携带目的基因的病毒,增加术后血管组织与病毒的接触时间,从而提高携带目的基因的病毒的转染效率。
2、本发明提供了一种提高病毒转染移植静脉组织效率的组合物,该组合物中还包括胰蛋白酶。移植静脉组织中血管外膜组织致密,携带目的基因的病毒通过血管外膜难以到达血管组织内部,而胰蛋白酶可以增加血管的通透性,有利于病毒载体通过血管外膜进入血管组织,进一步提高病毒转染效率。
3、本发明经过大量的研究表明,当温度敏感型原位凝胶是质量分数为20.00%的泊洛沙姆407溶液,胰蛋白酶的质量分数为0.1%~1.0%时,不仅能够满足哺乳动物(恒温37℃)体外为液体便于应用、体内呈现凝胶便于持续释放病毒的需求,而且对移植静脉的生物学特性影响小。尤其是当温度敏感型原位凝胶是质量分数为20.00%的泊洛沙姆407溶液,胰蛋白酶的质量分数为0.25%,不仅能够显著高病毒转染移植静脉组织的效率,而且基本不影响移植静脉本身的生物学特性。
4、本发明还提供了一种提高病毒转染移植静脉组织效率的组合物转染方法,该方法简单、稳定、高效、便于操作。
5、本发明提供的组合物在移植静脉再狭窄局部基因治疗中,能够显著提高携带目的基因病毒转染移植静脉组织的效率,将转染效率提高至75%~85%,完全可满足移植静脉再狭窄基因治疗所要求的转染效率,并且,该组合物能够显著提高携带目的基因病毒的腺相关病毒6血清型转染移植静脉血管组织的效率。
下面结合附图及实施例对本发明作进一步描述。
附图说明
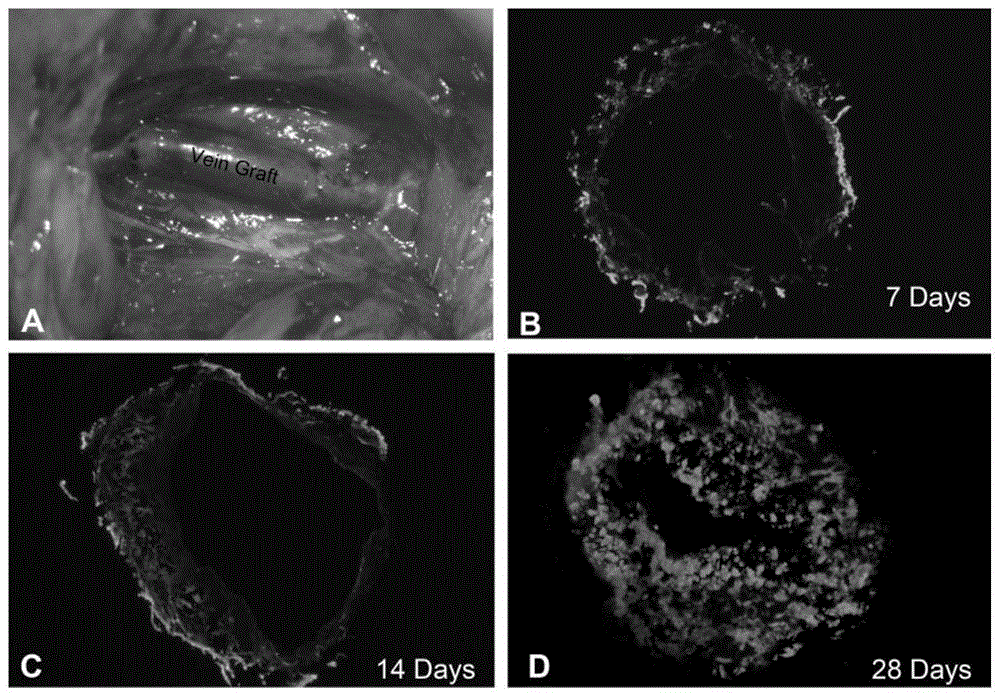
图1是桥静脉移植吻合手术(a)和术后不同时间点行冰冻切片检测egfp表达的免疫荧光(×100倍)显微镜图。
图2是ad-egfp转染移植静脉后行免疫组化检测egfp蛋白表达柱状图,*p<0.05:与对照组相比(a组与对照组相比,7d、14d、28d分别为p=0.023,p=0.011,p=0.014;b组与对照组相比,7d、14d、28d分别为p=0.024,p=0.015,p=0.011;c组与对照组相比,7d、14d、28d分别为p=0.011,p=0.003,p=0.001)。
图3是qrt-pcr检测桥静脉移植术后不同时间点不同实验组织中移植静脉egfp的表达柱状图,*p<0.05:与对照组相比(a组与对照组相比,7d、14d、28d分别为p=0.030,p=0.021,p=0.004;b组与对照组相比,7d、14d、28d分别为p=0.026,p=0.010,p=0.002;c组与对照组相比,7d、14d、28d分别为p=0.013,p=0.003,p=0.001)。
图4是检测桥静脉移植术后不同时间点不同实验组织中移植静脉抗拉力柱状图,*p=0.018:与对照组相比。
图5是腺相关病毒aav不同血清型(1、6、9)转染移植静脉移植21d行冰冻切片荧光显微镜观察egfp表达的免疫荧光(×200倍)显微镜图。
具体实施方式
以下通过特定的具体实施说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。
实验材料及检测分析方法
(1)实验材料
清洁级sd雌性大鼠,体重(250±50)g;
泊洛沙姆407(basf,germany);
胰蛋白酶(gibco公司);
转染液(qiagen,valencia,ca)
egfp抗体(abcam公司);
免疫组化试剂盒(roche公司);
qrt-pcr试剂盒(takara公司);
egfp引物由深圳华大基因公司合成;
重组腺病毒egfp表达载体(recombinantadenovirusencodingthereportergeneegfp,ad-egfp)由香港中文大学生物医学研究院冯波教授课题组提供;
重组腺相关病毒egfp表达载体(recombinantadenovirusencodingthereportergeneegfp,aav-egfp)1,6,9三种血清型由上海吉凯基因化学技术有限公司提供;
10/0、11/0polypropylene缝线(ethilon;ethiconinc.,somerville,nj);
体式动物手术显微镜(olympussz61);
显微外科手术器械(worldprecisioninstruments,usa);
冰冻切片机(cm305s,leica公司);
荧光显微镜(olympus公司)。
(2)实验前处理
根据本领域公知的实验手册和操作方法,将ad-egfp和aav-egfp1,6,9三种血清型经扩增和纯化后,获得滴度均为4×1011pfu/ml的ad-egfp和aav-egfp(aav1血清型、aav6血清型和aav9血清型)病毒液。
(3)检测分析方法
3.1冰冻切片荧光显微镜评估转染效率
采集移植静脉标本后,4℃预冷的pbs液冲洗干净,立即用包埋剂中低温成形,冰冻切片机连续切片(厚度8μm),倒置荧光显微镜下观察egfp荧光蛋白的表达情况,计数转染效率。每组每个时间点取随机挑取4张切片,每张切片在400倍放大倍数下随机挑取5个视野,转染效率为egfp阳性细胞数/总细胞数×100%,最后取平均值。
3.2免疫组化检测egfp蛋白的表达
采集移植静脉标本后,将标本用4%多聚甲醛固定后,常规脱水、透明、浸蜡、包埋、制成蜡块,连续切片(8μm)后行he和免疫组化染色(egfp抗体稀释1:500),在高倍镜下随机计数5个视野,以细胞内出现棕黄色颗粒为阳性,计数阳性细胞率。
3.3qrt-pcr测定egfp表达水平
组织匀浆,trizol法提取总rna并逆转录成cdna,反应程序为:25℃,30min;42℃,30min;85℃,5min;4℃保存。采用abi7900htrt-pcr仪进行pcr,反应体系共20ul,包括:sybrmix10μl,上下游引物各0.4μl,roxreferencedye0.4μl,cdna2μl。反应体系为:95℃预变性30sec,95℃5sec,60℃30sec,40个循环。egfp引物:f:;r:内参gapdh引物:f:5’-acagcaacagggtggtggac-3’,r:5’-tttgagggtgcagcgaactt-3’。扩增后应用sds2.3软件对结果进行分析,采用△△ct法计算egfpmrna的相对含量。
3.4移植静脉抗拉强度检测
用小型英斯特朗测试仪,加载力度为0.015n/s,在室温,生理盐水湿润的条件下,测定个组织样本的最大负荷。
3.5统计学方法
计量资料以均数±标准差表示,采用spss17.0统计学软件进行数据分析,组内比较采用方差分析,组间比较采用t检验和相关分析,以p<0.05为差异有显著性。
实施例1
1、移植静脉再狭窄动物模型构建
大鼠移植静脉再狭窄模型建立的方法采用本领域公知的血管端-端吻合术,即将自体颈外静脉移植至同侧颈总动脉,其操作步骤如下:sd大鼠10%水合氯醛水溶液(0.3ml/100g)腹腔注射麻醉。取颈前正中切口,显露右颈总静脉和颈外静脉。全身肝素化(150u/kg,皮下注射)后,仔细分离两端结后切断颈外静脉1-2cm。立即用4500u/l肝素生理盐水液冲洗干净。于正中切口继续向右侧钝性分离颌下腺及胸锁乳突肌、胸骨舌骨肌,显露颈动脉鞘,游离颈总动脉约3.0cm。修剪去除干净颈动脉断端处的血管外膜,用11-0polypropylene缝线间断端端吻合动静脉,先近心端,后远心端。开放两端血管夹,排气并检查吻合口,少量渗血,可用脂肪组织垫或纱布轻压止血,出血较多时,需加缝一针。吻合完毕,移植静脉充盈并随心律而博动,颈动脉远端博动良好,吻合口无出血、渗血,生理盐反复水冲洗伤口,缝合切口。
2、实验分组
36只sd雌性大鼠每组9只随机分为4组,每组提高病毒转染移植静脉组织效率的组合物不同,具体如下:
(1)对照组(control):组合物由ad-egfp病毒液和0.9%的nacl溶液组成;
(2)a组:组合物由ad-egfp病毒液、质量分数为20%泊洛沙姆407溶液和质量分数为0.1%的胰蛋白酶组成。
(3)b组:组合物由ad-egfp病毒液、质量分数为20%泊洛沙姆407溶液和质量分数为0.25%的胰蛋白酶组成。
(4)c组:组合物由ad-egfp病毒液、质量分数为20%泊洛沙姆407溶液和质量分数为1%的胰蛋白酶组成。
3、组合物转染移植静脉组织的方法
具体包括如下步骤:
(1)采用冷溶法制备泊洛沙姆407凝胶,具体为:在冷pbs溶液中加入泊洛沙姆407搅拌均匀,将其放入4℃冰箱中保存12h使其完全溶解,得到质量分数为20%的泊洛沙姆407水溶液;
(2)根据上述对照组、a组、b组和c组组合物的不同,在泊洛沙姆407水溶液中分别加入质量分数为1%的转染液、200ul的ad-egfp病毒液和不同浓度的胰蛋白酶,得到混合凝胶溶液;
(3)取下颈外静脉,应用微量注射器将转染液注入移植静脉使其轻微扩张,再将其浸泡在ad-egfp病毒液中,接着,采用血管端-端吻合术将移植静脉移植至颈动脉后,用生理盐水将吻合口周围冲洗干净,并用无菌纱布沾拭干血管吻合口周围,最后将混合凝胶溶液用移液器喷射涂抹在移植静脉的血管外膜和吻合口周围,尤其是吻合口周围是主要涂抹位置,得到病毒转染效率提高的移植静脉。
4、移植静脉标本的采集
大鼠分别在术后第7d、14d、28d应用过量麻醉法分批处死,处死后迅速取出移植静脉,用4℃预冷的pbs液冲洗干净,按照不同实验组分别存入液氮和4%多聚甲醛固定。
5、实验结果
手术过程中无大鼠死亡,均顺利完成静脉移植手术,吻合成功后观察各吻合口均通畅,无出血、狭窄及血管扭曲等情况,如图1a所示。分别在术后7d、14d、28d取材观察,移植静脉均通畅,无坏死和血栓形成等,如图1b、1c和1d。并且,如图1b,ad-gfp转染移植静脉后7d荧光显微镜下即可观察到明显的egfp表达所产生的绿色荧光;如图1c,14d时表达更为显著,静脉血管各层组织中荧光表达的强度不等,主要集中在外面和中膜,少部分集中在内膜。如图1d,28d达高峰,荧光强度显著,移植静脉全层组织都表达绿色荧光。
he染色结果显示,如图2a,正常大鼠颈外静脉血管壁薄,内膜仅为单层内皮细胞,无增生内膜,术后7d即可见移植血管内膜开始出现增生,14d可见明显增生,随着内膜增生逐渐加重,至28d时管壁逐渐加厚出现明显的狭窄,并伴有细胞基质的沉积,胶原增多及炎症细胞浸润等。如图2b所示:免疫组化染色显示egfp蛋白在移植静脉组织中均表达,且添加泊洛沙姆407和胰蛋白酶混合凝胶的a、b和c三组在术后7d、14d和28d均高于对照组,差异具有统计学意义(p<0.05);c组移植静脉中egfp蛋白的表达量在术后14d和28d略高于a、b组,差异具有统计学意义(p<0.05)。这表明是泊洛沙姆407和胰蛋白酶混合凝胶溶液提高了ad-egfp病毒转染移植静脉组织效率,而不是实验中的偶然因素造成的。
qrt-pcr定量检测结果如图3所示,对照组中仅有少量的egfpmrna的表达,而添加泊洛沙姆407和胰蛋白酶混合凝胶的a、b和c三组在术后7d、14d和28d均显著高于对照组,差异具有统计学意义(p<0.05);c组移植静脉中egfp蛋白的表达量在术后14d和28d略高于a、b组差异具有统计学意义(p<0.05)。这进一步验证了泊洛沙姆407和胰蛋白酶混合凝胶溶液提高了ad-egfp病毒转染移植静脉组织效率。
为了评估泊洛沙姆407和胰蛋白酶混合凝胶是否影响移植静脉本身的生物学特性,对不同实验组的移植静脉标本行抗拉强度检测,结果如图4所示。添加泊洛沙姆407和胰蛋白酶混合凝胶的a、b和c三组对移植静脉的血管抗拉强度稍有影响。其中,含质量分数1%胰蛋白酶的c组较对照组移植静脉抗拉强度显著减弱,差异具有统计学意义(p<0.05);但含0.1%胰蛋白酶浓度的a组和0.25%浓度的b组与对照组相比其抗拉强度在术后7d的减少并无统计学差异(p>0.05),其余时间点,实验组间及其与对照组间差异均无统计学意义(p>0.05)。因此,a组和b组不仅能够显著高病毒转染移植静脉组织的效率,而且对移植静脉本身的生物学特性影响较小,特别是b组基本不影响移植静脉本身的生物学特性。
本实施例提供了一种提高病毒转染移植静脉组织效率的组合物,该组合物包括温度敏感型原位凝胶泊洛沙姆407,低温时为自由流动的液体,温度升高时形成凝胶。在转染移植静脉组织的过程中,包含泊洛沙姆407的ad-egfp病毒以凝胶状态包裹在血管组织周围,能够持续释放ad-egfp病毒,增加术后血管组织与病毒的接触时间,从而提高ad-egfp病毒的转染效率。移植静脉组织中血管外膜组织致密,携带ad-egfp病毒通过血管外膜难以到达血管组织内部,而胰蛋白酶可以增加血管的通透性,有利于ad-egfp病毒通过血管外膜进入血管组织,进一步提高转染效率。
本实施例实验证明,当温度敏感型原位凝胶是质量分数为20.00%的泊洛沙姆407溶液,胰蛋白酶的质量分数为0.1%~1.0%时,不仅能够显著高病毒转染移植静脉组织的效率,而且对移植静脉本身的生物学特性影响小。尤其是当温度敏感型原位凝胶是质量分数为20.00%的泊洛沙姆407溶液,胰蛋白酶的质量分数为0.25%时,不仅能够显著高病毒转染移植静脉组织的效率,而且基本不影响移植静脉本身的生物学特性。
本实施例还提供了一种提高病毒转染移植静脉组织效率的组合物转染方法,该方法简单、稳定、高效、便于操作。
因此,本实施例提供的组合物能够应用于移植静脉再狭窄局部基因治疗中,显著提高病毒转染移植静脉组织的效率,完全可满足移植静脉再狭窄基因治疗所要求的转染效率。
作为实施例1的变形,泊洛沙姆407溶液的质量分数可由15.25%、16.00%、16.69%、18.00%或25.00%代替实施例1中的20.00%,除该参数外,其他试验方法和操作过程同实施例1,最终依旧能得到结论:泊洛沙姆407和胰蛋白酶混合凝胶溶液提高了ad-egfp病毒转染移植静脉组织效率。
同样的,作为实施例1的变形,当泊洛沙姆407溶液的质量分数在15%~30%的其他参数时(除去15.25%、16.00%、16.69%、18.00%、20.00%、25.00%)代替实施例1中的20.00%,除该参数外,其他试验方法和操作过程同实施例1,最终依旧能得到结论:泊洛沙姆407和胰蛋白酶混合凝胶溶液提高了ad-egfp病毒转染移植静脉组织效率。
并且,本发明中还采用了和泊洛沙姆407性质相似的其他温度敏感型原位凝胶,如n-异丙基丙烯酰胺(nipa),木聚糖,乙基羟乙基纤维素(ehec),聚乙二醇/聚乳酸羟乙酸嵌段共聚物(peg/plga),聚氧乙烯/聚氧丙烯嵌段共聚物(peo/ppo),用这些物质代替实施例1中的质量分数为的20.00%泊洛沙姆407和胰蛋白酶,除该参数外,其他试验方法和操作过程同实施例1,最终依旧能得到结论:温度敏感型原位凝胶提高了ad-egfp病毒转染移植静脉组织效率。
实施例2
1、移植静脉再狭窄动物模型构建
大鼠移植静脉再狭窄模型建立的方法采用本领域公知的血管端-端吻合术,即将自体颈外静脉移植至同侧颈总动脉,其操作步骤如下:sd大鼠10%水合氯醛水溶液(0.3ml/100g)腹腔注射麻醉。取颈前正中切口,显露右颈总静脉和颈外静脉。全身肝素化(150u/kg,皮下注射)后,仔细分离两端结后切断颈外静脉1-2cm。立即用4500u/l肝素生理盐水液冲洗干净。于正中切口继续向右侧钝性分离颌下腺及胸锁乳突肌、胸骨舌骨肌,显露颈动脉鞘,游离颈总动脉约3.0cm。修剪去除干净颈动脉断端处的血管外膜,用11-0polypropylene缝线间断端端吻合动静脉,先近心端,后远心端。开放两端血管夹,排气并检查吻合口,少量渗血,可用脂肪组织垫或纱布轻压止血,出血较多时,需加缝一针。吻合完毕,移植静脉充盈并随心律而博动,颈动脉远端博动良好,吻合口无出血、渗血,生理盐反复水冲洗伤口,缝合切口。
2、实验分组
12只sd雌性大鼠每组4只随机分为3组,提高病毒转染移植静脉组织效率的组合物由aav-egfp病毒液、质量分数为20%泊洛沙姆407溶液和质量分数为0.25%的胰蛋白酶组成。采用不同血清型aav,具体如下:
(1)aav1血清型;
(2)aav6血清型;
(3)aav9血清型。
3、组合物转染移植静脉组织的方法
具体包括如下步骤:
(1)采用冷溶法制备泊洛沙姆407凝胶,具体为:在冷pbs溶液中加入泊洛沙姆407搅拌均匀,将其放入4℃冰箱中保存12h使其完全溶解,得到质量分数为20%的泊洛沙姆407水溶液;
(2)根据上述实验分组的不同,在泊洛沙姆407水溶液中分别加入质量分数为1%的转染液、质量分数为0.25%的胰蛋白酶和不同血清型aav-egfp病毒液,得到混合凝胶溶液;
(3)取下颈外静脉,应用微量注射器将转染液注入移植静脉使其轻微扩张,再将其浸泡在不同血清型aav-egfp病毒液中,接着,采用血管端-端吻合术将移植静脉移植至颈动脉后,用生理盐水将吻合口周围冲洗干净,并用无菌纱布沾拭干血管吻合口周围,最后将混合凝胶溶液用移液器喷射涂抹在移植静脉的血管外膜和吻合口周围,尤其是吻合口周围是主要涂抹位置,得到病毒转染效率提高的移植静脉。
4、移植静脉标本的采集和实验分析
大鼠分别在术后第21d应用过量麻醉法分批处死,处死后迅速取出移植静脉,用4℃预冷的pbs液冲洗干净,按照不同实验组分别存入液氮和4%多聚甲醛固定,冰冻切片荧光显微镜观察荧光强度。
5、实验结果
如图5所示,aav-egfp病毒转染移植静脉组织21d后,在荧光显微镜下可观察到明显的egfp表达所产生的绿色荧光,荧光强度显著,移植静脉全层组织都表达绿色荧光,且内膜中膜荧光表达强度高于外膜,完全可满足移植静脉再狭窄基因治疗所要求的转染效率,其中aav6血清型转染效率最好,荧光表达强度明显高于aav1和9血清型。因此,本实施例不仅再次验证了泊洛沙姆407和胰蛋白酶混合凝胶能够提高移植静脉血管组织的转染效率,而且筛选出转染血管组织效率最佳的aav血清型,为后续的移植静脉再狭窄基因治疗研究提供了重要的参考资料。
以上所述,仅为本发明的较佳实施例,上述实施例仅示例性说明本发明的原理及其功效,而并非对本发明任何形式上和实质上的限制。应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。凡熟悉本专业的技术人员,在不脱离本发明的精神和范围的情况下,当可利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明得到实质技术对上述实施例所作的任何等同变化的更动、修饰与演变,均仍属于本发明的技术方案的范围内。
- 还没有人留言评论。精彩留言会获得点赞!