一种pH响应型聚合物膜及其制备方法与流程
本发明属于防污技术领域,尤其涉及一种pH响应型聚合物膜及其制备方法。
背景技术:
海洋污损生物附着在海洋设备表面造成设备损坏,影响海洋经济发展。全世界每年因海洋生物污损造成的经济损失达数千亿美元(Biofouling,2011,27,87-98)。海洋生物污损的防治一直是国内外研究的焦点。在众多防污策略中,涂覆海洋防污涂层仍是最简洁、经济和有效的方法(Adv.Funct.Mater.,2013,23,5706-5718)。目前,发展防污性能优异、防污周期持久以及环境友好型的防污体系已成为海洋防污涂层发展的主导方向(Adv.Funct.Mater.2013,23,3307-3314)。
近年来,利用刺激响应型高分子聚合物构造的智能防污体系,可通过感应生物污损部位环境信息的变化,例如微生物附着所导致的微环境pH的降低,从而调节杀生剂的释放,使杀生剂在必要的时间和特定部位释放出所需的有效剂量,实现杀生剂的定点、定时、定量控制释放。
然而,制备防污膜层的高分子材料通常是人工合成高分子,这些高分子的合成步骤繁琐,成本较高,更重要的是这些有机高分子多具有环境毒性,严重限制了其在智能防污涂层领域的应用。相比之下,天然高分子具有环境友好性及生物可降解性,并且能够维持包埋在其中的药物的稳定性,增强防污效果,这些特性使得其很适合作为防污体系的绿色材料。目前,基于天然多糖类高分子壳聚糖、右旋糖酐醛与天然聚多酚单宁酸构建pH响应型聚合物膜层尚未见报道。
技术实现要素:
本发明的目的就在于为了解决上述问题而提供一种pH响应型聚合物膜及其制备方法。
为实现上述目的,本发明采用的技术方案为:
一种pH响应型聚合物膜的制备方法,采用单宁酸、壳聚糖与右旋糖酐醛为原料,通过共价键层层自组装法合成目标产物,即右旋糖苷醛-单宁酸/壳聚糖聚合物膜;其中,单宁酸、壳聚糖和右旋糖酐醛的质量比为0.3-1:0.3-1:1。
进一步的说:
1)将十六烷基三甲基溴化铵溶于去离子水中形成胶束溶液;
2)向上述获得胶束溶液中加入含单宁酸的乙酸水溶液,搅拌均匀后得单宁酸胶囊溶液;而后再加入含壳聚糖的乙酸水溶液,搅拌均匀后即为单宁酸/壳聚糖纳米胶囊溶液;
3)将高碘酸钠溶于去离子水中形成高碘酸钠的水溶液,而后加入葡聚糖搅拌,获得右旋糖酐醛水溶液;
4)将三羟甲基氨基甲烷溶于去离子水中,调节溶液pH值为8-8.5,得三羟甲基氨基甲烷缓冲液;而后再加入盐酸多巴胺混合均匀后形成盐酸多巴胺-三羟甲基氨基甲烷缓冲液;
5)将基体浸泡在上述盐酸多巴胺-三羟甲基氨基甲烷缓冲液中,使基体表面得以修饰形成聚多巴胺修饰的基体;将聚多巴胺修饰的基体加入至步骤3)所得的右旋糖苷醛的水溶液中,沉积处理,而后再将基体浸泡至步骤2)所得单宁酸/壳聚糖纳米胶囊溶液中,而后取出基体,再反复按照此步骤在不同溶液中沉积浸泡,即基体表面沉积形成右旋糖苷醛-单宁酸/壳聚糖聚合物膜。
基体可为玻璃片、聚二甲基硅氧烷片或金属片(铝片、铜片)。
所述步骤1)中十六烷基三甲基溴化铵与水混匀后在40-50℃下搅拌10-15min,待用。
步骤2)含单宁酸的乙酸水溶液中单宁酸的终浓度为1-3mg/mL;其中,乙酸水溶液中乙酸的加入量为1-3μL/mL;
所述含壳聚糖的乙酸水溶液中壳聚糖的终浓度为1-3mg/mL,其中,乙酸水溶液中乙酸的加入量为1-3μL/mL。
所述步骤3)高碘酸钠的水溶液中高碘酸钠的终浓度为32mg/mL,葡聚糖加入量为25mg/mL;
所述高碘酸钠的水溶液中加入葡聚糖,搅拌一夜,而后透析即获得右旋糖酐醛水溶液。
所述步骤4)三羟甲基氨基甲烷溶于去离子水中三羟甲基氨基甲烷的终浓度为12.1mg/mL,盐酸多巴胺加入量为2mg/mL;
所述基体浸入盐酸多巴胺-三羟甲基氨基甲烷缓冲液中,浸泡时间为24h,使其修饰形成聚多巴胺修饰的基体;
所述步骤5)聚多巴胺修饰的基体加入至步骤3)所得的右旋糖苷醛的水溶液中,浸泡时间为15min,沉积处理,而后再将基体浸泡至步骤2)所得单宁酸/壳聚糖纳米胶囊溶液中,浸泡时间为15min,沉积处理,即基体表面沉积形成右旋糖苷醛-单宁酸/壳聚糖聚合物膜。
一种权利要求1所述方法制备的pH响应型聚合物膜,其特征在于:按权利要求1所述方法制备所得pH响应型双分子层的右旋糖苷醛-单宁酸/壳聚糖聚合物膜。
一种pH响应型聚合物膜,按所述方法制备所得pH响应型双分子层的右旋糖苷醛-单宁酸/壳聚糖聚合物膜。
一种pH响应型聚合物膜的应用,所述右旋糖苷醛-单宁酸/壳聚糖聚合物膜作为药物包载体。
所述聚合物膜在pH响应下释放包埋的药物。
所述药物为疏水性广谱杀菌剂的三氯生、百菌清或多菌灵。
所述药物的加入量占胶囊质量的1.03-1.74%。
本发明的有益效果在于:
本发明具有操作方便,制备技术工艺简便和制造成本低廉等优点。本发明所使用的原材料是天然绿色高分子,具有广泛的适用性。本发明制备的聚合物膜,具有pH敏感性,有利于实现杀菌剂的定点、定时、定量控制释放。在海洋污损防护方面具有良好的研究和开发应用前景,因此,该发明技术具有很好的经济开发潜力。
本发明聚合物膜可进一步的包埋广谱杀菌剂,如三氯生,具体使用表面活性剂十六烷基三甲基溴化铵将疏水性三氯生分子包埋进入单宁酸/壳聚糖纳米胶囊中,制备得到载药纳米胶囊,其有效解决了三氯生疏水性的缺陷;将制备的纳米胶囊与右旋糖苷醛通过层层自组装法制备得到载药聚合物膜,该聚合物膜具有高效持久的稳定性,而且可以对pH变化作出响应释放包埋分子,避免了有效成分三氯生流失,提高了三氯生的利用效率。
附图说明
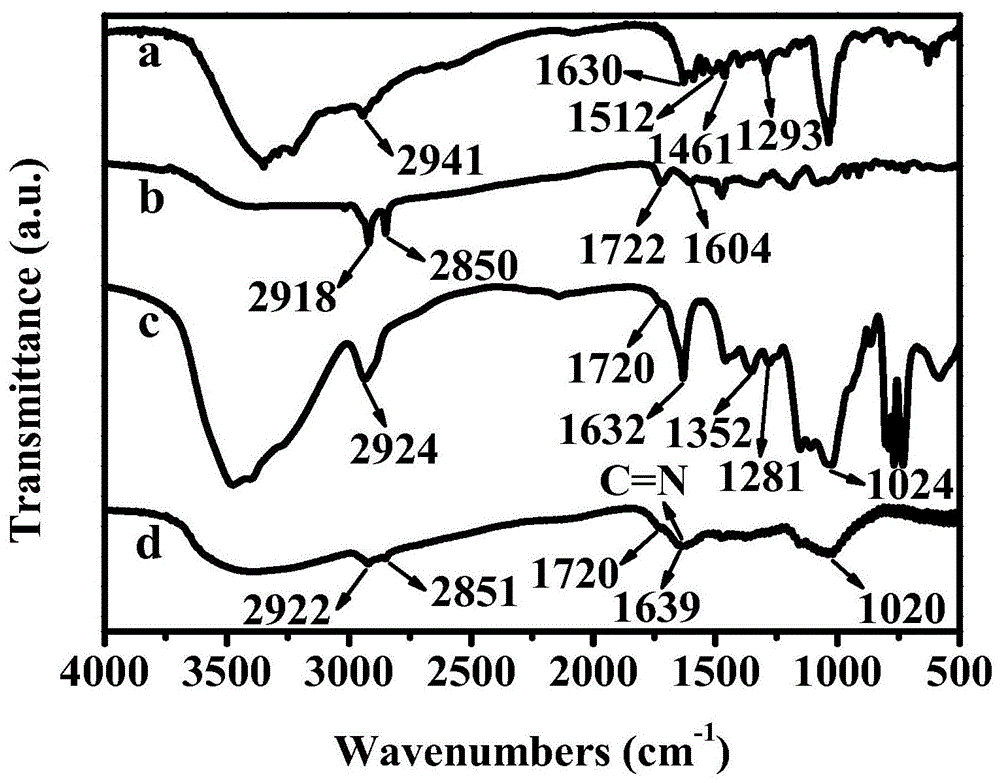
图1为实施例3制备的(a)聚多巴胺,(b)三氯生@单宁酸/壳聚糖纳米胶囊,(c)右旋糖酐醛,(d)右旋糖酐醛-三氯生@单宁酸/壳聚糖聚合物膜的红外光谱(FTIR)谱图;
图2为实施例3制备的三氯生@单宁酸/壳聚糖纳米胶囊的扫描电子显微镜(SEM)照片;
图3为实施例3制备的右旋糖酐醛-三氯生@单宁酸/壳聚糖聚合物膜的SEM截面照片;
图4为实施例3制备的右旋糖酐醛-三氯生@单宁酸/壳聚糖聚合物膜的SEM表面照片;
图5为实施例3制备的右旋糖酐醛-三氯生@单宁酸/壳聚糖聚合物膜在不同pH的PBS缓冲液中三氯生释放曲线。
具体实施方式
下面结合附图对本发明作进一步说明:
实施例1
(1)称取0.15g十六烷基三甲基溴化铵,溶于40mL去离子水中,在水浴50℃下搅拌15min,得到浓度为3.75mg/mL的十六烷基三甲基溴化铵胶束溶液。
(2)称取50mg单宁酸溶于50mL水溶液中(水溶液中含有50μL乙酸),得到浓度为1mg/mL的含单宁酸的乙酸水溶液;同样地,配制浓度为1mg/mL的含壳聚糖的乙酸水溶液。量取5mL含单宁酸的乙酸水溶液加入到5mL十六烷基三甲基溴化铵胶束溶液中,搅拌20min,使得胶束表面包覆囊壁单宁酸;随后,量取5mL含壳聚糖的乙酸水溶液加入到以上溶液中,搅拌20min,使得单宁酸表面再包覆壳聚糖,得到核壳结构的单宁酸/壳聚糖纳米胶囊。
(3)称取3.2g高碘酸钠溶于100mL去离子水,得到浓度为32mg/mL的高碘酸钠的水溶液;称取2.5g葡聚糖加入到以上高碘酸钠水溶液中,避光搅拌一夜,透析除去多余反应物,冷冻干燥后得到右旋糖酐醛。
(4)称取1.21g三羟甲基氨基甲烷溶于100mL去离子水,得到浓度为100mM的三羟甲基氨基甲烷的水溶液,使用盐酸调节溶液pH值为8.5,得到三羟甲基氨基甲烷缓冲液;称取0.2g盐酸多巴胺溶于以上三羟甲基氨基甲烷缓冲液中,得到浓度为2mg/mL的盐酸多巴胺-三羟甲基氨基甲烷缓冲液。
(5)将玻璃片切割成1×2.5cm,分别用丙酮,乙醇,去离子水洗涤,氮气吹干备用;将玻璃片置于盐酸多巴胺-三羟甲基氨基甲烷缓冲液中,避光沉积24h,而后经去离子水洗涤,得到聚多巴胺修饰的玻璃片;再将聚多巴胺修饰的玻璃片浸入到上述浓度1mg/mL为右旋糖苷醛溶液中15min,而后经去离子水洗涤,得到沉积右旋糖苷醛的玻璃片。随后将沉积上右旋糖酐醛的玻璃片再浸入单宁酸/壳聚糖纳米胶囊溶液中15min,而后经去离子水洗涤,得到右旋糖苷醛与单宁酸/壳聚糖纳米胶囊的双分子层膜。重复以上步骤20次,得到右旋糖苷醛-单宁酸/壳聚糖聚合物膜,氮气吹干。
实施例2
(1)称取0.15g十六烷基三甲基溴化铵,溶于40mL去离子水中,在水浴50℃下搅拌15min,得到浓度为3.75mg/mL的十六烷基三甲基溴化铵胶束溶液。
(2)称取150mg单宁酸溶于50mL水溶液中(水溶液中含有150μL乙酸),得到浓度为3mg/mL的含单宁酸的乙酸水溶液;同样地,配制浓度为3mg/mL的含壳聚糖的乙酸水溶液。量取5mL含单宁酸的乙酸水溶液加入到5mL十六烷基三甲基溴化铵胶束溶液中,搅拌20min,使得胶束表面包覆囊壁单宁酸;随后,量取5mL含壳聚糖的乙酸水溶液加入到以上溶液中,搅拌20min,使得单宁酸表面再包覆壳聚糖,得到核壳结构的单宁酸/壳聚糖纳米胶囊。
(3)称取3.2g高碘酸钠溶于100mL去离子水,得到浓度为32mg/mL的高碘酸钠的水溶液;称取2.5g葡聚糖加入到以上高碘酸钠水溶液中,避光搅拌一夜,透析除去多余反应物,冷冻干燥后得到右旋糖酐醛。
(4)称取1.21g三羟甲基氨基甲烷溶于100mL去离子水,得到浓度为100mM的三羟甲基氨基甲烷的水溶液,使用盐酸调节溶液pH值为8.5,得到三羟甲基氨基甲烷缓冲液;称取0.2g盐酸多巴胺溶于以上三羟甲基氨基甲烷缓冲液中,得到浓度为2mg/mL的盐酸多巴胺-三羟甲基氨基甲烷缓冲液。
(5)将玻璃片切割成1×2.5cm,分别用丙酮,乙醇,去离子水洗涤,氮气吹干备用;将玻璃片置于盐酸多巴胺-三羟甲基氨基甲烷缓冲液中,避光沉积24h,而后经去离子水洗涤,得到聚多巴胺修饰的玻璃片;再将聚多巴胺修饰的玻璃片浸入到上述浓度1mg/mL为右旋糖苷醛溶液中15min,而后经去离子水洗涤,得到沉积右旋糖苷醛的玻璃片。随后将沉积上右旋糖酐醛的玻璃片再浸入单宁酸/壳聚糖纳米胶囊溶液中15min,而后经去离子水洗涤,得到右旋糖苷醛与单宁酸/壳聚糖纳米胶囊的双分子层膜。重复以上步骤20次,得到右旋糖苷醛-单宁酸/壳聚糖聚合物膜,氮气吹干。
实施例3
以三氯生为例,制备包埋药物的聚合物膜:
(1)称取0.15g十六烷基三甲基溴化铵,溶于40mL去离子水中,在水浴50℃下搅拌15min,得到浓度为3.75mg/mL的十六烷基三甲基溴化铵胶束溶液。
(2)称取4g三氯生,溶于50mL二氯甲烷中,配制成20mg/mL的母液,取200μL母液加入到40mL十六烷基三甲基溴化铵胶束溶液中,超声60min,搅拌过夜,使二氯甲烷挥发,得到包埋三氯生的十六烷基三甲基溴化铵胶束溶液。
(3)称取50mg单宁酸溶于50mL水溶液中(水溶液中含有50μL乙酸),得到浓度为1mg/mL的含单宁酸的乙酸水溶液;同样地,配制浓度为1mg/mL的含壳聚糖的乙酸水溶液。量取5mL含单宁酸的乙酸水溶液加入到5mL包埋三氯生的十六烷基三甲基溴化铵胶束溶液中,搅拌20min,使得胶束表面包覆囊壁单宁酸;随后,量取5mL含壳聚糖的乙酸水溶液加入到以上溶液中,搅拌20min,使得单宁酸表面再包覆壳聚糖,得到包埋着三氯生的单宁酸/壳聚糖纳米胶囊,记为三氯生@单宁酸/壳聚糖纳米胶囊(参见图1及图2)。
(4)称取3.2g高碘酸钠溶于100mL去离子水,得到浓度为32mg/mL的高碘酸钠的水溶液;称取2.5g葡聚糖加入到以上高碘酸钠水溶液中,避光搅拌一夜,透析除去多余反应物,冷冻干燥后得到右旋糖酐醛。
(5)称取1.21g三羟甲基氨基甲烷溶于100mL去离子水,得到浓度为100mM的三羟甲基氨基甲烷的水溶液,使用盐酸调节溶液pH值为8.5,得到三羟甲基氨基甲烷缓冲液;称取0.2g盐酸多巴胺溶于以上三羟甲基氨基甲烷缓冲液中,得到浓度为2mg/mL的盐酸多巴胺-三羟甲基氨基甲烷缓冲液。
(6)将玻璃片切割成1×2.5cm,分别用丙酮,乙醇,去离子水洗涤,氮气吹干备用;将玻璃片置于盐酸多巴胺-三羟甲基氨基甲烷缓冲液中,避光沉积24h,去离子水洗涤,得到聚多巴胺修饰的玻璃片;将聚多巴胺修饰的玻璃片浸入到浓度1mg/mL为右旋糖苷醛溶液中15min,去离子水洗涤,得到沉积右旋糖苷醛的玻璃片。随后将沉积上右旋糖酐醛的玻璃片浸入三氯生@单宁酸/壳聚糖纳米胶囊溶液中15min,去离子水洗涤,得到右旋糖苷醛与三氯生@单宁酸/壳聚糖纳米胶囊的双分子层膜。重复以上步骤20次,得到右旋糖苷醛-三氯生@单宁酸/壳聚糖聚合物膜(参见图1、图3及图4),氮气吹干。
实施例4
以三氯生为例,制备包埋药物的聚合物膜:
(1)称取0.15g十六烷基三甲基溴化铵,溶于40mL去离子水中,在水浴50℃下搅拌15min,得到浓度为3.75mg/mL的十六烷基三甲基溴化铵胶束溶液。
(2)称取4g三氯生,溶于50mL二氯甲烷中,配制成20mg/mL的母液,取200μL母液加入到40mL十六烷基三甲基溴化铵胶束溶液中,超声60min,搅拌过夜,使二氯甲烷挥发,得到包埋三氯生的十六烷基三甲基溴化铵胶束溶液。
(3)称取150mg单宁酸溶于50mL水溶液中(水溶液中含有150μL乙酸),得到浓度为3mg/mL的含单宁酸的乙酸水溶液;同样地,配制浓度为3mg/mL的含壳聚糖的乙酸水溶液。量取5mL含单宁酸的乙酸水溶液加入到5mL包埋三氯生的十六烷基三甲基溴化铵胶束溶液中,搅拌20min,使得胶束表面包覆囊壁单宁酸;随后,量取5mL含壳聚糖的乙酸水溶液加入到以上溶液中,搅拌20min,使得单宁酸表面再包覆壳聚糖,得到包埋着三氯生的单宁酸/壳聚糖纳米胶囊,记为三氯生@单宁酸/壳聚糖纳米胶囊。
(4)称取3.2g高碘酸钠溶于100mL去离子水,得到浓度为32mg/mL的高碘酸钠的水溶液;称取2.5g葡聚糖加入到以上高碘酸钠水溶液中,避光搅拌一夜,透析除去多余反应物,冷冻干燥后得到右旋糖酐醛。
(5)称取1.21g三羟甲基氨基甲烷溶于100mL去离子水,得到浓度为100mM的三羟甲基氨基甲烷的水溶液,使用盐酸调节溶液pH值为8.5,得到三羟甲基氨基甲烷缓冲液;称取0.2g盐酸多巴胺溶于以上三羟甲基氨基甲烷缓冲液中,得到浓度为2mg/mL的盐酸多巴胺-三羟甲基氨基甲烷缓冲液。
(6)将玻璃片切割成1×2.5cm,分别用丙酮,乙醇,去离子水洗涤,氮气吹干备用;将玻璃片置于盐酸多巴胺-三羟甲基氨基甲烷缓冲液中,避光沉积24h,去离子水洗涤,得到聚多巴胺修饰的玻璃片;将聚多巴胺修饰的玻璃片浸入到浓度1mg/mL为右旋糖苷醛溶液中15min,去离子水洗涤,得到沉积右旋糖苷醛的玻璃片。随后将沉积上右旋糖酐醛的玻璃片浸入三氯生@单宁酸/壳聚糖纳米胶囊溶液中15min,去离子水洗涤,得到右旋糖苷醛与三氯生@单宁酸/壳聚糖纳米胶囊的双分子层膜。重复以上步骤20次,得到右旋糖苷醛-三氯生@单宁酸/壳聚糖聚合物膜,氮气吹干。
对上述获得包埋药物的右旋糖苷醛-三氯生@单宁酸/壳聚糖聚合物膜进行性能测试:
(1)对包埋药物的右旋糖苷醛-三氯生@单宁酸/壳聚糖聚合物膜分别进行FTIR和SEM测试。
由图1(a)聚多巴胺,(b)三氯生@单宁酸/壳聚糖纳米胶囊,(c)右旋糖酐醛,(d)右旋糖酐醛-三氯生@单宁酸/壳聚糖聚合物膜的FTIR谱图可见,对于(a)谱图,在2941cm-1处的吸收峰归因于C–H伸缩振动,在1630cm-1处的吸收峰归因于芳香环的伸缩振动和N–H弯曲振动,在1512和1293cm-1处观察到的吸收峰分别归因于酰胺基的N–H剪切振动与酚的C–O–H伸缩振动,在1461cm-1处的吸收峰归因于吲哚中C=C伸缩振动,该特征峰在(d)的FTIR谱图中也被观察到,表明聚多巴胺沉积在玻璃基板上。对于(b)的FTIR谱图,在2918,2850,1722,1604cm-1处观察到的吸收峰分别归因于十六烷基三甲基溴化铵中–CH2及–CH3的C–H伸缩振动与单宁酸中C=O及C=C–C伸缩振动。(d)的FTIR谱图中C–H伸缩振动吸收峰转移到2922和2851cm-1处,表明三氯生@单宁酸/壳聚糖纳米胶囊沉积在聚合物膜之中。对于(c)的FTIR谱图,在1720和1153cm-1处的吸收峰分别归因于羰基的伸缩振动与C–H伸缩振动。对于(d)的FTIR谱图,在1639cm-1处的吸收峰归因于C=N伸缩振动,这是由于右旋糖苷醛的羰基与纳米胶囊中壳聚糖的氨基发生醛氨缩合反应生成亚胺键所致。此外,在1720和1158cm-1处的弱吸收峰也被观察到,表明右旋糖苷醛被沉积到聚合物膜上。以上结果表明右旋糖苷醛-三氯生@单宁酸/壳聚糖聚合物膜被成功制备。
由图2SEM照片可明显的观察到三氯生@单宁酸/壳聚糖纳米胶囊的形状接近于球形,结构致密、无明显缺陷,平均直径约为500nm;图3SEM截面照片可以测量出右旋糖苷醛-三氯生@单宁酸/壳聚糖聚合物膜厚度为3.91μm;图4SEM形貌照片可以看到三氯生@单宁酸/壳聚糖纳米胶囊分布于聚合物膜表面。
(2)对包埋药物的右旋糖苷醛-三氯生@单宁酸/壳聚糖聚合物膜进行pH响应释放三氯生检测:
缓冲液为PBS缓冲液,使用盐酸和氢氧化钠调节缓冲液pH分别为4、5、6、7、8。实验中,将沉积上右旋糖苷醛-三氯生@单宁酸/壳聚糖聚合物膜的玻璃基板置于10mL不同pH值的PBS缓冲液中,每隔一定的时间移取2mL缓冲液,使用Hitachi U-2900分光光度计在λ=281nm测量吸光度。结合标准曲线,得到释放的三氯生浓度与时间的关系曲线(参见图5)。
结果如图5所示,在24h的释放时间内,右旋糖苷醛-三氯生@单宁酸/壳聚糖聚合物膜在pH=6的PBS缓冲液中释放效率最大,释放的三氯生浓度达到4.01mg/L;在pH=5的PBS缓冲液中释放效率次之,释放的三氯生浓度为3.03mg/L;在pH=4,7,8的PBS缓冲液中释放效率较低,释放的三氯生浓度分别为2.05mg/L,1.82mg/L,1.27mg/L。结果表明右旋糖苷醛-三氯生@单宁酸/壳聚糖聚合物膜在弱酸性条件下释放三氯生效率最高,而在强酸性、中性及弱碱性条件下具有较低的三氯生释放效率。
按照上述实施例记载将三氯生由其他疏水性杀菌剂分子进行替换,即获得厚度约为3.9μm的载药聚合物膜,由于右旋糖苷醛-三氯生@单宁酸/壳聚糖聚合物膜的药物控制释放性能只与亚胺键的pH响应性质有关,即单宁酸/壳聚糖纳米胶囊与右旋糖苷醛是通过亚胺键连接形成的聚合物膜,而亚胺键在pH=5.0-6.5的条件下断裂,导致右旋糖苷醛-三氯生@单宁酸/壳聚糖聚合物膜的破坏,从而使得包埋的药物分子释放。因此,凡能被引入表面活性剂十六烷基三甲基溴化铵疏水端的药物分子,均可被包埋进聚合物膜中,同时药物分子均能实现相同的pH响应释放效果。
以上显示和描述了本发明的基本原理和主要特征及本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!