一种微流控芯片及其设计方法和应用与流程
本发明涉及一种微流控芯片及其设计方法和应用,用于两种细胞中单细胞捕获培养,以及细胞间相互作用的研究。
背景技术:
单个细胞是构成生命体的基本单位,传统的细胞研究总是在一组细胞上进行的。得到的结果往往是一群细胞的平均值,掩盖了个体之间的信息差异,在蛋白质组学的研究中发现同一细胞在不同时期,不同环境中细胞的行为和反应完全不同,在肿瘤细胞和干细胞中,细胞的异质性特点最为显著。微全分析系统又称微流控芯片(microfluidicchip)或芯片实验室(labonachip,loc),是指在一块几平方厘米(甚至更小)的芯片上集成或基本集成化学和生物等领域中所涉及的样品制备、反应、分离、检测以及细胞培养、分选、裂解等基本操作单元,由微通道形成网络,以可控流体贯穿这个系统,用于取代常规化学或生物实验室的各种功能的一种技术平台。利用微流控芯片技术可以实现从单细胞捕获、鉴别和检测的一键式封闭操作,效率高、误差小。因此,微流控芯片技术已经成为单细胞分析的有力工具。
多细胞系统依赖细胞间的相互作用来协调细胞信号和调节细胞功能,理解细胞间的相互作用的机制和过程对于许多生理和病理过程,如胚胎发生、组织再生、干细胞分化、癌症转移等都是至关重要的。不同类种类细胞之间往往存在密切的相互作用,这种相互作用是同型的或异型的,并且取决于细胞间的距离,可通过多种机制发生,例如:直接物理接触、可溶性分泌因子的扩散、电信号传导、细胞周围基质。例如在患病组织中,细胞间的相互作用会受到干扰,这对疾病的发生和发展都有至关重要的作用。又如肿瘤出芽是肿瘤高侵袭性行为一个重要的病理学特征,与肿瘤的复发和转移密切相关。在肿瘤微环境中,血管内皮细胞在受到肿瘤细胞分泌的vegf等因子的作用下向肿瘤内部迁移,从而成为肿瘤的营养供应以及侵袭转移准备了条件。文献chungwoosung.;eumh.m.;leeh.o.;leek.m.;leeh.b.;kimk.t.;ryuh.s.;kims.;leej.e.;parky.h.naturecommunications,2017,8.收集了11个患乳腺癌病人的515个细胞,通过单细胞转录组分析,癌细胞早肿瘤内表现出共同的特征,在乳腺癌亚型和与癌症相关的重要通路上表现出瘤内异质性。
开发单细胞的捕获、操纵以及分析方法研究细胞的异质性,对于研究细胞生长、分化、疾病诊断和监测都具有十分重要的意义。虽然微流控芯片上进行单细胞捕获、培养和分析是一个很好的平台,但是目前尚未有利用微流控技术实现多种细胞两种单细胞的分离捕获和多种细胞单个细胞间相互作用的研究。
技术实现要素:
本发明的目的在于克服现有技术的不足之处,提供了一种微流控芯片及其设计方法和应用,该微流控芯片结构微型化、成本低、适用性高,能够实现单细胞的捕获和培养并研究两种细胞间的相互作用,能够揭示一定的细胞间相互作用机制。解决了上述背景技术中两种单细胞的分离捕获的问题,还解决了多种细胞单个细胞间相互作用的研究问题。
本发明解决其技术问题所采用的技术方案是:为单细胞捕获和研究细胞间相互作用,提供了一种微流控芯片,由聚二甲基硅氧烷片和雕刻有通道的基底键合而成,所述通道包括主通道、捕获单元和窄通道;
所述主通道用于传输细胞和细胞培养基,包括并排设置的第一主通道和第二主通道;所述第一主通道和第二主通道的侧壁上相向且间隔设置有若干捕获单元,所述捕获单元用于单细胞的捕获和培养;所述窄通道用于连通第一主通道的捕获单元和第二主通道对应位置的捕获单元,形成捕获后单细胞间的交流通路并阻止被捕获的单细胞流入对侧主通道。
在本发明一较佳实施例中,所述捕获单元的宽度由主通道向窄通道减小,当一侧细胞进去捕获单元后,窄通道相当于一个阀门。
在本发明一较佳实施例中,所述捕获单元的剖面形状为半椭圆形或三角形。本发明采用一种流体流线与捕获细胞位置关系的方法,通过流线的方向可以引导细胞在捕获单元的位置,从而影响下一次细胞流动的情况。在不改变主通道长度、宽度,间隙处宽度、长度,捕获单元长度、宽度的情况下,改变捕获单元的形状,查看对细胞捕获位置的影响。
在本发明一较佳实施例中,所述主通道的宽度为20~40μm,同一主通道上捕获单元的间隔距离为100~200μm,捕获单元的入口尺寸为20~35μm,窄通道宽度为2~10μm,窄通道长度为5~10μm,所述通道的高度为20~40μm。
在本发明一较佳实施例中,所述主通道宽度为30μm,同一主通道上捕获单元的间隔距离为150μm,捕获单元的入口尺寸为25μm,窄通道宽度为5μm,窄通道长度为6μm,所述通道的高度为25μm。
本发明还提供了上述一种微流控芯片的设计方法,包括如下步骤:
1)利用“流阻最小路径”原则,通道中流体的流动通常在低雷诺系数(re)下发生,对于没有落差和阻碍物的矩形通道层流时,阻力计算公式为
其中,μ为流体的粘度,q为流量,q=v×a,v为流速,a为通道的横截面积,l、w、h分别为通道的长宽高,α是与宽高比有关的无量纲参数,
2)计算压降△p:
对于捕获单元的阻力,近似计算为矩形阻力;
流体经过第一主通道和窄通道的压降,其中p0表示窄通道,p1表示第一主通道
流体经过窄通道和第二主通道的压降,其中p2表示第二主通道
3)由于窄通道的高度大于宽度,将公式④的高度h和宽度w对换,得到如下公式
4)当第一主通道和第二主通道的压降相同时,
q捕获单元=q窄通道⑧;
5)代入数值计算,并根据待捕获的细胞大小设计通道尺寸。
本发明还提供了上述的一种微流控芯片在单细胞捕获中的应用。
在本发明一较佳实施例中,所述应用为两种细胞中单细胞捕获,在第一主通道内进行第一种细胞的单细胞捕获,将捕获的细胞进行培养贴壁后,再进行第二主通道的第二种细胞的单细胞捕获。
本发明采用一种三维建模模拟细胞运动情况的方法:利用comsol软件中的粒子追踪模块,构建细胞模型模拟其在微通道中的流动,并且提出需要将捕获好的一侧细胞进行培养使其贴壁后,才可进行另一侧细胞的捕获。细胞悬浮时,细胞的体积相当于一个微阀,大部分流体从细胞上方流过,相当于窄通道的高度发生了变化,此时
在本发明一较佳实施例中,所述应用为研究细胞间相互作用,在第一主通道和第二主通道均进行单细胞的捕获,细胞产生的细胞因子通过扩散作用进行互相传递,进而实现细胞间相互作用的研究。
在本发明一较佳实施例中,将利用comsol软件中的粒子追踪模块,对微流控芯片进行三维建模模拟细胞运动情况;或利用comsol软件中的稀物质传递模块,模拟微流控芯片捕获的细胞之间的信号传递情况。
本发明的用于单细胞捕获和研究细胞间相互作用的微流控芯片展示了一些显著的优点,包括:制作简单,易于操作,所用材料生物兼容性好,细胞培养条件接近于体内微环境,能够实现较高单细胞捕获效率,并且能进行细胞间信号的传递,为研究细胞间相互作用提供了一种良好的装置。该微流控芯片可用于开展肿瘤出芽机理的研究,为构建体外有效的肿瘤出芽模型提供依据和新的研究思路,为肿瘤的发生发展提供一定的理论支持。
附图说明
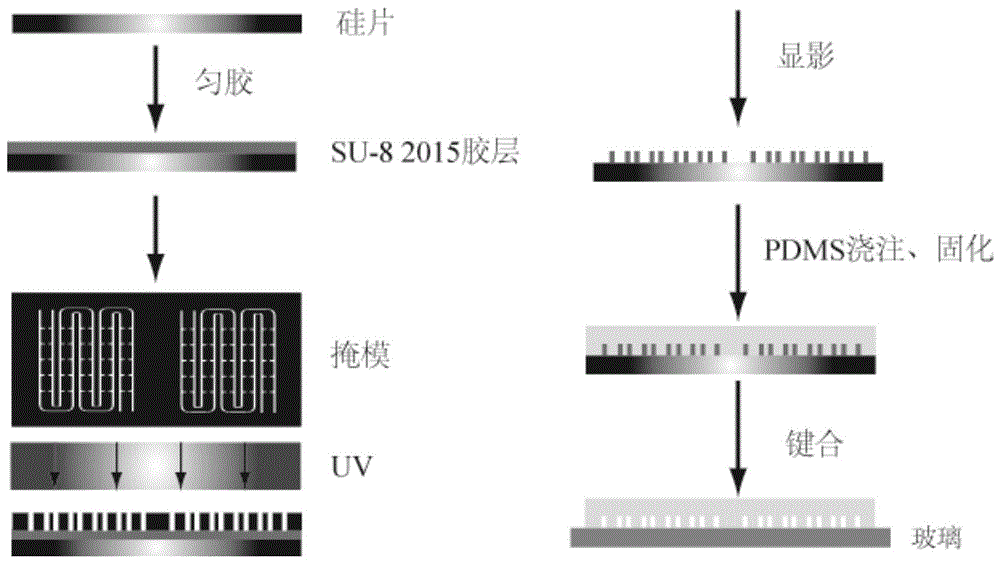
图1微流控芯片制作图。
图2a微流控芯片结构图,b实际的微流控芯片示意图,c、d和e通入两种染料后混合图。
图3微流控芯片单细胞捕获原理图和模拟结构示意图。
图4(a)100μm、(b)150μm、(c)200μm不同主通道长度的速度分布图,(d)通道长度比与q关系图。
图5(a)三角形、(b)半椭圆形、(c)矩形、(d)圆形,由上至下依次为捕获单元的速度分布图、速度流线图和压力分布图。
图6(a)、(b)、(c)通道入口速度优化图与(d)一次细胞捕获后,另一侧捕获细胞所受的压力关系图。
图7优化单侧捕获单元入口宽度,(a)入口速度5μm/s捕获单元速度流线图,(b)comsol中粒子追踪模块模拟细胞运动情况。
图8三维模拟捕获细胞悬浮时另一侧流体速度分布图,(a)窄通道三维速度分布图,(b)窄通道y-z截面速度分布图。
图9三维模拟细胞贴壁时另一侧粒子运动,(a)窄通道三维速度分布图,(b)粒子流动位置分布图。
图10模拟细胞间相互作用物质扩散图。
具体实施方式
下面结合附图和实施例具体说明本发明的内容:
实施例1
如图1,本实施例微流控芯片的制作,采用软光刻方法,包括如下步骤:
模具的制作:硅片在水虎酸溶液中加热至沸腾30min,使用超纯水清洗,氮气吹干后,用匀胶机以2500rpm的转速在表面甩一层su-82015负光胶,在65,烘烤10min,95m烘烤4min后,使用紫外曝光机曝光3次,每次30s,显影后使用氮气吹干,即在硅片上得到了细胞捕获的图案。
芯片的制作:在干燥器皿中加入三氟(1h,1h,2h,2h全氟辛基)硅烷和模具,真空保持2h后使模具表面疏水,聚二甲基硅氧烷(pdms)预聚物与引发剂以质量比10:1混合倒入模具,除气泡后在75入放置2h。将聚合后的pdms片揭下来,切割成型,用平头注射器针打孔,将pdms与玻璃等离子体处理后键合,芯片即制作成功。
如图2和图3,本微流控芯片由聚二甲基硅氧烷片和雕刻有通道的基底键合而成,所述通道包括主通道、捕获单元和窄通道;
所述主通道用于传输细胞和细胞培养基,包括并排设置的第一主通道和第二主通道;两条主通道并行或弯折排布于芯片,形成捕获阵列;
所述第一主通道和第二主通道的侧壁上相向且间隔设置有若干捕获单元,所述捕获单元用于单细胞的捕获和培养;所述窄通道用于连通第一主通道的捕获单元和第二主通道对应位置的捕获单元,形成捕获后单细胞间的交流通路并阻止被捕获的单细胞流入对侧主通道。
所述捕获单元的宽度由主通道向窄通道减小。所述主通道宽度为30μm,同一主通道上捕获单元的间隔距离为150μm,捕获单元的入口尺寸为25μm,窄通道宽度为5μm,窄通道长度为6μm,所述微流控芯片的高度为25μm。
实施例2~4
微流控芯片各部分尺寸的设计方法,包括如下步骤:
1)利用“流阻最小路径”原则,通道中流体的流动通常在低雷诺系数(re)下发生,对于没有落差和阻碍物的矩形通道层流时,阻力计算公式为
其中,μ为流体的粘度,q为流量,q=v×a,v为流速,a为通道的横截面积,l、w、h分别为通道的长宽高,α是与宽高比有关的无量纲参数,
2)计算压降△p:
对于捕获单元的阻力,近似计算为矩形阻力;
流体经过第一主通道和窄通道的压降,其中p0表示窄通道,p1表示第一主通道
流体经过窄通道和第二主通道的压降,其中p2表示第二主通道
3)由于窄通道的高度大于宽度,将公式④的高度h和宽度w对换,得到如下公式
4)当第一主通道和第二主通道的压降相同时,
q捕获单元=q窄通道⑧;
5)代入数值计算,并根据待捕获的细胞大小设计通道尺寸。
实施例2~4分别考察了100μm、150μm和200μm三种情况,并使用comsol软件进行流体流动模拟;
如图3所示的入口1和入口2位置,入口1的流体的流速设定为1μl.min-1,v=0.0267m.s-1,l入口长度,层流发展为层流的入口长度。水作为模拟的材料。
实施例5~8
水作为模拟材料,捕获单元之间主通道长度为150μm,捕获单元入口宽度和长度不变,改变捕获单元的形状,实施例3~8的捕获单元形状分别为三角形、半椭圆、正方形和圆形。
如图5所示,四种形状的捕获单元对流动阻力没有影响,但是经过捕获单元的流体流线不相同,捕获单元为三角形和半椭圆形时,流体更加聚集,可以减少细胞在捕获单元的聚集。细胞占据更大的面积比。而圆形,矩形在捕获单元内非线性流体更多,并且压力图显示,圆形,矩形在主通道与捕获单元的连接处也更容易产生剪切力。
一、两种细胞分别进行单细胞捕获分析
细胞进入捕获单元,像一个阀门关闭了捕获单元的入口,大部分流体不会通过,导致q窄通道/q主通道<1。下一个细胞就会进去第二个捕获单元,以此类推,实现单侧的单细胞捕获。第二个通道进行捕获时,为了减小第二主通道液体进入捕获单元的阻力,我们将第一主通道的入口敞开,设置速度为0μm/s,压力为0pa。由于第一主通道处捕获单元细胞存在,增加了第二主通道液体流动的阻力,通过计算q窄通道/q主通道=0.23~0.25之间。
如图6所示,通过增加第二主通道的入口速度实现第二主通道处的单细胞捕获是行不通的。而且还会增加已捕获细胞侧面所受压力不断增加。在流速、出口压力等其他条件不变的情况下,增加了细胞流入捕获单元入口的宽度,如图7所示,结果qgap/qbypass<1,而且还会引起流体的非线性聚集。根据公式可知,决定qgap/qbypass主要是窄通道部位的长度和宽度。细胞进入捕获单元的入口宽度对流量影响不大。
如图6和图7,当一侧细胞捕获后,通过改变另一侧入口的速度,捕获单元入口的宽度不能实现q窄通道/q主通道>1,利用comsol软件进行了三维模拟。以二维图形为工作平面进行拉伸,通道的高度是一个重要的参数,h必须大于单个细胞的直径,但是h太大,会导致多个细胞在捕获单元的聚集(φ<h<1.4φ)会实现一个捕获单元一个细胞。因此我们将整个通道的高度设定为25μm进行模拟。根据细胞贴壁流动的习性,我们设置第一主通道捕获的细胞距通道底部为1μm,设置细胞直径为16μm。在三维环境中模拟第二主通道处的细胞流动,设置第二主通道入口速度为5μm/s,第一主通道入口速度为0μm/s,根据图8所示,窄通道中的流体在高于细胞直径的位置聚集,此处流过了绝大部分流体。细胞悬浮时,细胞的体积相当于一个微阀,大部分流体从细胞上方流过,相当于窄通道的高度发生了变化,h有效高度=h窄通道-r细胞<h窄通道,q窄通道/q主通道=0.598<1,根据图6二维模拟的结果,改变入口速度无法有效提高捕获效率,相反会增加另一侧细胞受到的剪切力,速度的增加也会使已经捕获好的细胞重新冲到主通道中。
捕获单元流动阻力的增加,主要是一侧细胞捕获后,窄通道中溶液流通的有效高度减少。将单侧捕获好的细胞放入co2培养箱,37℃培养一段时间。活细胞会贴壁生长,降低了细胞的高度,细胞贴壁后高度为5μm进行模拟。根据图9所示,细胞贴壁生长后,窄通道溶液流动的有效高度与悬浮细胞相比会增加,此时q窄通道/q主通道>1,通过窄通道的流量远大于通过主通道的流量。可以实现细胞捕获,并且死细胞的形态不发生变化,适当增加第二主通道入口速度,死细胞会被重新冲到主通道中,可以对第一主通道侧捕获的细胞进行死活筛选。
二、细胞间相互作用分析
两侧入口通道速度相同条件下,模拟捕获单元细胞间的物质扩散。如图10所示,细胞间的物质可以进行有效扩散,并且随着通道长度的增加细胞之间的物质交换更加充分。模拟发现,每经过通道底部的u型通道,两侧细胞浓度扩散的方向会发生变化。
以上所述,仅为本发明较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围内。
- 还没有人留言评论。精彩留言会获得点赞!