基于ARTP复合诱变技术的高通量筛选庆大霉素高产菌株的方法与流程
本发明属于微生物培养技术领域,尤其是涉及一种基于artp复合诱变技术的高通量筛选庆大霉素高产菌株的方法。
背景技术:
庆大霉素是由小单胞菌(绛红小单胞菌或棘孢小单胞菌)经发酵提取产生的一种氨基糖苷类抗生素,可以抑制细菌的蛋白质的生物合成,从而起到抑杀细菌的作用,对革兰氏阴性菌和部分革兰氏阳性菌有强效的杀菌作用。庆大霉素是主要的氨基糖苷类抗菌素,其市场占到氨基糖苷类抗菌素的50%。因此,开发针对庆大霉素工业生产菌株的高通量筛选诱变获取高产菌株,对实际应用有着重要意义。
实际企业生产庆大霉素的绛红小单胞菌或棘孢小单胞菌株大多由传统的筛选方法获得,摇瓶培养,液相或生物法检测效价,存在投资高,筛选周期长,筛选通量小,筛选方法单一,筛选效率低下等缺点,因此庆大霉素的生产能力提高幅度较低。现有技术中并未形成整套的可以大规模高通量诱变筛选生产庆大霉素菌株的方法。
技术实现要素:
本发明的目的就是为了克服上述现有技术存在的缺陷而提供一种基于artp复合诱变技术的高通量筛选庆大霉素高产菌株的方法。
本发明的方法可以帮助生产企业快速获取能够应用于实际生产的高产菌株。
本发明的目的可以通过以下技术方案来实现:
一种基于artp复合诱变技术的高通量筛选庆大霉素高产菌株的方法,包括以下步骤:
第一步,孢子悬浮液制备:将成熟的工业生产菌株斜面上孢子或甘油管保藏的孢子接种于双碟培养基内,待孢子成熟后,取培养基上成熟的孢子转移至装有无菌生理盐水的离心管中制备孢子悬浮液,根据孢子量稀释不同梯度;
第二步,artp诱变复合诱变:将不同梯度的孢子悬浮液加入诱变剂后,使用artp诱变仪产生的等离子流处理不同时间进行诱变,诱变完成后立即涂布于双碟培养基内,待孢子成熟后,将待筛选的工业生产菌株单菌落分别接种于装有斜面培养基和发酵培养基的深孔板中培养;
第三步,快速检测产物:微孔板发酵培养4-5天后对发酵液调节ph至1.4-1.5,常温放置后离心,取上清加入opa衍生剂,加水,然后水浴,待冷至常温后放置于孔板离心机上离心,取上清液转移到酶标板上,然后设定酶标仪在325nm下测定各发酵液的吸光度,根据标准曲线计算对应产物含量获得高产菌株;
第四步:初筛庆大霉素高产菌株和复筛获得高产菌株保藏:将快速筛选得到的菌株转接至深孔板斜面培养基上长出的对应的高产菌株同时接种于大试管斜面或茄子瓶斜面并进行摇瓶发酵培养,发酵摇瓶培养结束后执行液相检测方法确定组分是否符合药典要求,如确认高产菌株则进行20-30%甘油管保藏菌种;
第五步,高产菌株稳定性考察:大试管斜面或茄子瓶斜面连续传代五次并进行发酵摇瓶培养测定庆大霉素产量和组分,确定经过初筛和复筛而获得高产菌的遗传稳定性。
在本发明的一个实施方式中,培养用的深孔板或微孔板斜面为24孔板或48孔板,培养温度35±0.5℃,湿度40%~65%,培养时间8-10天。
在本发明的一个实施方式中,斜面培养基或发酵培养基组成(g/l)为:淀粉10,kno31,k2hpo4·3h2o0.3,mgso4·7h2o0.5,nacl0.5,l-天冬酰胺0.02,caco31,麸皮17,琼脂粉14,ph=7.8,121℃高压湿热灭菌30min。
在本发明的一个实施方式中,第一步中,孢子悬浮液制备的浓度范围在2~5×109个孢子数量范围最佳,稀释梯度在10-4~10-6范围适合于artp诱变处理。
在本发明的一个实施方式中,第一步中,所用发酵培养基的微孔板为24孔,微孔板震荡摇床培养,转速220±10rpm,培养温度35±0.5℃,培养时间4-5天。
在本发明的一个实施方式中,第二步中,所述诱变剂包括licl、亚硝酸钠等。
在本发明的一个实施方式中,第二步中,使用artp诱变仪产生的等离子流处理不同时间的梯度为:10s、30s、60s、90s、120s共计5个梯度。
在本发明的一个实施方式中,第二步中,使用artp诱变仪产生的等离子流处理不同时间进行诱变的同时,结合紫外线、超声波等复合诱变,效果更佳。
在本发明的一个实施方式中,第二步中,使用artp诱变仪产生的等离子流处理不同时间进行诱变的条件为:等离子发射源与单孢子悬浮液的距离,气体流速,输出功率等参数一定的条件下,通过改变诱变时间这唯一参数,进行诱变实验,诱变使用的工作气体为高纯氮(99.99%),产生的等离子体温度控制在25℃到35℃之间。
在本发明的一个实施方式中,第二步中,双碟培养基内可以加入庆大霉素或其他代谢阻遏剂。
在本发明的一个实施方式中,第三步中,采用6mol/l硫酸调节发酵液ph至1.4-1.5。
在本发明的一个实施方式中,第三步中,所述opa衍生剂的配制方法为:称量邻苯二甲醛0.5g溶解于2.5ml甲醇中,加入ph为10.4的0.4mol/l硼酸47.5ml,混合均匀,加入3-巯基丙酸1ml,将混合均匀的溶液用45%naoh调至10.4,放入棕色广口瓶中避光保存。
在本发明的一个实施方式中,第三步中,所述酶标仪中设定检测波长为325nm测定od值,根据0-4000μg/ml不同浓度范围下庆大霉素标准品在335nm下的吸光度值做标准曲线得:y=(od335-0.6215)/0.4985,y代表庆大霉素浓度,标准曲线的r2=0.998,计算方法为最小二乘法线性回归。
在本发明的一个实施方式中,第三步与第四步中,进行发酵培养的发酵培养液中含有(g/l):玉米粉15,淀粉31,葡萄糖5,高温豆粉31,caco31,蛋白胨2,kno30.5,(nh4)2so40.6,cocl2·6h2o0.01,121℃高压湿热灭菌30min。
在本发明的一个实施方式中,第四步中,所述液相检测方法的预处理与第三步中快速检测相同,衍生后的上清液直接用于液相检测,色谱柱为安捷伦c18色谱柱,流动相为甲醇:水:乙酸=71:24:5的混合流动相;柱温40℃,流速1ml/min,检测时间为45min,分别根据标准品各组分含量制定标准曲线获得各组分比例含量。
在本发明的一个实施方式中,第五步中,发酵摇瓶培养条件为:将60ml发酵培养基加入500ml三角瓶中,121℃高压湿热灭菌30min,在无菌的超净工作台中,用接种铲挖取1cm×2cm的斜面孢子琼脂块到发酵摇瓶中,在35.5℃,250rpm,湿度为40%-60%条件下培养4d。
在本发明的一个实施方式中,第一步,孢子悬浮液制备:将成熟的工业生产菌株斜面上孢子或甘油管保藏的孢子接种于9cm双碟培养基内,待孢子成熟后,使用接种铲刮取培养基上成熟的孢子转移至装有10ml无菌生理盐水的离心管中制备孢子悬浮液,根据孢子量稀释不同梯度。
在本发明的一个实施方式中,第二步,artp诱变复合诱变:将不同梯度的孢子悬浮液1ml加入诱变剂后,使用artp诱变仪产生的等离子流处理不同时间进行诱变,诱变完成后立即涂布于9cm双碟培养基内,待孢子成熟后,将待筛选的工业生产菌株单菌落分别接种于装有斜面培养基和发酵培养基的深孔板中培养;
在本发明的一个实施方式中,第三步,快速检测产物:微孔板发酵培养4-5天后对发酵液调节ph至1.4-1.5,常温放置1h后采用4000rpm离心机离心10min,取上清0.2ml加入opa衍生剂0.8ml,加水4ml,然后60℃水浴15min,待冷至常温后放置于孔板离心机上离心4000rpm,10min后取上清液转移到酶标板上,然后设定酶标仪在325nm下测定各发酵液的吸光度,根据标准曲线计算对应产物含量获得高产菌株。
本发明方法操作简单,周期短,筛选效率高。本发明高通量筛选方法使用的仪器主要包括artp诱变仪、测试用的酶标板和酶标仪、培养用的深孔板等工具。
与现有技术相比,本发明具有以下技术效果:
1、本发明快速检测方法具有灵敏度高、检测效率高、预处理简单和专一性较强的优点。利用opa与庆大霉素发生反应形成在330nm左右形成特征吸收峰的原理,通过酶标仪实现快速测定od值从而成功实现了庆大霉素快速检测。克服了常规采用磷钨酸法与庆大霉素形成的沉淀导致od值下降的方法存在的专一性较差,发酵液颜色等干扰问题。
2、本发明采用新型的诱变方法artp结合常规诱变的复合诱变方式,使得诱变效果明显,正突变率较高。对快速获取高产菌株具有有益的帮助。
3、本发明采用复合诱变结合微孔板斜面和微孔板发酵的培养使庆大霉素高通量筛选技术形成了一整套的高通量筛选模型。该模型具有快速、高通量、操作便捷、准确等特点,很大程度上提高了庆大霉素诱变育种、筛选效率,使获得庆大霉素高产菌株的几率大大提高。
附图说明
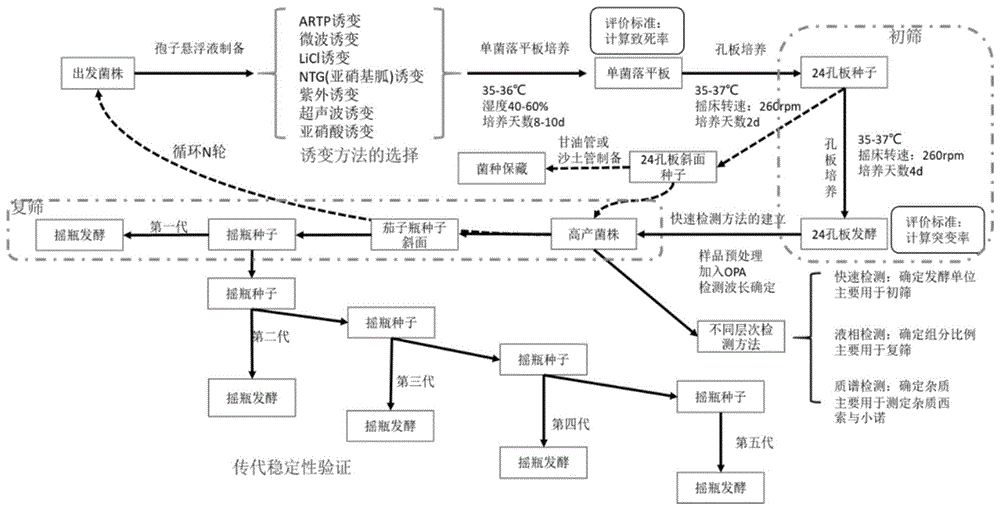
附图1是本发明的高通量筛选流程示意图。
附图2是庆大霉素浓度(μg/ml)对od值曲线图。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明。
实施例
一种基于artp复合诱变技术的高通量筛选庆大霉素高产菌株的方法,流程示意图如图1所示,包括以下步骤:
第一步,孢子悬浮液制备:对甘油管保藏的孢子或斜面、茄子瓶上菌落用用接种铲刮取培养基上成熟的孢子转移至装有10ml无菌生理盐水的离心管中制备孢子悬浮液,制备的孢子悬浮液制备的浓度为2×109个孢子数量,然后采用生理盐水稀释梯度3个梯度为10-4、10-5和10-6进行artp复合诱变处理。
第二步,artp复合诱变处理及培养:将500ul浓度为10%的氯化锂溶液加入500ul孢子数为105个/ml的单孢子悬浮液中,振荡混合5min,取20ullicl诱变的单孢子悬浮液,进行artp诱变,使用artp诱变仪产生的等离子流处理10s、30s、60s、90s、120s共计5个梯度,诱变完成后立即涂布于9cm双碟培养基内,培养条件为养温度35±0.5℃,湿度40%~65%,培养时间8-10天。待孢子成熟后,计算致死率和正突变率。将双碟培养基上的工业生产菌株单菌落分别使用牙签接种于装有斜面培养基和发酵培养基的微空孔板中培养。微孔板为24孔,微孔板摇床培养,转速220±10rpm,培养温度35±0.5℃,培养时间96h。斜面培养基和发酵培养基分别为:淀粉10,kno31,k2hpo4·3h2o0.3,mgso4·7h2o0.5,nacl0.5,l-天冬酰胺0.02,caco31,麸皮17,琼脂粉14,ph=7.8,121℃高压湿热灭菌30min;玉米粉15,淀粉31,葡萄糖5,高温豆粉31,caco31,蛋白胨2,kno30.5,(nh4)2so40.6,cocl2·6h2o0.01,121℃高压湿热灭菌30min,待培养;
第三步,将微孔板发酵培养96h后发酵液采用6mol/l硫酸处理至ph至1.4-1.5,常温放置1h后采用4000rpm离心机离心10min,取上清0.2ml加入opa衍生剂0.8ml,加水4ml,然后60℃水浴15min,待冷至常温后放置于孔板离心机上离心4000rpm,10min后取上清液转移到酶标板上,然后设并酶标仪在325nm下测定各发酵液的吸光度,根据标准曲线(图2)计算对应产物含量获得高产菌株。其中opa配制方法为:称量邻苯二甲醛0.5g溶解于2.5ml甲醇中,加入ph为10.4的0.4mol/l硼酸47.5ml,混合均匀,加入3-巯基丙酸1ml,将混合均匀的溶液用45%naoh调至10.4,放入棕色广口瓶中避光保存。酶标仪中设定检测波长为325nm测定od值(通过200-600nm全波长扫描后获得特征峰)。根据不同浓度下(范围0-4000μg/ml)庆大霉素标准品在335nm下的吸光度值做标准曲线得:y=(od325-0.6215)/0.4985,y代表庆大霉素浓度,标准曲线的r2=0.998,计算方法为最小二乘法线性回归。
第四步:复筛及菌种保藏:将快速筛选得到的菌株转接至深孔板斜面培养基上长出的对应的高产菌株同时接种于大试管斜面或茄子瓶斜面并进行摇瓶发酵培养,发酵摇瓶培养结束后执行液相检测方法确定组分是否符合药典要求,如确认高产菌株则进行20-30%甘油管保藏菌种。其中液相检测方法的预处理与快速检测相同,衍生后的上清液直接用于液相检测,色谱柱为安捷伦c18色谱柱,流动相为甲醇:水:乙酸=71:24:5的混合流动相。柱温40℃,流速1ml/min,检测时间为45min。分别根据标准品各组分含量制定标准曲线获得个组分比例含量。
第五步,遗传稳定性考察:大试管斜面或茄子瓶斜面连续传代五次并进行发酵摇瓶培养测定庆大霉素产量和组分,确定经过初筛和复筛而获得高产菌的遗传稳定性。将60ml发酵培养基加入500ml三角瓶中,121℃高压湿热灭菌30min。在无菌的超净工作台中,用接种铲挖取1cm×2cm的斜面孢子琼脂块到发酵摇瓶中,在35.5℃,250rpm,湿度为40%-60%条件下培养4d后液相测定结果。
经过以上步骤,采用artp结合licl的复合诱变下筛选了进1000株菌,确定了5株较为高产菌(比出发菌株提高20%),经遗传稳定性测定,确认一株菌编号为ll115的菌株比对照提高了近35%,且液相测定组分结果符合药典要求。
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!