中间体的制造方法与流程
1.本发明涉及中间体的制造方法。
背景技术:
2.在相位差片中,有将线偏振光变换为圆偏振光的1/4波片、将线偏振光的偏振振动面变换90度的1/2波片等。这些相位差片对于某特定的单色光能够准确地变换为光线波长的1/4λ或1/2λ的相位差。
3.然而,在现有的相位差片中,存在通过相位差片所输出的偏振光被变换为有色的偏振光的问题。这是如下的原因造成的:由于构成相位差片的材料在相位差上具有波长色散性,对于作为可见光区域的光线混合存在的合成波的白色光,在各波长处的偏振状态下会产生色散,所以不能在所有的波长区域中均调节为准确的1/4λ或1/2λ的相位差。
4.为了解决这样的问题,正在研究能够得到在宽的波长区域中可进行同样的偏振光变换的光学膜的化合物及其制造方法(例如参考专利文献1~4)。
5.现有技术文献
6.专利文献
7.专利文献1:国际公开第2009/116657号;
8.专利文献2:国际公开第2011/068138号;
9.专利文献3:日本特开2016
‑
216433号公报;
10.专利文献4:国际公开第2016/159193号。
技术实现要素:
11.发明要解决的问题
12.然而,在专利文献1~3中,存在制造方法中的工序数多、制造方法繁杂的问题。此外,在专利文献4中,得不到以高浓度含有目标化合物的中间体,并且,用于反应的溶剂的量多,从生产效率的观点出发仍有改善的余地。
13.本发明是鉴于上述情况完成的,其目的在于提供一种能够高效地制造以高浓度含有规定的化合物(i)的中间体的中间体的制造方法。
14.用于解决问题的方案
15.本发明人为了解决上述问题进行了深入研究,结果发现,如果在含有化合物(i)和化合物(ii)的溶液(x)中添加质子性溶剂,使化合物(ii)析出,除去析出的化合物(ii),则能够高效地制造以高浓度含有化合物(i)的中间体,以至完成了本发明。
16.此外,根据本发明,可提供如下所示的中间体的制造方法。
17.[1]一种中间体的制造方法,包含如下的工序:
[0018]
(i)工序(α),得到含有下述化合物(i)和下述式(ii)所表示的化合物(ii)的溶液(x);以及
[0019]
(ii)工序(β),在上述溶液(x)中添加质子性溶剂,使上述化合物(ii)析出,除去析
出的上述化合物(ii),得到含有上述化合物(i)的中间体,
[0020]
通过上述工序(β)得到的中间体包含86质量%以上的上述化合物(i)。
[0021]
[化学式1]
[0022][0023]
[式(i)中,a2和b2各自独立地表示可以具有取代基的环状脂肪族基或可以具有取代基的芳香族基,
[0024]
y2和l2各自独立地表示化学单键、
‑
o
‑
、
‑
c(=o)
‑
、
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
、
‑
nr
21
‑
c(=o)
‑
、
‑
c(=o)
‑
nr
22
‑
、
‑
o
‑
c(=o)
‑
o
‑
、
‑
nr
23
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
nr
24
‑
或
‑
nr
25
‑
c(=o)
‑
nr
26
‑
,r
21
~r
26
各自独立地表示氢原子或碳原子数为1~6的烷基,
[0025]
r3表示氢原子、甲基或氯原子,
[0026]
fg2表示羟基、羧基或氨基,
[0027]
d表示1~20的整数,
[0028]
e为1或2]
[0029]
[化学式2]
[0030][0031]
[式(ii)中,a
21
、b
21
以及b
22
各自独立地表示可以具有取代基的环状脂肪族基或可以具有取代基的芳香族基,
[0032]
y
21
、y
22
、l
21
以及l
22
各自独立地表示化学单键、
‑
o
‑
、
‑
c(=o)
‑
、
‑
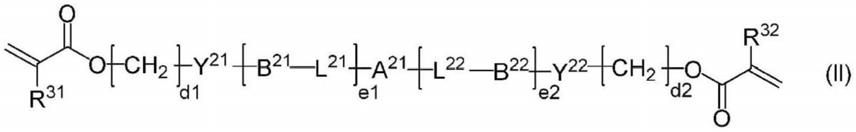
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
、
‑
nr
21
‑
c(=o)
‑
、
‑
c(=o)
‑
nr
22
‑
、
‑
o
‑
c(=o)
‑
o
‑
、
‑
nr
23
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
nr
24
‑
或
‑
nr
25
‑
c(=o)
‑
nr
26
‑
,r
21
~r
26
各自独立地表示氢原子或碳原子数为1~6的烷基,
[0033]
r
31
和r
32
各自独立地表示氢原子、甲基或氯原子,
[0034]
d1和d2各自独立地表示1~20的整数,
[0035]
e1和e2各自独立地为1或2。]
[0036]
换言之,上述[1]的中间体的制造方法是包含上述化合物(i)的中间体的制造方法,包含如下的工序:
[0037]
(i)工序(α),得到含有上述化合物(i)和上述化合物(ii)的溶液(x),以及
[0038]
(ii)工序(β),在上述溶液(x)中添加质子性溶剂,使上述化合物(ii)析出,除去析出的上述化合物(ii),得到含有86质量%以上的上述化合物(i)的中间体。
[0039]
[2]根据[1]所述的中间体的制造方法,其中,上述化合物(i)在上述溶液(x)中的浓度为8.0质量%以上。
[0040]
[3]根据上述[1]或[2]所述的中间体的制造方法,其中,上述化合物(i)为下述式(i
‑
1)所表示的化合物(i
‑
1)。
[0041]
[化学式3]
[0042][0043]
[式(i
‑
1)中,r3、d表示与上述相同的含义。]
[0044]
[4]根据上述[1]至[3]中任一项所述的中间体的制造方法,其中,上述化合物(ii)为下述式(ii
‑
1)所表示的化合物(ii
‑
1)。
[0045]
[化学式4]
[0046][0047]
[式(ii
‑
1)中,r3、d表示与上述相同的含义。]
[0048]
[5]根据上述[1]至[4]中任一项所述的中间体的制造方法,其中,上述溶液(x)还包含有机溶剂,该有机溶剂为水不混溶性有机溶剂。
[0049]
[6]根据上述[5]所述的中间体的制造方法,其中,上述水不混溶性有机溶剂的希尔德布兰德溶解度参数为14.0mpa
1/2
以上且22.0mpa
1/2
以下。
[0050]
[7]根据上述[1]至[6]中任一项所述的中间体的制造方法,其中,上述质子性溶剂为醇。
[0051]
发明效果
[0052]
根据本发明,可提供能够高效地制造以高浓度含有化合物(i)的中间体的中间体的制造方法。
具体实施方式
[0053]
以下,对本发明进行详细说明。另外,在本发明中,“可以具有取代基”是指“未取代的或具有取代基”。此外,在通式中所包含的烷基、芳香族烃环基等有机基团具有取代基的情况下,在该具有取代基的有机基团的碳原子数中不包含取代基的碳原子数。例如,在碳原子数为6~20的芳香族烃环基具有取代基的情况下,在碳原子数为6~20的芳香族烃环基的碳原子数中不包含这样的取代基的碳原子数。此外,在本发明中,“烷基”是指链状(直链状或支链状)的饱和烃基,在“烷基”中不包含作为环状的饱和烃基的“环烷基”。另一方面,在“rf中的环结构所包含的π电子的总数”中也包含取代基所包含的环结构的π电子。进而,在本发明中,“中间体”至少含有化合物(i),可以是单独的化合物(i),也可以是含有化合物(i)和除化合物(i)以外的其它成分的混合物。
[0054]
(中间体的制造方法)
[0055]
以下,对本发明的中间体的制造方法进行详细说明。
[0056]
本发明的中间体的制造方法至少包含:工序(α),得到含有化合物(i)和化合物(ii)的溶液(x);以及工序(β),在溶液(x)中添加质子性溶剂,使化合物(ii)析出,除去析出的化合物(ii),得到含有化合物(i)的中间体;还根据需要包含其它工序。
[0057]
[化学式5]
[0058][0059]
[化学式6]
[0060][0061]
<工序(α)>
[0062]
工序(α)是得到含有化合物(i)和化合物(ii)的溶液(x)的工序。
[0063]
<<溶液(x)>>
[0064]
溶液(x)至少包含化合物(i)和化合物(ii),还根据需要包含有机溶剂、其它成分。
[0065]
化合物(i)在溶液(x)中的浓度优选为8.0质量%以上、更优选为8.5质量%以上、特别优选为9.0质量%以上,且优选为40质量%以下、更优选为30质量%以下、特别优选为20质量%以下。如果化合物(i)在溶液(x)中的浓度为上述下限值以上且上述上限值以下,则能够高选择性地除去式(ii)所表示的化合物。
[0066]
另外,“化合物(i)在溶液(x)中的浓度”通过下述式计算。
[0067]
化合物(i)在溶液(x)中的浓度(质量%)=
[0068]
(化合物(i)的质量)/[(化合物(i)的质量)+溶剂质量]
×
100
[0069]
化合物(ii)在溶液(x)中的浓度优选为3.0质量%以上、更优选为3.5质量%以上、特别优选为4.0质量%以上,且优选为10质量%以下、更优选为9.0质量%以下、特别优选为8.0质量%以下。如果化合物(ii)在溶液(x)中的浓度为上述下限值以上且上述上限值以下,则能够高选择性地除去式(ii)所表示的化合物。
[0070]
另外,“化合物(ii)在溶液(x)中的浓度”通过下述式计算。
[0071]
化合物(ii)在溶液(x)中的浓度=
[0072]
(化合物(ii)的质量)/[(化合物(ii)的质量)+溶剂质量]
×
100
[0073]
化合物(ii)在溶液(x)中的浓度相对于化合物(i)在溶液中的浓度之比(化合物(ii)在溶液(x)中的浓度/化合物(i)在溶液(x)中的浓度)优选为20%以上、更优选为25%以上、特别优选为30%以上,且优选为60%以下、更优选为55%以下、特别优选为50%以下。如果化合物(ii)在溶液(x)中的浓度与化合物(i)在溶液(x)中的浓度之比(化合物(ii)在溶液(x)中的浓度/化合物(i)在溶液(x)中的浓度)为上述下限值以上且上述上限值以下,则能够高选择性地除去式(ii)所表示的化合物。
[0074]
[化合物(i)]
[0075]
下述式(i)所表示的化合物(i)可以仅由一种化合物构成、也可以由两种化合物构成,优选仅由一种化合物构成。在此,当化合物(i)仅由一种化合物构成时,后述的化合物(ii)以a
21
为中心左右对称。
[0076]
[化学式7]
[0077][0078]
[a2、b2]
[0079]
式(i)中,a2和b2各自独立地表示可以具有取代基的环状脂肪族基或可以具有取代基的芳香族基。
[0080]
在这些之中,a2和b2优选各自独立地表示可以具有取代基的碳原子数为5~20的环状脂肪族基或可以具有取代基的碳原子数为2~20的芳香族基。
[0081]
作为环状脂肪族基的具体例子,可举出:环戊烷
‑
1,3
‑
二基、环己烷
‑
1,4
‑
二基、环庚烷
‑
1,4
‑
二基、环辛烷
‑
1,5
‑
二基等碳原子数为5~20的环烷烃二基;十氢萘
‑
1,5
‑
二基、十氢萘
‑
2,6
‑
二基等碳原子数为5~20的双环烷烃二基等。其中,作为环状脂肪族基,优选能够被取代的碳原子数为5~20的环烷烃二基,更优选环己烷二基,特别地,优选1,4
‑
亚环己基(环己烷
‑
1,4
‑
二基),更优选反式
‑
1,4
‑
亚环己基。
[0082]
作为芳香族基的具体例子,可举出:1,2
‑
亚苯基、1,3
‑
亚苯基、1,4
‑
亚苯基、1,4
‑
亚萘基、1,5
‑
亚萘基、2,6
‑
亚萘基、4,4
’‑
亚联苯基等碳原子数为6~20的芳香族烃环基;呋喃
‑
2,5
‑
二基、噻吩
‑
2,5
‑
二基、吡啶
‑
2,5
‑
二基、吡嗪
‑
2,5
‑
二基等碳原子数为2~20的芳香族杂环基等。其中,作为芳香族基,优选碳原子数为6~20的芳香族烃环基,进一步优选亚苯基,特别优选1,4
‑
亚苯基。
[0083]
作为环状脂肪族基和芳香族基的取代基,可举出例如:氟原子、氯原子、溴原子等卤原子;甲基、乙基等碳原子数为1~6的烷基;甲氧基、异丙氧基等碳原子数为1~5的烷氧基;硝基;氰基等。上述环状脂肪族基、碳原子数为5~20的环状脂肪族基、芳香族基、碳原子数为2~20的芳香族基可以具有选自上述的取代基中的至少一个的取代基。另外,在具有多个取代基的情况下,各取代基可以相同、也可以不同。
[0084]
在此,优选a2为可以具有取代基的环状脂肪族基、b2为可以具有取代基的芳香族基。
[0085]
而且,更优选a2为式(a)所表示的“可以具有取代基的反式
‑
1,4
‑
亚环己基”、b2为式(b)所表示的“可以具有取代基的1,4
‑
亚苯基”的组合。
[0086]
[化学式8]
[0087][0088]
式(a)和(b)中,r0表示:卤原子;甲基、乙基、丙基等碳原子数为1~6的烷基;氰基;硝基;三氟甲基、五氟乙基等至少一个氢原子被卤原子取代的碳原子数为1~6的烷基;甲氧基、乙氧基、丙氧基等碳原子数为1~6的烷氧基;
‑
ocf3;
‑
c(=o)
‑
o
‑
r
a
;或
‑
o
‑
c(=o)
‑
r
a
。在此,r
a
表示:可以具有取代基的碳原子数为1~20的烷基、可以具有取代基的碳原子数为2~20的烯基、可以具有取代基的碳原子数为3~12的环烷基、或可以具有取代基的碳原子数为
5~12的芳香族烃环基。
[0089]
作为r0,从提高溶解性的观点出发,优选:氟原子、氯原子等卤原子;甲基、乙基、丙基等碳原子数为1~6的烷基;氰基;硝基;三氟甲基、五氟乙基等至少一个氢原子被卤原子取代的碳原子数为1~6的烷基;甲氧基、乙氧基、丙氧基等碳原子数为1~6的烷氧基。另外,在r0为多个的情况下,多个r0彼此可以相同、也可以不同。进而,p1表示0~4的整数,优选为0。
[0090]
作为r
a
的可以具有取代基的碳原子数为1~20的烷基的碳原子数为1~20的烷基,可举出:甲基、乙基、正丙基、异丙基、正丁基、异丁基、1
‑
甲基戊基、1
‑
乙基戊基、仲丁基、叔丁基、正戊基、异戊基、新戊基、正己基、异己基、正庚基、正辛基、正壬基、正癸基、正十一烷基、正十二烷基、正十三烷基、正十四烷基、正十五烷基、正十六烷基、正十七烷基、正十八烷基、正十九烷基以及正二十烷基等。另外,可以具有取代基的碳原子数为1~20的烷基的碳原子数优选为1~12,进一步优选为4~10。
[0091]
作为r
a
的可以具有取代基的碳原子数为2~20的烯基的碳原子数为2~20的烯基,可举出:乙烯基、丙烯基、异丙烯基、丁烯基、异丁烯基、戊烯基、己烯基、庚烯基、辛烯基、壬烯基、癸烯基、十一碳烯基、十二碳烯基、十三碳烯基、十四碳烯基、十五碳烯基、十六碳烯基、十七碳烯基、十八碳烯基、十九碳烯基以及二十碳烯基等。
[0092]
可以具有取代基的碳原子数为2~20的烯基的碳原子数优选为2~12。
[0093]
作为r
a
的碳原子数为1~20的烷基和碳原子数为2~20的烯基的取代基,可举出:氟原子、氯原子等卤原子;氰基;二甲氨基等碳原子数为2~12的n,n
‑
二烷基氨基;甲氧基、乙氧基、异丙氧基、丁氧基等碳原子数为1~20的烷氧基;甲氧基甲氧基、甲氧基乙氧基等被碳原子数为1~12的烷氧基取代了的碳原子数为1~12的烷氧基;硝基;苯基、萘基等碳原子数为6~20的芳香族烃环基;三唑基、吡咯基、呋喃基、噻吩基、苯并噻唑
‑2‑
基硫基等碳原子数为2~20的芳香族杂环基;环丙基、环戊基、环己基等碳原子数为3~8的环烷基;环戊氧基、环己氧基等碳原子数为3~8的环烷氧基;四氢呋喃基、四氢吡喃基、二氧戊环基、二烷基等碳原子数为2~12的环状醚基;苯氧基、萘氧基等碳原子数为6~14的芳氧基;三氟甲基、五氟乙基、
‑
ch2cf3等至少一个氢原子被氟原子取代了的碳原子数为1~12的氟烷基;苯并呋喃基;苯并吡喃基;苯并二氧戊环基;以及苯并二烷基等。在这些之中,作为r
a
的碳原子数为1~20的烷基和碳原子数为2~20的烯基的取代基,优选:氟原子、氯原子等卤原子;氰基;甲氧基、乙氧基、异丙氧基、丁氧基等碳原子数为1~20的烷氧基;硝基;苯基、萘基等碳原子数为6~20的芳香族烃环基;呋喃基、噻吩基等碳原子数为2~20的芳香族杂环基;环丙基、环戊基、环己基等碳原子数为3~8的环烷基;三氟甲基、五氟乙基、
‑
ch2cf3等至少一个氢原子被氟原子取代了的碳原子数为1~12的氟烷基。
[0094]
另外,r
a
的碳原子数为1~20的烷基、碳原子数为2~20的烯基可以具有选自上述的取代基中的多个取代基。在r
a
的碳原子数为1~20的烷基、碳原子数为2~20的烯基具有多个取代基的情况下,多个取代基彼此可以相同、也可以不同。
[0095]
作为r
a
的可以具有取代基的碳原子数为3~12的环烷基的碳原子数为3~12的环烷基,可举出环丙基、环丁基、环戊基、环己基、环辛基等。在这些之中,优选环戊基、环己基。
[0096]
作为r
a
的碳原子数为3~12的环烷基的取代基,可举出:氟原子、氯原子等卤原子;
氰基;二甲氨基等碳原子数为2~12的n,n
‑
二烷基氨基;甲基、乙基、丙基等碳原子数为1~6的烷基;甲氧基、乙氧基、异丙氧基等碳原子数为1~6的烷氧基;硝基;以及苯基、萘基等碳原子数为6~20的芳香族烃环基等。其中,作为r
a
的碳原子数为3~12的环烷基的取代基,优选:氟原子、氯原子等卤原子;氰基;甲基、乙基、丙基等碳原子数为1~6的烷基;甲氧基、乙氧基、异丙氧基等碳原子数为1~6的烷氧基;硝基;以及苯基、萘基等碳原子数为6~20的芳香族烃环基。
[0097]
另外,r
a
的碳原子数为3~12的环烷基可以具有多个取代基。在r
a
的碳原子数为3~12的环烷基具有多个取代基的情况下,多个取代基彼此可以相同、也可以不同。
[0098]
作为r
a
的可以具有取代基的碳原子数为5~12的芳香族烃环基的碳原子数为5~12的芳香族烃环基,可举出苯基、1
‑
萘基、2
‑
萘基等。在这些之中,优选苯基。
[0099]
作为可以具有取代基的碳原子数为5~12的芳香族烃环基的取代基,可举出:氟原子、氯原子等卤原子;氰基;二甲氨基等碳原子数为2~12的n,n
‑
二烷基氨基;甲氧基、乙氧基、异丙氧基、丁氧基等碳原子数为1~20的烷氧基;甲氧基甲氧基、甲氧基乙氧基等被碳原子数为1~12的烷氧基取代了的碳原子数为1~12的烷氧基;硝基;苯基、萘基等碳原子数为6~20的芳香族烃环基;三唑基、吡咯基、呋喃基、噻吩基等碳原子数为2~20的芳香族杂环基;环丙基、环戊基、环己基等碳原子数为3~8的环烷基;环戊氧基、环己氧基等碳原子数为3~8的环烷氧基;四氢呋喃基、四氢吡喃基、二氧戊环基、二烷基等碳原子数为2~12的环状醚基;苯氧基、萘氧基等碳原子数为6~14的芳氧基;三氟甲基、五氟乙基、
‑
ch2cf3等至少一个氢原子被氟原子取代了的碳原子数为1~12的氟烷基;
‑
ocf3;苯并呋喃基;苯并吡喃基;苯并二氧戊环基;苯并二烷基等。其中,作为碳原子数为5~12的芳香族烃环基的取代基,优选:选自氟原子、氯原子等卤原子;氰基;甲氧基、乙氧基、异丙氧基、丁氧基等碳原子数为1~20的烷氧基;硝基;苯基、萘基等碳原子数为6~20的芳香族烃环基;三唑基、吡咯基、呋喃基、噻吩基等碳原子数为2~20的芳香族杂环基;环丙基、环戊基、环己基等碳原子数为3~8的环烷基;三氟甲基、五氟乙基、
‑
ch2cf3等至少一个氢原子被氟原子取代了的碳原子数为1~12的氟烷基;
‑
ocf3中的至少一个取代基。
[0100]
另外,碳原子数为5~12的芳香族烃环基可以具有多个取代基。在碳原子数为5~12的芳香族烃环基具有多个取代基的情况下,取代基可以相同、也可以不同。
[0101]
[y2、l2]
[0102]
式(i)中,y2和l2各自独立地表示化学单键、
‑
o
‑
、
‑
c(=o)
‑
、
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
、
‑
nr
21
‑
c(=o)
‑
、
‑
c(=o)
‑
nr
22
‑
、
‑
o
‑
c(=o)
‑
o
‑
、
‑
nr
23
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
nr
24
‑
或
‑
nr
25
‑
c(=o)
‑
nr
26
‑
。在此,r
21
~r
26
各自独立地表示氢原子或碳原子数为1~6的烷基。
[0103]
在这些之中,从合成难易和显现期望的光学特性的观点出发,y2优选为
‑
o
‑
,l2优选为
‑
c(=o)
‑
o
‑
或
‑
o
‑
c(=o)
‑
。
[0104]
[r3]
[0105]
式(i)中,r3表示氢原子、甲基或氯原子。
[0106]
在这些之中,从合成难易和聚合速度的观点出发,r3优选为氢原子。
[0107]
[fg2]
[0108]
式(i)中,fg2表示羟基、羧基或氨基。
[0109]
在这些之中,从合成难易和显现期望的光学特性的观点出发,fg2优选为羧基。
[0110]
[d]
[0111]
式(i)中,d表示1~20的整数。
[0112]
在这些之中,从合成难易和显现期望的光学特性的观点出发,d优选为2~12的整数,更优选为4~12的整数,特别优选为4~10的整数。
[0113]
[e]
[0114]
式(i)中,e为1或2。
[0115]
在这些之中,e优选为1。
[0116]
另外,在e为2的情况下,两个b2可以相同也可以不同,并且,2个l2可以相同也可以不同。
[0117]
作为化合物(i)的具体例子,可优选地举出例如下述式(i
‑
1)所表示的化合物(i
‑
1)。
[0118]
[化学式9]
[0119][0120]
式(i
‑
1)中,r3、d表示与上述相同的含义,其优选例也与上述相同。
[0121]
[化合物(i)的制备]
[0122]
关于化合物(i)的制备,分成e为1的情况和e为2的情况进行说明。
[0123]
在e为1的情况下,化合物(i)(下述式(i
‑
a)所表示的化合物(i
‑
a))能够通过例如使下述式(a
‑
0)所表示的化合物(a
‑
0)与下述式(b
‑
0)所表示的化合物(b
‑
0)反应来得到,更具体地,能够通过如下的方式得到:在含有三乙胺等碱的反应溶剂中,使下述式(a
‑
1)所表示的化合物(a
‑
1)与反式
‑
1,4
‑
环己二酰氯进行酯化反应,然后进行水解。此外,还能够在脱水缩合剂存在下,使下述式(a
‑
1)所表示的化合物(a
‑
1)与反式
‑
1,4
‑
环己烷二羧酸在反应溶剂中反应来得到。
[0124]
[化学式10]
[0125][0126]
式(a
‑
0)、(b
‑
0)以及(i
‑
a)中,a2、b2、y2、l2、r3、fg2以及d各自独立地表示与上述相同的含义,其优选例也与上述相同。
[0127]
式(a
‑
0)中,z表示羟基、羧基或氨基。
[0128]
在这些之中,从合成难易的观点出发,z优选为羟基。
[0129]
式(b
‑
0)中,fq为与z反应形成l2且能够成为fg2的官能团,表示
‑
c(=o)cl、clc(=o)
‑
、
‑
cooh、hooc
‑
、
‑
nh2或h2n
‑
。
[0130]
在这些之中,从合成难易的观点出发,fq优选为
‑
c(=o)cl或clc(=o)
‑
、
‑
cooh、hooc
‑
。
[0131]
[化学式11]
[0132][0133]
式(a
‑
1)中,r3、d表示与上述相同的含义,其优选例也与上述相同。
[0134]
在e为2的情况下,化合物(i)(下述式(i
‑
b)所表示的化合物(i
‑
b))能够通过例如使下述式(a
‑
2)所表示的化合物(a
‑
2)与下述式(b
‑
0)所表示的化合物(b
‑
0)反应来得到。
[0135]
[化学式12]
[0136][0137]
式(a
‑
2)、(b
‑
0)以及(i
‑
b)中,a2、b2、y2、l2、r3、fg2以及d各自独立地表示与上述相同的含义,其优选例也与上述相同。
[0138]
式(a
‑
2)中,z表示羟基、羧基或氨基。
[0139]
在这些之中,从合成难易的观点出发,z优选为羟基。
[0140]
式(b
‑
0)中,fq表示与上述相同的含义,其优选例也与上述相同。
[0141]
式(i
‑
b)中的两个b2可以相同也可以不同,式(i
‑
b)中的两个l2可以相同也可以不同。
[0142]
‑
反应溶剂
‑
[0143]
作为反应溶剂,可举出:环戊基甲醚(cpme)、四氢呋喃、甲基叔丁醚、二乙醚、二丁醚、二异丙醚、1,2
‑
二甲氧基乙烷等醚类;2
‑
丁酮、甲基异丁酮等酮类;二氯甲烷、氯仿、1,2
‑
二氯乙烷等卤化烃类;乙酸乙酯、乙酸丙酯等酯类;苯、甲苯、二甲苯等芳香族烃类;环戊烷、环己烷等脂环式烃类;n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、n
‑
甲基
‑2‑
吡咯烷酮等酰胺类;乙腈、丙腈等腈类;以及它们的混合溶剂等。这些可以单独使用一种,也可以以任意的比率组合使用两种以上。
[0144]
相对于10g的上述化合物(a
‑
0)或化合物(a
‑
2),用于上述反应的反应溶剂的使用量优选为10ml以上,更优选为20ml以上,特别优选为40ml以上,并且,优选为500ml以下,更优选为250ml以下,特别优选为100ml以下。如果反应溶剂的使用量为上述下限值以上且上述上限值以下,则能够提高式(i)所表示的化合物的选择性。
[0145]
[化合物(ii)]
[0146]
下述式(ii)所表示的化合物(ii)可以以a
21
为中心左右对称,也可以为左右非对称,在合成难易的方面上,优选以a
21
为中心左右对称(即,b
21
和b
22
相同、y
21
和y
22
相同、l
21
和l
22
相同、r
31
和r
32
相同、d1和d2相同、e1和e2相同)。
[0147]
[化学式13]
[0148][0149]
[a
21
、b
21
、b
22
]
[0150]
式(ii)中,a
21
、b
21
以及b
22
各自独立地表示与上述a2、b2相同的含义,其优选例也与上述a2、b2相同。
[0151]
[y
21
、y
22
]
[0152]
式(ii)中,y
21
和y
22
各自独立地表示与上述y2相同的含义,其优选例也与上述y2相同。
[0153]
[l
21
、l
22
]
[0154]
式(ii)中,l
21
和l
22
各自独立地表示与上述l2相同的含义,其优选例也与上述l2相同。
[0155]
[r
31
、r
32
]
[0156]
式(ii)中,r
31
和r
32
各自独立地表示与上述r3相同的含义,其优选例也与上述r3相同。
[0157]
[d1、d2]
[0158]
式(ii)中,d1和d2各自独立地表示与上述d相同的含义,其优选例也与上述d相同。
[0159]
[e1、e2]
[0160]
式(ii)中,e1和e2各自独立地表示与上述e相同的含义,其优选例也与上述e相同。
[0161]
作为化合物(ii)的具体例子,可优选地举出例如下述式(ii
‑
1)所表示的化合物(ii
‑
1)。
[0162]
[化学式14]
[0163][0164]
[式(ii
‑
1)中,r3、d表示与上述相同的含义,其优选例也与上述相同。]
[0165]
[有机溶剂]
[0166]
作为有机溶剂,可举出:环戊基甲醚(cpme)、四氢呋喃、甲基叔丁醚、二乙醚、二丁醚、二异丙醚、1,2
‑
二甲氧基乙烷、1,4
‑
二烷、1,3
‑
二氧戊环等醚类;2
‑
丁酮、甲基异丁酮
等酮类;二氯甲烷、氯仿、1,2
‑
二氯乙烷等卤化烃类;乙酸乙酯、乙酸丙酯等酯类;苯、甲苯、二甲苯等芳香族烃类;环戊烷、环己烷等脂环式烃类;n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、n
‑
甲基
‑2‑
吡咯烷酮等酰胺类;乙腈、丙腈等腈类;以及它们的混合溶剂等。这些可以单独使用一种,也可以以任意的比率组合使用两种以上。
[0167]
在这些之中,优选水不混溶性有机溶剂。在此,“水不混溶性有机溶剂”是具有即使与水混合也不相溶、2相分离的性质的有机溶剂。水不混溶性有机溶剂在水中的溶解度为40g(有机溶剂)/100ml(水)以下,优选为30g(有机溶剂)/100ml(水)以下,更优选为15g(有机溶剂)/100ml(水)以下。
[0168]
另外,在使用两种以上的混合溶剂的情况下,在添加水混溶性溶剂时,在相对于水混溶性溶剂和水不混溶性有机溶剂的总和满足上述在水中的溶解度的情况下,该混合溶剂为“水不混溶性有机溶剂”。
[0169]
作为水不混溶性有机溶剂的具体例子,可举出:环戊基甲醚(cpme)、2
‑
甲基四氢呋喃、1,4
‑
二烷、1,3
‑
二氧戊环、四氢呋喃、甲基叔丁醚、二乙醚、二丁醚、二异丙醚、1,2
‑
二甲氧基乙烷等醚类;2
‑
丁酮等酮类;二氯甲烷、氯仿、1,2
‑
二氯乙烷等卤化烃类;乙酸乙酯、乙酸丙酯等酯类;苯、甲苯、二甲苯等芳香族烃类;环戊烷、环己烷等脂环式烃类;n,n
‑
二甲基甲酰胺、n,n
‑
二甲基乙酰胺、n
‑
甲基
‑2‑
吡咯烷酮等酰胺类;乙腈、丙腈等腈类;以及它们的混合溶剂等。
[0170]
水不混溶性有机溶剂的希尔德布兰德溶解度参数优选为14.0mpa
1/2
以上,更优选为14.3mpa
1/2
以上,特别优选为14.5mpa
1/2
以上,并且,优选为22.0mpa
1/2
以下,更优选为20.0mpa
1/2
以下,特别优选为19.5mpa
1/2
以下。如果水不混溶性有机溶剂的希尔德布兰德溶解度参数为上述下限值以上且上述上限值以下,则能够以高的选择率得到式(i)所表示的化合物。
[0171]
希尔德布兰德溶解度参数是由希尔德布兰德引入的、由规则溶液理论定义的提供材料间的相互作用的程度的数值预测的值(δ)。
[0172]
作为希尔德布兰德溶解度参数为14.0mpa
1/2
以上且22.0mpa
1/2
以下的有机溶剂,能够优选地例示出:环戊基甲醚(cpme)(希尔德布兰德溶解度参数(δ):17.2mpa
1/2
)、四氢呋喃((δ):18.6mpa
1/2
)、甲基叔丁醚((δ):15.6mpa
1/2
)、二乙醚((δ):15.1mpa
1/2
)、二丁醚((δ):14.9mpa
1/2
)、二异丙醚((δ):14.1mpa
1/2
)、1,2
‑
二甲氧基乙烷((δ):19.2mpa
1/2
)、2
‑
丁酮((δ):19.0mpa
1/2
)等醚类;氯仿((δ):19.0mpa
1/2
)等卤化烃类;乙酸乙酯((δ):18.6mpa
1/2
)等酯类;甲苯((δ):18.2mpa
1/2
)等芳香族烃类;环己烷((δ):16.7mpa
1/2
)等脂环式烃类;以及它们的混合溶剂等。在使用混合溶剂的情况下,其溶解度参数能够通过求和规则计算。
[0173]
有机溶剂在溶液(x)中的含量优选为50质量%以上,更优选为60质量%以上,特别优选为70质量%以上,并且,优选为95质量%以下,更优选为93质量%以下,特别优选为90质量%以下。如果有机溶剂在溶液(x)中的含量为上述下限值以上且上述上限值以下,则能够以高的选择率除去式(ii)所表示的化合物。
[0174]
[其它成分]
[0175]
作为其它成分,可举出例如:三乙胺(et3n)、二异丙基乙胺、吡啶、n,n
‑
二甲基
‑4‑
二甲氨基吡啶等碱;二环己基碳二亚胺、n,n
‑
二异丙基碳二亚胺、1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐等脱水缩合剂;2,6
‑
二叔丁基对甲酚、对甲氧基苯酚等阻聚剂等。
[0176]
<工序(β)>
[0177]
工序(β)工序是在溶液(x)中添加质子性溶剂,使化合物(ii)析出,除去析出的化合物(ii),得到含有化合物(i)的中间体的工序。
[0178]
<<质子性溶剂>>
[0179]
质子性溶剂是在添加到含有化合物(i)和化合物(ii)的溶液(x)中时,化合物(i)容易溶解且化合物(ii)不易溶解的溶剂(即,相对于溶液(x)中的化合物(i)是良溶剂、相对于溶液(x)中的化合物(ii)是不良溶剂的溶剂)。
[0180]
另外,即使相对于单个化合物(i)是良溶剂,相对于溶液(x)中的化合物(i)也不一定是良溶剂,并且,即使相对于单个化合物(ii)是不良溶剂,相对于溶液(x)中的化合物(i)也不一定是不良溶剂。
[0181]
作为质子性溶剂,可举出例如乙醇、甲醇、1
‑
丙醇、2
‑
丙醇、1
‑
丁醇、环己醇、环戊醇等醇;甘油;乙二醇、丙二醇等二元醇;甲酸、乙酸等羧酸;乙醇酸、2
‑
羟基丙二酸、甘油酸等羟基酸等。这些可以单独使用一种,也可以以任意的比率组合使用两种以上。
[0182]
在这些之中,在能够使化合物(ii)高效地析出的方面,优选醇,更优选甲醇。
[0183]
质子性溶剂的使用量以上述化合物(a
‑
0)或化合物(a
‑
2)基准计,优选为0.1质量倍数以上,更优选为0.2质量倍数以上,特别优选为0.3质量倍数以上,并且,优选为5质量倍数以下,更优选为3质量倍数以下,特别优选为2质量倍数以下。如果质子性溶剂的使用量为上述下限值以上且上述上限值以下,则能够以高的选择率除去式(ii)所表示的化合物,使式(i)所表示的化合物的纯度提高。
[0184]
<<除去>>
[0185]
作为除去析出的化合物(ii)的除去方法,可举出例如过滤、离心分离等,更具体地,可举出作为过滤的抽滤、加压过滤等。在这些之中,在除去效率的观点上,优选离心分离、加压过滤。
[0186]
<<中间体>>
[0187]
中间体至少含有化合物(i),可以是单个化合物(i),也可以是含有化合物(i)和除化合物(i)以外的其它成分(例如化合物(ii))的混合物。
[0188]
作为化合物(i)在中间体中的含量,需要为86质量%以上,优选为88质量%以上,更优选为90质量%以上,特别优选为92质量%以上。如果化合物(i)在中间体中的含量为上述下限值以上,则能够高效地制造可得到在宽的波长区域中可进行同样的偏振变换的光学膜的化合物。
[0189]
另外,在工序(β)中,为了得到上述中间体,在除去化合物(ii)后进行冷却,使含有化合物(i)的中间体析出,过滤,进行真空干燥等。
[0190]
作为冷却温度,优选为20℃以下,更优选为10℃以下,特别优选为5℃以下,最优选为0℃附近。如果冷却温度为上述上限值以下,能够使中间体高效地析出。
[0191]
<其它工序>
[0192]
其它工序可举出例如干燥等制备上述的化合物(i)的工序等。
[0193]
<聚合性化合物>
[0194]
通过本发明的中间体的制造方法制造中间体,对由该中间体制造的聚合性化合物进行说明。
[0195]
聚合性化合物为例如下述式(iii)所示的化合物(以下有时称作“聚合性化合物(iii)”),能够在制备后述的高分子、光学膜以及光学各向异性体时有利地使用。
[0196]
[化学式15]
[0197][0198]
另外,如后所述,通过使用式(iii)所表示的化合物,能够得到涂敷性优异的聚合性组合物,有利地制造膜厚的面内均匀性优异、光学特性的面内均匀性得到改善的光学膜等。
[0199]
<<ar>>
[0200]
在此,式(iii)中,ar由下述式(iv
‑
1)或(iv
‑
2)表示,优选由下述式(iv
‑
3)或(iv
‑
4)表示。
[0201]
[化学式16]
[0202][0203]
(上述式(iv
‑
1)和(iv
‑
2)中,*表示与y3或y4结合。)
[0204]
[化学式17]
[0205][0206]
(上述式(iv
‑
3)和(iv
‑
4)中,*表示与y3或y4结合。)
[0207]
[r]
[0208]
式(iv
‑
1)~(iv
‑
4)中,r表示可以具有取代基的碳原子数为1~60的有机基团,优选由rf
‑
k
‑
ga(ga与n结合)表示的有机基团、由gb表示的有机基团。
[0209]
作为r的可以具有取代基的碳原子数为1~60的有机基团的碳原子数为1~60的有机基团,没有特别限制,可举出例如:(i)碳原子数为1~60的烷基;(ii)碳原子数为2~60的烯基;(iii)碳原子数为2~60的炔基等。
[0210]
[(i)碳原子数为1~60的烷基]
[0211]
作为碳原子数为1~60的烷基,可举出:甲基、乙基、正丙基、异丙基、正丁基、仲丁基、叔丁基、正戊基、正己基、正庚基、正十一烷基、正十二烷基、1
‑
甲基戊基、1
‑
乙基戊基等。在这些之中,优选碳原子数为1~12的烷基,更优选正丁基、正己基、正辛基,特别优选正己基。
[0212]
[(ii)碳原子数为2~60的烯基]
[0213]
作为碳原子数为2~60的烯基,可举出乙烯基、烯丙基、异丙烯基、丁烯基等,优选碳原子数为2~12的烯基。
[0214]
[(iii)碳原子数为2~60的炔基]
[0215]
作为碳原子数为2~60的炔基,可举出丙炔基、炔丙基、丁炔基等,优选碳原子数为2~12的炔基。
[0216]
作为r的碳原子数为1~60的有机基团的取代基,可举出:氰基;硝基;羟基;氟原子、氯原子、溴原子等卤原子;甲基、乙基等碳原子数为1~6的烷基;甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、叔丁氧基等碳原子数为1~6的烷氧基;甲氧基甲氧基、甲氧基乙氧基、乙氧基乙氧基等被碳原子数为1~6的烷氧基取代了的碳原子数为1~6的烷氧基;环丙基、环戊基、环己基、环庚基等碳原子数为3~8的环烷基;甲氨基、乙氨基、乙酰氨基、二甲氨基等取代氨基等。
[0217]
[rf]
[0218]
rf表示具有芳香族烃环和芳香族杂环中的至少一者的环状基团。
[0219]
在这些之中,更优选碳原子数为6~30的芳香族烃环基。
[0220]
‑
芳香族烃环
‑
[0221]
作为芳香族烃环,可举出例如苯环、萘环、蒽环、菲环、芘环、芴环等。在这些之中,优选苯环、萘环、蒽环、芴环,更优选苯环、萘环。
[0222]
‑
芳香族杂环
‑
[0223]
作为芳香族杂环,可举出例如1h
‑
异吲哚
‑
1,3(2h)
‑
二酮环、1
‑
苯并呋喃环、2
‑
苯并呋喃环、吖啶环、异喹啉环、咪唑环、吲哚环、二唑环、唑环、唑并吡嗪环、唑并吡啶环、唑并哒嗪环、唑并嘧啶环、喹唑啉环、喹喔啉环、喹啉环、噌啉环、噻二唑环、噻唑环、噻唑并吡嗪环、噻唑并吡啶环、噻唑并哒嗪环、噻唑并嘧啶环、噻吩环、三嗪环、三唑环、萘啶环、吡嗪环、吡唑环、吡喃酮环、吡喃环、吡啶环、哒嗪环、嘧啶环、吡咯环、菲啶环、酞嗪环、呋喃环、苯并[b]噻吩环、苯并[c]噻吩环、苯并异唑环、苯并异噻唑环、苯并咪唑环、苯并二唑环、苯并唑环、苯并噻二唑环、苯并噻唑环、苯并噻吩环、苯并三嗪环、苯并三唑环、苯并吡唑环、苯并吡喃酮环等。
[0224]
在这些之中,作为芳香族杂环,优选呋喃环、吡喃环、噻吩环、唑环、二唑环、噻唑环、噻二唑环等单环的芳香族杂环;以及苯并噻唑环、苯并唑环、喹啉环、1
‑
苯并呋喃环、2
‑
苯并呋喃环、苯并[b]噻吩环、1h
‑
异吲哚
‑
1,3(2h)
‑
二酮环、苯并[c]噻吩环、噻唑并吡啶环、噻唑并吡嗪环、苯并异唑环、苯并二唑环、苯并噻二唑环等稠环的芳香族杂环。
[0225]
rf具有的芳香族烃环和芳香族杂环可以具有取代基。作为该取代基,可举出:氟原子、氯原子等卤原子;氰基;甲基、乙基、丙基等碳原子数为1~6的烷基;乙烯基、烯丙基等碳原子数为2~6的烯基;三氟甲基、五氟乙基等至少一个氢原子被卤素取代了的碳原子数为1~6的烷基;二甲氨基等碳原子数为2~12的n,n
‑
二烷基氨基;甲氧基、乙氧基、异丙氧基等碳原子数为1~6的烷氧基;硝基;苯基、萘基等碳原子数为6~20的芳香族烃环基;
‑
ocf3;
‑
c(=o)
‑
r
x
;
‑
c(=o)
‑
o
‑
r
x
;
‑
o
‑
c(=o)
‑
r
x
;以及
‑
so2rb等。在此,r
x
表示“(i)可以具有取代基的碳原子数为1~20的烷基”、“(ii)可以具有取代基的碳原子数为2~20的烯基”、“(iii)可以具有取代基的碳原子数为3~12的环烷基”或“(iv)可以具有取代基的碳原子数为5~18的芳香族烃环基”。此外,rb表示:甲基、乙基等碳原子数为1~6的烷基;或苯基、4
‑
甲基苯基、4
‑
甲氧基苯基等可以具有碳原子数为1~6的烷基或碳原子数为1~6的烷氧基作为取代基的碳原子数为6~20的芳香族烃环基。
[0226]
在这些之中,作为rf具有的芳香族烃环和芳香族杂环的取代基,优选卤原子、氰基、碳原子数为1~6的烷基、碳原子数为1~6的烷氧基。
[0227]
另外,rf可以具有选自上述的取代基中的多个取代基。在rf具有多个取代基的情况下,取代基可以相同、也可以不同。
[0228]
‑‑
r
x
‑‑
[0229]
‑‑‑
(i)可以具有取代基的碳原子数为1~20的烷基
‑‑‑
[0230]
作为r
x
的“(i)可以具有取代基的碳原子数为1~20的烷基”的“碳原子数为1~20的烷基”,可举出:甲基、乙基、正丙基、异丙基、正丁基、异丁基、1
‑
甲基戊基、1
‑
乙基戊基、仲
丁基、叔丁基、正戊基、异戊基、新戊基、正己基、异己基、正庚基、正辛基、正壬基、正癸基、正十一烷基、正十二烷基、正十三烷基、正十四烷基、正十五烷基、正十六烷基、正十七烷基、正十八烷基、正十九烷基、正二十烷基等。
[0231]
另外,“(i)可以具有取代基的碳原子数为1~20的烷基”的碳原子数优选为1~12,进一步优选为1~10。
[0232]
‑‑‑
(ii)可以具有取代基的碳原子数为2~20的烯基
‑‑‑
[0233]
作为r
x
的“(ii)可以具有取代基的碳原子数为2~20的烯基”的“碳原子数为2~20的烯基”,可举出:乙烯基、丙烯基、异丙烯基、丁烯基、异丁烯基、戊烯基、己烯基、庚烯基、辛烯基、壬烯基、癸烯基、十一碳烯基、十二碳烯基、十三碳烯基、十四碳烯基、十五碳烯基、十六碳烯基、十七碳烯基、十八碳烯基、十九碳烯基、二十碳烯基等。
[0234]
另外,“(ii)可以具有取代基的碳原子数为2~20的烯基”的碳原子数优选为2~12。
[0235]
作为r
x
的“(i)可以具有取代基的碳原子数为1~20的烷基”的“碳原子数为1~20的烷基”和“(ii)可以具有取代基的碳原子数为2~20的烯基”的“碳原子数为2~20的烯基”的取代基,可举出:氟原子、氯原子等卤原子;氰基;二甲氨基等碳原子数为2~12的n,n
‑
二烷基氨基;甲氧基、乙氧基、异丙氧基、丁氧基等碳原子数为1~20的烷氧基;甲氧基甲氧基、甲氧基乙氧基等被碳原子数为1~12的烷氧基取代了的碳原子数为1~12的烷氧基;硝基;苯基、萘基等碳原子数为6~20的芳香族烃环基;三唑基、吡咯基、呋喃基、噻吩基、苯并噻唑
‑2‑
基硫基等碳原子数为2~20的芳香族杂环基;环丙基、环戊基、环己基等碳原子数为3~8的环烷基;环戊氧基、环己氧基等碳原子数为3~8的环烷氧基;四氢呋喃基、四氢吡喃基、二氧戊环基、二烷基等碳原子数为2~12的环状醚基;苯氧基、萘氧基等碳原子数为6~14的芳氧基;三氟甲基、五氟乙基、
‑
ch2cf3等至少一个氢原子被氟原子取代了的碳原子数为1~12的氟烷基;苯并呋喃基;苯并吡喃基;苯并二氧戊环基;苯并二烷基等。在这些之中,作为r
x
的“(i)可以具有取代基的碳原子数为1~20的烷基”的“碳原子数为1~20的烷基”和“(ii)可以具有取代基的碳原子数为2~20的烯基”的“碳原子数为2~20的烯基”的取代基,优选:氟原子、氯原子等卤原子;氰基;甲氧基、乙氧基、异丙氧基、丁氧基等碳原子数为1~20的烷氧基;硝基;苯基、萘基等碳原子数为6~20的芳香族烃环基;呋喃基、噻吩基、苯并噻唑
‑2‑
基硫基等碳原子数为2~20的芳香族杂环基;环丙基、环戊基、环己基等碳原子数为3~8的环烷基;三氟甲基、五氟乙基、
‑
ch2cf3等至少一个氢原子被氟原子取代了的碳原子数为1~12的氟烷基。
[0236]
另外,r
x
的“(i)可以具有取代基的碳原子数为1~20的烷基”的“碳原子数为1~20的烷基”和“(ii)可以具有取代基的碳原子数为2~20的烯基”的“碳原子数为2~20的烯基”可以具有选自上述的取代基中的多个取代基。在r
x
的“(i)可以具有取代基的碳原子数为1~20的烷基”的“碳原子数为1~20的烷基”和“(ii)可以具有取代基的碳原子数为2~20的烯基”的“碳原子数为2~20的烯基”具有多个取代基的情况下,多个取代基彼此可以相同、也可以不同。
[0237]
‑‑‑
(iii)可以具有取代基的碳原子数为3~12的环烷基
‑‑‑
[0238]
作为r
x
的“(iii)可以具有取代基的碳原子数为3~12的环烷基”的“碳原子数为3
~12的环烷基”,可举出环丙基、环丁基、环戊基、环己基、环辛基等。在这些之中,优选环戊基、环己基。
[0239]
作为r
x
的“(iii)可以具有取代基的碳原子数为3~12的环烷基”的“碳原子数为3~12的环烷基”的取代基,可举出:氟原子、氯原子等卤原子;氰基;二甲氨基等碳原子数为2~12的n,n
‑
二烷基氨基;甲基、乙基、丙基等碳原子数为1~6的烷基;甲氧基、乙氧基、异丙氧基等碳原子数为1~6的烷氧基;硝基;苯基、萘基等碳原子数为6~20的芳香族烃环基等。在这些之中,作为r
x
的“(iii)可以具有取代基的碳原子数为3~12的环烷基”的“碳原子数为3~12的环烷基”的取代基,优选:氟原子、氯原子等卤原子;氰基;甲基、乙基、丙基等碳原子数为1~6的烷基;甲氧基、乙氧基、异丙氧基等碳原子数为1~6的烷氧基;硝基;苯基、萘基等碳原子数为6~20的芳香族烃环基。
[0240]
另外,r
x
的“(iii)可以具有取代基的碳原子数为3~12的环烷基”的“碳原子数为3~12的环烷基”可以具有多个取代基。在r
x
的“(iii)可以具有取代基的碳原子数为3~12的环烷基”的“碳原子数为3~12的环烷基”具有多个取代基的情况下,多个取代基彼此可以相同、也可以不同。
[0241]
‑‑‑
(iv)可以具有取代基的碳原子数为5~18的芳香族烃环基
‑‑‑
[0242]
作为r
x
的“(iv)可以具有取代基的碳原子数为5~18的芳香族烃环基”的“碳原子数为5~18的芳香族烃环基”,可举出苯基、1
‑
萘基、2
‑
萘基等。在这些之中,优选苯基、萘基,更优选苯基、1
‑
萘基、2
‑
萘基。
[0243]
作为r
x
的“(iv)可以具有取代基的碳原子数为5~18的芳香族烃环基”的取代基,可举出:氟原子、氯原子等卤原子;氰基;二甲氨基等碳原子数为2~12的n,n
‑
二烷基氨基;甲氧基、乙氧基、异丙氧基、丁氧基等碳原子数为1~20的烷氧基;甲氧基甲氧基、甲氧基乙氧基等被碳原子数为1~12的烷氧基取代了的碳原子数为1~12的烷氧基;硝基;苯基、萘基等碳原子数为6~20的芳香族烃环基;三唑基、吡咯基、呋喃基、噻吩基等碳原子数为2~20的芳香族杂环基;环丙基、环戊基、环己基等碳原子数为3~8的环烷基;环戊氧基、环己氧基等碳原子数为3~8的环烷氧基;四氢呋喃基、四氢吡喃基、二氧戊环基、二烷基等碳原子数为2~12的环状醚基;苯氧基、萘氧基等碳原子数为6~14的芳氧基;三氟甲基、五氟乙基、
‑
ch2cf3等至少一个氢原子被氟原子取代了的碳原子数为1~12的氟烷基;
‑
ocf3;苯并呋喃基;苯并吡喃基;苯并二氧戊环基;苯并二烷基等。在这些之中,作为r
x
的“(iv)可以具有取代基的碳原子数为5~18的芳香族烃环基”的取代基,优选:选自氟原子、氯原子等卤原子;氰基;甲氧基、乙氧基、异丙氧基、丁氧基等碳原子数为1~20的烷氧基;硝基;苯基、萘基等碳原子数为6~20的芳香族烃环基;三唑基、吡咯基、呋喃基、噻吩基等碳原子数为2~20的芳香族杂环基;环丙基、环戊基、环己基等碳原子数为3~8的环烷基;三氟甲基、五氟乙基、
‑
ch2cf3等至少一个氢原子被氟原子取代了的碳原子数为1~12的氟烷基;
‑
ocf3中的至少一个取代基。
[0244]
另外,r
x
的“(iv)可以具有取代基的碳原子数为5~18的芳香族烃环基”的“碳原子数为5~18的芳香族烃环基”可以具有多个取代基。在r
x
的“(iv)可以具有取代基的碳原子数为5~18的芳香族烃环基”的“碳原子数为5~18的芳香族烃环基”具有多个取代基的情况下,取代基可以相同、也可以不同。
[0245]
在此,rf的具有芳香族烃环和芳香族杂环中的至少一者的环状基团的“碳原子数”是指不包含取代基的碳原子的、具有芳香族烃环和芳香族杂环中的至少一者的有机基团自身的碳原子数。
[0246]
在rf具有多个芳香族烃环和/或多个芳香族杂环的情况下,这些多个基团分别可以相同、也可以不同。
[0247]
上述rf优选为“具有碳原子数为6~30的芳香族烃环和碳原子数为2~30的芳香族杂环中的至少一者的环状基团”。
[0248]
rf的“具有碳原子数为6~30的芳香族烃环和碳原子数为2~30的芳香族杂环中的至少一者的环状基团”的优选的具体例子如下所示。但是,并不限于如下所示的具体例子。另外,在下述式中,
“‑”
表示从环的任意的位置延伸的与k的结合处。
[0249]
1)作为具有至少一个碳原子数为6~30的芳香族烃环的、可以具有取代基的烃环基的具体例子,可举出下述式(1
‑
1)~(1
‑
21)所表示的结构,优选式(1
‑
8)~(1
‑
21)等所表示的碳原子数为6~18的烃环基。另外,下述式(1
‑
1)~(1
‑
21)所表示的基团可以具有取代基。
[0250]
[化学式18]
[0251][0252]
[化学式19]
[0253][0254]
2)作为具有选自碳原子数为6~30的芳香族烃环和碳原子数为2~30的芳香族杂环中的至少一个芳香环的、可以具有取代基的杂环基的具体例子,可举出下述式(2
‑
1)~(2
‑
51)所表示的结构等,优选式(2
‑
11)~(2
‑
51)等所表示的碳原子数为2~16的杂环基。另外,下述式(2
‑
1)~(2
‑
51)所表示的基团可以具有取代基。
[0255]
[化学式20]
[0256][0257]
[化学式21]
[0258][0259]
[化学式22]
[0260][0261]
[化学式23]
[0262][0263]
[各式中,a表示
‑
ch2‑
、
‑
nrc
‑
、氧原子、硫原子、
‑
so
‑
或
‑
so2‑
,
[0264]
b和d各自独立地表示
‑
nrc
‑
、氧原子、硫原子、
‑
so
‑
或
‑
so2‑
,
[0265]
e表示
‑
nrc
‑
、氧原子或硫原子。
[0266]
在此,rc表示氢原子或甲基、乙基、丙基等碳原子数为1~6的烷基。(其中,在各式中,氧原子、硫原子、
‑
so
‑
、
‑
so2‑
各自不相邻。)]
[0267]
在上述之中,rf优选为上述式(1
‑
8)、式(1
‑
11)、式(1
‑
12)、式(1
‑
13)、式(1
‑
14)、式(1
‑
15)、式(1
‑
20)、式(2
‑
9)~式(2
‑
11)、式(2
‑
24)~式(2
‑
33)、式(2
‑
35)~式(2
‑
43)、式(2
‑
47)以及式(2
‑
49)~(2
‑
51)所表示的基团中的任一个。
[0268]
另外,rf中的环结构所包含的π电子的总数优选为4以上,更优选为6以上,进一步优选为8以上,特别优选为10以上,优选为20以下,更优选为18以下。
[0269]
进而,rf优选为下述(i
‑
1)~(i
‑
6)中的任一个。另外,下述式(i
‑
1)~(i
‑
6)所表示的基团可以具有取代基。
[0270]
[化学式24]
[0271][0272]
(式(i
‑
4)中,j表示
‑
ch2‑
、
‑
nr
d
‑
、氧原子、硫原子、
‑
so
‑
或
‑
so2‑
、r
d
表示氢原子或碳原子数为1~6的烷基。)
[0273]
另外,rf的“具有碳原子数为6~30的芳香族烃环和碳原子数为2~30的芳香族杂环中的至少一者的环状基团”可以具有一个以上的取代基。在具有多个取代基的情况下,多个取代基彼此可以相同、也可以不同。
[0274]
作为rf的“具有碳原子数为6~30的芳香族烃环和碳原子数为2~30的芳香族杂环中的至少一者的环状基团”具有的取代基,可举出例如:氟原子、氯原子等卤原子;氰基;甲基、乙基、丙基等碳原子数为1~6的烷基;乙烯基、烯丙基等碳原子数为2~6的烯基;三氟甲基、五氟乙基等至少一个氢原子被卤素取代了的碳原子数为1~6的烷基;二甲氨基等碳原子数为2~12的n,n
‑
二烷基氨基;甲氧基、乙氧基、异丙氧基等碳原子数为1~6的烷氧基;硝基;苯基、萘基等碳原子数为6~20的芳香族烃环基;
‑
ocf3;
‑
c(=o)
‑
r
x
;
‑
c(=o)
‑
o
‑
r
x
;
‑
o
‑
c(=o)
‑
r
x
;
‑
so2rb等。在此,r
x
和rb表示与上述相同的含义,其优选例也与上述相同。而且,在具有多个取代基的情况下,多个取代基彼此可以相同、也可以不同。
[0275]
在这些之中,优选选自卤原子、氰基、碳原子数为1~6的烷基以及碳原子数为1~6的烷氧基中的至少一个取代基。
[0276]
[k]
[0277]
k表示化学单键、
‑
o
‑
、
‑
s
‑
、
‑
c(=o)
‑
、
‑
o
‑
crbrc
‑
、
‑
crbrc
‑
o
‑
、
‑
o
‑
ch2‑
ch2‑
、
‑
ch2‑
ch2‑
o
‑
、
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
、
‑
c(=o)
‑
s
‑
、
‑
s
‑
c(=o)
‑
、
‑
nr
14
‑
c(=o)
‑
、
‑
c(=o)
‑
nr
14
‑
、
‑
ch=ch
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
ch=ch
‑
、
‑
ch2‑
ch2‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
ch2‑
ch2‑
、
‑
ch2‑
ch2‑
o
‑
c(=o)
‑
、
‑
c(=o)
‑
o
‑
ch2‑
ch2‑
、
‑
c(=o)
‑
o
‑
crbrc
‑
、
‑
crcrb
‑
o
‑
c(=o)
‑
、
‑
o
‑
c(=o)
‑
crbrc
‑
、
‑
crcrb
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
nr
14
‑
、
‑
nr
14
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
ch2‑
s
‑
、
‑
s
‑
ch2‑
c(=o)
‑
o
‑
或
‑
o
‑
c(=o)
‑
o
‑
。在此,r
14
表示氢原子或碳原子数为1~6的烷基,rc、rb各自独立地表示氢原子、碳原子数为6~12的可以具有取代基的芳香族烃环基或碳原子数为3~12的可以具有取代基的芳香族杂环基。
[0278]
作为k,在这些之中,优选化学单键、
‑
o
‑
、
‑
o
‑
crbrc
‑
、
‑
crcrb
‑
o
‑
、
‑
o
‑
ch2‑
ch2‑
、
‑
ch2‑
ch2‑
o
‑
、
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
、
‑
ch2‑
ch2‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
ch2‑
ch2‑
、
‑
ch2‑
ch2‑
o
‑
c(=o)
‑
、
‑
c(=o)
‑
o
‑
ch2‑
ch2‑
、
‑
c(=o)
‑
o
‑
crbrc
‑
、
‑
crcrb
‑
o
‑
c(=o)
‑
、
‑
o
‑
c(=o)
‑
crbrc
‑
、
‑
crcrb
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
nr
14
‑
、
‑
nr
14
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
ch2‑
s
‑
、
‑
s
‑
ch2‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
o
‑
,更优选化学单键、
‑
o
‑
、
‑
o
‑
crbrc
‑
、
‑
crcrb
‑
o
‑
、
‑
o
‑
ch2‑
ch2‑
、
‑
ch2‑
ch2‑
o
‑
、
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
、
‑
ch2‑
ch2‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
ch2‑
ch2‑
、
‑
ch2‑
ch2‑
o
‑
c(=o)
‑
、
‑
c(=o)
‑
o
‑
ch2‑
ch2‑
、
‑
c(=o)
‑
o
‑
crbrc
‑
、
‑
crcrb
‑
o
‑
c(=o)
‑
、
‑
o
‑
c(=o)
‑
crbrc
‑
、
‑
crcrb
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
nr
14
‑
、
‑
nr
14
‑
c(=o)
‑
o
‑
、
‑
s
‑
ch2‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
ch2‑
s
‑
,特别优选化学单键、
‑
o
‑
、
‑
o
‑
crbrc
‑
、
‑
crcrb
‑
o
‑
、
‑
o
‑
ch2‑
ch2‑
、
‑
ch2‑
ch2‑
o
‑
、
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
、
‑
ch2‑
ch2‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
ch2‑
ch2‑
、
‑
c(=o)
‑
o
‑
crbrc
‑
、
‑
crcrb
‑
o
‑
c(=o)
‑
、
‑
o
‑
c(=o)
‑
crbrc
‑
、
‑
crcrb
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
nr
14
‑
、
‑
nr
14
‑
c(=o)
‑
o
‑
、
‑
s
‑
ch2‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
ch2‑
s
‑
。
[0279]
在此,r
14
表示(i)氢原子或(ii)甲基、乙基等碳原子数为1~6的烷基,在这些之中,r
14
优选氢原子。
[0280]
rc、rb各自独立地表示氢原子、碳原子数为6~12的可以具有取代基的芳香族烃环基或碳原子数为3~12的可以具有取代基的芳香族杂环基。rc、rb彼此可以相同、也可以不同。
[0281]
作为rb和rc的碳原子数为6~12的可以具有取代基的芳香族烃环基或碳原子数为3~12的可以具有取代基的芳香族杂环基的具体例子,可举出与上述rf同样的基团之中的分别具有规定碳原子数的基团。作为rb、rc具有的取代基,可举出与上述rf具有的取代基同样的取代基,其优选的取代基也是同样的。此外,在具有多个取代基时,可以相同、也可以不同。
[0282]
rc、rb各自独立地优选氢原子、碳原子数为6~12的可以具有取代基的芳香族烃环基,进一步各自独立地优选氢原子、苯基或萘基,进一步地,特别优选rc和rb两者同时为氢原子的组合、氢原子与苯基的组合、或氢原子与萘基的组合。
[0283]
作为rf
‑
k
‑
的优选的组合,
[0284]
优选rf选自上述通式(i
‑
1)~(i
‑
6),k选自化学单键、
‑
o
‑
t、
‑
o
‑
crbrc
‑
t、
‑
crbrc
‑
o
‑
t、
‑
o
‑
ch2‑
ch2‑
t、
‑
ch2‑
ch2‑
o
‑
t、
‑
c(=o)
‑
o
‑
t、
‑
o
‑
c(=o)
‑
t、
‑
ch2‑
ch2‑
c(=o)
‑
o
‑
t、
‑
o
‑
c(=o)
‑
ch2‑
ch2‑
t、
‑
c(=o)
‑
o
‑
crbrc
‑
t、
‑
crbrc
‑
o
‑
c(=o)
‑
t、
‑
o
‑
c(=o)
‑
crbrc
‑
t、
‑
crbrc
‑
c(=o)
‑
o
‑
t、
‑
nr
14
‑
c(=o)
‑
o
‑
t、
‑
s
‑
ch2‑
c(=o)
‑
o
‑
t的组合。
[0285]
更优选rf选自上述通式(i
‑
1)~(i
‑
6),k选自化学单键、
‑
o
‑
t、
‑
crbrc
‑
o
‑
t、
‑
ch2‑
ch2‑
o
‑
t、
‑
c(=o)
‑
o
‑
t、
‑
o
‑
c(=o)
‑
t、
‑
ch2‑
ch2‑
c(=o)
‑
o
‑
t、
‑
crbrc
‑
o
‑
c(=o)
‑
t、
‑
crbrc
‑
c(=o)
‑
o
‑
t、
‑
nr
14
‑
c(=o)
‑
o
‑
t、
‑
s
‑
ch2‑
c(=o)
‑
o
‑
t的组合。
[0286]
进而,rf
‑
k
‑
特别优选为下述式(ii
‑
1)~(ii
‑
45)中的任一个,最优选为(iii
‑
1)~(iii
‑
46)中的任一个。rb、rc表示与上述相同的含义,t表示与ga结合的方向。此外,下述式(ii
‑
1)~(ii
‑
45)所表示的基团和(iii
‑
1)~(iii
‑
46)所表示的基团中的
●
(实心圆)表示与ga的结合部位。
[0287]
下述式(ii
‑
1)~(ii
‑
45)所表示的基团和(iii
‑
1)~(iii
‑
46)所表示的基团可以具有取代基。
[0288]
另外,在下述式(ii
‑
26)~(ii
‑
32)和下述式(iii
‑
26)~(iii
‑
32)中,j表示
‑
ch2‑
、
‑
nr
d
‑
、氧原子、硫原子、
‑
so
‑
或
‑
so2‑
,r
d
表示氢原子或碳原子数为1~6的烷基。
[0289]
[化学式25]
[0290][0291]
[化学式26]
[0292][0293]
[ga]
[0294]
ga为可以具有取代基的碳原子数为1~20的2价的有机基团,优选为可以具有取代基的碳原子数为3~20的2价的有机基团。
[0295]
ga更优选为(i)碳原子数为1~20的2价的脂肪族烃基、以及(ii)碳原子数为3~20的2价的脂肪族烃基所包含的
‑
ch2‑
中的至少一个被
‑
o
‑
、
‑
s
‑
、
‑
o
‑
c(=o)
‑
、
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
o
‑
、
‑
nr
15
‑
c(=o)
‑
、
‑
c(=o)
‑
nr
15
‑
、
‑
nr
15
‑
或
‑
c(=o)
‑
取代了的基团中的任一有机
基团。其中,不包含插入相邻的两个以上的
‑
o
‑
或相邻的2个以上的
‑
s
‑
的情况。
[0296]
在此,r
15
表示氢原子或碳原子数为1~6的烷基。在这些之中,优选氢原子或甲基。此外,作为ga的上述有机基团具有的取代基,可举出:甲基、乙基、丙基等碳原子数为1~5的烷基;甲氧基、乙氧基、丙氧基等碳原子数为1~5的烷氧基;氰基;氟原子、氯原子等卤原子。
[0297]
作为ga的上述取代基,可举出:羟基;甲基、乙基、丙基等碳原子数为1~5的烷基;甲氧基、乙氧基、异丙氧基等碳原子数为1~5的烷氧基;氰基;氟原子、氯原子等卤原子。
[0298]
在此,关于ga,上述“2价的脂肪族烃基”优选为2价的链状的脂肪族烃基,更优选为亚烷基。此外,上述“2价的脂肪族烃基”的碳原子数优选为3~20,更优选为3~18。而且,上述“2价的脂肪族烃基”优选为碳原子数为2~20的2价的脂肪族烃基,更优选为碳原子数为2~18的2价的链状的脂肪族烃基,进一步优选为碳原子数为2~18的亚烷基。
[0299]
关于ga的碳原子数,优选碳原子数为4~16,更优选碳原子数为5~14,特别优选碳原子数为6~12,最优选碳原子数为6~10。
[0300]
作为ga的结构,优选碳原子数为4~16的未取代的亚烷基,更优选碳原子数为5~14的未取代的亚烷基,进一步优选碳原子数为6~12的未取代的亚烷基,特别优选碳原子数为6~10的未取代的亚烷基,最优选正亚己基、正亚辛基。
[0301]
另外,在ga的碳原子数为3以上的情况下,优选ga的两末端为
‑
ch2‑
(ga的两末端没有被取代)。此外,在“(ii)碳原子数为3~20的2价的脂肪族烃基所包含的
‑
ch2‑
的至少一个被
‑
o
‑
、
‑
s
‑
、
‑
o
‑
c(=o)
‑
、
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
o
‑
、
‑
nr
15
‑
c(=o)
‑
、
‑
c(=o)
‑
nr
15
‑
、
‑
nr
15
‑
或
‑
c(=o)
‑
取代了的基团”中,优选
‑
o
‑
和
‑
s
‑
不取代脂肪族烃基中的连续的
‑
ch2‑
(即不形成
‑
o
‑
o
‑
和
‑
s
‑
s
‑
的结构)(也就是说,优选不包含插入相邻的两个以上的
‑
o
‑
或相邻的两个以上的
‑
s
‑
的情况),优选
‑
c(=o)
‑
不取代脂肪族烃基中的连续的
‑
ch2‑
(即不形成
‑
c(=o)
‑
c(=o)
‑
的结构)。
[0302]
在碳原子数为3~20的2价的脂肪族烃基所包含的
‑
ch2‑
的至少一个被
‑
o
‑
、
‑
s
‑
、
‑
o
‑
c(=o)
‑
、
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
o
‑
、
‑
nr
15
‑
c(=o)
‑
、
‑
c(=o)
‑
nr
15
‑
、
‑
nr
15
‑
或
‑
c(=o)
‑
取代了的情况下,最优选被
‑
o
‑
取代,优选将每隔两个碳原子被
‑
o
‑
取代的所谓的亚乙基氧基作为重复单元、ga的两末端为
‑
ch2‑
。
[0303]
作为ga,优选(i)“碳原子数为1~18、优选碳原子数为3~18的2价的链状的脂肪族烃基、以及碳原子数为3~18的2价的链状的脂肪族烃基所包含的
‑
ch2‑
的至少一个被
‑
o
‑
、
‑
s
‑
、
‑
o
‑
c(=o)
‑
、
‑
c(=o)
‑
o
‑
或
‑
c(=o)
‑
取代了的基团中的任一有机基团,不包含插入相邻的2个以上的
‑
o
‑
或相邻的2个以上的
‑
s
‑
的情况”,更优选(ii)“碳原子数为3~18的2价的链状的脂肪族烃基”,进一步优选(iii)“碳原子数为3~18的亚烷基”,更进一步优选(iv)“碳原子数为4~16的未取代的亚烷基”,更进一步优选(v)“碳原子数为5~14的未取代的亚烷基”,更进一步优选(vi)“碳原子数为6~12的未取代的亚烷基”,特别优选(vii)“碳原子数为6~10的未取代的亚烷基”,最优选“正亚己基、正亚辛基、正亚癸基”。
[0304]
[gb]
[0305]
gb为可以具有取代基的碳原子数为1~20的有机基团,优选为可以具有取代基的碳原子数为3~20的有机基团。
[0306]
gb更优选为(i)可以具有取代基的碳原子数为1~20的脂肪族烃基、以及(ii)可以具有取代基的碳原子数为3~20的脂肪族烃基所包含的
‑
ch2‑
的至少一个被
‑
o
‑
、
‑
s
‑
、
‑
o
‑
c
(=o)
‑
、
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
o
‑
、
‑
nr
15
‑
c(=o)
‑
、
‑
c(=o)
‑
nr
15
‑
、
‑
nr
15
‑
或
‑
c(=o)
‑
取代了的基团中的任一有机基团。其中,不包含插入相邻的两个以上的
‑
o
‑
或相邻的两个以上的
‑
s
‑
的情况。
[0307]
在此,r
15
表示氢原子或碳原子数为1~6的烷基。在这些之中,优选氢原子或甲基。
[0308]
此外,作为gb的上述有机基团具有的取代基,可举出:羟基;甲基、乙基、丙基等碳原子数为1~5的烷基;甲氧基、乙氧基、丙氧基等碳原子数为1~5的烷氧基;氰基;氟原子、氯原子等卤原子;
‑
o
‑
c(=o)
‑
crg=ch2等聚合性基团等。在此,rg表示氢原子、甲基或氯原子。
[0309]
在此,关于gb,上述“脂肪族烃基”优选为链状的脂肪族烃基,更优选为烷基、炔基或烯基。而且,上述“脂肪族烃基”优选为碳原子数为2~20的脂肪族烃基,更优选为碳原子数为2~18的链状的脂肪族烃基,进一步优选为碳原子数为2~18的烷基(例如正己基)、碳原子数为2~18的炔基(例如2
‑
丁炔基)或碳原子数为2~18的烯基(例如1
‑
丁烯基)。
[0310]
关于gb的碳原子数,优选碳原子数为4~16,更优选碳原子数为4~14,特别优选碳原子数为4~12,最优选碳原子数为4~10。
[0311]
作为gb的结构,优选碳原子数为4~16的未取代的烷基、碳原子数为4~16的未取代的炔基或者碳原子数为4~16的未取代的烯基,更优选碳原子数为4~14的未取代的烷基、碳原子数为4~14的未取代的炔基或者碳原子数为4~14的未取代的烯基,进一步优选为碳原子数为4~12的未取代的烷基、碳原子数为4~12的未取代的炔基或者碳原子数为4~12的未取代的烯基,特别优选碳原子数为4~10的未取代的烷基、碳原子数为4~10的未取代的炔基或者碳原子数为4~10的未取代的烯基,进一步特别优选碳原子数为4~10的未取代的烷基,最优选正己基。
[0312]
另外,在gb的碳原子数为3以上的情况下,优选gb的单末端(与n的结合侧)为
‑
ch2‑
(gb的单末端没有被取代)。此外,在“(ii)碳原子数为3~20的脂肪族烃基所包含的
‑
ch2‑
的至少一个被
‑
o
‑
、
‑
s
‑
、
‑
o
‑
c(=o)
‑
、
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
o
‑
、
‑
nr
15
‑
c(=o)
‑
、
‑
c(=o)
‑
nr
15
‑
、
‑
nr
15
‑
、或
‑
c(=o)
‑
取代了的基团”中,优选
‑
o
‑
和
‑
s
‑
不取代脂肪族烃基中的连续的
‑
ch2‑
(即不形成
‑
o
‑
o
‑
和
‑
s
‑
s
‑
的结构)(也就是说,优选不包含插入相邻的2个以上的
‑
o
‑
或相邻的2个以上的
‑
s
‑
的情况),优选
‑
c(=o)
‑
不取代脂肪族烃基中的连续的
‑
ch2‑
(即不形成
‑
c(=o)
‑
c(=o)
‑
的结构)。
[0313]
在碳原子数为3~20的脂肪族烃基所包含的
‑
ch2‑
的至少一个被
‑
o
‑
、
‑
s
‑
、
‑
o
‑
c(=o)
‑
、
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
o
‑
、
‑
nr
15
‑
c(=o)
‑
、
‑
c(=o)
‑
nr
15
‑
、
‑
nr
15
‑
或
‑
c(=o)
‑
取代的情况下,最优选被
‑
o
‑
取代,优选将每隔2个碳原子被
‑
o
‑
取代的所谓的亚乙基氧基作为重复单元、ga的单末端(与n的结合侧)为
‑
ch2‑
。
[0314]
作为gb,优选(i)“可以具有取代基的碳原子数为1~18、优选碳原子数为3~18的链状的脂肪族烃基、以及可以具有取代基的碳原子数为3~18的链状的脂肪族烃基所包含的
‑
ch2‑
的至少一个被
‑
o
‑
、
‑
s
‑
、
‑
o
‑
c(=o)
‑
、
‑
c(=o)
‑
o
‑
或
‑
c(=o)
‑
取代的基团中的任一有机基团,不包含插入相邻的2个以上的
‑
o
‑
或相邻的2个以上的
‑
s
‑
的情况”,更优选(ii)“可以具有取代基的碳原子数为3~18的链状的脂肪族烃基”,进一步优选(iii)“可以具有取代基的碳原子数为3~18的烷基、炔基或烯基”,更进一步优选(iv)“碳原子数为4~16的未取代的烷基、碳原子数为4~16的未取代的炔基或碳原子数为4~16的未取代的烯基”,更
进一步优选(v)“碳原子数为4~14的未取代的烷基、碳原子数为4~14的未取代的炔基或碳原子数为4~14的未取代的烯基”,更进一步优选(vi)“碳原子数为4~12的未取代的烷基、碳原子数为4~12的未取代的炔基或碳原子数为4~12的未取代的烯基”,特别优选(vii)“碳原子数为4~10的未取代的烷基、碳原子数为4~10的未取代的炔基或碳原子数为4~10的未取代的烯基”,进一步特别优选碳原子数为4~10的未取代的烷基,最优选(viii)“正己基”。
[0315]
[q]
[0316]
式(iv
‑
1)~(iv
‑
4)中,q表示氢原子或可以具有取代基的碳原子数为1~6的烷基。作为可以具有取代基的碳原子数为1~6的烷基的碳原子数为1~6的烷基,可举出甲基、乙基、丙基以及异丙基等,作为取代基,可举出苯基和萘基等碳原子数为6~12的芳香族烃基。
[0317]
[r
i
~r
iv
]
[0318]
式(iv
‑
1)~(iv
‑
4)中,r
i
~r
iv
各自独立地表示氢原子;氟原子、氯原子等卤原子;甲基、乙基、丙基等碳原子数为1~6的烷基;氰基;硝基;三氟甲基、五氟乙基等至少一个氢原子被卤原子取代的碳原子数为1~6的烷基;甲氧基、乙氧基、异丙氧基等碳原子数为1~6的烷氧基;
‑
ocf3;
‑
c(=o)
‑
o
‑
r
a
;或
‑
o
‑
c(=o)
‑
r
a
,r
a
表示与上述相同的含义,其优选例也与上述相同。
[0319]
在这些之中,优选(i)r
i
~r
iv
均为氢原子、或(ii)r
i
~r
iv
之中的至少一个为可以具有取代基的碳原子数为1~6的烷氧基且其余为氢原子。
[0320]
r
i
~r
iv
可以全部相同、也可以不同,构成环的至少一个c
‑
r
i
~c
‑
r
iv
能够被氮原子取代。
[0321]
c
‑
r
i
~c
‑
r
iv
中的至少一个被氮原子取代的基团的具体例子如下所示。但是,c
‑
r
i
~c
‑
r
iv
中的至少一个被氮原子取代的基团并不限于这些。
[0322]
[化学式27]
[0323][0324]
[各式中,r
i
~r
iv
表示与上述相同的含义,其优选例也与上述相同。]
[0325]
[r0、p、p1、p2]
[0326]
式(iv
‑
1)~(iv
‑
4)中,r0表示:卤原子;甲基、乙基、丙基等碳原子数为1~6的烷基;氰基;硝基;三氟甲基、五氟乙基等至少一个氢原子被卤原子取代的碳原子数为1~6的烷基;甲氧基、乙氧基、丙氧基等碳原子数为1~6的烷氧基;
‑
ocf3;
‑
c(=o)
‑
o
‑
r
a
;或
‑
o
‑
c(=o)
‑
r
a
,r
a
表示与上述相同的含义,其优选例也与上述相同。
[0327]
作为r0,从提高溶解性的观点出发,优选:氟原子、氯原子等卤原子;甲基、乙基、丙
基等碳原子数为1~6的烷基;氰基;硝基;三氟甲基、五氟乙基等至少一个氢原子被卤原子取代的碳原子数为1~6的烷基;甲氧基、乙氧基、丙氧基等碳原子数为1~6的烷氧基。另外,在r0为多个的情况下,多个r0彼此可以相同、也可以不同。进而,式(iv
‑
1)~(iv
‑
4)中,p表示0~3的整数,p1表示0~4的整数,p2表示0或1,优选p、p1以及p2均为0。
[0328]
<<y3、y4>>
[0329]
式(iii)中,y3和y4各自独立地表示化学单键、
‑
o
‑
、
‑
o
‑
ch2‑
、
‑
ch2‑
o
‑
、
‑
o
‑
ch2‑
ch2、
‑
ch2‑
ch2‑
o
‑
、
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
、
‑
o
‑
c(=o)
‑
o
‑
、
‑
c(=o)
‑
s
‑
、
‑
s
‑
c(=o)
‑
、
‑
nr
13
‑
c(=o)
‑
、
‑
c(=o)
‑
nr
13
‑
、
‑
cf2‑
o
‑
、
‑
o
‑
cf2‑
、
‑
ch2‑
ch2‑
、
‑
cf2‑
cf2‑
、
‑
o
‑
ch2‑
ch2‑
o
‑
、
‑
ch=ch
‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
ch=ch
‑
、
‑
ch2‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
ch2‑
、
‑
ch2‑
o
‑
c(=o)
‑
、
‑
c(=o)
‑
o
‑
ch2‑
、
‑
ch2‑
ch2‑
c(=o)
‑
o
‑
、
‑
o
‑
c(=o)
‑
ch2‑
ch2‑
、
‑
ch2‑
ch2‑
o
‑
c(=o)
‑
、
‑
c(=o)
‑
o
‑
ch2‑
ch2‑
、
‑
ch=ch
‑
、
‑
n=ch
‑
、
‑
ch=n
‑
、
‑
n=c(ch3)
‑
、
‑
c(ch3)=n
‑
、
‑
n=n
‑
或
‑
c≡c
‑
。在此,r
13
表示氢原子或碳原子数为1~6的烷基。
[0330]
在这些中,y3和y4各自独立地优选为化学单键、
‑
o
‑
、
‑
o
‑
c(=o)
‑
、
‑
c(=o)
‑
o
‑
或
‑
o
‑
c(=o)
‑
o
‑
。
[0331]
<<a
23
、a
24
>>
[0332]
式(iii)中,a
23
和a
24
各自独立地表示与上述a2相同的含义,其优选例也与上述a2相同。
[0333]
<<b
21
、b
22
、y
21
、y
22
、l
21
、l
22
、r
31
、r
32
、d1、d2、e1、e2>>
[0334]
式(iii)中、b
21
、b
22
、y
21
、y
22
、l
21
、l
22
、r
31
、r
32
、d1、d2、e1、e2表示与上述相同的含义,其优选例也与上述相同。
[0335]
此外,聚合性化合物(iii)没有特别限定,优选具有以ar为中心的对称结构(即y3和y4相同、a
23
和a
24
相同、b
21
和b
22
相同、y
21
和y
22
相同、l
21
和l
22
相同、r
31
和r
32
相同、d1和d2相同、e1和e2相同(以ar为中心对称))。
[0336]
在此,聚合性化合物(iii)优选为下述式(v
‑
1)和(v
‑
2)中的任一个所表示的聚合性化合物,更优选为下述式(v
‑
1)。
[0337]
[化学式28]
[0338][0339]
[化学式29]
[0340][0341]
(式(v
‑
1)和(v
‑
2)中,r、q、r
i
~r
iv
、r0、y3、y4、a
23
、a
24
、b
21
、b
22
、y
21
、y
22
、l
21
、l
22
、r
31
、r
32
、d1、d2、e1、e2、p、p1以及p2表示与上述相同的含义,其优选例也与上述相同。)
[0342]
在此,作为上述式(v
‑
1)所表示的聚合性化合物,优选为下述式(iii
‑
1)所表示的聚合性化合物(iii
‑
1),更优选为下述式(iii
‑
2)所表示的聚合性化合物(iii
‑
2),特别优选为下述式(1)和(2)中的任一个。
[0343]
[化学式30]
[0344][0345]
(式(iii
‑
1)中,r、q、r
i
~r
iv
、r0、y3、y4、a
23
、a
24
、b
21
、b
22
、y
21
、y
22
、l
21
、l
22
、r
31
、r
32
、d1、d2、e1、e2以及p表示与上述相同的含义,其优选例也与上述相同。)
[0346]
[化学式31]
[0347][0348]
(式(iii
‑
2)中,r
i
~r
iv
、q以及r表示与上述相同的含义,其优选例也与上述相同。k和l各自独立地表示1~18的整数。)
[0349]
[化学式32]
[0350][0351]
[化学式33]
[0352][0353]
上述的聚合性化合物(iii)能够组合已知的合成反应来合成。即,能够参照各种文献(例如国际公开第2012/141245号、国际公开第2012/147904号、国际公开第2014/010325号、国际公开第2013/046781号、国际公开第2014/061709号、国际公开第2014/126113号、国际公开第2015/064698号、国际公开第2015
‑
140302号、国际公开第2015/129654号、国际公开第2015/141784号、国际公开第2016/159193号、国际公开第2012/169424号、国际公开第2012/176679号、国际公开第2015/122385号、日本特开2016
‑
190818号、国际公开第2017/150622号)等记载的方法来合成。
[0354]
例如,使通过本发明的中间体的制造方法制造的中间体所含有的化合物(i)与式(aa)所表示的苯甲醛化合物(aa)反应,由此得到下述式(ab)所表示的化合物(ab),其后,使化合物(ab)与下述式(ac)所表示的化合物(ac)反应,由此能够得到上述聚合性化合物(iii
‑
1)(q为氢原子,p为0)。
[0355]
另外,关于反应条件等的详细内容,能够参照国际公开2014/010325号公报、国际公开2015/064698号公报、国际公开2015/141784号公报来设定。
[0356]
[化学式34]
[0357][0358]
[化学式35]
[0359][0360]
(式(i)、式(ab)、式(ac)以及式(iii
‑
1)中,r3、y2、b2、l2、a2、fg2、d、e、y3、y4、a
23
、a
24
、b
21
、b
22
、y
21
、y
22
、l
21
、l
22
、r
31
、r
32
、d1、d2、e1、e2、r以及r
i
~r
iv
表示与上述相同的含义,其优选例也与上述相同。)
[0361]
<聚合性组合物>
[0362]
上述聚合性组合物至少含有聚合性化合物(iii)和聚合引发剂。
[0363]
另外,如后所述,上述聚合性组合物作为高分子、光学膜、光学各向异性体的制造原料有用。而且,根据上述聚合性组合物,能够良好地制造膜厚的面内均匀性优异、光学特性的面内均匀性得到改善的光学膜等。
[0364]
在此,从更高效地进行聚合性组合物所包含的聚合性化合物(iii)的聚合反应的观点出发,配合聚合引发剂。
[0365]
而且,作为使用的聚合引发剂,可举出自由基聚合引发剂、阴离子聚合引发剂、阳离子聚合引发剂等。
[0366]
作为自由基聚合引发剂,能够使用:热自由基产生剂,其为通过加热产生可引发聚合性化合物的聚合的活性种的化合物;光自由基产生剂,其为通过可见光线、紫外线(i线等)、远紫外线、电子束、x射线等的曝光产生可引发聚合性化合物的聚合的活性种的化合物中的任一种,优选使用光自由基产生剂。
[0367]
作为光自由基产生剂,能够举出:苯乙酮系化合物、双咪唑系化合物、三嗪系化合物、o
‑
酰基肟系化合物、盐系化合物、二苯乙酮系化合物、二苯甲酮系化合物、α
‑
二酮系化合物、多核醌系化合物、呫吨酮系化合物、重氮系化合物、酰亚胺磺酸酯系化合物等。这些化合物是通过曝光产生活性自由基或活性酸、或活性自由基和活性酸两者的成分。光自由基产生剂可以单独使用一种、或组合使用两种以上。
[0368]
作为苯乙酮系化合物的具体例子,能够举出:2
‑
羟基
‑2‑
甲基
‑1‑
苯基丙烷
‑1‑
酮、2
‑
甲基
‑1‑
[4
‑
(甲基硫代)苯基]
‑2‑
吗啉丙烷
‑1‑
酮、2
‑
苄基
‑2‑
二甲氨基
‑1‑
(4
‑
吗啉苯基)丁烷
‑1‑
酮、1
‑
羟基环己基苯基酮、2,2
‑
二甲氧基
‑
1,2
‑
二苯基乙烷
‑1‑
酮、1
‑
[4
‑
(苯硫基)苯基]
‑
辛烷
‑
1,2
‑
二酮2
‑
(o
‑
苯甲酰肟)等。
[0369]
作为双咪唑系化合物的具体例子,能够举出:2,2
’‑
双(2
‑
氯苯基)
‑
4,4’,5,5
’‑
四
(4
‑
乙氧基羰基苯基)
‑
1,2
’‑
双咪唑、2,2
’‑
双(2
‑
溴苯基)
‑
4,4’,5,5
’‑
四(4
‑
乙氧基羰基苯基)
‑
1,2
’‑
双咪唑、2,2
’‑
双(2
‑
氯苯基)
‑
4,4’,5,5
’‑
四苯基
‑
1,2
’‑
双咪唑、2,2
’‑
双(2,4
‑
二氯苯基)
‑
4,4’,5,5
’‑
四苯基
‑
1,2
’‑
双咪唑、2,2
’‑
双(2,4,6
‑
三氯苯基)
‑
4,4’,5,5
’‑
四苯基
‑
1,2
’‑
双咪唑、2,2
’‑
双(2
‑
溴苯基)
‑
4,4’,5,5
’‑
四苯基
‑
1,2
’‑
双咪唑、2,2
’‑
双(2,4
‑
二溴苯基)
‑
4,4’,5,5
’‑
四苯基
‑
1,2
’‑
双咪唑、2,2
’‑
双(2,4,6
‑
三溴苯基)
‑
4,4’,5,5
’‑
四苯基
‑
1,2
’‑
双咪唑等。
[0370]
另外,在使用双咪唑系化合物作为光聚合引发剂(光自由基产生剂)的情况下,在能够进一步改良灵敏度的方面上,优选并用供氢体。
[0371]
在此,“供氢体”是指能够对由于曝光从双咪唑系化合物中产生的自由基供给氢原子的化合物。作为供氢体,优选下述定义的硫醇系化合物、胺系化合物等。
[0372]
作为硫醇系化合物的具体例子,能够举出:2
‑
巯基苯并噻唑、2
‑
巯基苯并唑、2
‑
巯基苯并咪唑、2,5
‑
二巯基
‑
1,3,4
‑
噻二唑、2
‑
巯基
‑
2,5
‑
二甲氨基吡啶等。作为胺系化合物,能够举出4,4
’‑
双(二甲氨基)二苯甲酮、4,4
’‑
双(二乙氨基)二苯甲酮、4
‑
二乙氨基苯乙酮、4
‑
二甲氨基苯丙酮、4
‑
二甲氨基苯甲酸乙酯、4
‑
二甲氨基苯甲酸、4
‑
二甲氨基苯甲腈等。
[0373]
作为三嗪系化合物的具体例子,能够举出:2,4,6
‑
三(三氯甲基)
‑
s
‑
三嗪、2
‑
甲基
‑
4,6
‑
双(三氯甲基)
‑
s
‑
三嗪、2
‑
[2
‑
(5
‑
甲基呋喃
‑2‑
基)乙烯基]
‑
4,6
‑
双(三氯甲基)
‑
s
‑
三嗪、2
‑
[2
‑
(呋喃
‑2‑
基)乙烯基]
‑
4,6
‑
双(三氯甲基)
‑
s
‑
三嗪、2
‑
[2
‑
(4
‑
二乙氨基
‑2‑
甲基苯基)乙烯基]
‑
4,6
‑
双(三氯甲基)
‑
s
‑
三嗪、2
‑
[2
‑
(3,4
‑
二甲氧基苯基)乙烯基]
‑
4,6
‑
双(三氯甲基)
‑
s
‑
三嗪、2
‑
(4
‑
甲氧基苯基)
‑
4,6
‑
双(三氯甲基)
‑
s
‑
三嗪、2
‑
(4
‑
乙氧基苯乙烯基)
‑
4,6
‑
双(三氯甲基)
‑
s
‑
三嗪、2
‑
(4
‑
正丁氧基苯基)
‑
4,6
‑
双(三氯甲基)
‑
s
‑
三嗪等具有卤代甲基的三嗪系化合物。
[0374]
作为o
‑
酰基肟系化合物的具体例子,能够举出:1
‑
[4
‑
(苯硫基)苯基]
‑
庚烷
‑
1,2
‑
二酮
‑2‑
(o
‑
苯甲酰肟)、1
‑
[4
‑
(苯硫基)苯基]
‑
辛烷
‑
1,2
‑
二酮
‑2‑
(o
‑
苯甲酰肟)、1
‑
[4
‑
(苯甲酰基)苯基]
‑
辛烷
‑
1,2
‑
二酮2
‑
(o
‑
苯甲酰肟)、1
‑
[9
‑
乙基
‑6‑
(2
‑
甲基苯甲酰基)
‑
9h
‑
咔唑
‑3‑
基]
‑
乙酮
‑1‑
(o
‑
乙酰肟)、1
‑
[9
‑
乙基
‑6‑
(3
‑
甲基苯甲酰基)
‑
9h
‑
咔唑
‑3‑
基]
‑
乙酮
‑1‑
(o
‑
乙酰肟)、1
‑
(9
‑
乙基
‑6‑
苯甲酰基
‑
9h
‑
咔唑
‑3‑
基)
‑
乙酮
‑1‑
(o
‑
乙酰肟)、乙酮
‑1‑
[9
‑
乙基
‑6‑
(2
‑
甲基
‑4‑
四氢呋喃基苯甲酰基)
‑
9h
‑
咔唑
‑3‑
基]
‑1‑
(o
‑
乙酰肟)、乙酮
‑1‑
[9
‑
乙基
‑6‑
(2
‑
甲基
‑4‑
四氢吡喃基苯甲酰基)
‑
9h
‑
咔唑
‑3‑
基]
‑1‑
(o
‑
乙酰肟)、乙酮
‑1‑
[9
‑
乙基
‑6‑
(2
‑
甲基
‑5‑
四氢呋喃基苯甲酰基)
‑
9h
‑
咔唑
‑3‑
基]
‑1‑
(o
‑
乙酰肟)、乙酮
‑1‑
[9
‑
乙基
‑6‑
(2
‑
甲基
‑5‑
四氢吡喃基苯甲酰基)
‑
9h
‑
咔唑
‑3‑
基]
‑1‑
(o
‑
乙酰肟)、乙酮
‑1‑
[9
‑
乙基
‑6‑
{2
‑
甲基
‑4‑
(2,2
‑
二甲基
‑
1,3
‑
二氧戊环基)苯甲酰基}
‑
9h
‑
咔唑
‑3‑
基]
‑1‑
(o
‑
乙酰肟)、乙酮
‑1‑
[9
‑
乙基
‑6‑
(2
‑
甲基
‑4‑
四氢呋喃基甲氧基苯甲酰基)
‑
9h
‑
咔唑
‑3‑
基]
‑1‑
(o
‑
乙酰肟)、乙酮
‑1‑
[9
‑
乙基
‑6‑
(2
‑
甲基
‑4‑
四氢吡喃基甲氧基苯甲酰基)
‑
9h
‑
咔唑
‑3‑
基]
‑1‑
(o
‑
乙酰肟)、乙酮
‑1‑
[9
‑
乙基
‑6‑
(2
‑
甲基
‑5‑
四氢呋喃基甲氧基苯甲酰基)
‑
9h
‑
咔唑
‑3‑
基]
‑1‑
(o
‑
乙酰肟)、乙酮
‑1‑
[9
‑
乙基
‑6‑
(2
‑
甲基苯甲酰基)
‑
9h
‑
咔唑
‑3‑
基]
‑1‑
(o
‑
乙酰肟)、乙酮
‑1‑
[9
‑
乙基
‑6‑
(2
‑
甲基
‑5‑
四氢吡喃基甲氧基苯甲酰基)
‑
9h
‑
咔唑
‑3‑
基]
‑1‑
(o
‑
乙酰肟)、乙酮
‑1‑
[9
‑
乙基
‑6‑
{2
‑
甲基
‑4‑
(2,2
‑
二甲基
‑
1,3
‑
二氧戊环基)甲氧基苯甲酰基}
‑
9h
‑
咔唑
‑3‑
基]
‑1‑
(o
‑
乙酰肟)等。
[0375]
此外,作为光自由基产生剂,也能够直接使用市售品。作为具体例子,可举出:basf
公司制的、商品名:irgacure907、商品名:irgacure184、商品名:irgacure369、商品名:irgacure651、商品名:irgacure819、商品名:irgacure907以及商品名:irgacureoxe02和adeka公司制的、商品名:adeka arkls n1919t等。
[0376]
作为上述阴离子聚合引发剂,可举出:烷基锂化合物;联苯、萘、芘等的单锂盐或单钠盐;二锂盐、三锂盐等多官能性引发剂等。
[0377]
此外,作为上述阳离子聚合引发剂,可举出:硫酸、磷酸、高氯酸、三氟甲磺酸等质子酸;三氟化硼、氯化铝、四氯化钛、四氯化锡之类的路易斯酸;芳香族盐或芳香族盐与还原剂的并用体系。
[0378]
这些聚合引发剂能够单独使用一种或组合使用两种以上。
[0379]
另外,在上述聚合性组合物中,相对于100质量份的聚合性组合物所包含的聚合性化合物,聚合引发剂的配合比例通常为0.1~30质量份,优选为0.5~10质量份。
[0380]
此外,为了调节表面张力,在上述聚合性组合物中优选配合表面活性剂。作为该表面活性剂,没有特别限定,通常优选非离子系表面活性剂。作为该非离子系表面活性剂,使用市售品即可,例如作为含有含氟基团、亲水性基团以及亲油性基团的低聚物的非离子系表面活性剂,可举出例如:agc seimi chemical公司制的surflon系列(s242、s243、s386、s611、s651等)、dic公司制的megaface系列(f251、f554、f556、f562、rs
‑
75、rs
‑
76
‑
e等)、neos公司制的ftergent系列(ftx601ad、ftx602a、ftx601adh2、ftx650a等)等。此外,这些表面活性剂可以单独使用一种,也可以以任意的比率组合使用两种以上。
[0381]
在此,在上述聚合性组合物中,相对于100质量份的聚合性组合物所包含的聚合性化合物,表面活性剂的配合比例通常为0.01~10质量份,优选为0.01~2质量份。
[0382]
进而,在上述聚合性组合物中,除聚合性化合物、聚合引发剂、表面活性剂以外,还可以包含其它成分。作为其它成分,可举出:金属、金属配位化合物、染料、颜料、荧光材料、磷光材料、流平剂、触变剂、凝胶化剂、多糖类、紫外线吸收剂、红外线吸收剂、抗氧化剂、离子交换树脂、氧化钛等金属氧化物等。
[0383]
此外,作为其它成分,也可举出其它能够共聚的单体。具体地,没有特别限定,可举出例如4
‑
(2
‑
甲基丙烯酰氧基乙基氧基)苯甲酸
‑4’‑
甲氧基苯酯、4
‑
(6
‑
甲基丙烯酰氧基己基氧基)苯甲酸联苯酯、4
‑
(2
‑
丙烯酰氧基乙基氧基)苯甲酸
‑4’‑
氰基联苯酯、4
‑
(2
‑
甲基丙烯酰基氧基乙基氧基)苯甲酸
‑4’‑
氰基联苯酯、4
‑
(2
‑
甲基丙烯酰基氧基乙基氧基)苯甲酸
‑3’
,4
’‑
二氟苯酯、4
‑
(2
‑
甲基丙烯酰氧基乙基氧基)苯甲酸萘酯、4
‑
丙烯酰氧基
‑4’‑
癸基联苯酯、4
‑
丙烯酰氧基
‑4’‑
氰基联苯酯、4
‑
(2
‑
丙烯酰氧基乙基氧基)
‑4’‑
氰基联苯酯、4
‑
(2
‑
甲基丙烯酰氧基乙基氧基)
‑4’‑
甲氧基联苯酯、4
‑
(2
‑
甲基丙烯酰氧基乙基氧基)
‑4’‑
(4
”‑
氟苄基氧基)
‑
联苯酯、4
‑
丙烯酰氧基
‑4’‑
丙基环己基苯酯、4
‑
甲基丙烯酰基
‑4’‑
丁基双环己酯、4
‑
丙烯酰基
‑4’‑
戊基二苯乙炔、4
‑
丙烯酰基
‑4’‑
(3,4
‑
二氟苯基)双环己酯、4
‑
(2
‑
丙烯酰氧基乙基)苯甲酸(4
‑
戊基苯酯)、4
‑
(2
‑
丙烯酰氧基乙基)苯甲酸(4
‑
(4
’‑
丙基环己基)苯酯)、商品名“lc
‑
242”(basf公司制)、反式
‑
1,4
‑
双[4
‑
[6
‑
(丙烯酰氧基)己基氧基]苯基]环己烷二羧酸酯、以及日本特开2007
‑
002208号公报、日本特开2009
‑
173893号公报、日本特开2009
‑
274984号公报、日本特开2010
‑
030979号公报、日本特开2010
‑
031223号公报、日本特开2011
‑
006360号公报及日本特开2010
‑
24438号公报、国际公开第2012/141245号、国际公开第2012/147904号、国际公开第2012/169424号、国际公开第2012/76679号、国际公开第
2013/180217号、国际公开第2014/010325号、国际公开第2014/061709号、国际公开第2014/065176号、国际公开第2014/126113号、国际公开第2015/025793号、国际公开第2015/064698号、国际公开第2015/122384号、国际公开第2015/122385号所公开的化合物等能够共聚的单体。
[0384]
相对于100质量份的聚合性组合物所包含的聚合性化合物,这些其它成分的配合比例通常为0.005~50质量份。
[0385]
上述聚合性组合物通常能够通过使规定量的聚合性化合物、聚合引发剂以及根据期望配合的其它成分等混合、溶解在适当的有机溶剂中来制备。
[0386]
作为用于制备聚合性组合物的有机溶剂,可举出:环戊酮、环己酮、甲乙酮等酮类;乙酸丁酯、乙酸戊酯等乙酸酯类;氯仿、二氯甲烷、二氯乙烷等卤化烃类;1,4
‑
二烷、环戊基甲醚、四氢呋喃、四氢吡喃、1,3
‑
二氧戊环等醚类等。
[0387]
<高分子>
[0388]
高分子是聚合上述的聚合性化合物(iii)或上述的聚合性组合物得到的。
[0389]
在此,“聚合”除通常的聚合反应之外,还意味着包含交联反应的广泛的含义上的化学反应。
[0390]
而且,高分子通常具有来自聚合性化合物(iii)的单体单元。
[0391]
另外,高分子由于使用上述的聚合性化合物(iii)或上述的聚合性组合物制备,所以能够良好地作为光学膜等的构成材料使用。
[0392]
此外,高分子能够没有特别限定地制成膜状、粉体状、粉体集合的层状等根据用途的任意的形状使用。
[0393]
具体地,高分子的膜能够良好地作为后述的光学膜和光学各向异性体的构成材料使用,高分子的粉能够用于涂料、防伪物品、安全物品等,由高分子的粉形成的层能够良好地作为光学各向异性体的构成材料使用。
[0394]
而且,具体地,高分子能够通过如下的方法等优选地制造:(α)在适当的有机溶剂的存在下,进行上述的聚合性化合物(iii)或上述的聚合性组合物的聚合反应后,分离作为目标的高分子,将得到的高分子溶解在适当的有机溶剂中,制备溶液,将该溶液涂覆在适当的基板上,干燥得到的涂膜后,根据期望进行加热来得到;(β)将上述的聚合性化合物(iii)或上述的聚合性组合物溶解在有机溶剂中,将该溶液通过公知的涂覆方法涂敷在基板上后,进行脱溶剂,接下来通过加热或照射活性能量束来进行聚合反应。另外,可以单独聚合上述的聚合性化合物(iii)。
[0395]
作为在上述(α)的方法中用于聚合反应的有机溶剂,如果是非活性的有机溶剂,则没有特别限制。可举出例如:甲苯、二甲苯、均三甲苯等芳香族烃;环己酮、环戊酮、甲乙酮等酮类;乙酸丁酯、乙酸戊酯等乙酸酯类;氯仿、二氯甲烷、二氯乙烷等卤化烃类;环戊基甲醚、四氢呋喃、四氢吡喃等醚类等。
[0396]
在这些之中,从处理性优异的观点出发,优选沸点为60℃~250℃的有机溶剂,更优选沸点为60℃~150℃的有机溶剂。
[0397]
此外,作为在上述(α)的方法中作为用于溶解分离的高分子的有机溶剂和在上述(β)的方法中使用的有机溶剂,可举出:丙酮、甲乙酮、甲基异丁酮、环戊酮、环己酮等酮系溶剂;乙酸丁酯、乙酸戊酯等酯系溶剂;二氯甲烷、氯仿、二氯乙烷等卤化烃系溶剂;四氢呋喃、
四氢吡喃、1,2
‑
二甲氧基乙烷、1,4
‑
二烷、环戊基甲醚、1,3
‑
二氧戊环等醚系溶剂;n,n
‑
二甲基甲酰胺、n,n
‑
二乙基乙酰胺、二甲基亚砜、γ
‑
丁内酯、n
‑
甲基吡咯烷酮(n
‑
甲基
‑2‑
吡咯烷酮)等非质子性极性溶剂等。在这些之中,从处理容易的观点出发,优选溶剂的沸点为60℃~200℃的有机溶剂。这些溶剂可以单独使用,也可以组合使用两种以上。
[0398]
作为在上述(α)和(β)的方法中使用的基板,不论有机、无机,能够使用公知惯用的材质的基板。例如,作为有机材料,可举出:聚环烯烃[例如,zeonex、zeonor(注册商标;日本瑞翁公司制)、arton(注册商标;jsr公司制)以及apel(注册商标;三井化学公司制)]、聚对苯二甲酸乙二醇酯、聚碳酸酯、聚酰亚胺、聚酰胺、聚甲基丙烯酸甲酯、聚苯乙烯、聚氯乙烯、聚四氟乙烯、纤维素、三乙酸纤维素、聚醚砜等,作为无机材料,可举出:硅、玻璃、方解石等。
[0399]
此外,使用的基板可以是单层的也可以是层叠体。
[0400]
作为基板,优选由有机材料形成的基板,进一步优选将有机材料制成膜状的树脂膜。
[0401]
另外,作为基板,也可举出用于制作后述的光学各向异性体的基板等。
[0402]
此外,作为在(α)的方法中将高分子的溶液涂敷在基板上的方法和在(β)的方法中将聚合反应用的溶液涂敷在基板上的方法,能够使用公知的方法。具体地,能够使用例如帘式涂敷法、挤出涂敷法、辊涂法、旋涂法、浸涂法、棒涂法、喷涂法、滑动涂敷法、印刷涂敷法、凹版涂敷法、模涂法、狭缝涂敷法等。
[0403]
进而,作为上述(α)和(β)的方法中的干燥或脱溶剂的方法,能够使用自然干燥、加热干燥、减压干燥、减压加热干燥等。
[0404]
干燥温度如果能够对溶剂进行脱溶剂,则没有特别限制,关于下限温度,从可稳定地得到一定的温度的观点出发,优选为50℃以上,更优选为70℃以上。
[0405]
关于干燥温度的上限温度,从不对基板造成不良影响的范围的观点出发,优选为200℃以下,更优选为195℃以下。
[0406]
此外,作为使上述的聚合性化合物(iii)或上述的聚合性组合物聚合的方法,可举出照射活性能量束的方法、热聚合法等,从不需要加热、在室温进行反应的方面出发,优选照射活性能量束的方法。其中,从操作简便的方面出发,优选照射紫外线等光的方法。
[0407]
照射紫外线等光的温度如果是能够维持液晶相的温度,则没有特别限制,关于下限温度,从能够使光聚合稳定地进行的观点出发,优选为15℃以上,更优选为20℃以上。
[0408]
关于照射紫外线等光的温度的上限温度,从不对基板造成不良影响的范围的观点出发,优选为200℃以下,更优选为195℃以下。
[0409]
在此,光的照射时的温度优选为100℃以下。光照射强度通常为1w/m2~10kw/m2的范围,优选为5w/m2~2kw/m2的范围。紫外线的照射量优选为0.1mj/cm2以上,更优选为0.5mj/cm2以上,优选为5000mj/cm2以下,更优选为4000mj/cm2以下。
[0410]
如上所述地得到的高分子能够从基板转印使用,也能够从基板剥离单个地使用,还能够不从基板剥离直接作为光学膜等的构成材料使用。
[0411]
此外,从基板剥离的高分子能够用已知的方法粉碎,制成粉体状后使用。
[0412]
如上所述地得到的高分子的数均分子量优选为500~500000,进一步优选为5000~300000。如果该数均分子量处于该范围,则可得到高的硬度,处理性也优异,因此优选。高分子的数均分子量能够通过以单分散的聚苯乙烯作为标准试样、以四氢呋喃作为洗脱液的
凝胶渗透色谱(gpc)来测定。
[0413]
而且,根据高分子,能够得到膜厚的面内均匀性优异、光学特性的面内均匀性得到改善的光学膜等。
[0414]
<光学膜>
[0415]
光学膜包含使用高分子和/或聚合性化合物形成、具有光学功能的层。光学功能是指单纯的透射、反射、折射、双折射等。而且,光学膜可以是以高分子为具有光学功能的层的主要的构成材料的光学膜或具有光学功能的层含有聚合性化合物的光学膜。优选在以具有光学功能的层的全部构成成分为100质量%的情况下,以高分子为构成材料的光学膜的高分子的占有比例超过50质量%。此外,优选在以具有光学功能的层的全部构成成分为100质量%的情况下,包含聚合性化合物的光学膜含有0.01质量%以上的聚合性化合物。
[0416]
在此,光学膜可以为在可以具有取向膜的取向基板上形成后保持原样的形式(取向基板/(取向膜)/光学膜)、将光学膜转印到与取向基板不同的透明基板膜等的形式(透明基板膜/光学膜)、或在光学膜具有自支撑性的情况下为光学膜单层形式(光学膜)中的任一形式。
[0417]
另外,作为取向膜和取向基板,能够使用与后述的光学各相异性体相同的基板和取向膜。
[0418]
而且,光学膜能够通过如下的方法制造:(a)将包含聚合性化合物的溶液或聚合性组合物的溶液涂敷在取向基板上,干燥得到的涂膜,进行热处理(液晶的取向)以及光照射和/或加热处理(聚合);(b)将聚合性化合物或对聚合性组合物进行聚合得到液晶性高分子的溶液涂敷在取向基板上,任意地干燥得到的涂膜;(c)将包含聚合性化合物和树脂的溶液涂敷在取向基板上,干燥得到的涂膜。
[0419]
光学膜能够用于光学各向异性体、液晶显示元件用取向膜、滤色片、低通滤波器、光偏振棱镜、各种滤光片等。
[0420]
另外,光学膜可根据用mueller matrix polarimeter axoscan测定的波长400nm~800nm处的相位差求出。下述α值和β值优选处于规定的范围内。具体地,α值优选为0.70~0.99,更优选为0.75~0.90。此外,β值优选为1.00~1.25,更优选为1.01~1.20。
[0421]
α=(450nm处的相位差)/(550nm处的相位差)
[0422]
β=(650nm处的相位差)/(550nm处的相位差)
[0423]
<光学各向异性体>
[0424]
光学各向异性体具有以高分子为构成材料的层。
[0425]
光学各向异性体能够通过例如在基板上形成取向膜,在该取向膜上进一步形成由高分子形成的层(液晶层)来得到。另外,光学各向异性体可以为在基板上直接形成由高分子形成的层(液晶层)的光学各向异性体,也可以为仅通过由高分子形成的层(液晶层)而成的光学各向异性体。
[0426]
另外,由高分子形成的层可以由膜状的高分子形成,也可以为粉体状的高分子的集合体。
[0427]
在此,为了在面内沿一个方向对聚合性化合物进行取向限制,取向膜被形成在基板的表面。
[0428]
取向膜能够通过如下的方式得到:将含有聚酰亚胺、聚乙烯醇、聚酯、聚芳酯、聚酰
胺酰亚胺、聚醚酰亚胺等聚合物的溶液(取向膜用组合物)在基板上涂敷成膜状,使其干燥,然后在一个方向上进行摩擦处理等。
[0429]
取向膜的厚度优选为0.001~5μm,进一步优选为0.001~1.0μm。
[0430]
摩擦处理的方法没有特别限制,可举出例如用缠绕了由尼龙等合成纤维、木棉等天然纤维形成的布、毛毡的辊在一定方向上摩擦取向膜的方法。为了除去在进行摩擦处理时产生的微粉末(异物)使取向膜的表面处于清洁的状态,优选在摩擦处理后通过异丙醇等对取向膜进行清洗。
[0431]
此外,除进行摩擦处理的方法之外,通过对取向膜的表面照射偏振紫外线的方法也能够使其具有在面内在一个方向上进行取向限制的功能。
[0432]
作为形成取向膜的基板,可举出:玻璃基板、由合成树脂膜形成的基板等。作为上述合成树脂,可举出:丙烯酸树脂、聚碳酸酯树脂、聚醚砜树脂、聚对苯二甲酸乙二醇酯树脂、聚酰亚胺树脂、聚甲基丙烯酸甲酯树脂、聚砜树脂、聚芳酯树脂、聚乙烯树脂、聚苯乙烯树脂、聚氯乙烯树脂、二乙酸纤维素、三乙酸纤维素以及脂环式烯烃聚合物等热塑性树脂。
[0433]
作为脂环式烯烃聚合物,可举出:日本特开平05
‑
310845号公报、美国专利第5179171号说明书所记载的环状烯烃无规多元共聚物、日本特开平05
‑
97978号公报、美国专利第5202388号说明书所记载的加氢聚合物、日本特开平11
‑
124429号公报(国际公开99/20676号)所记载的热塑性双环戊二烯系开环聚合物及其加氢物等。
[0434]
作为在取向膜上形成由高分子形成的液晶层的方法,可举出与上述高分子的项中记载的方法相同的方法(上述(α)和(β))。
[0435]
得到的液晶层的厚度没有特别限制,通常为1~10μm。
[0436]
另外,作为光学各相异性体的一种,没有特别限定,可举出相位差片、视角扩大片等。
[0437]
另外,光学各相异性体可根据用mueller matrix polarimeter axoscan测定的波长400nm~800nm处的相位差求出。下述α值和β值优选处于规定的范围内。具体地,α值优选为0.70~0.99,更优选为0.75~0.90。此外,β值优选为1.00~1.25,更优选为1.01~1.25。
[0438]
α=(450nm处的相位差)/(550nm处的相位差)
[0439]
β=(650nm处的相位差)/(550nm处的相位差)
[0440]
<偏振片等>
[0441]
偏振片包含光学各向异性体和偏振膜。
[0442]
作为偏振片的具体例子,可举出光学各向异性体直接或隔着其它层(玻璃片等)层叠在偏振膜上而成的偏振片。
[0443]
偏振膜的制造方法没有特别限定。作为制造pva系的偏振膜的方法,可举出:在使pva系膜吸附碘离子后沿单轴拉伸的方法、在将pva系膜沿单轴拉伸后使其吸附碘离子的方法、同时进行碘离子向pva系膜的吸附和单轴拉伸的方法、在用二向色性染料将pva系膜染色后沿单轴拉伸的方法、在将pva系膜沿单轴拉伸后用二向色性染料染色的方法、同时进行用二向色性染料对pva系膜染色和单轴拉伸的方法。此外,作为制造聚烯系的偏振膜的方法,可举出:在将pva系膜沿单轴拉伸后在脱水催化剂存在下进行加热
·
脱水的方法;在将聚氯乙烯系膜沿单轴拉伸后在脱盐酸催化剂存在下进行加热
·
脱水的方法等。
[0444]
在偏振片中,偏振膜和光学各向异性体可以经由由粘接剂(包含粘结剂)形成的粘
接层相接。粘接层的平均厚度通常为0.01μm~30μm,优选为0.1μm~15μm。上述粘接层优选为根据jis k7113的拉伸破坏强度为40mpa以下的层。
[0445]
作为构成粘接层的粘接剂,可举出:丙烯酸粘接剂、聚氨酯粘接剂、聚酯粘接剂、聚乙烯醇粘接剂、聚烯烃系粘接剂、改性聚烯烃粘接剂、聚乙烯基烷基醚粘接剂、橡胶粘接剂、氯乙烯
·
乙酸乙烯酯粘接剂、苯乙烯
·
丁二烯
·
苯乙烯共聚物(sbs共聚物)粘接剂、其加氢物(sebs共聚物)粘接剂、乙烯
·
乙酸乙烯酯共聚物和乙烯
·
苯乙烯共聚物等乙烯粘接剂、以及乙烯
·
甲基丙烯酸甲酯共聚物、乙烯
·
丙烯酸甲酯共聚物、乙烯
·
甲基丙烯酸乙酯共聚物和乙烯
·
丙烯酸乙酯共聚物等丙烯酸酯粘接剂等。
[0446]
偏振片由于使用了光学各向异性体,所以具有反向波长色散性,并且光学特性的面内均匀性优异。
[0447]
此外,通过使用偏振片,能够优选地制造具有面板的显示装置、防反射膜。作为上述面板,可举出液晶面板、有机电致发光面板。作为上述显示装置,可举出具有偏振片和液晶面板的平板显示装置、具有液晶面板和有机电致发光面板的有机电致发光显示装置。
[0448]
实施例
[0449]
以下,基于实施例对本发明进行具体说明,但本发明并不限定于这些实施例。需要说明的是,在以下说明中,只要没有特别说明,表示量的“%”和“份”为质量基准。
[0450]
(实施例1:化合物1的合成)
[0451]
经过后述的步骤1和步骤2,得到下述结构式所表示的化合物1。
[0452]
[化学式36]
[0453][0454]
<步骤1:化合物a的合成>
[0455]
首先,用国际公开第2017/150622号所记载的方法合成下述结构式所表示的化合物a(步骤1)。
[0456]
[化学式37]
[0457][0458]
<步骤2:化合物1的合成>
[0459]
接下来,在氮气流中,在具有温度计的3口反应器中加入83.05g(0.397mol)的反式
‑
1,4
‑
环己二酰氯和830g的环戊基甲醚(cpme)。向其中加入100.0g(0.378mol)的在之前的步骤1中合成的化合物a,将反应器浸在冰浴中,使反应液内温为0℃。接下来,一边将反应液内温保持在10℃以下一边历经20分钟缓慢滴加40.2g(0.397mol)的三乙胺(et3n)。滴加结束后,就这样在10℃以下进一步搅拌1小时。向得到的反应液中加入250g的水,在50℃搅拌2小时。进行分液,抽出水层后,重新加入250g的水,在50℃搅拌2小时。合计实施3次该操作。用高效液相色谱对该阶段的有机层(溶液(x))中的化合物1的浓度进行定量,结果为10.57质量%。反应式如下所示。需要说明的是,在该阶段的有机层中,包含44.9g的下述结构式所表示的化合物x。
[0460]
[化学式38]
[0461][0462]
[化学式39]
[0463][0464]
进而,向得到的有机层中加入200g的甲醇,缓缓冷却至0℃,缓慢搅拌1小时,由此使固体析出。通过过滤除去析出的固体,得到滤液。用100g的另外准备的冷却至0℃的甲醇清洗过滤器中的过滤物,将通过该清洗得到的清洗液与之前的滤液合并。进一步使用416g的浓度1mol/升的由乙酸和乙酸钠形成的缓冲溶液(ph5.5)将合并了上述清洗液的滤液在40℃搅拌30分钟,进行清洗。清洗后进行分液,抽出水层后,重新加入416g的浓度1mol/升的由乙酸和乙酸钠形成的缓冲溶液(ph5.5),在40℃搅拌30分钟。合计实施5次该操作,进行分液,在抽出水层得到的有机层(油层)中加入1200g的正己烷,缓缓冷却至0℃,由此使固体析出,滤取析出的固体。用正己烷清洗过滤物后,真空干燥,得到98.55g的作为中间体的白色固体(化合物1和化合物x的混合物y)。用高效液相色谱对得到的白色固体(化合物1和化合物x的混合物y)进行定量,结果化合物1相对于白色固体(化合物1和化合物x的混合物y)的含量为92.6质量%。以化合物a基准计,化合物1的收率为57.64摩尔%。
[0465]
(实施例2:化合物1的合成)
[0466]
在氮气流中,在具有温度计的3口反应器中加入83.05g(0.397mol)的反式
‑
1,4
‑
环己二酰氯和830g的环戊基甲醚(cpme)。向其中加入100.0g(0.378mol)的在上述实施例1的步骤1中合成的化合物a,将反应器浸在冰浴中,使反应液内温为0℃。接下来,一边将反应液内温保持在10℃以下一边历经20分钟缓慢滴加40.2g(0.397mol)的三乙胺(et3n)。滴加结束后,就这样在10℃以下进一步搅拌1小时。在得到的反应液中加入250g的水,在50℃搅拌2小时。进行分液,抽出水层后,重新加入250g的水,在50℃进行搅拌2小时。合计实施3次该操作。进一步使用416g的浓度1mol/升的由乙酸和乙酸钠形成的缓冲溶液(ph5.5)将有机层在40℃搅拌30分钟进行清洗。清洗后,进行分液,抽出水层后,重新加入416g的浓度1mol/升的由乙酸和乙酸钠形成的缓冲溶液(ph5.5),在40℃搅拌30分钟。合计实施5次该操作。用高效液相色谱对该阶段的有机层(溶液(x))中的化合物1的浓度进行定量,结果为10.58质量%。另外,在该阶段的有机层中,包含44.8g的上述结构式所表示的化合物x。
[0467]
进而,在得到的有机层中加入200g的甲醇,缓缓冷却至0℃,缓慢搅拌1小时,由此使固体析出。通过过滤除去析出的固体,得到滤液。用100g的另外准备的冷却至0℃的甲醇清洗过滤器中的过滤物,将通过该清洗得到的清洗液与之前的滤液合并。在5℃对上述合并了清洗液的滤液加入250g的水,搅拌30分钟,进行清洗。清洗后,进行分液,抽出水层后,重新加入250g的水,搅拌30分钟进行清洗,分液,在抽出水层得到的有机层(油层)中加入1200g的正己烷,缓缓冷却至0℃,由此使固体析出,滤取析出的固体。用正己烷清洗过滤物后,真空干燥,得到98.88g的作为中间体的白色固体(化合物1和化合物x的混合物y)。用高效液相色谱对得到的白色固体(化合物1和化合物x的混合物y)进行定量,结果化合物1相对
于白色固体(化合物1和化合物x的混合物y)的含量为91.8质量%。以化合物a基准计,化合物1的收率为57.33摩尔%。
[0468]
(实施例3:化合物1的合成)
[0469]
在氮气流中,在具有温度计的3口反应器中加入83.05g(0.397mol)的反式
‑
1,4
‑
环己二酰氯和830g的环戊基甲醚(cpme)。向其中加入100.0g(0.378mol)的在上述实施例1的步骤1中合成的化合物a,将反应器浸在冰浴中,使反应液内温为0℃。接下来,一边将反应液内温保持在10℃以下一边历经20分钟缓慢滴加40.2g(0.397mol)的三乙胺(et3n)。滴加结束后,就这样在10℃以下进一步搅拌1小时。在得到的反应液中加入250g的水,在50℃搅拌2小时。进行分液,抽出水层后,重新加入250g的水,在50℃搅拌2小时。合计实施3次该操作。用高效液相色谱对该阶段的有机层(溶液(x))中的化合物1的浓度进行定量,结果为10.59质量%。另外,在该阶段的有机层中,包含45.0g的上述结构式所表示的化合物x。
[0470]
进而,在得到的有机层中加入50g的甲醇,缓缓冷却至0℃,缓慢搅拌1小时,由此使固体析出。通过过滤除去析出的固体,得到滤液。用100g的另外准备的冷却至0℃的甲醇清洗过滤器中的过滤物,将通过该清洗得到的清洗液与之前的滤液合并。进一步使用416g的浓度1mol/升的由乙酸和乙酸钠形成的缓冲溶液(ph5.5)将上述合并了清洗液的滤液在40℃搅拌30分钟,进行清洗。清洗后,进行分液,抽出水层后,重新加入416g的浓度1mol/升的由乙酸和乙酸钠形成的缓冲溶液(ph5.5),在40℃搅拌30分钟。合计实施5次该操作,进行分液,在抽出水层得到的有机层(油层)中加入1200g的正己烷,缓缓冷却至0℃,由此使固体析出,滤取析出的固体。用正己烷清洗过滤物后,真空干燥,得到99.22g的作为中间体的白色固体(化合物1和化合物x的混合物y)。用高效液相色谱对得到的白色固体(化合物1和化合物x的混合物y)进行定量,结果化合物1相对于白色固体(化合物1和化合物x的混合物y)的含量为92.5质量%。以化合物a基准计,化合物1的收率为57.97摩尔%。
[0471]
(实施例4:化合物1的合成)
[0472]
在氮气流中,在具有温度计的3口反应器中加入83.05g(0.397mol)的反式
‑
1,4
‑
环己二酰氯和830g的环戊基甲醚(cpme)。向其中加入100.0g(0.378mol)的在上述实施例1的步骤1中合成的化合物a,将反应器浸在冰浴中,使反应液内温为0℃。接下来,一边将反应液内温保持在10℃以下一边历经20分钟缓慢滴加40.2g(0.397mol)的三乙胺(et3n)。滴加结束后,就这样在10℃以下进一步搅拌1小时。在得到的反应液中加入250g的水,在50℃搅拌2小时。进行分液,抽出水层后,重新加入250g的水,在50℃进行搅拌2小时。合计实施3次该操作。进一步使用416g的浓度1mol/升的由乙酸和乙酸钠形成的缓冲溶液(ph5.5)以在40℃搅拌30分钟的方式清洗有机层。清洗后,进行分液,抽出水层后,重新加入416g的浓度1mol/升的由乙酸和乙酸钠形成的缓冲溶液(ph5.5),在40℃搅拌30分钟。合计实施5次该操作。用高效液相色谱对该阶段的有机层(溶液(x))中的化合物1的浓度进行定量,结果为10.59质量%。需要说明的是,在该阶段的有机层中,包含44.5g的上述结构式所表示的化合物x。
[0473]
进而,在得到的有机层中加入50g的甲醇,缓缓冷却至0℃,缓慢搅拌1小时,由此使固体析出。通过过滤除去析出的固体,得到滤液。用100g的另外准备的冷却至0℃的甲醇清洗过滤器中的过滤物,将通过该清洗得到的清洗液与之前的滤液合并。在5℃对上述合并了清洗液的滤液加入250g的水,搅拌30分钟,进行清洗。清洗后,进行分液,抽出水层后,重新加入250g的水,搅拌30分钟进行清洗,进行分液,在抽出水层得到的有机层(油层)中加入
1200g的正己烷,缓缓冷却至0℃,由此使固体析出,滤取析出的固体。用正己烷清洗过滤物后,真空干燥,得到99.88g的作为中间体的白色固体(化合物1和化合物x的混合物y)。用高效液相色谱对得到的白色固体(化合物1和化合物x的混合物y)进行定量,结果化合物1相对于白色固体(化合物1和化合物x的混合物y)的含量为92.5质量%。以化合物a基准计,化合物1的收率为58.35摩尔%。
[0474]
(实施例5:化合物1的合成)
[0475]
在氮气流中,在具有温度计的3口反应器中加入83.05g(0.397mol)的反式
‑
1,4
‑
环己二酰氯和830g的环戊基甲醚(cpme)。向其中加入100.0g(0.378mol)的在上述实施例1的步骤1中合成的化合物a,将反应器浸在冰浴中,使反应液内温为0℃。接下来,一边将反应液内温保持在10℃以下一边历经20分钟缓慢滴加40.2g(0.397mol)的三乙胺(et3n)。滴加结束后,就这样在10℃以下进一步搅拌1小时。在得到的反应液中加入250g的水,在50℃搅拌2小时。进行分液,抽出水层后,重新加入250g的水,在50℃搅拌2小时。合计实施3次该操作。用高效液相色谱对该阶段的有机层(溶液(x))中的化合物1的浓度进行定量,结果为10.56质量%。需要说明的是,在该阶段的有机层中,包含44.2g的上述结构式所表示的化合物x。
[0476]
进而,在得到的有机层中加入300g的甲醇,缓缓冷却至0℃,缓慢搅拌1小时,由此使固体析出。通过过滤除去析出的固体,得到滤液。用100g的另外准备的冷却至0℃的甲醇清洗过滤器中的过滤物,将通过该清洗得到的清洗液与之前的滤液合并。进一步使用416g的浓度1mol/升的由乙酸和乙酸钠形成的缓冲溶液(ph5.5)将上述合并了清洗液的滤液在40℃搅拌30分钟,进行清洗。清洗后,进行分液,抽出水层后,重新加入416g的浓度1mol/升的由乙酸和乙酸钠形成的缓冲溶液(ph5.5),在40℃搅拌30分钟。该操作合计实施5次,进行分液,在抽出水层得到的有机层(油层)中加入1200g的正己烷,缓缓冷却至0℃,由此使固体析出,滤取析出的固体。用正己烷清洗过滤物后,真空干燥,得到100.1g的作为中间体的白色固体(化合物1和化合物x的混合物y)。用高效液相色谱对得到的白色固体(化合物1和化合物x的混合物y)进行定量,结果化合物1相对于白色固体(化合物1和化合物x的混合物y)的含量为91.8质量%。以化合物a基准计,化合物1的收率为58.04摩尔%。
[0477]
(实施例6:化合物1的合成)
[0478]
在氮气流中,在具有温度计的3口反应器中加入83.05g(0.397mol)的反式
‑
1,4
‑
环己二酰氯和830g的环戊基甲醚(cpme)。在其中加入100.0g(0.378mol)的在上述实施例1的步骤1中合成的化合物a,将反应器浸在冰浴中,使反应液内温为0℃。接下来,一边将反应液内温保持在10℃以下一边历经20分钟缓慢滴加40.2g(0.397mol)的三乙胺(et3n)。滴加结束后,就这样在10℃以下进一步搅拌1小时。在得到的反应液中加入250g的水,在50℃搅拌2小时。进行分液,抽出水层后,重新加入250g的水,在50℃搅拌2小时。合计实施3次该操作。进一步使用416g的浓度1mol/升的由乙酸和乙酸钠形成的缓冲溶液(ph5.5)以在40℃搅拌30分钟的方式清洗有机层。清洗后,进行分液,抽出水层后,重新加入416g的浓度1mol/升的由乙酸和乙酸钠形成的缓冲溶液(ph5.5),在40℃搅拌30分钟。合计实施5次该操作。用高效液相色谱对该阶段的有机层(溶液(x))中的化合物1的浓度进行定量,结果为10.57质量%。需要说明的是,在该阶段的有机层中,包含45.2g的上述结构式所表示的化合物x。
[0479]
进而,在得到的有机层中加入300g的甲醇,缓缓冷却至0℃,缓慢搅拌1小时,由此使固体析出。通过过滤除去析出的固体,得到滤液。用100g的另外准备的冷却至0℃的甲醇
清洗过滤器中的过滤物,将通过该清洗得到的清洗液与之前的滤液合并。在5℃对上述合并了清洗液的滤液加入250g的水,搅拌30分钟,进行清洗。清洗后,进行分液,抽出水层后,重新加入250g的水,搅拌30分钟进行清洗,进行分液,在抽出水层得到的有机层(油层)中加入1200g的正己烷,缓缓冷却至0℃,由此使固体析出,滤取析出的固体。用正己烷清洗过滤物后,真空干燥,得到98.9g的作为中间体的白色固体(化合物1和化合物x的混合物y)。用高效液相色谱对得到的白色固体(化合物1和化合物x的混合物y)进行定量,结果化合物1相对于白色固体(化合物1和化合物x的混合物y)的含量为89.8质量%。以化合物a基准计,化合物1的收率为56.09摩尔%。
[0480]
(比较例1:化合物1的合成)
[0481]
在氮气流中,在具有温度计的3口反应器中加入83.05g(0.397mol)的反式
‑
1,4
‑
环己二酰氯和830g的环戊基甲醚(cpme)。向其中加入100.0g(0.378mol)的在上述实施例1的步骤1中合成的化合物a,将反应器浸在冰浴中,使反应液内温为0℃。接下来,一边将反应液内温保持在10℃以下一边历经20分钟缓慢滴加40.2g(0.397mol)的三乙胺(et3n)。滴加结束后,就这样在10℃以下进一步搅拌1小时。在得到的反应液中加入250g的水,在50℃搅拌2小时。进行分液,抽出水层后,重新加入250g的水,在50℃搅拌2小时。合计实施3次该操作。用高效液相色谱对该阶段的有机层(溶液(x))中的化合物1的浓度进行定量,结果为10.59质量%。需要说明的是,在该阶段的有机层中,包含44.3g的上述结构式所表示的化合物x。
[0482]
进而,将得到的有机层缓缓冷却,在0℃缓慢搅拌1小时,由此使固体析出。通过过滤除去析出的固体,得到滤液。用100g的另外准备的冷却至0℃的cpme清洗过滤器中的过滤物,将通过该清洗得到的清洗液与之前的滤液合并。进一步使用416g的浓度1mol/升的由乙酸和乙酸钠形成的缓冲溶液(ph5.5)将上述合并了清洗液的滤液在40℃搅拌30分钟,进行清洗。清洗后,进行分液,抽出水层后,重新加入416g的浓度1mol/升的由乙酸和乙酸钠形成的缓冲溶液(ph5.5),在40℃搅拌30分钟。合计实施5次该操作,进行分液,在抽出水层得到的有机层(油层)中加入1200g的正己烷,缓缓冷却至0℃,由此使固体析出,滤取析出的固体。用正己烷清洗过滤物后,真空干燥,得到73.8g的作为中间体的白色固体(化合物1和化合物x的混合物y)。用高效液相色谱对得到的白色固体(化合物1和化合物x的混合物y)进行定量,结果化合物1相对于白色固体(化合物1和化合物x的混合物y)的含量为91.5质量%。以化合物a基准计,化合物1的收率为42.65摩尔%。
[0483]
(比较例2:化合物1的合成)
[0484]
在氮气流中,在具有温度计的3口反应器中加入83.05g(0.397mol)的反式
‑
1,4
‑
环己二酰氯和830g的环戊基甲醚(cpme)。向其中加入100.0g(0.378mol)的在上述实施例1的步骤1中合成的化合物a,将反应器浸在冰浴中,使反应液内温为0℃。接下来,一边将反应液内温保持在10℃以下一边历经20分钟缓慢滴加40.2g(0.397mol)的三乙胺(et3n)。滴加结束后,就这样在10℃以下进一步搅拌1小时。在得到的反应液中加入250g的水,在50℃搅拌2小时。进行分液,抽出水层后,重新加入250g的水,在50℃搅拌2小时。合计实施3次该操作。进一步使用416g的浓度1mol/升的由乙酸和乙酸钠形成的缓冲溶液(ph5.5)以在40℃搅拌30分钟的方式清洗有机层。清洗后,进行分液,抽出水层后,重新加入416g的浓度1mol/升的由乙酸和乙酸钠形成的缓冲溶液(ph5.5),在40℃搅拌30分钟。合计实施5次该操作。用高效液相色谱对该阶段的有机层(溶液(x))中的化合物1的浓度进行定量,结果为10.57质量%。
需要说明的是,在该阶段的有机层中,包含44.8g的上述结构式所表示的化合物x。
[0485]
进而,将得到的有机层缓缓冷却,在0℃缓慢搅拌1小时,由此使固体析出。通过过滤除去析出的固体,得到滤液。用100g的另外准备的冷却至0℃的cpme清洗过滤器中的过滤物,将通过该清洗得到的清洗液与之前的滤液合并。对合并了上述清洗液的滤液进行分液,在抽出水层得到的有机层(油层)中加入1200g的正己烷,缓缓冷却至0℃,由此使固体析出,滤取析出的固体。用正己烷清洗过滤物后,真空干燥,得到74.7g的作为中间体的白色固体(化合物1和化合物x的混合物y)。用高效液相色谱对得到的白色固体(化合物1和化合物x的混合物y)进行定量,结果化合物1相对于白色固体(化合物1和化合物x的混合物y)的含量为91.1质量%。以化合物a基准计,化合物1的收率为42.98摩尔%。
[0486]
(比较例3:化合物1的合成)
[0487]
在氮气流中,在具有温度计的3口反应器中加入83.05g(0.397mol)的反式
‑
1,4
‑
环己二酰氯和830g的环戊基甲醚(cpme)。向其中加入100.0g(0.378mol)的在上述实施例1的步骤1中合成的化合物a,将反应器浸在冰浴中,使反应液内温为0℃。接下来,一边将反应液内温保持在10℃以下一边历经20分钟缓慢滴加40.2g(0.397mol)的三乙胺(et3n)。滴加结束后,就这样在10℃以下进一步搅拌1小时。在得到的反应液中加入250g的水,在50℃搅拌2小时。进行分液,抽出水层后,重新加入250g的水,在50℃搅拌2小时。合计实施3次该操作。用高效液相色谱对该阶段的有机层(溶液(x))中的化合物1的浓度进行定量,结果为10.55质量%。需要说明的是,在该阶段的有机层中,包含44.6g的上述结构式所表示的化合物x。
[0488]
进而,在得到的有机层中加入550g的甲醇,缓缓冷却至0℃,缓慢搅拌1小时,由此使固体析出。通过过滤除去析出的固体,得到滤液。用100g的另外准备的冷却至0℃的甲醇清洗过滤器中的过滤物,将通过该清洗得到的清洗液与之前的滤液合并。此时的过滤性从整体来说非常差。进一步使用416g的浓度1mol/升的由乙酸和乙酸钠形成的缓冲溶液(ph5.5)将上述合并了清洗液的滤液在40℃搅拌30分钟,进行清洗。清洗后,进行分液,抽出水层后,重新加入416g的浓度1mol/升的由乙酸和乙酸钠形成的缓冲溶液(ph5.5),在40℃搅拌30分钟。合计实施5次该操作,进行分液,在抽出水层得到的有机层(油层)中加入1200g的正己烷,缓缓冷却至0℃,由此使固体析出,滤取析出的固体。用正己烷清洗过滤物后,真空干燥,得到82.3g的作为中间体的白色固体(化合物1和化合物x的混合物y)。用高效液相色谱对得到的白色固体(化合物1和化合物x的混合物y)进行定量,结果化合物1相对于白色固体(化合物1和化合物x的混合物y)的含量为85.5质量%。以化合物a基准计,化合物1的收率为44.44摩尔%。
[0489]
(比较例4:化合物1的合成)
[0490]
在氮气流中,在具有温度计的3口反应器中加入83.05g(0.397mol)的反式
‑
1,4
‑
环己二酰氯和830g的环戊基甲醚(cpme)。向其中加入100.0g(0.378mol)的在上述实施例1的步骤1中合成的化合物a,将反应器浸在冰浴中,使反应液内温为0℃。接下来,一边将反应液内温保持在10℃以下一边历经20分钟缓慢滴加40.2g(0.397mol)的三乙胺(et3n)。滴加结束后,将全部内容物恢复到25℃,进一步搅拌1小时。在得到的反应液中加入250g的水,在50℃搅拌2小时。进行分液,抽出水层后,重新加入250g的水,在50℃搅拌2小时。合计实施3次该操作。进一步使用416g的浓度1mol/升的由乙酸和乙酸钠形成的缓冲溶液(ph5.5)以在40℃搅拌30分钟的方式清洗有机层。清洗后,进行分液,抽出水层后,重新加入416g的浓度
1mol/升的由乙酸和乙酸钠形成的缓冲溶液(ph5.5),在40℃搅拌30分钟。合计实施5次该操作。用高效液相色谱对该阶段的有机层(溶液(x))中的化合物1的浓度进行定量,结果为10.58质量%。需要说明的是,在该阶段的有机层中,包含44.4g的上述结构式所表示的化合物x。
[0491]
进而,在得到的有机层中加入550g的甲醇,缓缓冷却至0℃,缓慢搅拌1小时,由此使固体析出。通过过滤除去析出的固体,得到滤液。用100g的另外准备的冷却至0℃的甲醇清洗过滤器中的过滤物,将通过该清洗得到的清洗液与之前的滤液合并。此时的过滤性从整体来说非常差。在5℃对上述合并了清洗液的滤液加入250g的水,搅拌30分钟,进行清洗。清洗后,进行分液,抽出水层后,重新加入250g的水,搅拌30分钟进行清洗,进行分液,在抽出水层得到的有机层(油层)中加入1200g的正己烷,缓缓冷却至0℃,由此使固体析出,滤取析出的固体。用正己烷清洗过滤物后,真空干燥,得到82.2g的作为中间体的白色固体(化合物1和化合物x的混合物y)。用高效液相色谱对得到的白色固体(化合物1和化合物x的混合物y)进行定量,结果化合物1相对于白色固体(化合物1和化合物x的混合物y)的含量为85.3质量%。以化合物a基准计,化合物1的收率为44.29摩尔%。
[0492]
(比较例5:国际公开2011/068138号的比较例1)
[0493]
[化学式40]
[0494][0495]
混合甲苯和24.68g的反式
‑
1,4
‑
环己烷二羧酸。在得到的溶液中加入74.91g的草酰氯和0.5ml的n,n
‑
二甲基甲酰胺。在氮环境下搅拌得到的溶液,使其反应。将得到的反应混合物减压浓缩,除去甲苯和未反应的草酰氯。混合得到的溶液和氯仿,得到包含反式
‑
1,4
‑
环己二酰氯的溶液。
[0496]
混合氯仿和12g的上述式(a
‑
iv)所表示的化合物。在冰冷却下,将得到的溶液和12.6g的吡啶滴加至之前得到的包含反式
‑
1,4
‑
环己二酰氯的溶液中。在氮环境下搅拌得到的混合物。通过过滤除去沉淀,将得到的滤液减压浓缩。将浓缩液滴加至水/甲醇溶液(体积比=1/1)中。将生成的沉淀粉碎后,进行过滤。用纯水清洗沉淀。过滤沉淀,进行真空干燥。将得到的粉末粉碎后,加入庚烷。搅拌得到的混合物后,取出沉淀。将沉淀与甲苯混合,通过过滤除去不溶解成分。将滤液减压浓缩,在得到的浓缩液中加入庚烷。通过过滤取出沉淀,进行真空干燥,得到7.8g的包含上述式(6
‑
a)所表示的化合物(化合物(i))的粉末(中间体)。以上述式(a
‑
iv)所表示的化合物基准计,上述式(6
‑
a)所表示的化合物的收率为40.00摩尔%。上述式(6
‑
a)所表示的化合物相对于得到的粉末的含量(纯度)为70.0质量%。
[0497]
(比较例6:国际公开2011/068138号的比较例2)
[0498]
混合24.68g的反式
‑
1,4
‑
环己烷二羧酸、74.91g的草酰氯以及0.5ml的n,n
‑
二甲基
甲酰胺。在氮环境下,搅拌得到的溶液,使其反应。将得到的反应混合物减压浓缩,除去甲苯和未反应的草酰氯。混合得到的溶液和氯仿,得到包含反式
‑
1,4
‑
环己二酰氯的溶液。
[0499]
混合氯仿和12g的上述式(6
‑
a)所表示的化合物。在冰冷却下,将得到的溶液和12.6g的吡啶滴加至之前得到的包含反式
‑
1,4
‑
环己二酰氯的溶液中。在氮环境下搅拌得到的溶液。通过过滤除去沉淀,将滤液减压浓缩。将浓缩液滴加至水中,将生成的沉淀粉碎后,进行过滤。将沉淀与纯水混合,进行过滤。将沉淀真空干燥。粉碎得到的粉末后,加入至水/甲醇溶液(体积比=1/1)中。将沉淀粉碎后,进行过滤。在沉淀中加入庚烷,搅拌得到的混合物,通过过滤取出不溶解成分。将不溶解成分与甲苯混合后,进行过滤。将得到的滤液减压浓缩,在得到的浓缩液中加入庚烷。通过过滤取出沉淀,进行真空干燥,得到2.1g的包含上述式(6
‑
a)所表示的化合物(化合物(i))的粉末(中间体)。以上述式(a
‑
iv)所表示的化合物基准计,上述式(6
‑
a)所表示的化合物的收率为12.00摩尔%。上述式(6
‑
a)所表示的化合物相对于得到的粉末的含量(纯度)为85.0质量%。
[0500]
[表1]
[0501][0502]
(实施例7:聚合性化合物1的合成)
[0503]
[化学式41]
[0504][0505]
<步骤1:化合物b的合成>
[0506]
[化学式42]
[0507]
[0508]
在氮气流中,在具有温度计的3口反应器中,将100g(0.605mol)的2
‑
肼基苯并噻唑加入到750g的n,n
‑
二甲基甲酰胺中,接下来,加入119.9g(0.726mol)的1
‑
溴己烷。在该溶液中加入192.72g(0.908mol)的磷酸三钾,在100℃搅拌全部内容物3小时。反应结束后,将反应液冷却至60℃,在降温了的反应液中加入750g的甲苯和750g的水后,维持60℃搅拌15分钟。当静置反应液时,分离为三层。抽出下层的两层。在得到的甲苯层中加入430g的10质量%的氯化钠水溶液,维持60℃搅拌15分钟。进行分液,在减压下对抽出水层得到的甲苯层(有机层)进行浓缩,抽出560g的甲苯。将浓缩后的甲苯层(有机层)加热至60℃,加入500g的水,一边进行强力搅拌一边缓缓冷却。达到0℃后,在这样的温度强力搅拌1小时。过滤该浆料溶液。使用500g的冷却至5℃以下的水/甲醇=1/4(质量比)的混合溶液喷洗得到的湿固体,进行清洗。用真空干燥机使得到的湿固体减压干燥,由此得到132.8g的作为白色固体的化合物b。收率为88摩尔%。化合物b的结构用1h
‑
nmr鉴定。1h
‑
nmr谱数据如下所示。
[0509]1h
‑
nmr(500mhz,cdcl3,tms,δppm):7.60(dd、1h、j=1.0,8.0hz)、7.53(dd,1h,j=1.0,8.0hz)、7.27(ddd,1h,j=1.0,8.0,8.0hz)、7.06(ddd,1h,j=1.0,8.0,8.0hz)、4.22(s,2h)、3.74(t,2h,j=7.5hz)、1.69
‑
1.76(m,2h)、1.29
‑
1.42(m,6h)、0.89(t,3h,j=7.0hz)。
[0510]
<步骤2:聚合性化合物1的合成>
[0511]
在氮气流中,在具有温度计的3口反应器中加入10.80g(作为化合物1的纯量为10.00g(23.90mmol))的在上述实施例1中合成的作为中间体的白色固体(化合物1和化合物x的混合物y)、100g的氯仿以及3.49g的二甲基甲酰胺(dmf),冷却至10℃以下。将反应温度控制为10℃以下,在其中滴加3.27g(27.48mmol)的亚硫酰氯。滴加结束后,将反应液恢复为25℃,搅拌1小时。反应结束后,用蒸发器浓缩至反应液的量成为四分之一。其后,加入25g的氯仿,得到化合物1的酰氯的氯仿溶液。在氮气流中,在另外的具有温度计的3口反应器中,使1.50g(10.86mmol)的2,5
‑
二羟基苯甲醛和6.98g(65.17mmol)的作为碱的2,6
‑
二甲基吡啶溶解在50g的氯仿中,将得到的溶液冷却至10℃以下。一边将反应液内温保持在10℃以下,一边缓慢滴加之前合成的化合物1的酰氯的氯仿溶液的全部量。滴加结束后,一边将反应液保持在10℃以下,一边进一步进行1小时反应。其后,进一步加入40g的1.0当量的盐酸水溶液,在10℃以下搅拌30分钟,进行反应。反应结束后,进一步就这样在10℃以下在得到的反应液中加入3.52g(14.12mmol)的在上述步骤1中合成的化合物b。其后,将反应液加热至40℃,进行4小时反应。反应结束后,将反应液冷却至25℃,进行分液操作。在得到的有机层中加入0.50g的rokahelp#479(三井金属矿业公司制),搅拌30分钟后,滤出rokahelp#479。接下来,用蒸发器从得到的反应液中抽出总质量约80%,进行浓缩。在该溶液中加入20g的thf后,搅拌1小时。接下来,在该溶液中滴加80g的正己烷后,冷却至0℃,使结晶析出。其后,通过过滤滤取析出的结晶。在得到的结晶中加入108g的thf、1.8g的rokahelp#479以及100mg的2,6
‑
二叔丁基
‑4‑
甲基苯酚,搅拌30分钟后,滤出rokahelp#479。接下来,用蒸发器从得到的反应液中蒸馏除去36g的thf。在得到的溶液中滴加117g的甲醇后,冷却至0℃,使结晶析出。其后,通过过滤滤取析出的结晶。用甲醇清洗过滤物后,真空干燥,得到11.7g的聚合性化合物1。分离收率为92.0摩尔%(2,5
‑
二羟基苯甲醛基准)。聚合性化合物1的结构用1h
‑
nmr鉴定。1h
‑
nmr谱数据如下所示。
[0512]1h
‑
nmr(400mhz,cdcl3,tms,δppm):7.75(d,1h,j=2.5hz)、7.67
‑
7.70(m,3h)、7.34
(ddd,1h、j=1.0hz,7.0hz,7.5hz)、7.17(ddd,1h,j=1.0hz,7.5hz,7.5hz)、7.12(d,1h,j=9.0hz)、7.10(dd,1h,j=2.5hz,9.0hz)、6.99(d,2h,j=9.0hz)、6.98(d,2h,j=9.0hz)、6.88(d,4h,j=9.0hz)、6.40(dd,2h,j=1.5hz,17.0hz)、6.13(dd,2h,j=10.5hz,17.5hz)、5.82(dd,2h、j=1.5hz,10.5hz)、4.30(t,2h,j=8.0hz)、4.18(t,4h,j=6.5hz)、3.95(t,4h,j=6.5hz)、2.58
‑
2.70(m,4h)、2.31
‑
2.35(m,8h)、1.66
‑
1.82(m,18h)、1.31
‑
1.54(m,14h)、0.90(t,3h,j=7.0hz)。
[0513]
(实施例8:聚合性化合物1的合成)
[0514]
在上述实施例7中,在步骤2中,使用10.89g(作为化合物1的纯量为10.00g(23.90mmol))的在上述实施例2中合成的作为中间体的白色固体(化合物1和化合物x的混合物y)代替10.80g(作为化合物1的纯量为10.00g(23.90mmol))的在上述实施例1中合成的作为中间体的白色固体(化合物1和化合物x的混合物y),除此以外,与实施例7同样地进行聚合性化合物1的合成。结果,得到11.6g的聚合性化合物1。以2,5
‑
二羟基苯甲醛基准计,聚合性化合物1的分离收率为91.3摩尔%。
[0515]
(实施例9:聚合性化合物1的合成)
[0516]
在上述实施例7中,在步骤2中,使用10.81g(作为化合物1的纯量为10.00g(23.90mmol))的在上述实施例3中合成的作为中间体的白色固体(化合物1和化合物x的混合物y)代替10.80g(作为化合物1的纯量为10.00g(23.90mmol))的在上述实施例1中合成的作为中间体的白色固体(化合物1和化合物x的混合物y),除此以外,与实施例7同样地进行聚合性化合物1的合成。结果,得到11.7g的聚合性化合物1。以2,5
‑
二羟基苯甲醛基准计,聚合性化合物1的分离收率为92.0摩尔%。
[0517]
(实施例10:聚合性化合物1的合成)
[0518]
在上述实施例7中,在步骤2中,使用10.81g(作为化合物1的纯量为10.00g(23.90mmol))的在上述实施例4中合成的作为中间体的白色固体(化合物1和化合物x的混合物y)代替10.80g(作为化合物1的纯量为10.00g(23.90mmol))的在上述实施例1中合成的作为中间体的白色固体(化合物1和化合物x的混合物y),除此以外,与实施例7同样地进行聚合性化合物1的合成。结果,得到11.8g的聚合性化合物1。以2,5
‑
二羟基苯甲醛基准计,聚合性化合物1的分离收率为92.8摩尔%。
[0519]
(实施例11:聚合性化合物1的合成)
[0520]
在上述实施例7中,在步骤2中,使用10.89g(作为化合物1的纯量为10.00g(23.90mmol))的在上述实施例5中合成的作为中间体的白色固体(化合物1和化合物x的混合物y)代替10.80g(作为化合物1的纯量为10.00g(23.90mmol))的在上述实施例1中合成的作为中间体的白色固体(化合物1和化合物x的混合物y),除此以外,与实施例7同样地进行聚合性化合物1的合成。结果,得到11.5g的聚合性化合物1。以2,5
‑
二羟基苯甲醛基准计,聚合性化合物1的分离收率为90.5摩尔%。
[0521]
(实施例12:聚合性化合物1的合成)
[0522]
在上述实施例7中,在步骤2中,使用11.14g(作为化合物1的纯量为10.00g(23.90mmol))的在上述实施例6中合成的作为中间体的白色固体(化合物1和化合物x的混合物y)代替10.80g(作为化合物1的纯量为10.00g(23.90mmol))的在上述实施例1中合成的作为中间体的白色固体(化合物1和化合物x的混合物y),除此以外,与实施例7同样地进行
聚合性化合物1的合成。结果,得到11.6g的聚合性化合物1。2,5
‑
二羟基苯甲醛基准计,聚合性化合物1的分离收率以为91.3摩尔%。
[0523]
(实施例13:聚合性化合物2的合成)
[0524]
[化学式43]
[0525][0526]
<步骤1:化合物c的合成>
[0527]
[化学式44]
[0528][0529]
在氮气流中,在具有温度计的3口反应器中投入500.5g(2.69mol)的1
‑
萘乙酸和1049g的甲苯。进而,加入349.5g(2.56mol)的6
‑
氯
‑1‑
己醇、48.6g(0.26mol)的对甲苯磺酸一水合物,制备溶液。使用dean
‑
stark装置加热制备的溶液,一边将生成的水在反应体系外排出一边进行2小时的共沸脱水(内温约95℃)。反应结束后,在冷却至25℃的反应液中加入742g的5.8质量%的碳酸氢钠水溶液,进行分液,进行清洗。清洗后,进一步用500g的水对抽出水层得到的有机层进行清洗。清洗后,在抽出水层得到的有机层中加入7g的过滤助剂(商品名:rokahelp#479,三井金属矿业公司制),在室温下搅拌30分钟,进行过滤,除去过滤助剂。用旋转蒸发器从有机层除去溶剂,得到755g的包含化合物c的淡棕色油。通过利用高效液相色谱的定量可知,在该包含化合物c的淡棕色油中包含93.0质量%的化合物c。不进行该淡棕色油的提纯,就这样用于接下来的反应(步骤2:化合物d的合成)。
[0530]
<步骤2:化合物d的合成>
[0531]
[化学式45]
[0532][0533]
在氮气流中,在具有温度计的3口反应器中投入59.52g(作为化合物c的净量为55.35g(0.182mol))的在上述步骤1中合成的包含化合物c的淡棕色油和235g的n
‑
甲基
‑2‑
吡咯烷酮,制成均匀的溶液。在该均匀的溶液中加入25.0g(0.151mol)的2
‑
肼基苯并噻唑。接下来,加入48.18g(0.227mol)的磷酸三钾,在100℃搅拌全部内容物3小时。反应结束后,将反应液冷却至60℃,在降温了的反应液中加入312.5g的乙酸乙酯后,维持60℃,进行过滤。将作为滤液的有机层缓缓滴加至250g的0.5当量的柠檬酸水溶液中,在内温60℃搅拌30分钟后,抽出水层。进而,在有机层中加入275g的9.1质量%的氯化钠水溶液,在内温60℃搅
拌30分钟后,静置30分钟,抽出水层。接下来,在有机层中加入262.5g的4.76质量%的碳酸氢钠水溶液,在内温60℃搅拌30分钟后,静置30分钟,抽出水层。进而,在有机层中加入250g的水,在内温60℃搅拌30分钟后,静置30分钟,抽出水层。将得到的有机层缓缓冷却至0℃,在0℃搅拌30分钟。通过过滤取得生成的固体。其后,在取得的固体加入150g的乙酸乙酯,加热至60℃,制成均匀溶液,搅拌30分钟。其后,将乙酸乙酯溶液缓缓冷却至0℃,在0℃搅拌1小时。通过过滤取得生成的固体,使其减压干燥,由此得到36.9g的作为白色固体的化合物d。化合物d的收率为56.4摩尔%。化合物d的结构用1h
‑
nmr鉴定。1h
‑
nmr谱数据如下所示。
[0534]1h
‑
nmr(500mhz,cdcl3,tms,δppm):8.00(d,1h,j=8.5hz)、7.85(dd,1h、j=1.0hz、8.0hz)、7.78(dd,1h,j=1.5hz,7.5hz)、7.60(dd,1h,j=1.0hz,7.5hz)、7.54
‑
7.51(m,2h)、7.49
‑
7.40(m,3h)、7.28(ddd,1h,j=1.0hz,7.5hz,7.5hz)、7.07(ddd,1h,j=1.0hz,7.5hz,7.5hz)、4.16(br,2h)、4.08(t,2h,j=6.5hz)、4.06(s,2h)、3.66(t,2h,j=7.0hz)、1.63
‑
1.54(m,4h)、1.32
‑
1.22(m,4h)。
[0535]
<步骤3:聚合性化合物2的合成>
[0536]
在氮气流中,在具有温度计的3口反应器中加入32.43g(作为化合物1的纯量为30.00g(71.7mmol))的在上述实施例3中合成的作为中间体的白色固体(化合物1和化合物x的混合物y)、300g的氯仿以及10.5g(143.4mmol)的n,n
‑
二甲基甲酰胺(dmf),冷却至10℃以下。将反应温度控制为10℃以下,在其中滴加9.81g(82.44mmol)的亚硫酰氯。滴加结束后,将反应液恢复为25℃,搅拌1小时。反应结束后,用蒸发器抽出225g的氯仿,进行浓缩,合成化合物1的酰氯作为氯仿溶液。在氮气流中,在另外的具有温度计的3口反应器内,使4.5g(32.58mmol)的2,5
‑
二羟基苯甲醛和19.78g(195.5mmol)的作为碱的三乙胺溶解在150g的氯仿中,将得到的溶液冷却至10℃以下。一边将反应液内温保持在10℃以下,一边缓慢滴之前合成的化合物1的酰氯的氯仿溶液的全部量。滴加结束后,进一步在5~10℃搅拌全部内容物1小时,进行反应。反应结束后,一边将温度保持在10℃以下一边向反应液中加入120g的1.0当量的盐酸水溶液,在10℃以下搅拌30分钟,进行反应。反应结束后,进一步就这样在10℃以下向得到的反应液中加入18.38g(42.4mmol)的在上述步骤2中合成的化合物d和0.3g的2,6
‑
二叔丁基对甲酚。其后,将反应液加热至40℃,进行4小时反应。
[0537]
反应结束后,抽出水层,得到有机层。在得到的有机层中投入105g的蒸馏水,在40℃搅拌有机层30分钟,进行清洗。将抽出水层得到的有机层冷却至25℃,加入1.5g的rokahelp#479,搅拌30分钟。其后,用铺有1g的rokahelp#479的桐山漏斗进行过滤,除去rokahelp#479。用旋转蒸发器从除去rokahelp#479得到的有机层中抽出180g的氯仿,进行浓缩。历经1小时在浓缩得到的有机层中加入210g的己烷,使固体析出,通过过滤得到淡黄色固体。在25℃使得到的淡黄色固体溶解在120g的四氢呋喃中,加入1.5g的rokahelp#479,搅拌30分钟。其后,用铺有1g的rokahelp#479的桐山漏斗进行过滤,除去rokahelp#479。在15℃向除去rokahelp#479得到的有机层中缓慢滴加165g的甲醇,使固体析出,进行过滤,得到固体。用真空干燥机对得到的固体进行干燥,得到40.2g的作为淡黄色固体的聚合性化合物2。以2,5
‑
二羟基苯甲醛基准计,聚合性化合物2的收率为91.0摩尔%。聚合性化合物2的结构用1h
‑
nmr鉴定。1h
‑
nmr谱数据如下所示。
[0538]1h
‑
nmr(500mhz,cdcl3,tms,δppm):7.97(dd,1h,j=0.5hz,8.5hz)、7.80(ddd,1h,j=0.5hz,0.5hz,8.0hz)、7.73
‑
7.76(m,2h)、7.67
‑
7.71(m,2h)、7.61(s,1h)、7.49(ddd,1h,j
=1.0hz,6.5hz,8.5hz)、7.42(ddd,1h,j=1.5hz,7.0hz,7.0hz)、7.33
‑
7.39(m,3h)、7.18(ddd,1h,j=1.0hz,7.5hz,8.0hz)、7.10
‑
7.14(m,2h)、6.95
‑
7.01(m,4h)、6.85
‑
6.90(m,4h)、6.405(dd,1h,j=1.5hz,17.5hz)、6.402(dd,1h,j=1.5hz,17.5hz)、6.127(dd,1h,j=10.5hz,17.5hz)、6.124(dd,1h,j=10.5hz,17.5hz)、5.822(dd,1h,j=1.5hz,10.5hz)、5.819(dd,1h,j=1.5hz,10.5hz)、4.16
‑
4.22(m,6h)、4.08(t,2h,j=6.5hz)、4.03(s,2h)、3.95(t,2h,j=6.5hz)、3.93(t,2h,j=6.5hz)、2.56
‑
2.67(m,4h)、2.28
‑
2.36(m,8h)、1.59
‑
1.83(m,20h)、1.42
‑
1.56(m,8h)、1.24
‑
1.36(m,4h)。
[0539]
(实施例14:聚合性化合物2的合成)
[0540]
在上述实施例13中,在步骤3,使用32.43g(作为化合物1的纯量为30.00g(71.7mmol))的在上述实施例4中合成的作为中间体的白色固体(化合物1和化合物x的混合物y)代替32.43g(作为化合物1的纯量为30.00g(71.7mmol))的在上述实施例3中合成的作为中间体的白色固体(化合物1和化合物x的混合物y),除此以外,与实施例13同样地进行聚合性化合物2的合成。结果,得到40.6g的聚合性化合物2。以2,5
‑
二羟基苯甲醛基准计,聚合性化合物2的分离收率为92.1摩尔%。
[0541]
由实施例7~14的结果可知,通过本发明的制造方法得到的以高浓度包含化合物(i)的中间体能够优选地用于聚合性化合物的制造。
[0542]
产业上的可利用性
[0543]
根据本发明,可提供能够高效地制造以高浓度含有化合物(i)的中间体的中间体的制造方法。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1