氘代奥希替尼药用盐的晶型及其制备方法与流程
本发明属于医药
技术领域:
,具体涉及氘代奥希替尼药用盐的晶型及其制备方法。
背景技术:
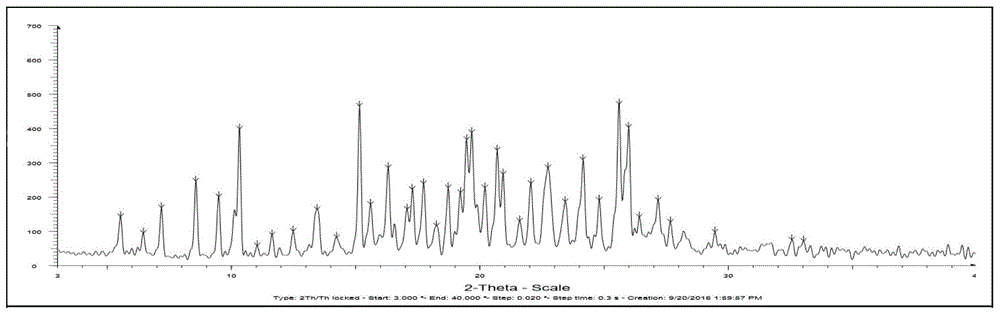
:在我国,每年新发病的肺癌患者超过73万人,是发病率和死亡率最高的恶性肿瘤。在中国的非小细胞肺癌患者中,约有30%~40%发生egfr突变,而接受过egfr-tki药物(如吉非替尼、厄洛替尼、埃克替尼)治疗的egfr突变患者中,约三分之二患者会由于t790m突变而产生耐药,导致疾病再次进展,患者亟需得到新的治疗方案。奥希替尼(通用名为osimertinib,下文均以此代指)是阿斯利康公司研发的第三代口服、不可逆的选择性egfr突变抑制剂,是全球第一个上市,也是中国首个获批的用于egfrt790m突变阳性的局部晚期或转移性非小细胞肺癌的肿瘤药物。2015年11月,osimertinib获fda批准在美国首先上市;2017年3月,国家药品监督管理总局(nmpa)正式批准第三代肺癌靶向药物osimertinib用于既往经表皮生长因子受体(egfr)酪氨酸激酶抑制剂(tki)治疗时或治疗后出现疾病进展,并且经检测确认存在egfrt790m突变阳性的局部晚期或转移性非小细胞性肺癌(nsclc)成人患者的治疗。目前,国内已经有众多关于osimertinib报道。例如中国专利cn103702990a报道了非氘代的osimertinib的合成或制备方法及其多晶型。中国专利cn104140418a公开了2-(2,4,5-取代苯胺)嘧啶衍生物及用途,通过对osimertinib的选择性氘代,化合物(结构如式i~式v所示)或者其药学上可接受的盐或者溶剂化物改善了药物的药代性质、降低药物毒性;但未公开化合物的晶型、吸湿性、溶解度等具体的理化数据,也未报道化合物的其他晶型及稳定性数据。晶型是药物存在的固体物质状态,药物晶型研究就是对药物基础状态的研究,只有对化学药物晶型状态有了比较充分和全面的认识,才有可能寻找更合适与治疗疾病的药物晶型固体物质。同一药物的不同晶型在外观、溶解度、熔点、溶出度、生物有效性等方面可能会有显著不同,从而影响了药物的稳定性、生物利用度及疗效,该种现象在口服固体制剂方面表现得尤为明显。因此,研究氘代osimertinib的稳定晶型及其制备方法具有重要意义。技术实现要素:为了研究氘代osimertinib的具体药用形式与理化性质之间的关系,进而开发出更加适合成药的特定药用形式,本发明提供一种氘代osimertinib药用盐的晶型及其制备方法。本发明的具体技术内容如下:一种如式vi所示的氘代osimertinib药用盐的晶型i,使用cukα谱线,以2θ角度表示的x射线粉末衍射图在以下位置:5.49±0.2°、6.42±0.2°、11.01±0.2°、11.61±0.2°、12.46±0.2°、13.42±0.2°、14.22±0.2°、15.58±0.2°具有特征衍射峰。优选地,所述晶型i使用cukα谱线,以2θ角度表示的x射线粉末衍射图还在以下位置:5.49±0.2°、6.42±0.2°、11.01±0.2°、11.61±0.2°、12.46±0.2°、13.42±0.2°、14.22±0.2°、15.58±0.2°、19.22±0.2°、26.43±0.2°、29.48±0.2°、33.05±0.2°具有特征衍射峰。一种如式vi所示的氘代osimertinib药用盐的晶型i的制备方法,具体包括以下步骤:将如式i所示的氘代osimertinib溶解于溶剂中,升温至30~50℃,向溶液中按0.1~0.3ml/min的流速加入甲磺酸水溶液,加毕搅拌2h,降温至0~10℃,静置析晶2~4h,过滤、收集滤饼,干燥,即得。优选地,所述晶型i的制备方法中,所述溶剂为水、甲醇、乙醇、异丙醇、丙酮、乙酸乙酯、乙酸丁酯、乙酸异丁酯的一种或多种的混合液。优选地,所述的溶剂为乙醇、丙酮和乙酸异丁酯的混合溶剂。更优选地,所述的混合溶剂中,乙醇、丙酮和乙酸异丁酯的体积比为1:(1~2):(1~2);氘代osimertinib和混合溶剂的质量体积比为1:(5~10)。优选地,所述晶型i的制备方法中,所述甲磺酸水溶液中,甲磺酸和水的质量体积比为1:(4~8)。优选地,所述晶型i的制备方法中,氘代osimertinib与甲磺酸的摩尔比为1:(1~1.5)。更优选地,摩尔比为1:1.2。优选地,所述晶型i的制备方法中,所述降温的速度为每小时10℃,优选为降温至5℃。优选地,所述晶型i的制备方法中,所述静置析晶的时间优选为3h。对于如式vi所示的氘代osimertinib药用盐的晶型i的研究,本发明采用国际上公认的x-射线粉末衍射法(xrpd)来研究和表征其晶型。仪器设备:bruker公司生产的d8advance型x射线衍射仪。检测条件:靶材为铜靶,工作电压为40kv,工作电流为40ma,扫面范围为3°~40°,步径为0.02°,发散狭缝为1°,防散射狭缝为1°,接受狭缝为0.2°。本发明中式vi所示的氘代osimertinib药用盐的晶型i,其x-射线粉末衍射图基本如图1所示。其更详细的数据如表1所示。表1本发明所述的氘代osimertinib药用盐的晶型i的x-射线粉末衍射峰值在表1中,表示x-射线粉末衍射峰的2θ,其误差范围为±0.2°。应该理解,x射线粉末衍射图的2θ值可在机器之间和样品之间稍有变化,其数值范围可能相差0.2个单位,因此所引用的数值不能解释为绝对值。研究表明,在x-射线粉末衍射图谱中,由新晶型得到的衍射谱图对于特定的晶型往往是特征性的,其中谱带(尤其是在低角度)的相对强度可能会因为结晶条件、粒径和其它测定条件的差异而产生的优势取向效果而变化。因此,衍射峰的相对强度对所针对的晶型并非是特征性的,判断是否与已知的晶型相同时,更应该注意的是峰的相对位置而不是它们的相对强度。与现有技术相比,本发明具有如下优点:(1)本发明所提供的氘代osimertinib药用盐的晶型i是一种不同于现有技术的新晶型;(2)本发明所提供的氘代osimertinib药用盐的晶型i的流动性好、溶解度高、稳定性优,提高了生物利用度及用药安全性,有助于药物给药途径的选择设计和药物制剂工艺参数的确定,从而提高药品生产质量;(3)本发明所提供的氘代osimertinib药用盐的晶型i制备方法简单易操作,反应条件温和,适合大规模生产附图说明图1为实施例1的氘代osimertinib药用盐的晶型i的粉末衍射的xrd谱图;图2为实施例1的氘代osimertinib药用盐的晶型i的热重分析谱图;图3为实施例6制备的n-(2-{2-二甲氨基乙基-甲氨基}-4-甲氧基-5-{[4-(1-(d3-甲基)吲哚-3-基)嘧啶-2-基]氨基}苯基)丙-2-烯酰胺甲磺酸盐晶型的粉末衍射的xrd谱图;图4为实施例7制备的n-(2-{2-二甲氨基乙基-甲氨基}-4-甲氧基-5-{[4-(1-(d3-甲基)吲哚-3-基)嘧啶-2-基]氨基}苯基)丙-2-烯酰胺甲磺酸盐无定型的粉末衍射的xrd谱图。具体实施方式为了便于对本发明的进一步了解,下面提供实施例对其做了更详细的说明。这些实施例仅供叙述而并非用来限制本发明的范围或实施原则。本发明氘代osimertinib是根据专利cn104140418a中的实施例3a叙述的制备方法得到。实施例1:氘代osimertinib药用盐的晶型i的制备本实施例用于制备式vi所示的氘代osimertinib药用盐的晶型i,包括如下步骤:将氘代osimertinib2.00g溶解于20ml混合溶剂中(乙醇、丙酮和乙酸异丁酯的体积比为1:2:1.5),加热至45℃,向溶液中按0.2ml/min的流速加入甲磺酸水溶液(0.46g甲磺酸溶解于3ml水中),加毕搅拌2h,降温至5℃,降温速度为每小时10℃。随后,静置析晶3h,,然后过滤,滤饼室温真空干燥10h,得到2.20g黄色固体,收率92%。其x射线粉末衍射图如图1所示。用热重分析仪(型号:netzschtg209)氘代osimertinib药用盐的晶型i热失重情况。测量条件为从30℃加热到300℃,升温速率为10℃/min,加热在氮气气氛下进行,氮气流量为50ml每分钟。氘代osimertinib药用盐的晶型i的热重分析谱图如图2所示。实施例2:氘代osimertinib药用盐的晶型i的制备本实施例用于制备式vi所示的氘代osimertinib药用盐的晶型i,包括如下步骤:将氘代osimertinib4.00g溶解于20ml混合溶剂中(乙醇、丙酮和乙酸异丁酯的体积比为1:1:2),加热至30℃,向溶液中按0.1ml/min的流速加入甲磺酸水溶液(1.14g甲磺酸溶解于9ml水中),加毕搅拌2h,降温至0℃,降温速度为每小时10℃。随后,静置析晶4h,,然后过滤,滤饼室温真空干燥14h,得到4.28g黄色固体,收率90%。所制得的氘代osimertinib药用盐的晶型i使用cu-kα射线测量得到的x-射线粉末衍射谱图与实施例1相似。实施例3:氘代osimertinib药用盐的晶型i的制备本实施例用于制备式vi所示的氘代osimertinib药用盐的晶型i,包括如下步骤:将氘代osimertinib4.00g溶解于32ml混合溶剂中(乙醇、丙酮和乙酸异丁酯的体积比为1:1.2:1),加热至50℃,向溶液中按0.1ml/min的流速加入甲磺酸水溶液(0.76g甲磺酸溶解于6ml水中),加毕搅拌2h,降温至10℃,降温速度为每小时10℃。随后,静置析晶2h,,然后过滤,滤饼室温真空干燥10h,得到4.23g黄色固体,收率89%。所制得的氘代osimertinib药用盐的晶型i使用cu-kα射线测量得到的x-射线粉末衍射谱图与实施例1相似。实施例4:氘代osimertinib药用盐的晶型i的制备本实施例用于制备式vi所示的氘代osimertinib药用盐的晶型i,包括如下步骤:将氘代osimertinib4.00g溶解于24ml混合溶剂中(水、丙酮和乙酸乙酯的体积比为1:1.5:1.5),加热至30℃,向溶液中按0.2ml/min的流速加入甲磺酸水溶液(0.80g甲磺酸溶解于4ml水中),加毕搅拌2h,降温至5℃,降温速度为每小时10℃。随后,静置析晶2h,,然后过滤,滤饼室温真空干燥14h,得到4.14g黄色固体,收率87%。所制得的氘代osimertinib药用盐的晶型i使用cu-kα射线测量得到的x-射线粉末衍射谱图与实施例1相似。实施例5:氘代osimertinib药用盐的晶型i的制备本实施例用于制备式vi所示的氘代osimertinib药用盐的晶型i,包括如下步骤:将氘代osimertinib4.00g溶解于32ml混合溶剂中(甲醇、丙酮和乙酸丁酯的体积比为1:1.5:1.2),加热至30℃,向溶液中按0.2ml/min的流速加入甲磺酸水溶液(0.92g甲磺酸溶解于5ml水中),加毕搅拌2h,降温至5℃,降温速度为每小时10℃。随后,静置析晶3h,,然后过滤,滤饼室温真空干燥10h,得到4.28g黄色固体,收率90%。所制得的氘代osimertinib药用盐的晶型i使用cu-kα射线测量得到的x-射线粉末衍射谱图与实施例1相似。实施例6:专利cn104140418a中的化合物晶型的制备本实施例按照专利cn104140418a中的实施例3b的方法制备化合物晶型,包括如下步骤:将氘代osimertinib2.05g溶解于12ml乙醇和8ml乙酸乙酯中,室温下滴加0.41g甲磺酸+4ml乙酸乙酯,约1h滴完,滴完后于该温度保温1.5~2h,然后缓慢冷却至室温,过滤,滤饼用乙酸乙酯/乙醇溶液(2:1,v/v)洗涤1次后,过滤,滤饼室温真空干燥10h,得到1.88g黄色固体,收率79%。所制得的化合物晶型使用cu-kα射线测量得到的x-射线粉末衍射谱图如图3所示。表2按照专利cn104140418a中的实施例3b的方法制备化合物晶型的x-射线粉末衍射峰值实施例7:氘代osimertinib药用盐的无定型的制备本实施例用于制备氘代osimertinib药用盐的无定型,包括如下步骤:将氘代osimertinib游离碱2.00g溶解于20ml混合溶剂中(水和乙醇的体积比为1:1),加热至40℃,向溶液中按0.2ml/min的流速加入甲磺酸水溶液(0.38g甲磺酸溶解于3ml水中),加毕搅拌2h,减压浓缩至干。随后,加入5ml水,搅拌,继续减压浓缩至干后,于室温真空干燥14h,得浅棕色固体。所制得的氘代osimertinib药用盐的晶型i使用cu-kα射线测量得到的x-射线粉末衍射谱图如图3所示。实施例8:晶型引湿性研究分别取本发明的实施例1制得的氘代osimertinib药用盐的晶型i、实施例6制得的专利cn104140418a制备化合物晶型和实施例7制得的无定型,按照《中国药典》2015年版四部通则9103方法进行试验,分别于25℃±1℃,rh80%±2%的条件下进行试验,放置时间为24h。表3引湿性测定结果由上表的结果表明,本发明的晶型i在比专利cn104140418a中化合物晶型和无定型,引湿性更小,更加稳定,因而更有商业前景。实施例9:晶型溶解度研究分别取本发明的实施例1制得的氘代osimertinib药用盐的晶型i、实施例6制得的专利cn104140418a制备化合物晶型,采用摇瓶法获得各晶型在各ph溶液下的过饱和溶液,照高效液相色普法测定各晶型的平衡溶解度。表4氘代osimertinib药用盐的晶型i的ph-溶解度试验测的结果ph值ph1.2ph3.0ph4.0ph4.5ph6.0ph6.8ph7.4溶解度(mg/ml)123.064.952.244.829.725.517.4表5专利cn104140418a的化合物晶型的ph-溶解度试验测的结果ph值ph1.2ph3.0ph4.0ph4.5ph6.0ph6.8ph7.4溶解度(mg/ml)65.323.217.711.911.610.02.7由上表4~5的结果表明,氘代osimertinib甲磺酸盐的两种晶型均具有显著的ph值依赖性溶解度和适度的渗透性,在模拟胃液中的溶解度高于人工肠液中的溶解度,药物在酸性条件下溶解度最高,当该药物穿过胃肠道时其可以从溶液中沉淀,药物需要在溶液中以便吸收,所以此类沉淀可以导致该药物吸收程度/速率的可变性。本发明的晶型i在比专利cn104140418a中化合物晶型的在各ph条件下溶解度更高,达到该药剂的更快的初始溶解速率/较高的总释放预期,降低药物吸收的剂量间和患者间差异行的风险。实施例10:晶型稳定性研究分别取本发明的实施例1制得的氘代osimertinib药用盐的晶型i、实施例6制得的专利cn104140418a制备化合物晶型和实施例7制得的无定型,分别于25℃±2℃,rh60%±10%的条件下放置3个月,分别于0月、3月取样检测,重点考察性状、吸湿增重、纯度。表7长期稳定性测定结果由上表的结果表明,试验条件下放置3个月后,本发明的晶型i在化学稳定性(降解)还是在物理稳定性(吸湿)方面都优于专利cn104140418a中化合物晶型和无定型。实施例11:流动性测试以测定休止角大小来评价晶型颗粒的流动性,分别取本发明的实施例1制得的氘代osimertinib药用盐的晶型i、实施例6制得的专利cn104140418a制备化合物晶型和实施例7制得的无定型,过60-80目筛,采用漏斗法,以相同的速度从漏斗漏出,直到圆盘(r=5cm)满为止,测定峰高,每个样品重复三次。表8休止角测定结果晶型休止角(平均值)氘代osimertinib药用盐的晶型i24.45专利cn104140418a中化合物晶型28.98无定型34.10上表的结果表明,本发明的晶型i的休止角明显小于专利cn104140418a中化合物晶型和无定型。证明晶型i的流动性明显好于专利cn104140418a中化合物晶型和无定型的流动性,有利于其制剂的制造过程。基于上述引湿性、溶解度、稳定性和流动性研究结果可知,本发明的氘代osimertinib药用盐的晶型i较稳定的理化性质,更适合开发成药物,提高生物利用度,提高药物的安全性。最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1