一种耐奥希替尼的人非小细胞肺癌细胞株H1975/OR及其应用的制作方法
本发明涉及肿瘤生物学领域,尤其涉及一种耐奥希替尼的人非小细胞肺癌细胞株h1975/or及其应用。
背景技术:
肺癌是目前全世界发病率和死亡率最高的恶性肿瘤。肺癌分为小细胞肺癌(sclc)和非小细胞肺癌(nsclc),其中约85%为非小细胞肺癌。非小细胞肺癌的主要治疗手段包括分子靶向治疗、免疫治疗、化疗和放疗。其中,分子靶向治疗的有点在于特异性高、不良反应轻。
近几年来,表皮生长因子酪氨酸激酶抑制剂(egfr-tki)成为了egfr基因突变晚期非小细胞肺癌的首选治疗方案。egfr-tki可以与egfr酪氨酸激酶区域的atp位点竞争性结合,阻断egfr酪氨酸的自身磷酸化和酪氨酸激酶的活化,阻断信号传导,从而抑制肿瘤细胞的增殖并促进其凋亡,最终抑制肿瘤细胞的生长。大多数患者会在第一代egfr-tki使用10个月后出现获得性耐药。
在具有第一代egfr-tki获得性耐药突变的患者中,约50%患者会出现t970m点突变,针对t790m突变的患者可以选择第三代egfr-tki奥希替尼,然而患者在使用奥希替尼10个月后仍会出现再次耐药,现有技术中该耐药机制尚未明确。
技术实现要素:
为了探索奥希替尼获得性耐药的机制,我们建立了一种奥希替尼耐药人肺癌细胞系h1975/or,该细胞株存在t790m突变,且无797s顺式、反式改变,并有一定小细胞肺癌指标表达。目前国内外未见有此种奥希替尼耐药非小细胞肺癌细胞株的报道。这种耐奥希替尼的人肺癌细胞系株的建立,可成为研究t790m阳性的非小细胞肺癌的耐药机制、耐药性逆转、开发和评价新的抗癌药物和方法等的重要工具。
为实现上述目的,本发明提供了一种耐奥希替尼人的非小细胞肺癌细胞株,将其命名为人肺癌细胞系h1975ar,并保藏于武汉大学中国典型培养物保藏中心,地址:湖北省武汉市武昌区八一路299号武汉大学校内(武汉大学第一附小对面),武汉大学保藏中心,保藏日期为2019年11月17日,保藏编号为cctccno:c2019300。本发明中的人肺癌细胞系h1975/or保留对奥希替尼敏感的egfrexon21:c.t2573g:p.l858r及exon20:c.c2369t:p.t790m突变,获得性耐药后出现rb1基因缺失,并表现小细胞肺癌表型。
本发明的细胞株采用逐步半对数递增奥希替尼药物浓度的方法来建立源于亲代细胞h1975的人的egfr基因突变阳性的非小细胞肺癌奥希替尼耐药细胞株。该方法包括以下步骤:
(1)人的egfr基因突变阳性的非小细胞肺癌细胞株h1975购自美国典型培养物保藏中心(atcc),将该细胞株置于含25mmol/l4-(2-羟乙基)-1-哌嗪乙磺酸(hepes)和10%胎牛血清(fbs)的rpmi1640培养液(以下简称h1975培养基)中,于37℃、5%co2、饱和湿度的培养箱中培养,0.25%胰蛋白酶和乙二胺四乙酸(0.25%trypsin-edta)消化传代;
(2)取5×105个h1975细胞于培养瓶中,贴壁24小时后,加入新配制的含0.1μmol/l奥希替尼的h1975培养基,置于37℃、5%co2、饱和湿度的培养箱中培养,每3日更换含药培养基,待细胞逐渐出现耐受稳定生长后,予以不含药h1975培养基固定培养3天后传代。将培养基奥希替尼浓度在上一次浓度的基础上倍增,重复上述步骤,循环直至培养液中奥希替尼浓度增加至10μmol/l。
(3)取上述奥希替尼浓度增加至10μmol/l的h1975细胞株,在10μmol/l奥希替尼中培养2个月,直至传代的h1975能在含10μmol/l的奥希替尼培养液中以与亲代h1975细胞株相同的速率稳定生长、传代,即获得本发明的耐奥希替尼的人肺癌细胞系h1975/or。
(4)提取本发明的细胞株h1975/or的dna及蛋白裂解液;同时对提取的蛋白裂解液进行akt、p-akt、erk、p-erk蛋白免疫印迹实验。sanger法直接测序显示本耐奥希替尼人非小细胞肺癌细胞株h1975/or获得性rb1基因缺失,蛋白免疫印迹实验显示emt相关蛋白、肿瘤干细胞标志cd44水平较h1975亲代细胞显著增加。且本耐奥希替尼人非小细胞肺癌细胞株h1975/or对奥希替尼具有高度耐药性,能用于构建人非小细胞肺癌体内外奥希替尼耐药的肿瘤模型。
本发明的有益效果:本发明的耐奥希替尼人肺癌细胞株h1975/or可以用于研究奥希替尼耐药人非小细胞肺癌细胞形态学及生物学特点、研究肿瘤耐药机制、分析抗肿瘤药物敏感性及筛选和评估抗肿瘤药物、开发肿瘤耐药逆转药物、研究更有效的肿瘤治疗方法等,并可用于非小细胞肺癌耐药机制的探讨及其相关信号通路的研究,具有较高的科研和生产应用价值,预期能产生良好的科研、经济和社会效益。
附图说明
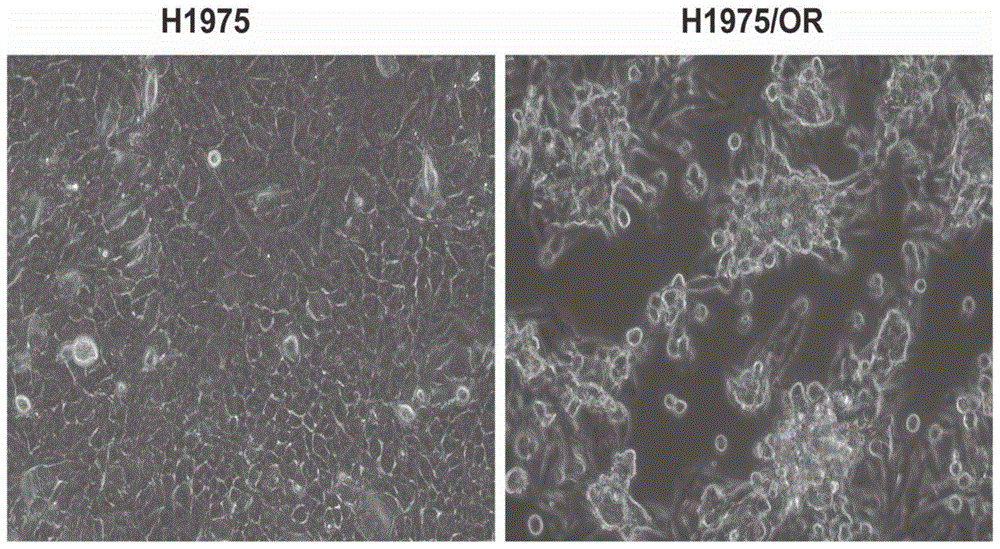
图1为人的非小细胞肺癌细胞株h1975和本发明的耐奥希替尼人非小细胞肺癌细胞株h1975/or在倒置相差显微镜下拍摄的照片。
图2为本发明耐奥希替尼人非小细胞肺癌细胞株h1975/or的对奥西替尼的耐药程度示意图(横坐标表示耐奥希替尼的浓度,纵坐标表示细胞存活率)。
图3为本发明耐奥希替尼人非小细胞肺癌细胞株egfr通路活化情况及emt相关蛋白免疫印迹结果示意图(图中的“h1975-r”为“h1975/or”)。
图4为本发明耐奥希替尼人非小细胞肺癌细胞株获得性p53失活、rb1缺失相关测序结果。
图5为本发明耐奥希替尼人非小细胞肺癌细胞株表达小细胞肺癌特异性蛋白synapsin的免疫组化结果示意图。
具体实施方式
为了更加简洁明了的展示本发明的技术方案、目的和优点,下面结合具体实施例及其附图对本发明做进一步的详细描述。
本发明中涉及的现有实验方法、测试方法及溶液配制方法可以参考《细胞实验指南》,标准书号:7-03-007598-6/q.891原著:[美]d.l.斯佩克特r.d.戈德曼&l.a.莱因万德。
实施例中提及的rpmi1640培养液、试剂、抗体及试剂盒为市购产品。
实施例1耐奥希替尼人的非小细胞肺癌细胞株h1975/or的制备
制备方法包括以下步骤:
(1)人的egfr阳性的非小细胞肺癌细胞株h1975(以下简称人非小细胞肺癌细胞株h1975)购买自美国典型培养物保藏中心(atcc)。将该细胞h1975株置于含25mmol/l4-(2-羟乙基)-1-哌嗪乙磺酸(hepes)和10%胎牛血清(fbs)的rpmi1640培养液(以下简称h1975培养基)中,于37℃、5%co2、饱和湿度的培养箱中培养,0.25%胰蛋白酶和乙二胺四乙酸(0.25%trypsin-edta)消化传代;
(2)取约5×105个h1975细胞于培养瓶中,贴壁24小时后,吸出旧培养液,加入新配制的含0.1μmol/l奥希替尼的h1975培养基,置于37℃、5%co2、饱和湿度的培养箱中培养,每两日更换含药培养基。待细胞密度达到80-90%时,消化细胞,通过细胞计数控制细胞个数约为5×105,配置原药物浓度培养基继续培养,每3日更换培养基一次。再次待细胞生长至密度达到70-90%时,消化细胞,控制细胞个数约为5×105,配置新药物浓度培养基培养(新浓度的奥希替尼培养液中的奥希替尼浓度按原浓度倍增),3天更换培养基一次,待细胞生长至密度达到70-90%时,消化细胞,控制细胞个数约为5×105,置于含1μmol/l奥希替尼的培养液中继续进行培养。培养液中的奥希替尼浓度按如此顺序递增2μmol/l→3μmol/l→4μmol/l→5μmol/l→6μmol/l→7μmol/l→8μmol/l→9μmol/l→10μmol/l→15μmol/l,进行培养。每一个药物浓度传代两次,直至奥希替尼浓度增加至15μmol/l。
(3)取奥希替尼浓度增加至15μmol/l的h1975细胞株,在15μmol/l奥希替尼中培养3个月,直至该人的egfr阳性的非小细胞肺癌细胞株h1975能在含15μmol/l浓度的奥希替尼培养液中以亲代同样的速率稳定生长、传代后,至此即获得本发明的耐奥希替尼人非小细胞肺癌细胞株h1975/or。
实施例2本发明耐奥希替尼人非小细胞肺癌细胞株h1975/or的冻存
将实施例1中获得的耐药细胞置入冻存管的冻存液中,再将冻存管置于液氮中保存。冻存液由90%h1975培养基和10%二甲基亚砜(dmso)组成。冻存过程采取将冻存管置于nalgene程序降温盒,-80℃过夜,最后放入液氮的步骤。
实施例3耐奥希替尼人非小细胞肺癌细胞株h1975/or的复苏
从液氮中取出装有细胞的冻存管,立即放入37-40℃水浴中轻轻摇动,使冻存物在1分钟内解冻,用酒精棉球擦拭冻存管外壁后拿入超净台。将解冻后的细胞悬液置于15ml无菌离心管中,加入5mlh1975培养基,1200转/分离心5分钟,弃上清,加入5ml含10μmol/l奥希替尼的h1975培养基,稍吹打混匀成混合液,吸混合液置入一个25cm2的细胞培养瓶中,拧松瓶盖放入二氧化碳培养箱中,在37℃、5%co2、饱和湿度的条件下培养,3-4天更换培养基一次,细胞密度达到80-90%时消化,1:3传代培养。
实施例4人非小细胞肺癌细胞株h1975及本发明的耐奥希替尼人非小细胞肺癌细胞株h1975/or的形态学观察
分别取人非小细胞肺癌细胞株h1975及本发明的耐奥希替尼人非小细胞肺癌细胞株h1975/or接种于25cm2培养瓶中,待生长至对数期,置倒置相差显微镜下观察活细胞形态并拍照,如图1所示,可见本发明细胞株h1975/or的细胞较亲本细胞h1975异型性明显,细胞间接触粘连减少,细胞成球并漂浮于培养液中,具有更强的转移能力。
实施例5人非小细胞肺癌细胞株h1975及本发明耐奥希替尼人非小细胞肺癌细胞株h1975-的细胞生长曲线和倍增时间测定
分别取人非小细胞肺癌细胞株h1975及本发明的耐奥希替尼人非小细胞肺癌细胞株h1975/or,用0.25%胰蛋白酶和乙二胺四乙酸(0.25%trypsin-edta)消化制备成单细胞悬液,接种于24孔板,每孔细胞1×104个,于24、48、72、96、120小时计算细胞数,每次数孔,取平均值绘制细胞曲线,并计算倍增时间(td)。按patterson公式计算细胞在对数生长的群体倍增时间td(h)=tlg2/lg(n/no),其中t表示细胞对数增值的时间,n为对数增殖期结时的细胞数,no为对数增殖期开始时的细胞数,算得h1975细胞群体倍增时间为37.35±2.47h,h1975/or群体倍增时间为42.63±4.39h。
实施例6人非小细胞肺癌细胞株h1975及本发明耐奥希替尼人非小细胞肺癌细胞株h1975/or的耐药指数的测定
(1)用0.25%胰蛋白酶和乙二胺四乙酸(0.25%trypsin-edta)分别消化处于对数生长期的人非小细胞肺癌细胞株h1975及本发明的耐奥希替尼人非小细胞肺癌细胞株h1975/or,用h1975培养基调整细胞浓度至4×104/ml,制成单细胞悬液。每孔接种0.2ml的单细胞悬液至96孔板,每个细胞株均设实验组、对照组,置37℃、5%co2、饱和湿度的培养箱中培养过夜。然后吸弃每孔中的上清液,磷酸盐缓冲液洗一次,之后对照组中分别加入h1975培养基0.1ml,实验组中分别加入含奥希替尼的h1975培养基0.1ml,含奥希替尼的h1975培养基中加奥希替尼的终浓度分别为31.25、62.5、125、250、500、1000nmol/l,每一浓度设3个复孔,同时设仅接种细胞的无药对照孔和仅加培养液的调零孔。
(2)常规培养48小时后,每孔加20μlmtt液(5mg/ml)于上述细胞的96孔板,继续培养4小时,取出96孔板,吸弃上清液,每孔加入二甲基亚砜150μl,置于振荡器上震荡1分钟,用酶标仪检测595nm波长od值,每3个复孔取其平均值。根据od值计算细胞抑制率,计算公式为:细胞抑制率(%)=(1-实验组od值/对照组od值)×100%,再利用spss15.0软件regreession中的probit过程计算半数抑制浓度(ic50)。根据公式:耐药指数r1=耐奥希替尼人非小细胞肺癌细胞株h1975/oric50÷人非小细胞肺癌细胞株h1975ic50,得出耐药指数为152,为高度耐药。
实施例7人非小细胞肺癌细胞株h1975及本发明耐奥希替尼人非小细胞肺癌细胞株h1975/or的dna的提取、扩增及测序
取人非小细胞肺癌细胞株h1975及本发明的耐奥希替尼人非小细胞肺癌细胞株h1975/or汇合至80-90%25cm2培养瓶细胞各一瓶,吸去培养液,0.25%胰蛋白酶和乙二胺四乙酸(0.25%trypsin-edta)消化,离心,弃去培养基,各加入5ml磷酸盐缓冲液,漂洗一遍,离心,弃去磷酸盐缓冲液,每管加入200ul磷酸盐缓冲液,混匀,转移混匀液至ep管,使用凯杰生物试剂盒qiaampdnabloodminikit提取dna,后续操作按试剂盒操作。
使用二代测序方法,该细胞株保留对奥希替尼敏感的egfrexon21:c.t2573g:p.l858r及exon20:c.c2369t:p.t790m突变,获得性耐药后出现rb1基因缺失,见图3。
实施例8人非小细胞肺癌细胞株h1975及本发明耐奥希替尼人非小细胞肺癌细胞株h1975/or的蛋白裂解液提取及emt相关蛋白(vimentin、e-cadherin)、肿瘤干细胞相关标志(cd44)、egfr通路蛋白(egfr、p-egfr)及旁路蛋白(akt、p-akt)免疫印迹实验
取6孔板培养的汇合至80-90%人非小细胞肺癌细胞株h1975及本发明耐奥希替尼人非小细胞肺癌细胞株h1975/or细胞,吸去原培养基,冷磷酸盐缓冲液漂洗一遍,加入含蛋白酶抑制剂及磷酸酶抑制剂的细胞裂解液,冰上立即用细胞刮刮取细胞,转刮取的细胞抽提液置ep管,超声10-15s,冰上冷却,离心4℃,12000转/分,10分钟,取上清,用bca试剂盒测蛋白浓度,每组取总蛋白25ug加上样缓冲液,上样,按蛋白免疫印迹方法常规电泳、转膜、孵育抗体,机器曝光。蛋白免疫印迹的结果显示,h1975/or发生上皮间质转化(emt),肿瘤干细胞标志物cd44水平较h1975亲代细胞显著增加,egfr通路活化减弱,旁路激活,见图4。
实施例9人非小细胞肺癌细胞株h1975及本发明耐奥希替尼人非小细胞肺癌细胞株h1975/or制作细胞组织蜡块并进行免疫组织化学染色(ihc)实验。
将切片在脱蜡前,放在apes(防止脱片用的,缺点是有低毒性)1:50丙酮溶液中浸泡3分钟,晾干或60℃恒温箱中烘烤20分钟,然后将组织切片置于二甲苯中浸泡10min,更换二甲苯再浸泡10min,无水乙醇浸泡10min,更换无水乙醇再浸泡10min,然后依次95%乙醇,70%乙醇,50%的乙醇各5min,最后用蒸馏水浸泡5min。
通过免疫组织化学发现,h1975/or保留了与亲本h1975细胞株的非小细胞肺癌相关的标志物(上皮来源标志物ck强阳性、腺癌标志物nepsina阴性),但h1975/or表现出鳞状细胞肺癌标志ttf的弱阳性,而亲本表达ttf强阳性,表明h1975/or表型已发生改变。两者均不表达小细胞肺癌特异性标志物(syn、nse、cd56、),但h1975/or发现表达小细胞肺癌标志物cga弱阳性,以此可说明h1975/or的组织表型已向小细胞肺癌转化,见图5。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!