一种用于培养人源细胞的无血清培养基添加剂的制作方法
本发明涉及细胞生物学领域,具体为一种用于培养人源细胞的无血清培养基添加剂。
背景技术:
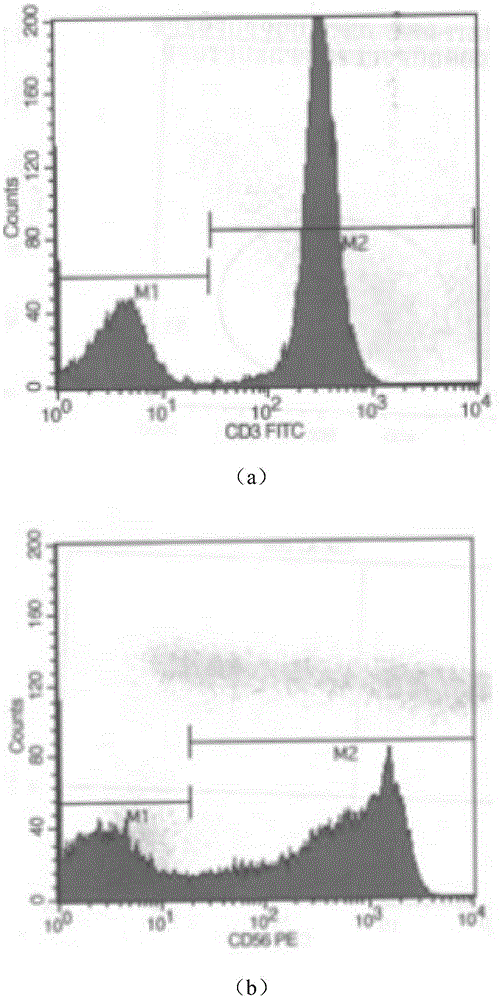
:人源细胞的体外培养需要一定的营养环境用于维持细胞的生长和繁殖,包括蛋白质、激素、生长因子和其他营养物质等。目前,在人源细胞培养研究及生产过程中,细胞培养基最常使用的关键组分是胎牛血清。虽然在实际应用中,由于胎牛血清所含的关键因子和蛋白,使得细胞生长状态、增殖速率都比较稳定,取得了良好的实验结果,但由于血清的添加,也为人源细胞的培养带来动物蛋白,病原体及抗生素等潜在危害,并且由于其成分的不确定性、批次间不稳定,存储时间短,供应时间存在周期性,生产方式的伦理争议等原因,为包括干细胞等生物药品的开发,带来了细胞生产不稳定,后续开发困难等诸多问题。另外,由于生物制药领域的快速发展,国内对细胞培养基的需求逐年增加,而胎牛血清作为细胞培养的常用添加物,由于产量少、产地限制等原因,一直供不应求。而细胞工程中无血清培养技术的应用,在很大程度上可以减少甚至避免含血清培养所带来的不利。因此,无血清培养基作为胎牛血清培养基的替代物,其科学性和经济性不断显现,市场规模逐年增长。仅2015年,国内对无血清培养基的需求已达到了376万升,而2016年国内无血清培养基市场规模达到了29亿元。此外,针对血清在细胞培养中的种种缺点,2015年卫计委发布了《干细胞制剂质量控制及临床前研究指导原则(试行)》,其中明确指出:除特殊情况外,应尽可能避免在干细胞培养过程中使用人源或动物源性血清,不得使用同种异体人血清或血浆;如必须使用动物血清,应确保其无特定动物源性病毒污染;严禁使用海绵体状脑病流行区来源的牛血清。因此,研制开发出适合人源细胞体外生长的无血清培养基,既能满足细胞培养的要求,又能避免临床应用上因使用血清带来的诸多不利因素。技术实现要素:本发明目的是针对现有技术存在的缺陷提供一种用于培养人源细胞的无血清培养基添加剂,利用白细胞裂解蛋白、重组人血白蛋白、胰岛素、人转铁蛋白、胆固醇、过氧化氢酶制备一种广谱、易保存的人源细胞培养基添加剂,旨在提高人源细胞无血清培养能力的同时,加强无血清培养的安全性,进而提高人源细胞的临床应用的安全性。本发明为实现上述目的,采用如下技术方案:一种用于培养人源细胞的无血清培养基添加剂,所述培养基添加剂包括浓度为0.1—10mg/ml的白细胞裂解蛋白、0.1—5mg/ml的重组人血白蛋白、5—20μg/ml的胰岛素、10—30μg/ml的人转铁蛋白、10—60μg/ml的胆固醇、20—60μg/ml的过氧化氢酶。现有技术中,通常替代胎牛血清过程中不得不添加大量生长因子和激素,如地塞米松、表皮细胞生长因子、孕酮、皮质酮等,这类成分在细胞培养中相互影响,且由于剂量的不恰当使用,虽然可以有效促进细胞的增殖,但也会影响细胞增殖过程中二倍体的变异。因此本发明所添加物质,旨在提高人源细胞无血清培养能力的同时,加强无血清培养的安全性,进而提高人源细胞临床应用时的安全性。进一步的技术方案中,所述白细胞裂解蛋白选自脐血来源的白细胞;所述白细胞裂解蛋白用于提供人源细胞所需的营养因子。进一步的技术方案中,所述无血清培养基的ph值为6.8-7.4;所述无血清培养基的渗透压为280-330mosm/kg。进一步的技术方案中,所述人源细胞包括脐静脉内皮细胞、免疫细胞、脐带间充质干细胞。本发明的有益效果:本发明利用白细胞裂解蛋白、重组人血白蛋白、胰岛素、人转铁蛋白、胆固醇、过氧化氢酶制备一种广谱、易保存的人源细胞培养基添加剂,在排除血清干扰的情况下,使人源细胞正常生长,减少甚至替代胎牛血清在细胞培养中的作用;本发明可根据人源细胞的特点,添加多种组分来共同制备无血清培养,使其较好适应不同种类人源细胞地培养,同时成分简练清晰,便于后续相关研究的开展,利于研究人员在此基础上优化某种人源细胞的无血清培养体系。附图说明图1为本发明实施例1的内皮细胞原代培养生长状态图;图2为本发明实施例1的内皮细胞培养至第3代的鉴定结果图;图3为本发明实施例2中免疫细胞表面分子标志检测结果图(图中:a为cd3+检测结果图,b为cd56+检测结果图,c为cd3+cd56+检测结果图);图4为本发明实施例3的间充质干细胞融合传代生长图;图5为本发明实施例3的间充质干细胞培养至第3代表面分子标志的鉴定结果图(图中:a为cd90检测结果图、b为cd73检测结果图);图6为本发明无血清培养基培养脐带间充质干细胞的核型检测分析图。具体实施方式下面将结合附图及实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例1无血清培养基培养脐静脉内皮细胞无血清培养基添加剂配方如下:白细胞裂解蛋白浓度0.1mg/ml,白蛋白浓度为1mg/ml,胰岛素浓度为30μg/ml,人转铁蛋白浓度为20μg/ml,胆固醇浓度为40μg/ml,过氧化氢酶浓度为40μg/ml,在无菌条件下除菌过滤后,结合imdm,添加egf和肝素钠,用于培养脐静脉内皮细胞,实验步骤如下:1、将装有脐带的瓶子用75%酒精擦拭一遍,放入超净台内;2、酒精浸泡脐带一分钟;3、用pbs清洗脐带三次,挤出脐带中的血液,待用;4、用锡箔纸覆盖软木,将纱布铺在铝箔上,用75%乙醇浸泡,等干;5、切除脐带一端2cm或2cm以上,包括动脉夹痕迹处;6、脐带一端通过接合管连接血转移袋,用手术刀和手术镊剥出一段静脉,长约2cm,缝线固定接合管,紧紧打结两次,另一端通过接合管连接20ml注射器,缝线固定接合管,用针将脐带钉在软木板上,但注意不要穿经血管腔;7、通过注射器注入25mld-pbsa注入脐带,靠d-pbsa的压力将静脉扩张,检查脐带是否有小孔,如有小孔,用鳄鱼夹夹持脐带,使小孔闭合,但不要夹闭静脉;8、用另一只注射器将25ml胶原蛋白酶液注入脐带,直至脐带膨胀;9、在37摄氏度条件下放置8分钟,温度低时适当延长时间,将胶原蛋白酶液挤出脐带;10、换注射器,将25mld-pbsa注入脐带挤压或拍打整段脐带一小会,然后用此端注射器抽取d-pbsa;11、将血转移袋其中一个口封住,注射器吸出血转移带中液体,4℃离心(210g,10min);(预先在离心管中加入fbs已终止消化)12、本实施例中所配培养基50ml,起悬后再离心(210g,10min);13、完全培养液(本实施例中所配培养基及10%fbs)起悬后再离心(210g,10min);14、吸去培养瓶内多余的明胶溶液,接种细胞;15、第二天从培养瓶吸去培养液,用d-pbsa洗2次,加入huvec生长培养液;16、吸去一半培养液,加入新鲜培养液,每周3次,细胞生长状态如图1,呈铺石子状;17、培养至第3代,进行鉴定,具体实验步骤如下:1)提前准备将microscopecoverglass放入24孔板中,铺上0.25%明胶,放至2h后,晾干待用。2)将huvec细胞按一定比例种与准备的24孔板中,待细胞基本长满,取出24孔板,弃去培养液,用dpbs洗涤两次,5min/次。3)用4%pfa室温固定15min,dpbs清洗细胞涂片3次,5min/次。4)0.5%triton-x100(acrosorganics,cas:9002-93-1)室温破膜5min,dpbs清洗细胞涂片3次,5min/次。5)1%bsa于37℃封闭90min。6)分别孵育一抗cd31工作液(用1%bsa按1:100稀释)和ve-cadherin工作液(用1%bsa按1:100稀释),4℃过夜。7)次日细胞涂片复温30min,dpbs清洗细胞涂片3次,10min/次,分别加入不同荧光二抗(用1%bsa按1:1000稀释)37℃避光孵育60min。dpbs清洗细胞涂片3次,10min/次。8)加入dapi,室温避光孵育5min。dpbs清洗细胞涂片3次,10min/次。9)50%甘油封片,显微镜观察拍照。鉴定结果如图2。实施例2无血清培养基培养免疫细胞无血清培养基添加剂配方如下:白细胞裂解蛋白浓度0.5mg/ml,白蛋白浓度为0.4mg/ml,胰岛素浓度为20μg/ml,人转铁蛋白浓度为10μg/ml,胆固醇浓度为30μg/ml,过氧化氢酶浓度为20μg/ml,在无菌条件下除菌过滤后,结合1640,添加il-2、ifn-γ后,用于培养cik细胞,培养16d后进行鉴定,具体实验步骤如下:1、无菌条件下取足月剖腹产或足月正常产乙肝病毒检测阴性孕妇的脐带血50-80ml,放于含cpda1复合抗凝剂的采血袋中,4℃保存;2、脐带血用生理盐水进行1:1稀释;3、将稀释好的脐带血沿管壁缓慢加入含ficollhypaque人淋巴细胞分离液上层(两者比例为1:1),其相对密度为1.077g/l;4、梯度离心,500g/min,30min;5、取中间云雾状的单个核细胞层,用本实施例配制的培养基(含90%实施例1配置的培养基以及10%fbs)离心洗涤2次,每次300g/min,离心5min;6、弃上清后用本实施例的培养基重新悬浮细胞调整密度成0.8-1.5×106/ml;7、在细胞悬液中添加重组人ifn-γ终浓度为1000u/ml,移入培养瓶中,置于37℃,5%co2饱和湿度培养箱中培养24小时;8、添加人cd3单克隆抗体,人重组白介素1和人重组白介素2,终浓度分别为100ng/ml,100u/ml和500u/ml;9、继续培养48~72小时后显微镜下细胞计数,调节细胞密度为1×105/ml;10、每隔72小时按上述相同条件扩大培养一次,培养至第21天时收集细胞待用;11、进行流式鉴定,具体操作步骤如下:将免疫细胞制成1×106/ml细胞悬液,分别加入鼠抗人单克隆抗体cd3-fitc、cd56-pe各10μl,充分混匀,室温下反应30min,每管加入1.5mlpbs,1200r/min离心5min,弃上清,每管加入100μlpbs,流式细胞仪检测,结果如表1:表1:细胞表面分子标志cd3+、cd56+、cd3+cd56+检测结果表表面分子标记阳性率cd3+74.32%cd56+63.32%cd3+cd56+38.50%细胞表面分子标志检测结果图如图3中a、b、c所示。实施例3无血清培养基培养脐带间充质干细胞无血清培养基添加剂配方如下:白细胞裂解蛋白浓度0.4mg/ml,白蛋白浓度为0.8mg/ml,胰岛素浓度为30μg/ml,人转铁蛋白浓度为20μg/ml,胆固醇浓度为20μg/ml,过氧化氢酶浓度为30μg/ml,在无菌条件下除菌过滤后,结合dmem/f12,用于培养脐带间充质干细胞,具体实验步骤如下:1、将装有脐带的瓶子用75%酒精擦拭一遍,放入超净台内;2、在净化工作台下,将脐带组织从脐带采集瓶中移出,放入无菌弯盘中;3、加入无菌pbs,轻轻冲洗后,移出pbs;4、将脐带放入,清洗一遍,放入弯盘内,取剪刀把脐带一头剪去,再剪下3段1cm左右的脐带组织,用止血钳将脐带血管内凝血去掉,剥去两条动脉;5、用手术剪剔除胎膜部分及血管,将组织剪碎直至组织块大小为2mm×2mm;6、将组织均匀的贴在t75瓶内,每行大约10个,贴10行左右;7、再往瓶内加入10ml全培(实施例1所配培养基及10%fbs);8、放入37℃培养箱内培养;9、细胞培养至7d,吸弃全部培养基,加入本实施例无血清培养基,继续培养5d后形成细胞集落;10、细胞培养至90%时融合进行传代;细胞融合率达90%以上时,细胞呈漩涡式生长,培养过程使用本实施例所指无血清培养基,如图4所示;11、细胞培养至第3代,进行流式鉴定,具体操作步骤如下:取第3代细胞,达到80%~90%融合时用胰蛋白酶/edta消化液消化,制成1×106/ml细胞悬液。分别加入鼠抗人单克隆抗体cd90-pe、cd73-pe各10μl,充分混匀,室温下反应30min,每管加入1.5mlpbs,1200r/min离心5min,弃上清,每管加入100μlpbs,流式细胞仪检测,结果如表2:表2:细胞表面分子标志cd90、cd73检测结果表表面分子标记阳性率cd9099.89%cd7399.86%细胞表面分子标志检测结果图如图5中a、b所示。实施例4无血清培养基培养脐带间充质干细胞的核型检测对实施例3无血清培养基中持续培养的第三代细胞进行核型分析,结果经传代后uc-mscs可维持核型正常,如图6所示。综上所述,本发明所述的用于培养人源细胞的无血清培养基添加剂不仅易于保存而且应用广泛,能适应不同种类人源细胞的培养,克服了传统无血清培养基仅适合某一类细胞培养的缺点,本发明应用前景十分广阔。以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1