大豆Glyma.04G016500.1抗病基因的用途的制作方法
本发明涉及基因工程技术领域,特别涉及大豆glyma.04g016500.1抗病基因及其编码的蛋白质gmsaul1与合成方法。
背景技术:
大豆是一种非常重要的农作物,可以为人类提供蛋白质。但是大豆在生长的过程中非常容易受到生物以及非生物胁迫,例如大豆斑点病菌、大豆斑疹病菌、大豆根腐病、大豆霜霉病、大豆花叶病毒,这些疾病都会影响大豆的产量,所以提高大豆的抗病性的研究是非常必要的。
e3连接酶是一个大家族。人类基因中e3编码基因不足700个,与人类基因组相比,高等植物大大扩展了e3基因家族。在拟南芥基因组中,比如:拟南芥中的e3编码基因已经超过了1400个。水稻中e3编码基因有1300多个,说明e3连接酶在植物的生命活动中扮演着重要的角色。这种扩展暗示了e3连接酶可能在植物特定的过程中发挥了一定的作用或者存在遗传冗余。衰老相关基因(saul1)是一种e3连接酶,通过不同的机制可以参与植物的抗病反应,在植物的防御反应中发挥着重要的作用。
泛素化过程是真核生物中常见的蛋白质翻译后修饰过程,该过程被用来调节蛋白质底物的稳定性。大豆glyma.04g016500.1编码的蛋白gmsaul1参与蛋白质泛素化的途径,该途径是蛋白质修饰的一部分。
专利号201510964032.8的发明《大豆glyma·04g253500抗病基因的用途》告知了:沉默大豆glyma.04g253500基因,验证其增强大豆抗病的能力;并转入诱导型启动子,增强大豆抗病能力---抗大豆花叶病毒(smv)、抗大豆霜霉菌(大豆霜霉病菌属于真菌),改良抗病性状。glyma.04g253500编码的是激酶,其主要是参与mapk途径。
技术实现要素:
本发明要解决的技术问题是提供一种大豆glyma.04g016500.1抗病基因的用途。
为了解决上述技术问题,本发明提供一种大豆glyma.04g016500.1抗病基因的用途,用于提高大豆的抗病性能;所述大豆glyma.04g016500.1抗病基因cdna核苷酸的序列如seqidno:1所述。
作为本发明的大豆glyma.04g016500.1抗病基因用途的改进:所述抗病包括抗大豆斑点病菌(psg)、抗大豆花叶病毒(smv)。
说明:大豆斑点病菌属于细菌。
本发明还同时提供了制备gmsaul1沉默植株的方法:沉默大豆glyma.04g016500.1基因,大豆glyma.04g016500.1抗病基因cdna核苷酸的序列如seqidno:1所述。
在本发明中,提供了大豆glyma.04g016500.1抗病基因及其编码的蛋白质gmsaul1与合成方法。
大豆glyma.04g016500.1抗病基因的cdna核苷酸的序列如seqidno:1所述。
大豆glyma.04g016500.1抗病基因编码的蛋白质gmsaul1的氨基酸序列如seqidno:2所述。
大豆glyma.04g016500.1抗病基因的合成方法为:提取基因沉默型大豆的rna,将rna反转录为cdna,再以cdna为模板,以下述序列为引物,通过rt-pcr获得glyma.04g016500.1的基因沉默序列,所述引物的序列为:
glyma.04g016500.1-f:aagggatccgttatgcgtgatcctgttactttaga
glyma.04g016500.1-r:ttgggtaccccttcagcatgtcaacaatcattg
本发明还提供了一种gmsaul1沉默植株,为验证沉默植株的沉默效果,通过提取沉默植株中的rna,将rna反转录为cdna,再以cdna为模板,以下述序列为引物,通过rt-pcr验证glyma.04g016500.1的基因沉默效果,所述引物的序列为:
glyma.04g016500.1验证-f:atgatggctgcgagct
glyma.04g016500.1验证-r:ctcatgtgaaaggaattttactac
本发明利用基因沉默及基因诱导技术,沉默大豆glyma.04g016500.1基因,验证其增强大豆抗病的能力;并转入诱导型启动子,增强大豆抗病能力,改良抗病性状。
本发明的glyma.04g016500.1编码的是e3连接酶,其主要参与的途径是泛素化途径。
本发明的有益效果:大豆glyma.04g016500.1抗病基因提高了大豆抗病性能;大豆glyma.04g016500.1抗病基因的合成方法简单,合成效率高,可以实现工业化生产。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细说明。
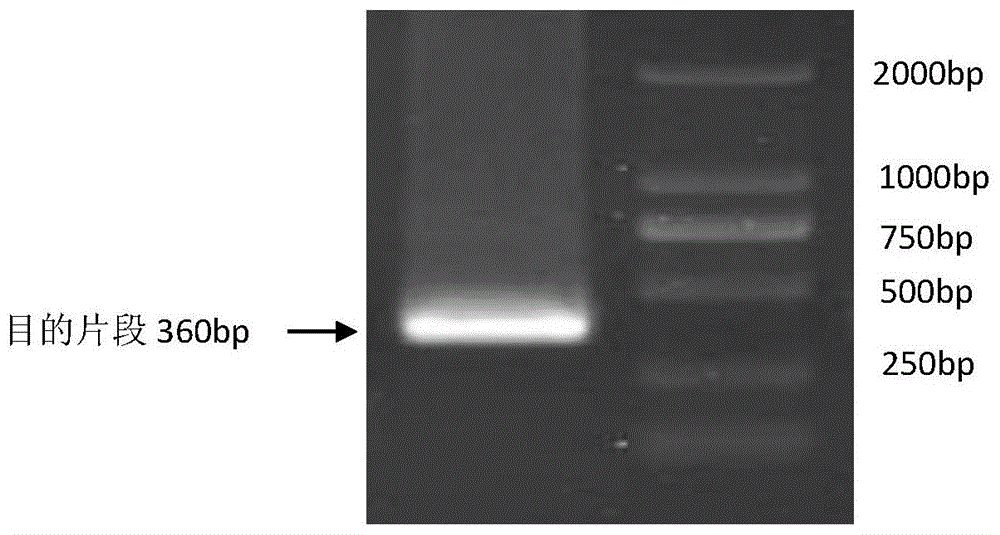
图1为glyma.04g016500.1抗病基因沉默片段的扩增结果。
图2为gmsaul1沉默植株表型;
图2中:
a为对照组与实验组的整体表型,沉默gmsaul1后,沉默植株与对照组相比生长发育受到影响,出现植株矮小的表型;
b为未沉默gmsaul1的对照组(bpmv-0)的局部叶片;
c为沉默gmsaul1的实验组(bpmv-gmsaul1)的局部叶片。
图3为gmsaul1沉默植株沉默效果分子验证;
图3中:
a为用载体上的引物进行验证,结果显示目的片段成功插入载体中;
b为用目的基因的验证引物进行验证,结果显示目的基因被沉默。
图4为检测gmsaul1沉默植株中pr1基因转录水平,结果显示gmsaul1沉默植株中pr1基因转录水平显著升高。
图5为gmsaul1沉默植株中出现细胞死亡;
图5中:
a为台盼蓝染色后的对照植株与沉默植株的整体叶片;
b为对照组bpmv-0在体式显微镜下的局部叶片;
c为实验组bpmv-gmsaul1在体式显微镜下的局部叶片,沉默植株叶片出现细胞死亡现象。
图6为gmsaul1沉默植株中h2o2积累增加;
图6中:
a为dab染色后对照植株与沉默植株的整体叶片;
b为对照组bpmv-0在体式显微镜下的局部叶片;
c为实验组bpmv-gmsaul1在体式显微镜下的局部叶片,沉默植株中h2o2积累增加。
图7为gmsaul1沉默植株中sa含量增加;
图7中:
a为对照组bpmv-0与实验组bpmv-gmsaul1中freesa(自由水杨酸)的含量比较,标准偏差p<0.05;
b为对照组bpmv-0与实验组bpmv-gmsaul1中totalsa(总水杨酸)的含量比较,标准偏差p<0.05。
图8为gmsaul1沉默植株接种大豆斑点病菌psg的表型及细菌计数比较;
图8中:
a为接种psg(pseudomonassyringaepv.glycinea大豆斑点病菌)6天后大豆的表型;
b为psg细菌侵染后的局部叶片;
c为接种psg6天后菌落数目,标准偏差p<0.005。
图9为沉默gmsaul1导致植株对大豆花叶病毒smv的抗性增强。
图9中:
a为沉默植株与对照组gus染色的结果;
b为体式显微镜下对照组smv-gus斑点分布;
c为体式显微镜下沉默植株中smv-gus斑点分布;
d为沉默植株与对照植株叶片上smv-gus病斑直径比较,标准偏差p<0.0001;
图10为沉默gmsaul1增强了gmmpk3激酶对flg22的激活程度。
图11为gmsaul1亚细胞定位,gmsaul1定位于细胞质及细胞核中;
图11中:
a为freegfp的亚细胞定位情况;
b为目的蛋白gmsaul1的亚细胞定位情况。
具体实施方式
下面结合图1至图11对本发明的优选实施例进行详细阐述,以使本发明的优点和特征能更易于被本领域技术人员理解,从而对本发明的保护范围做出更为清楚明确的界定。
实施例1、glyma.04g016500.1抗病基因序列合成
1、总rna的提取,采用trizol法提取总rna:
(1)取大豆幼苗植株叶片,并将植株叶片剪碎,去掉叶柄和较粗的叶脉,放入到液氮中预冷的研钵内,向研钵内加液氮并研磨至粉末,将粉末转移至液氮中冷却处理过的1.5ml的离心管内。
(2)向1.5ml的离心管中加1mltrizol,并使离心管漩涡震荡,每震荡一会儿对离心管进行开盖放气处理,防止离心管内的气压变大而使液体迸溅,从而得到研磨液。
(3)将得到的研磨液装入新的离心管内,将装好研磨液的离心管放在离心机上进行离心处理,该离心机的温度为4℃,转速为12000rpm,离心时间为10min。
(4)吸取离心处理后的离心管的上清液到一个新的离心管中,并将装有上清液的离心管室温放置5min。
(5)向装有上清液的离心管内加0.2ml氯仿,并对离心管盖紧盖子,强力震荡15秒后,室温放置2-3min。
(6)将上述离心管进行离心处理;离心温度为4℃,转速为12000rpm,离心时间为15min。
(7)离心后,离心管有液相和有机相,中间分层,将离心管倾斜45°,用100μl枪头向离心管内轻轻吸出最上面液相装入到新管中;不要吸到中间层和有机层。
(8)加0.5ml异丙醇于新管中,室温放置10min,离心温度为4℃,转速为12000rpm,离心时间10min。
(9)去除新管内的上清液,留沉淀于新管内。
(10)再向新管内加1ml75%乙醇,将新管震荡,再将新管进行离心处理,离心温度为4℃,转速为7500rpm,离心时间为5min。
(11)再去除上清液,室温放置2-3min。
(12)用20-30μlrnase-freewater重悬,取1μl测浓度。
(13)提取出总rna。
2、crna的合成
具体步骤:
(1)rna的变性
把rna放在65℃温度下热变性5min后,立即放于冰上冷却。
(2)反应液配制
(3)逆转录反应
37℃条件下进行15min的逆转录,然后在98℃条件下进行5min的酶失活反应,最后在4℃下保存。
3、以crna为模板合成目的片段
具体步骤:
(1)高保真pcr50μl体系
f引物(glyma.04g016500.1-f):aagggatccgttatgcgtgatcctgttactttaga
r引物(glyma.04g016500.1-r):ttgggtaccccttcagcatgtcaacaatcattg
(2)高保真pcr反应体系
将上述体系混匀,放入pcr仪中,进行反应。
①95℃,3min。
②98℃,10s
③55℃---60℃,15s
④72℃,1min/kb;
⑤72℃,10min。
⑥4℃,永久保存。
注意:②,③,④反应循环32次左右。
(3)琼脂糖凝胶电泳检测pcr结果。结果如图1所示,左表示目的基因沉默片段大小为360bp(如seqidno:1中的121-480bp),右表示2000bp的dnamaker。目的基因的全长为2442bp,选取其中的360bp进行扩增,可以达到glyma.04g016500.1整个基因被沉默。
大豆glyma.04g016500.1抗病基因cdna核苷酸的序列如seqidno:1所述。该大豆glyma.04g016500.1抗病基因编码的蛋白质gmsaul1的氨基酸序列如seqidno:2所述。
实施例2、bpmv-glyma.04g016500.1载体的构建:
1、载体bpmv-rna1的酶切体系
将离心管放置于37℃水浴下酶切3小时,后进行纯化,即在pcr、酶切、酶标、或测序反应液中,加3个体积的bufferpcr-a(若bufferpcr-a不足100μl,加至100μl);混匀后,转移到dna制备管中,将dna制备管置于2ml离心管中,12000rpm离心1min,弃滤液。将制备管置回2ml离心管,加0.7mlbufferw2,12000rpm离心1min,弃滤液。将制备管置于洁净的1.5ml离心管中,在dna制备膜正中央加20μlddh2o,室温静置1min。12000rpm离心1min洗脱dna。
2、基因片段glyma.04g016500.1的酶切体系
将离心管放置于37℃下酶切3小时,纯化(纯化条件同上),加20μlddh2o。
3、载体和基因片段的连接体系
将离心管放置在16℃水浴中连接16小时以上。
4、热激转化、验证
⑴将20μl重组质粒dna制剂(步骤3所得)与200μl的感受态dh5α悬液温和混合,置转化管于冰浴30min,再经42℃水浴90s,然后移置冰水中5min。转化管内加入800μllb培养基后,置37℃的摇床45min。从转化管内提取100μl转化细胞,均匀涂布于lb平板(含相应质粒抗性的抗生素,具体是浓度为50mg/ml的氨苄青霉素抗生素),将lb平板放于37℃过夜培养;后对生长的菌落进行菌落pcr验证。
菌落pcr验证体系:
f引物(glyma.04g016500.1-f):aagggatccgttatgcgtgatcctgttactttaga
r引物(glyma.04g016500.1-r):ttgggtaccccttcagcatgtcaacaatcattg
后将可能成功的菌液送去测序公司测序,测序成功的菌液进行提取质粒,从而获得质粒bpmv-rna1-glyma.04g016500.1。
备注说明:质粒的提取鉴定按照常规的试剂盒离心提取法进行。具体方法可如下:
①取测序成功的菌落,放入5mllb液体培养基中培养过夜(约12h)。
②取1-4ml在lb培养基中培养过夜的菌液(若使用丰富培养基,菌液体积应减半或更少),12000rpm离心1min,弃上清。
③加250μlbuffers1悬浮细菌沉淀,悬浮需均匀,不应留有小的菌块。
④加250μlbuffers2,温和并充分地上下翻转4-6次混合均匀使菌体充分裂解,直至形成透亮的溶液。此步骤不宜超过5min。
⑤加350μlbuffers3,温和并充分地上下翻转混合6-8次,12000rpm离心10min。
⑥吸取步骤4中的离心上清并转移到制备管(置于2ml离心管(试剂盒内提供)中),12000rpm离心1min,弃滤液。
⑦将制备管置回离心管,加500μlbufferw1,12000rpm离心1min,弃滤液。将制备管置回离心管,加700μlbufferw2,12000rpm离心1min,弃滤液;以同样的方法再用700μlbufferw2洗涤一次,弃滤液。
⑧将制备管置回2ml离心管中,12000rpm离心1min。将制备管移入新的1.5ml离心管(试剂盒内提供)中,在制备管膜中央加30-60μleluent或去离子水,室温静置1min。12000rpm离心1min。
⑨将获得的质粒-20℃保存,待用。
实施例3、基因枪法创制大豆沉默植株
1、微弹的制备
(1)称取3mg的金粉(直径0.6μm),并放入到1.5ml的离心管内;
(2)向离心管内加50μl无水乙醇,涡旋振荡2~3min;
(3)再将涡旋振荡后的离心管冰浴静置5min并使金粉沉降,10000rpm,离心30s,弃上清液;
(4)重复(2),(3)步骤2次;
(5)加向离心管内加50μl无菌水,涡旋振荡2-3min,充分重悬;
(6)再将离心管冰浴静置5min,10000rpm,离心30s,弃上清液;
(7)重复(5),(6)步骤2次;
(8)再将离心管加50μl无菌水,涡旋1min,-20℃保存。
2、dna包埋
(1)取步骤1制备得到的微弹放入离心管内并涡旋2-3min,使金粉充分重悬;
(2)向离心管内吸取100μl金粉悬液,分装成2管,每管50μl;
(3)向第一个离心管内加3μl构建成功的质粒bpmv-rna1-glyma.04g016500.1(实施例2所得)、3μlbpmv-rna2,101(基因沉默抑制子)3ul,涡旋振荡3min;向第二个离心管内加3μl质粒bpmv-rna1、3μlbpmv-rna2,101(基因沉默抑制子)3ul,涡旋振荡3min。
(4)向2个离心管内均加50μl2.5mcacl2,涡旋振荡3min;
(5)向2个离心管内均加20μl0.1m亚精胺,涡旋振荡3min;
(6)将2个离心管冰浴静置15min,10000rpm,离心30s,弃上清液;
(7)向2个离心管内均加250μl无水乙醇,轻轻吹打沉淀重悬,涡旋振荡2-3min,彻底重悬,10000rpm,离心1min,弃上清;
(8)向2个离心管内加60μl无水乙醇,涡旋振荡2-3min;
(9)每轰击一枪加10μl于微粒载片上。(以上步骤加样均在超净台中进行)
3、基因枪轰击
轰击过程按基因枪进行,操作都在超净台上进行,各装置都用75%酒精擦拭干净,可裂膜及微粒载片等均用酒精浸泡并在滤纸上干燥,具体操作步骤如下:
(1)打开真空泵和基因枪的电源开关;
(2)打开氦气瓶阀门,旋转氦气调节杆,使气压高于所选可裂膜压力200psi左右;
(3)旋下可裂膜挡盖,将可裂膜放在挡盖中央,旋上挡盖,用专用扳手加固(可裂膜选7.0mpa);
(4)把微粒发射装置移出轰击室,旋下盖子,放入阻挡网。取10μl步骤2第一管所得的微弹加于微粒载片中央,待其干燥,把微粒载片安装在固定槽中,旋上盖子,将微粒发射装置放回轰击室;
(5)将大豆植株放置在轰击室的适当位置(叶片距微粒发射装置6cm),关上轰击室门;
(6)按vac开关抽真空。当真空表读数为所需值时(26~28inhg),开关打到hold处,然后按住fire开关,当达到适当压力,可裂膜自动破裂后,松开fire开关,轰击完成;
(7)将开关打到vent处,释放轰击室内的真空;
(8)打开轰击室门,取出样品盘;
(9)取出微粒发射装置,卸下微粒载片和阻挡网,阻挡网放入75%的酒精中浸泡;
(10)旋下可裂膜挡盖,清除可裂膜碎片;
(11)第二管微弹使用上述同样的方法操作;
(12)当pds-1000/he使用完毕,关掉氦气瓶的主阀,按住fire开关,放掉气体加速管内的氦气压力,最后关掉一切电源。
4、将两株大豆植株放在黑暗环境中生长一天,之后正常光照培养。第一管微弹基因枪法所得植株即为glyma.04g016500.1实验组(bpmv-gmsaul1),第二管微弹基因枪法所得植株为对照组(bpmv-0)。一般15-20天出现症状,结果如图2中所示,a图中实验组与对照组bpmv-0相比,沉默植株bpmv-gmsaul1呈现植株矮小的表型,b图为对照组bpmv-0的局部叶片,c图为沉默植株bpmv-gmsaul1的局部叶片。
实施例4、病毒汁液保存
通过基因枪法获得沉默植株后,将发病的叶片取下进行研磨,保存病毒汁液供后续使用。
1.具体操作如下:
(1)将研钵用酒精进行灼烧,冷却后将出现病毒症状的叶片放入研钵中,进行研磨;
(2)在研磨的过程中加入提前配好的1m磷酸缓冲液进行充分研磨;
(3)将研磨好的汁液保存到2ml的离心管中,后保存于-80℃冰箱中供后续接种传代使用;
2.1m(1mol/l)磷酸缓冲液的配制
1mol/l的nah2po4:称17.907gna2hpo4的白色结晶性粉末于250ml的烧杯中,加入50ml的蒸馏水使其溶解,在高压灭菌锅里121℃灭菌20min。
1mol/l的na2hpo4:称7.801gnah2po4的白色结晶性粉末250ml的烧杯中,加入50ml的蒸馏水使其溶解,在高压灭菌锅里121℃灭菌20min。
将配制好的1mol/l的nah2po4及1mol/l的na2hpo4分别取21.15ml和28.85ml,并用灭菌后的蒸馏水定容至500ml,此时磷酸缓冲液的ph为7.0,即可用于实验。
实施例5、沉默植株沉默效果分子验证
1.提取对照组与实验组的总rna,采用trizol法提取总rna(同实施例1中的1)。
2.cdna的合成(同实施例1中的2)。
3.沉默植株进行分子验证。
①用载体上的引物进行验证,验证体系如下:
f引物(1548-f):caagagaaagatttgttggaggga
r引物(bpmv-rna2-r):acaaggaaatccggtacgctt
用载体上的引物进行pcr扩增后进行琼脂糖凝胶电泳,结果如图3中a所示,bpmv-0表示对照组,bpmv-gmsaul1表示沉默植株,根据图3的a图,可以得知:目的片段成功插入载体中。
②用目的基因的验证引物进行分子验证
f引物(glyma.04g016500.1验证):atgatggctgcgagct
r引物(glyma.04g016500.1验证):ctcatgtgaaaggaattttactac
用目的基因的验证引物进行pcr扩增后进行琼脂糖凝胶电泳,结果如图3中b所示,bpmv-0表示对照组,bpmv-gmsaul1表示沉默植株,根据图3的b图,可以得知:目的基因gmsaul1表达量很低,已经被沉默。
实施例6、检测沉默植株中pr1基因的表达量
将提取的质粒bpmv-rna1-glyma.04g016500.1进行rt-pcr扩增,pcr体系如下:
f引物(pr1-glyma.15g062500.1):atggggttgtacaagatttca
r引物(pr1-glyma.15g062500.1):ttagtatggtctttggccaatatag
f引物(gmelf1b):gagctatgaattgcctgatgg
r引物(gmelf1b):cgtttcatgaattccagtagc
pcr扩增后进行琼脂糖凝胶电泳,如图4所示,bpmv-0表示对照组,bpmv-gmsaul1表示沉默植株,根据图4可得知:沉默植株中pr1基因的表达量显著升高。
实施例7、检测沉默植株中的细胞死亡、h2o2的积累以及sa(水杨酸)的含量
1、通过台盼蓝染色来检测沉默植株中的细胞死亡情况,台盼蓝染色的方法如下:
(1)准备50ml的小烧杯,将10ml甘油、10ml乳酸、10ml无菌水混匀;
(2)后加入10mg台盼蓝、10g苯酚配制成台盼蓝染液;
(3)将沉默植株以及对照植株的叶片浸泡在预热煮沸的台盼蓝染液中,煮沸3-5分钟;
(4)后用镊子取出叶片,用无菌水冲洗三次;
(5)配制30ml2.5g/ml的水合氯醛,在摇床上脱色过夜;
(6)在体式显微镜下进行拍照观察。
所得结果为图5,bpmv-0表示对照组,bpmv-gmsaul1表示沉默植株,其中a图为台盼蓝染色后的整体叶片,b图为对照组局部叶片,c图为实验组的局部叶片。根据图5可以得知:与对照组相比,沉默植株中出现了大量的细胞死亡。
2、通过dab染色检测沉默植株中h2o2的积累情况,dab染色方法如下:
(1)称取50mgdab药品,加入50ml无菌水,配制成1mg/ml的dab溶液(称取时要避光);
(2)将dab溶液用0.2m的hcl调节ph值至3.0,后放于磁力搅拌器上使其充分溶解;
(3)溶液混合均匀后,向溶液中加入2.5ml的吐温20,2.5ml的200mm的nahpo4,并继续调节ph至3.0;
(4)后将沉默植株以及对照组的发病叶片剪下放入上述溶液中,在摇床上放置4-5小时;
(5)染色完毕后,用无水乙醇30ml、乙酸10ml、甘油10ml配制成50ml漂白液;
(6)后将叶片放入漂白液中并在沸水中煮沸15分钟,后将叶片用无菌水冲洗干净;
(7)在体式显微镜下进行拍照观察。
所得结果为图6,bpmv-0表示对照组,bpmv-gmsaul1表示沉默植株,其中a图为dab染色后的整体叶片,b图为对照组局部叶片,c图为实验组的局部叶片。根据图6可以得知:与对照组相比,沉默植株中h2o2的积累增加。
3、sa(水杨酸)的提取
(1)将发病叶片取下在液氮中进行研磨,然后取0.1g样品加入装有1ml80%甲醇的2ml离心管中,放入4℃混合仪中,1小时后在14000rpm,4℃条件下离心10分钟;
(2)将上清转移到新的2ml离心管中,剩余的沉淀用0.5ml100%的甲醇重提,后在4℃混合仪中混合1小时,离心后与第一次的上清进行混合,并且用氮吹仪吹干,大约需要1.5小时;
(3)用0.1m乙酸钠缓冲液(ph=5.5)重悬至500μl,3小时后,14000rpm,15分钟离心,后平均分装到两个2ml的离心管中,一个用于分析自由sa,一个用于分析总sa;
(4)向用于分析总sa的离心管中加入10μl的β-葡萄糖苷酶(溶于缓冲液中),将上述离心管置于37℃水浴1.5小时,酶解后样品在沸水中煮沸5分钟,然后15000rpm,4℃离心10分钟,取上清置于小瓶中,进行hplc分析;
(5)后将测得的结果整理成柱状图进行对比。
所得结果为图7,bpmv-0表示对照组,bpmv-gmsaul1表示沉默植株,其中a图为对照组与实验组中自由sa含量比较,b为对照组和实验组中总sa含量比较。根据图7可以得知:与对照组相比,沉默植株中自由sa和总sa含量显著升高。
实施例8、沉默植株抗细菌、抗病毒研究
1、实验所需的细菌的菌种psg(pseudomonassyringaepv.glycinea大豆斑点病菌)。
接种细菌菌液的制备:
(1)从4℃冰箱中拿出大豆斑点病菌的玻璃培养皿,挑选出单菌落加入100ml的nb液体培养基中,将菌落放入28℃恒温摇床培养约36小时后,待od600=0.8-1.2时取出。
(2)取适量的冰于冰盒内,将菌液分装到4个50ml的离心管中(每管大约有25ml的菌液),冰上放置10分钟,使菌落暂时停止生长。
(3)提前将离心机进行4℃预冷,上述步骤完成后将离心管配平,擦干净管壁上的水后放入离心机中,4℃,调节转速至5500rpm,离心10分钟后倒掉上清液。
(4)向带有菌体的离心管中加入25ml经过灭菌处理的ddh2o,漩涡震荡5分钟,保证菌液充分悬浮。
(5)重复步骤3的操作。
(6)每个离心管中加入25ml的ddh2o,上下翻转轻轻悬浮菌液,即成接种所用的细菌菌液。细菌的接种:
(1)将大豆幼苗接种病毒(实施例4中所得),待病毒症状出现明显后将大豆植株从大豆培养箱取出。
(2)对接种psg细菌前的大豆进行拍照,作为细菌接种开始时植株生长状况的对照。
(3)戴好口罩和防护眼镜,将细菌悬浮液装入到小喷壶中,在植株叶片的表面以及背面均匀的喷洒。
(4)喷洒完成后在大豆植株上罩上透明的塑料袋,避免细菌菌液蒸发过快。
(5)每隔3小时在塑料袋内喷洒适量的水分,保证细菌能充分侵染植株。
(6)时刻观察接种叶片以及整体植株的发病情况,出现细菌病斑时并记录下来。
细菌菌落计数:
(1)将na固体培养基高温熔化后,在超净工作台中倒入玻璃培养皿中(大约每个培养皿中倒入25ml的培养基),打开紫外和风挡将平板吹干。取直径为5cm的研钵,倒入适量的酒精后点燃进行灭菌,待完全冷却后使用。
(2)将感染细菌的叶片用直径为1cm打孔器(打孔器需进行消毒)取下,放入75%酒精中表面消毒30秒。
(3)用镊子将叶片取出放入3份ddh2o中分别清洗30秒,保证酒精充分洗净。
(4)将处理完成的叶片放入冷却好的研钵中,加入200μl的经过灭菌处理的ddh2o用研钵棒研磨至叶片成汁液,加入800μl的ddh2o将母液定容至1ml后倒入1.5ml灭菌处理后的离心管中。
(5)对得到的母液进行梯度稀释,分别稀释101倍,102倍,103倍,104倍以备后续涂板使用。
(6)用移液枪吸取100μl稀释101倍,102倍,103倍,使用玻璃棒均匀的涂布在平板上(每个梯度至少需要3个培养皿),封好封口膜,倒置放在28℃培养箱中,培养48小时。
(7)待菌落生长成为大小均匀规律的菌落后进行计数。
(8)将得到的菌落数目进行处理,绘制出柱状图。
所得结果如图8所示,其中图a为接种psg细菌6天后的植株表型为图a,图b为对照组与实验组的局部叶片,根据c图,可以得知glyma.04g016500.1沉默植株对psg的抗性显著增强。
2、将smv(大豆花叶病毒)通过基因枪接种在大豆叶片上,通过gus染色检测大豆叶片抗病情况。gus染色具体方法如下:
(1)x-gluc,用n-n-二甲基酰胺配成20mm的贮存液,分装成每管100μl,保存于-20℃;(2)底物溶液(染色液):1mmx-gluc加入100mm磷酸钠缓冲液(ph=7.0),缓冲液中含10mmedta-na2,1-5mmk3[fe(cn)6](铁氰化钾),1-5mmk4[fe(cn)6](亚铁氰化钾),0.001%(v/v)tritonx-100;
(3)将准备好的叶片放入小药瓶,加入染色液浸没试材,封好盖子;
(4)37℃培养箱中温育4小时;
(5)将浸染过的试材转入(冰醋酸:95%乙醇=1:3)混合物中并置于100℃热水中脱色2-3次(除去叶绿素),至阴性对照材料呈白色为止,观察实验组结果。
所得结果如图9所示,其中a图为gus染色后的整体叶片,b为体式显微镜下对照组gus染色后的局部叶片,c为体式显微镜下实验组gus染色后的局部叶片,根据图d得知:glyma.04g016500.1沉默大豆抵抗smv病毒的能力显著增强。
实施例9、沉默植株gmmpk3/6激酶对flg22的应答分析
(1)大豆蛋白的提取:
①用剪刀取下大豆发病叶片200mg,放置于研钵中(研钵提前用酒精烧灼),加入适量液氮研磨成粉。将取100μl粉末转入1.5ml的离心管(灭菌处理)中;
②加入200μl体积的proteinextractionbuffer,漩涡震荡使充分混匀;
③提前将离心机制冷至4℃,将离心管配平,放入离心机调节转速至14000rpm,离心45分钟;
④取上清转移到新的1.5ml的离心管中;
⑤取15ml的离心管,加入300μl考马斯亮蓝,285μl0.9%生理盐水,混合均匀后加入96孔板中;
⑥在96孔板中对应的孔中均加入1μl蛋白样品,后在酶标仪上测定蛋白浓度;
⑦根据测得蛋白的浓度算出需要加入蛋白的量,提取buffer以及sds,总的体系是60μl;
⑧将上述液体充分混合后,放入沸水中煮10min,进行变性处理。用于后续的sds-page电泳。
(2)sds-page电泳:
①在水平的桌面上,安装制胶器,按照下表中的比例分别制作分离胶和浓缩胶,立即加双蒸水于凝胶面,室温下放置40分钟,后将水倒掉并用滤纸条吸干表面剩余的水分,加入浓缩胶后并插入齿梳,让凝胶在室温下聚合1小时后拔下梳子;
②将12μg左右蛋白进行上样,在上样蛋白右边加一个拟南芥的对照样品,并在另外一个上样孔注入5μl蛋白marker;
③插上电源,进行电泳。设置浓缩胶电压为140v,10~15分钟后变换电压170v跑分离胶,当溴酚蓝跑出胶片后再进行20分钟左右电泳最后关闭电源;
(3)转膜:
①取出凝胶,根据蛋白marker来截取所需的凝胶部分;准备转印膜,剪下一的pvdf膜。准备4张滤纸(2张厚滤纸,2张薄滤纸),剪下比凝胶稍大的滤纸,并用转膜缓冲液湿润备用。在半干转转移盒的底面,依次将以下物品组装至转印夹层中:厚滤纸、薄滤纸、pvdf膜、凝胶、薄滤纸、厚滤纸,用玻璃棒在凝胶表面轻轻转动,将凝胶与滤纸间的气泡彻底赶出。
②放入电转槽内,恒压12v,30分钟;
③电转移结束后将pvdf膜取出,可以用剪刀剪掉一个小孔来做上标记,分出正负面。
(4)封闭及杂交:
①将pvdf膜放入封闭盒内,直接用tbst封闭液室温封闭2小时;
②将一抗用tbst按照1:3000的比例进行稀释,将pvdf膜与一抗进行杂交(4℃,过夜),漂洗之前先把膜用滤纸稍微干一下,然后用lxtbst100ml漂洗液漂洗3次,每次10分钟;③将二抗用tbst按照1:7500的比例进行稀释,将pvdf膜与二抗进行杂交(25℃,2h),漂洗之前先把膜用滤纸稍微干一下,然后用l×tbst100ml漂洗液漂洗3次;每次10分钟;(5)显影
①各取ecla液及b液1ml,混合,将pvdf膜用滤纸吸干后放入其中,反应2min左右,然后将pvdf膜正面朝上放置在化学发光成像仪里进行显影。
所得结果如图10所示;根据该结果可以得知:沉默glyma.04g016500.1增强了gmmpk3激酶对flg22的激活程度,该激活程度的增加,说明沉默植株表现的防御反应是依赖于gmmpk3。
实施例10、gmsaul1亚细胞定位
1.gmsaul1亚细胞定位载体构建(同实施例2)
2.农杆菌gv3101感受态的制备
以下为50ml体系的制备过程:
(1)从-80℃的冰箱里取出保存好的gv3101菌液;
(2)活化:用接种环蘸取部分菌液在yep固体平板上(rif抗性)划线;
(3)小摇:待两天左右,即可从lb固体平板上看见菌落,并挑一个克隆于yep液体培养基里,在28℃、200rpm的摇床上摇24h左右;
(4)扩大培养:按1:100的比例向含有50mlyep(rif抗性)的锥形瓶里加入0.5ml小摇后的菌液,28℃、200rpm摇至od600为05-0.6;
(5)在超净工作台上将菌液分装到50ml预冷的ep管中,冰浴30min;
(6)4℃、6000rpm离心10min,去上清,倒置竖干,没管加入5ml预冷的150mmnacl悬浮菌体;
(7)4℃、6000rpm离心10min,去上清,倒置竖干,每管加入2ml、2mm预冷的cacl2(含15%甘油)悬浮菌体;
(8)用移液枪轻轻吹打混匀,冰浴30min;
(9)每管100μl分装至1.5ml的离心管,后立即置于液氮中,后在-80℃保存。
3.转化及鉴定
(1)将1μg质粒与100μl农杆菌感受态混合,冰上放置10min;
(2)用液氮冰激5min;
(3)37℃水浴热激5min;
(4)后向离心管中加入800μl的lb培养基,28℃、200rpm摇床中摇3h;
(5)后4000rpm离心1min,去上清,取100μl重新悬浮;
(6)后将100μl的菌液涂布在lb(kana+rif抗性)平板上进行培养,28℃培养2天;
(7)对生长的菌落进行菌落验证(同实施例2菌落验证);
4.农杆菌的培养及本氏烟的注射
(1)将鉴定成功的菌在15ml离心管中加入5mlyep液体培养基,置于28℃、200rpm摇床中,培养12h;
(2)将上述菌液接种到25mlyep(250μlmes+25μlkan+12μlrif+5μlas)液体培养基,置于28℃、200rpm摇床中,培养12h;
(3)将菌液倒入50ml离心管中,5500rpm离心5min,去上清;
(4)加入预先配好的mma液进行重悬,后5500rpm离心5min,去上清;
(5)用mma液将od值调到0.5;
(6)选取幼嫩的本氏烟叶片,从叶片背面进行注射,注射后暗处理12h;
(7)在烟草室培养3天,后在激光共聚焦显微镜下进行拍照。
所得结果如图11所示,根据图11可以得知:gmsaul1定位于细胞质及细胞核中。
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
序列表
<110>浙江师范大学
<120>大豆glyma.04g016500.1抗病基因的用途
<160>2
<170>siposequencelisting1.0
<210>1
<211>2442
<212>dna
<213>大豆(glycinemax)
<400>1
atgatggctgcgagctgggatggaagtagtgaccctggcagtcagtcagatgatagcttt60
cttgagaggttgcacattgagcctctttatgatgcctttgtatgtccgctgacgaagcaa120
gttatgcgtgatcctgttactttagaaaatgggcagacttttgaacgtgaagcaattgaa180
aaatggttcaaggaatgtagagagagcgggcggagactgctatgccctttgactcttcaa240
gaactaagaagtacagagctgaatccaagtatggctttgcgtaacaccattgaagaatgg300
actgccaggaatgaagctgcacagctggatatggctcgccggtcattgaatatggggagt360
ccagaaaatgagactcttcaggccttaaagtatgtccagcacatctgccgaagaagtcga420
tcaaacaaatacactgtccgcaatgcagggcttatcccaatgattgttgacatgctgaag480
agtagcagccgtaaggttcgttgtagagctctggaaacccttagagttgtggtagaggaa540
gatgatgagaataaggaattgttggctgaaggggatactgttcgcactgtagtaaaattc600
ctttcacatgagctttctaaagaaagagaggaggctgtctccttgctttacgagctctca660
aaatctgcaaccctttgtgagaagattggttctatcaatggtgccattcttatactagta720
gggatgacaagcagcaaatcagaagatcttctcactgttgagaaggcagataaaacattg780
gagaatctggagaagtgtgagagtaatgtgcggcagatggccgaaaatggtagattgcag840
cctcttctgacccagcttcttgaaggtccaccagaaaccaaactctccatggctacatac900
cttggtgagctggttttaaacaatgatgttaaagtccttgttgctggaactgtgggttca960
tctctgatcaatataatgaaaagtggtaatatgcaatcaagagaagcagcactgagggca1020
ctaaatcagatatcatcatgtgacccaagtgcaaaaattttaatagaggctggaatactt1080
tctcctcttgtcaatgacctttttgcagtcggtcctaatcagcttccaacacgattaaaa1140
gagatctccgctacaattcttgctagtgttgtaaactcaggagaagacttttattccatt1200
ccatttgggcctgaccaccaaactctggtctcagaggatatagttcgtaatctactccat1260
cttataagtaacactggtccagcaatagagtgcaaacttctccaagttcttgttggactt1320
actatttctccaactacagttctgagtgttgtggctgctatcaaaagctctggtgccacc1380
atcagtctagttcagttcattgaggcaccacagaaagatctgcgtgtagcttccataaaa1440
cttcttcagaatttgtctcctcatatgggtcaggaactagctgatgcactacgcggctca1500
gttggacagcttggtagtctaattaaagtcatatcagaaaatacaggaatcactgaagag1560
caggcagcggccgttggccttttagcggatcttcctgaacgggacttgggcctcacaaga1620
cagctactagatgaaggtgcctttgtgatggtcatatccagggtgattgccatcaggcag1680
ggagagatccgaggcactcgcttcatgacaccatttcttgaggggcttgtaaagattgtt1740
gcaagggttacatatgtcttggcagaagagcctgatgccattgctctctgccgtgatcac1800
aatcttgccgctctctttattgatctgcttcagtccaatggacttgataacgtacagatg1860
gtttctgctacagctctggagaatttatcccaagaatcgaaaaacttaaccagactacct1920
gaaatgccatcgctgggtttttgtgcttcagtgttttcatgcttcagcaagcagccagtc1980
ataactggattgtgtaggctccaccgagggatatgttctttaaaagaaacattctgtctc2040
tatgaagggcaggcagtgcttaagttagtaggtctactggaccacacaaatgtgattgtg2100
gtcgaggcagcacttgcagccttagctactttaatagatgatggagtagatattgagcaa2160
ggagtggcaattttgtgtgaagcagagggagtgaagcctatactggatgtgctacttgag2220
aaaagaacagaaacattgaggaggagggcagtttgggcagtggagagactattgagaaca2280
gatgatatagcctatgaagtttctggggaccaaaatgtgagtactgcacttgtggatgct2340
ttccagcatggtgactatcgaactcggcagacagctgagcgtgccctcaagcatgttgat2400
aagattccaaacttctcaggaatctttccaaacatgggatga2442
<210>2
<211>813
<212>prt
<213>大豆(glycinemax)
<400>2
metmetalaalasertrpaspglyserseraspproglyserglnser
151015
aspaspserpheleugluargleuhisilegluproleutyraspala
202530
phevalcysproleuthrlysglnvalmetargaspprovalthrleu
354045
gluasnglyglnthrphegluargglualaileglulystrpphelys
505560
glucysarggluserglyargargleuleucysproleuthrleugln
65707580
gluleuargserthrgluleuasnprosermetalaleuargasnthr
859095
ilegluglutrpthralaargasnglualaalaglnleuaspmetala
100105110
argargserleuasnmetglyserprogluasngluthrleuglnala
115120125
leulystyrvalglnhisilecysargargserargserasnlystyr
130135140
thrvalargasnalaglyleuileprometilevalaspmetleulys
145150155160
serserserarglysvalargcysargalaleugluthrleuargval
165170175
valvalglugluaspaspgluasnlysgluleuleualagluglyasp
180185190
thrvalargthrvalvallyspheleuserhisgluleuserlysglu
195200205
arggluglualavalserleuleutyrgluleuserlysseralathr
210215220
leucysglulysileglyserileasnglyalaileleuileleuval
225230235240
glymetthrserserlyssergluaspleuleuthrvalglulysala
245250255
asplysthrleugluasnleuglulyscysgluserasnvalarggln
260265270
metalagluasnglyargleuglnproleuleuthrglnleuleuglu
275280285
glyproprogluthrlysleusermetalathrtyrleuglygluleu
290295300
valleuasnasnaspvallysvalleuvalalaglythrvalglyser
305310315320
serleuileasnilemetlysserglyasnmetglnserarggluala
325330335
alaleuargalaleuasnglnilesersercysaspproseralalys
340345350
ileleuileglualaglyileleuserproleuvalasnaspleuphe
355360365
alavalglyproasnglnleuprothrargleulysgluileserala
370375380
thrileleualaservalvalasnserglygluaspphetyrserile
385390395400
propheglyproasphisglnthrleuvalsergluaspilevalarg
405410415
asnleuleuhisleuileserasnthrglyproalaileglucyslys
420425430
leuleuglnvalleuvalglyleuthrileserprothrthrvalleu
435440445
servalvalalaalailelysserserglyalathrileserleuval
450455460
glnpheileglualaproglnlysaspleuargvalalaserilelys
465470475480
leuleuglnasnleuserprohismetglyglngluleualaaspala
485490495
leuargglyservalglyglnleuglyserleuilelysvalileser
500505510
gluasnthrglyilethrglugluglnalaalaalavalglyleuleu
515520525
alaaspleuprogluargaspleuglyleuthrargglnleuleuasp
530535540
gluglyalaphevalmetvalileserargvalilealailearggln
545550555560
glygluileargglythrargphemetthrpropheleugluglyleu
565570575
vallysilevalalaargvalthrtyrvalleualaglugluproasp
580585590
alailealaleucysargasphisasnleualaalaleupheileasp
595600605
leuleuglnserasnglyleuaspasnvalglnmetvalseralathr
610615620
alaleugluasnleuserglngluserlysasnleuthrargleupro
625630635640
glumetproserleuglyphecysalaservalphesercyspheser
645650655
lysglnprovalilethrglyleucysargleuhisargglyilecys
660665670
serleulysgluthrphecysleutyrgluglyglnalavalleulys
675680685
leuvalglyleuleuasphisthrasnvalilevalvalglualaala
690695700
leualaalaleualathrleuileaspaspglyvalaspileglugln
705710715720
glyvalalaileleucysglualagluglyvallysproileleuasp
725730735
valleuleuglulysargthrgluthrleuargargargalavaltrp
740745750
alavalgluargleuleuargthraspaspilealatyrgluvalser
755760765
glyaspglnasnvalserthralaleuvalaspalapheglnhisgly
770775780
asptyrargthrargglnthralagluargalaleulyshisvalasp
785790795800
lysileproasnpheserglyilepheproasnmetgly
805810
- 还没有人留言评论。精彩留言会获得点赞!