铂错合物、含氮双牙配位基及可发出可见光或近红外光的装置
1.本发明是有涉及一种金属错合物及其应用,尤其涉及一种铂错合物、含氮双牙配位基及可发出可见光或近红外光的装置。
背景技术:
2.有机发光二极管组件拥有高亮度、屏幕反应速度快、轻薄短小、全彩、无视角差、不需液晶显示器式背光板以及节省能源及耗电量等优点,目前被广泛应用于制作大面积、高亮度、全彩化的平面显示器。
3.为了发展发光范围涵盖可见光区至近红外光区的各项新型发光组件,开发高稳定及高发光效率的各色光发光材料为现今研究oled的主要目标。目前已知四配位的铂错合物具有适合的放光性质,但其合成过程往往需要较耗时的纯化步骤,造成量产上的困难。
技术实现要素:
4.本发明提供一种铂错合物、含氮双牙配位基及其应用。本发明制备出的铂错合物结构稳定、发光效率优异(特别是在红光至近红外光区)且合成步骤简易。
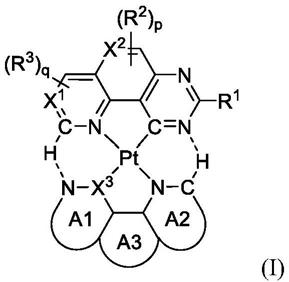
5.本发明提供一种铂错合物,具有由以下通式(i)所表示的结构:
[0006][0007]
其中a1至a3各自独立地为不饱和的五元环或不饱和的六元环,a3可视情况形成于a1与a2之间;x1、x2以及x3各自独立地为碳或氮;r1为氢、经取代或未经取代的c
1-c6烷基、-cf2h、-cfh2、经取代或未经取代的c
6-c
12
芳基或c
mf2m+1
,m为1~5的整数;r2以及r3各自独立地为氢、经取代或未经取代的c
1-c
12
烷基、经取代或未经取代的c
1-c6烷氧基、经取代或未经取代的c
6-c
12
芳基或-c
nf2n+1
,n为0~3的整数;p、q各自独立地为1~2的整数;当p等于2,两个r2可彼此连接形成c
3-c8芳香环或含氮杂芳香环;以及当q等于2,两个r3可彼此连接形成c
3-c8芳香环或含氮杂芳香环。
[0008]
本发明提供一种可发出可见光或近红外光的装置,包括上述的铂错合物。
[0009]
本发明提供一种含氮双牙配位基,具有由以下通式(ii)所表示的结构:
[0010][0011]
其中*为键结点;x1以及x2各自独立地为碳或氮;r1为氢、经取代或未经取代的c
1-c6烷基、-cf2h、-cfh2、经取代或未经取代的c
6-c
12
芳基或c
mf2m+1
,m为1~5的整数;r2以及r3各自独立地为氢、经取代或未经取代的c
1-c
12
烷基、经取代或未经取代的c
1-c6烷氧基、经取代或未经取代的c
6-c
12
芳基或-c
nf2n+1
,n为0~3的整数;p、q各自独立地为1~2的整数;当p等于2,两个r2可彼此连接形成c
3-c8芳香环或含氮杂芳香环;以及当q等于2,两个r3可彼此连接形成c
3-c8芳香环或含氮杂芳香环。
[0012]
基于上述,本发明的铂错合物具有两个含氮芳(ic基螯合配体,且在两个含氮芳基螯合配体之间具有一个新增的六元环状结构,故可以更加稳定配体与平面结构刚性。本发明的铂错合物具有更佳的平面结构构型与更有效的双键轨域共轭,后者是由中心的六元环状结构提供。本发明中,这两项结构特性使得制备出的铂错合物在近红外光区具有更佳的光物理性质,例如:红移发射光谱波长暨增加发光量子效率。
[0013]
为让本发明的上述特征和优点能更明显易懂,下文特举实施例,并配合所附附图作详细说明如下。
附图说明
[0014]
图1为本发明的配位基前驱物l1的x-光晶体衍射分子结构图;
[0015]
图2为本发明化合物(id-6)的x-光晶体衍射分子结构图;
[0016]
图3为本发明化合物(ia-1)、(ia-2)、(ia-3)以及(ia-4)的蒸镀薄膜的放射光谱图;
[0017]
图4为本发明化合物(ia-1)、(ia-2)、(ia-3)以及(ia-4)的热重分析图;
[0018]
图5为本发明化合物(ib-1)以及(ib-2)的蒸镀薄膜的放射光谱图;
[0019]
图6为本发明化合物(ib-1)以及(ib-2)的热重分析图;
[0020]
图7为本发明化合物(id-1)、(id-2)、(id-3)、(id-4)、(id-5)、(id-6)以及(id-7)的蒸镀薄膜的放射光谱图;
[0021]
图8为本发明化合物(id-1)、(id-2)、(id-3)、(id-4)、(id-5)、(id-6)以及(id-7)的热重分析图。
具体实施方式
[0022]
以下将通过实施方式对本发明作进一步说明,但所述实施方式仅为例示说明之用,而非用以限制本发明的范围。
[0023]
[铂错合物的结构]
[0024]
本发明提供一种铂错合物,具有由以下通式(i)所表示的结构:
[0025][0026]
其中a1至a3各自独立地为不饱和的五元环或不饱和的六元环,a3可视情况形成于a1与a2之间;x1、x2以及x3各自独立地为碳或氮;r1为氢、经取代或未经取代的c
1-c6烷基、-cf2h、-cfh2、经取代或未经取代的c
6-c
12
芳基或c
mf2m+1
,m为1~5的整数;r2以及r3各自独立地为氢、经取代或未经取代的c
1-c
12
烷基、经取代或未经取代的c
1-c6烷氧基、经取代或未经取代的c
6-c
12
芳基或-c
nf2n+1
,n为0~3的整数;p、q各自独立地为1~2的整数;当p等于2,两个r2可彼此连接形成c
3-c8芳香环或含氮杂芳香环;以及当q等于2,两个r3可彼此连接形成c
3-c8芳香环或含氮杂芳香环。
[0027]
上述芳香环或含氮杂芳香环可包括芳香烃环(aromatic hydrocarbon)或芳香杂环(aromatic heterocycle)。上述芳香环或含氮杂芳香环的特定实例包括苯环(benzene)、吡啶环(pyridine)、吡嗪环(pyrazine)、嘧啶环(pyrimidine)、哒嗪环(pyridazine)、三嗪环(triazine)、吡咯环(pyrrole)、呋喃环(furan)、噻吩环(thiophene)、硒吩环(selenophene)、碲吩环(tellurophene)、咪唑环(imidazole)、噻唑环(thiazole)、硒唑环(selenazole)、碲唑环(tellurazole)、噻二唑环(thiadiazole)、恶二唑环(oxadiazole)以及吡唑环(pyrazole)。
[0028]
在一实施例中,当a1为六元环,a2为六元环,a3为六元环时,本发明的铂错合物具有由以下通式(ia)所表示的结构:
[0029][0030]
其中x4为碳或氮;r4为经取代或未经取代的c
1-c6烷基、-cf2h、-cfh2、经取代或未经取代的c
6-c
12
芳基或c
mf2m+1
,m为1~5的整数;r5以及r6各自独立地为氢、经取代或未经取代的c
1-c
12
烷基、经取代或未经取代的c
1-c6烷氧基、经取代或未经取代的c
6-c
12
芳基或-c
nf2n+1
,n为0~3的整数;r、s各自独立地为1~2的整数;当r等于2,两个r5可彼此连接形成c
3-c8芳香环或含氮杂芳香环;以及当s等于2,两个r6可彼此连接形成c
3-c8芳香环或含氮杂芳香环。
[0031]
在一实施例中,本发明的铂错合物具有由式(ia-1)至式(ia-22)中任一者所表示
的结构:
[0032]
[0033]
[0034][0035]
在一实施例中,当a1为五元环,a2为六元环,a3为六元环时,本发明的铂错合物具有由以下通式(ib)所表示的结构:
[0036][0037]
其中x5为碳或氮;r4为经取代或未经取代的c
1-c6烷基、-cf2h、-cfh2、经取代或未经取代的c
6-c
12
芳基或c
mf2m+1
,m为1~5的整数;r5以及r6各自独立地为氢、经取代或未经取代的c
1-c
12
烷基、经取代或未经取代的c
1-c6烷氧基、经取代或未经取代的c
6-c
12
芳基或-c
nf2n+1
,n为0~3的整数;r、s各自独立地为1~2的整数;当r等于2,两个r5可彼此连接形成c
3-c8芳香环或含氮杂芳香环;以及当s等于2,两个r6可彼此连接形成c
3-c8芳香环或含氮杂芳香环。
[0038]
在一实施例中,本发明的铂错合物具有由式(ib-1)至式(ib-28)中任一者所表示的结构:
[0039]
[0040]
[0041][0042]
在一实施例中,当a1为六元环,a2为六元环时,本发明的铂错合物具有由以下通式(ic)所表示的结构:
[0043]
[0044]
其中r4为经取代或未经取代的c
1-c6烷基、-cf2h、-cfh2、经取代或未经取代的c
6-c
12
芳基或c
mf2m+1
,m为1~5的整数;r6为氢、经取代或未经取代的c
1-c
12
烷基、经取代或未经取代的c
1-c6烷氧基、经取代或未经取代的c
6-c
12
芳基或-c
nf2n+1
,n为0~3的整数;s为1~3的整数;以及当s大于或等于2,两个或两个以上的r6可彼此连接形成c
3-c8芳香环或含氮杂芳香环。
[0045]
在一实施例中,本发明的铂错合物具有由式(ic-1)至式(ic-16)中任一者所表示的结构:
[0046]
[0047][0048]
在一实施例中,当a1为五元环,a2为六元环时,本发明的铂错合物具有由以下通式(id)所表示的结构:
[0049][0050]
其中x5为碳或氮;r4为经取代或未经取代的c
1-c6烷基、-cf2h、-cfh2、经取代或未经取代的c
6-c
12
芳基或c
mf2m+1
,m为1~5的整数;r6为氢、经取代或未经取代的c
1-c
12
烷基、经取代或未经取代的c
1-c6烷氧基、经取代或未经取代的c
6-c
12
芳基或-c
nf2n+1
,n为0~3的整数;s为1~3的整数;以及当s大于或等于2,两个或两个以上的r6可彼此连接形成c
3-c8芳香环或含氮杂芳香环。
[0051]
在一实施例中,本发明的铂错合物具有由式(id-1)至式(id-36)中任一者所表示的结构:
[0052]
[0053]
[0054]
[0055][0056]
本发明中,通式(ia)~(id)系列的所示结构的两个双牙配位基之间会有c
─h…n氢键生成。因此,这类错合物分子会有较好的刚性与平面性、堆栈方便,易形成较佳的1d线性堆栈结构,经激发后会有高效率近红外光的放射。
[0057]
本发明提供一种可发出可见光或近红外光的装置,其包括如上所述的铂错合物。
[0058]
在一实施例中,本发明提供一种有机发光二极管,其包括二电极及配置于所述二电极之间的一发光层。在一实施例中,所述发光层仅含有上述铂错合物,无须掺入任何主体材料(host material)。在另一实施例中,作为特殊用途,上述铂错合物亦可作为掺杂剂使用。二电极各自的材料可选用本领域中通常使用者,各电极与发光层之间亦可依本领域所熟知的技术来加设其他功能层,例如电子传输层、空穴注入、传输或阻挡层等等。此有机发光二极管可制作于平面基板上,例如导电的玻璃或塑料基板。
[0059]
在一实施例中,本发明的铂错合物的发光波长介于约550纳米至1,000纳米,例如600纳米至955纳米,应用层面相当广。更具体地说,当本发明的铂错合物的发光波长介于可见光范围内时,可应用于有机发光二极管(oled)领域。而当本发明的铂错合物的发光波长大于700纳米时,落入近红外光范围内,可应用于军事或医疗领域,提供一项肉眼看不见的隐形光源或是能够有效穿透人体(或是动物组织)的光源。本发明的铂错合物的发光波长可大于800纳米,与一般的铂错合物相比,具有更长的放光波长,对人体的穿透能力更佳。
[0060]
[含氮双牙配位基的结构]
[0061]
本发明提供一种含氮双牙配位基,具有由以下通式(ii)所表示的结构:
[0062][0063]
其中*为键结点;x1以及x2各自独立地为碳或氮;r1为氢、经取代或未经取代的c
1-c6烷基、-cf2h、-cfh2、经取代或未经取代的c
6-c
12
芳基或c
mf2m+1
,m为1~5的整数;r2以及r3各自独立地为氢、经取代或未经取代的c
1-c
12
烷基、经取代或未经取代的c
1-c6烷氧基、经取代或未经取代的c
6-c
12
芳基或-c
nf2n+1
,n为0~3的整数;p、q各自独立地为1~2的整数;当p等于2,两个r2可彼此连接形成c
3-c8芳香环或含氮杂芳香环;以及当q等于2,两个r3可彼此连接形成c
3-c8芳香环或含氮杂芳香环。
[0064]
[含氮双牙配位基前驱物的合成]
[0065]
本发明的铂错合物所使用的配位基上具有五元环或六元环,且五元环或六元环上具有氮原子或其他高电负度的原子(如氟、氧或氮)。在一实施例中,本发明的铂错合物所使用的配位基前驱物可选自由以下配位基前驱物l1至配位基前驱物l13所组成的族群。
[0066][0067]
在一实施例中,本发明的铂错合物所使用的配位基前驱物l1(pnazh)的合成步骤流程s1如下:
[0068][0069]
流程s1实验条件:
[0070]
(i)甘油,3-硝基苯磺酸钠,feso4·
7h2o,msoh,160℃,3小时
[0071]
(ii)nbs,bpo,苯,回流,隔夜
[0072]
(iii)nan3,dmf,80℃,隔夜
[0073]
(iv)pph3,h2o,thf,室温,2小时
[0074]
(v)三氟乙脒,cui,k2co3,邻二氮菲,dmso,100℃,24小时
[0075]
7-溴-8-甲基喹啉(7-bromo-8-methylquinoline)(1)的制备方法如下。取一双颈瓶,加入3-溴-2-甲基苯胺(3-bromo-2-methylaniline)(5g,26.9mmol)、feso4·
7h2o(220mg,0.8mmol)和3-硝基苯磺酸钠(sodium 3-nitrobenzenesulfonate)(3.81g,16.9mmol),并以甲磺酸(msoh,25ml)溶解,加热至80℃。之后分次且缓慢地加入甘油(glycerol)(7.42g,80.6mmol),并升温至回流下剧烈搅拌3小时。以tlc片确认反应结束后,将反应物倒入碎冰中,加入适量氢氧化钠中和至ph=9,溶于乙酸乙酯、并用水清洗数次,收集有机层并以无水硫酸钠除水,经减压浓缩移除溶剂,再以管柱层析分离(sio2,ea/hexane=1:3),可得黄色固体5.39g,产率90%。
[0076]
配位基前驱物1的光谱数据:1h nmr(400mhz,cdcl3,298k):δ8.40(dd,j=4.2,1.4hz,1h),8.11(dd,j=8.2,1.6hz,1h),7.68(d,j=8.8hz,1h),7.53(d,j=8.8hz,1h),7.41(dd,j=8.2,4.2hz,1h),2.93(s,3h).
[0077]
7-溴-8-(溴甲基)喹啉(7-bromo-8-(bromomethyl)quinoline)(2)的制备方法如下。取一双颈瓶,加入配位基前驱物1(4g,18.0mmol)、n-溴代丁二酰亚胺(n-bromosuccinimide,nbs)(3.53g,19.8mmol)和75%过氧化苯甲酰(benzoyl peroxide in water,bpo)(290mg,0.9mmol),并以苯(60ml)溶解,加热回流12小时。以tlc片确认反应结束后,将反应物溶于乙酸乙酯、并用水清洗两次,收集有机层并以无水硫酸钠除水,经减压浓缩移除溶剂,再以管柱层析分离(sio2,ea/hexane=1:5),可得米黄色固体4.77g,产率88%。
[0078]
配位基前驱物2的光谱数据:1h nmr(400mhz,cdcl3,298k):δ9.02(dd,j=4.2,1.8hz,1h),8.15(dd,j=8.3,1.8hz,1h),7.72(d,j=8.8hz,1h),7.66(d,j=8.8hz,1h),7.47(dd,j=8.3,4.2hz,1h),5.42(s,2h).
[0079]
8-(叠氮甲基)-7-溴喹啉(8-(azidomethyl)-7-bromoquinoline)(3)的制备方法如下。取一双颈瓶,加入配位基前驱物2(4.3g,14.3mmol)和叠氮化钠(sodium azide,nan3)(2.79g,42.9mmol),并以二甲基甲酰胺(48ml)溶解,于90℃下反应12小时。以tlc片确认反应结束后,将反应物溶于乙酸乙酯、并用水清洗两次,收集有机层并以无水硫酸钠除水,经减压浓缩移除溶剂,再以管柱层析分离(sio2,ea/hexane=1:5),可得米黄色固体3.38g,产
率90%。
[0080]
配位基前驱物3的光谱数据:1h nmr(400mhz,cdcl3,298k):δ8.98(dd,j=4.2,1.7hz,1h),8.15(dd,j=8.2,1.7hz,1h),7.75(d,j=8.8hz,1h),7.69(d,j=8.8hz,1h),7.47(dd,j=8.2,4.2hz,1h),5.25(s,2h).
[0081]
(7-溴喹啉-8-基)甲胺((7-bromoquinolin-8-yl)methanamine)(4)的制备方法如下。取一双颈瓶,加入配位基前驱物3(3.5g,13.3mmol)和三苯基膦(triphenylphosphine,pph3)(7.8g,26.6mmol),并以四氢呋喃(44ml)溶解,之后再加入水(4.4ml)于室温下反应2小时。以tlc片确认反应结束后,将反应物溶于乙酸乙酯、并用水清洗数次,收集有机层并以无水硫酸钠除水,经减压浓缩移除溶剂,再以管柱层析分离(sio2,dcm/meoh=15:1),可得黄色黏稠液体2.93g,产率93%。
[0082]
配位基前驱物4的光谱数据:1h nmr(400mhz,cdcl3,298k):δ8.93(dd,j=4.2,1.8hz,1h),8.11(dd,j=8.2,1.8hz,1h),7.67(d,j=8.8hz,1h),7.57(d,j=8.8hz,1h),7.42(dd,j=8.2,4.2hz,1h),4.61(s,2h).
[0083]
8-(三氟甲基)吡啶并[2,3-f]喹唑啉(8-(trifluoromethyl)pyrido[2,3-f]quinazoline)(pnazh,l1)的制备方法如下。取一封管,加入配位基前驱物4(2.75g,11.6mmol)、三氟乙脒(trifluoroacetamidine)(2.62g,11.1mmol)、邻二氮菲(1,10-phenanthroline)(315mg,1.7mmol)、碳酸钾(3.2g,23.2mmol)和碘化亚铜(copper(i)iodide,cui)(220mg,1.2mmol),并以二甲基亚砜(38ml)溶解,于110℃下反应24小时。之后先将反应物溶于乙酸乙酯、并用饱和氯化铵水溶液清洗两次,经减压浓缩移除溶剂,再加入2,3-二氯-5,6-二氰对苯醌(2,3-dichloro-5,6-dicyano-1,4-benzoquinone,ddq)(2.63g,11.6mmol)并以无水四氢呋喃(38ml)溶解,于室温下反应1小时。以tlc片确认反应结束后,先经减压浓缩移除溶剂,将反应物置于冰浴下,以2n氢氧化钠水溶液中和至碱性,再将反应物溶于乙酸乙酯、并用水清洗两次,收集有机层并以无水硫酸钠除水,经减压浓缩移除溶剂,再以管柱层析分离(sio2,ea/hexane=1:3),可得淡黄色固体1.73g,产率60%。
[0084]
配位基前驱物l1的光谱数据:1h nmr(500mhz,cdcl3,298k):δ10.76(s,1h),9.16(dd,j=4.4,1.8hz,1h),8.35(dd,j=8.0,1.7hz,1h),8.29(d,j=9.1hz,1h),8.13(d,j=9.1hz,1h),7.74(dd,j=8.1,4.4hz,1h).
19
f nmr(470mhz,cdcl3,298k):δ-69.71(s,3f).ms(fd)calcd.for c
12
h6f3n3[m+]:m/z:249.1,found:249.0.
[0085]
图1为本发明的配位基前驱物l1的x-光晶体衍射分析图。由此证明此项多步骤合成方法确实能够有效合成所需的配位基前驱物。
[0086]
在另一实施例中,本发明的铂错合物所使用的配位基前驱物l2(mpnazh)的合成步骤流程s2如下:
[0087][0088]
流程s2实验条件:
[0089]
(i)丁烯酮,h2so4,二恶烷(dioxane),回流,2小时
[0090]
(ii)nbs,bpo,苯,回流,隔夜
[0091]
(iii)nan3,dmf,80℃,隔夜
[0092]
(iv)pph3,h2o,thf,室温,2小时
[0093]
(v)三氟乙脒,cui,k2co3,邻二氮菲,dmso,100℃,24小时
[0094]
7-溴-4,8-二甲基喹啉(7-bromo-4,8-dimethylquinoline)(5)的制备方法如下。取一双颈瓶,加入3-溴-2-甲基苯胺(3-bromo-2-methylaniline)(3g,16.1mmol)并以1,4-二恶烷(40ml)溶解,室温下滴入浓硫酸(h2so4,1.3ml,24.3mmol),于空气下加热回流1小时。之后缓慢地加入丁烯酮(methyl vinyl ketone)(2ml,24.2mmol)与1,4-二恶烷(10ml)的混合溶液,再加热回流1小时。以tlc片确认反应结束后,抽气过滤收集固体并以丙酮多次冲洗,之后将固体溶于乙酸乙酯、并用饱和碳酸氢钠溶液清洗,收集有机层并以无水硫酸钠除水,经减压浓缩移除溶剂,可得白色固状粗产物2.52g,产率66%。
[0095]
配位基前驱物5的光谱数据:1h nmr(400mhz,cdcl3,298k):δ8.79(d,j=4.4hz,1h),7.75-7.68(m,2h),7.25(d,j=4.3hz,1h),2.94(s,3h),2.69(s,3h).
[0096]
7-溴-8-(溴甲基)-4-甲基喹啉(7-bromo-8-(bromomethyl)-4-methylquinoline)(6)的制备方法与配位基前驱物2的制备方法类似,改以配位基前驱物5为起始物,最后经管柱层析分离(sio2,ea/hexane=1:5),可得淡橘色固体,产率94%。
[0097]
配位基前驱物6的光谱数据:1h nmr(400mhz,cdcl3,298k):δ8.86(d,j=4.4hz,1h),7.85(d,j=9.0hz,1h),7.72(d,j=9.0hz,1h),7.30(dd,j=2.2,0.9hz,1h),5.43(s,2h),2.70(s,3h).
[0098]
8-(叠氮基甲基)-7-溴-4-甲基喹啉(8-(azidomethyl)-7-bromo-4-methylquinoline)(7)的制备方法与配位基前驱物3的制备方法类似,改以配位基前驱物6为起始物,最后经管柱层析分离(sio2,ea/hexane=1:5),可得黄色固体,产率90%。
[0099]
配位基前驱物7的光谱数据:1h nmr(400mhz,cdcl3,298k):δ8.82(d,j=4.3hz,1h),7.88(d,j=9.0hz,1h),7.75(d,j=9.0hz,1h),7.29(dd,j=2.2,0.8hz,1h),5.25(s,2h),2.71(s,3h).
[0100]
(7-溴-4-甲基喹啉-8-基)甲胺((7-bromo-4-methylquinolin-8-yl)methanamine)(8)的制备方法与配位基前驱物4的制备方法类似,改以配位基前驱物7为起始物,最后经管柱层析分离(sio2,dcm/meoh=15:1),可得绿色黏稠液体,产率89%。
[0101]
配位基前驱物8的光谱数据:1h nmr(400mhz,cdcl3,298k):δ8.78(d,j=4.4hz,
1h),7.76(d,j=9.0hz,1h),7.68(d,j=9.0hz,1h),7.27-7.25(m,1h),4.61(s,2h),2.69(s,3h).
[0102]
4-甲基-8-(三氟甲基)吡啶并[2,3-f]喹唑啉(4-methyl-8-(trifluoromethyl)pyrido[2,3-f]quinazoline)(mpnazh,l2)的制备方法与配位基前驱物l1的制备方法类似,改以配位基前驱物8为起始物,最后经管柱层析分离(sio2,ea/hexane=1:3),可得黄色固体,产率65%。
[0103]
配位基前驱物l2的光谱数据:1h nmr(500mhz,cdcl3,298k):δ10.77(s,1h),9.00(d,j=4.3hz,1h),8.52(d,j=9.2hz,1h),8.15(d,j=9.2hz,1h),7.56(d,j=5.5hz,1h),2.84(s,3h).
19
f nmr(470mhz,cdcl3,298k):δ-69.71(s,3f).ms(fd)calcd.for c
13
h8f3n3[m
+
]:m/z:263.1,found:263.1.
[0104]
在又一个实施例中,本发明的铂错合物所使用的配位基前驱物l3(ppnazh)的合成步骤流程s3如下:
[0105][0106]
流程s3实验条件:
[0107]
(i)原甲酸三乙酯,120℃,2小时
[0108]
(ii)2-甲基-3-硝基苯胺,etoh,回流,2小时
[0109]
(iii)ph2o,260℃,1小时
[0110]
(iv)pocl3,dipea,甲苯,回流,3小时
[0111]
(v)苯硼酸,pd(pph3)2cl2,k2co3,甲苯,etoh,h2o,回流,隔夜
[0112]
(vi)sncl2,hcl,etoh,回流,3小时
[0113]
(vii)cubr2,
t
buono,mecn,回流,1小时
[0114]
(viii)nbs,bpo,苯,回流,隔夜
[0115]
(ix)nan3,dmf,80℃,隔夜
[0116]
(x)pph3,h2o,thf,室温,2小时
[0117]
(xi)三氟乙脒,cui,k2co3,邻二氮菲,dmso,100℃
[0118]
8-甲基-7-硝基喹啉-4-醇(8-methyl-7-nitroquinolin-4-ol)(9)的制备方法如下。取一双颈瓶,加入米氏酸(meldrum's acid)(5g,34.7mmol)和原甲酸三乙酯(triethyl orthoformate)(15ml,140.8mmol),于120℃下反应1小时。以tlc片确认反应结束后,以真空抽掉未反应的原甲酸三乙酯并回到室温。之后加入2-甲基-3-硝基苯胺(2-methyl-3-nitroaniline)(4.8g,31.5mmol),以乙醇(40ml)溶解,加热回流1小时。以tlc片确认反应结束后,经减压浓缩移除溶剂,抽气过滤收集固体并以己烷多次冲洗,即可得土黄色固状粗产物。之后再取一双颈瓶,加入二苯醚(30ml)并预热至280℃,缓慢地倒入粗产物亚甲基二苯胺(n-methyleneaniline),于空气下反应1小时。以tlc片确认反应结束后,抽气过滤收集固体并以己烷多次冲洗,可得土色固状粗产物5.04g,三步骤的产率合计71%。
[0119]
配位基前驱物9的光谱数据:1h nmr(400mhz,dmso-d6,298k):δ11.51(br,1h),8.13(d,j=8.9hz,1h),8.05-7.94(m,1h),7.69(d,j=8.8hz,1h),6.19(d,j=7.4hz,1h),2.53(s,3h).
[0120]
4-氯-8-甲基-7-硝基喹啉(4-chloro-8-methyl-7-nitroquinoline)(10)的制备方法如下。取一双颈瓶,加入配位基前驱物9(4.04g,19.8mmol)并以无水甲苯(66ml)溶解,之后缓慢地滴入三氯氧磷(phosphoryl chloride,pocl3)(5.53ml,59.3mmol)与n,n-二异丙基乙基胺(diisopropylethylamine,dipea)(5.17ml,29.7mmol),加热回流3小时。以tlc片确认反应结束后,将反应物倒入碎冰中、并加入适量氢氧化钠中和,溶于乙酸乙酯、并用水清洗两次,收集有机层并以无水硫酸钠除水,经减压浓缩移除溶剂,再以管柱层析分离(sio2,ea/hexane=1:3),可得米黄色固体3.53g,产率80%。
[0121]
配位基前驱物10的光谱数据:1h nmr(400mhz,cdcl3,298k):δ8.93(d,j=4.6hz,1h),8.23(d,j=9.2hz,1h),7.99(d,j=9.2hz,1h),7.64(d,j=4.6hz,1h),3.02(s,3h).
[0122]
8-甲基-7-硝基-4-苯基喹啉(8-methyl-7-nitro-4-phenylquinoline)(11)的制备方法如下。取一双颈瓶,加入配位基前驱物10(4g,18.1mmol)、苯硼酸(phenylboronic acid)(2.85g,23.4mmol)、碳酸钾(7.45g,53.9mmol)和pd(pph3)2cl2(630mg,0.9mmol)并将其抽换氮气数次,再以除氧的甲苯(53ml)、水(21ml)及乙醇(11ml)的混合溶液溶解,加热回流12小时。以tlc片确认反应结束后,将反应物溶于乙酸乙酯、并用水清洗两次,收集有机层并以无水硫酸钠除水,经减压浓缩移除溶剂,再以管柱层析分离(sio2,ea/hexane=1:5),可得淡黄色固体4.63g,产率98%。
[0123]
配位基前驱物11的光谱数据:1h nmr(400mhz,cdcl3,298k):δ9.09(d,j=4.3hz,1h),7.89-7.82(m,2h),7.59-7.52(m,3h),7.50-7.45(m,3h),3.07(s,3h).
[0124]
8-甲基-4-苯基喹啉-7-胺(8-methyl-4-phenylquinolin-7-amine)(12)的制备方法如下。取一双颈瓶,加入配位基前驱物11(4.63g,17.5mmol)及氯化亚锡(tin(ii)chloride,sncl2)(13.3g,70.1mmol),并以乙醇(33ml)溶解,之后缓慢地滴入浓盐酸(hcl,25ml),加热回流1小时。以tlc片确认反应结束后,将反应物倒入碎冰中、并加入适量氢氧化钠中和至ph=9,溶于乙酸乙酯、并用水清洗数次,收集有机层并以无水硫酸钠除水,经减压浓缩移除溶剂,再以管柱层析分离(sio2,ea/hexane=1:3),可得黄色固体3.79g,产率92%。
[0125]
配位基前驱物12的光谱数据:1h nmr(400mhz,cdcl3,298k):δ8.84(d,j=4.4hz,
1h),7.60(d,j=9.0hz,1h),7.53-7.45(m,5h),7.09(d,j=4.4hz,1h),6.96(d,j=8.9hz,1h),2.65(s,3h).
[0126]
7-溴-8-甲基-4-苯基喹啉(7-bromo-8-methyl-4-phenylquinoline)(13)的制备方法如下。取一双颈瓶,加入配位基前驱物12(3.79g,16.2mmol)及溴化铜(copper(ii)bromide,cubr2)(4.34g,19.4mmol),并以乙腈(54ml)溶解,再滴入亚硝酸叔丁酯(tert-butyl nitrite)(4.28ml,32.4mmol),于空气下加热回流2小时。以tlc片确认反应结束后,将反应物溶入乙酸乙酯、并用饱和碳酸氢钠溶液与食盐水清洗数次,收集有机层并以无水硫酸钠除水,经减压浓缩移除溶剂,再以管柱层析分离(sio2,ea/hexane=1:5),可得橘色固体3.34g,产率69%。
[0127]
配位基前驱物13的光谱数据:1h nmr(400mhz,cdcl3,298k):δ8.94(d,j=4.4hz,1h),7.62(s,2h),7.54-7.49(m,3h),7.48-7.45(m,2h),7.35(d,j=4.4hz,1h),2.99(s,3h).
[0128]
7-溴-8-(溴甲基)-4-苯基喹啉(7-bromo-8-(bromomethyl)-4-phenylquinoline)(14)的制备方法与配位基前驱物2的制备方法类似,改以配位基前驱物13为起始物,最后经管柱层析分离(sio2,ea/hexane=1:7),可得橘色固体,产率95%。
[0129]
配位基前驱物14的光谱数据:1h nmr(400mhz,cdcl3,298k):δ9.03(d,j=4.4hz,1h),7.75(d,j=9.1hz,1h),7.65(d,j=9.1hz,1h),7.55-7.51(m,3h),7.48-7.43(m,2h),7.40(d,j=4.4hz,1h),5.48(s,2h).
[0130]
8-(叠氮甲基)-7-溴-4-苯基喹啉(8-(azidomethyl)-7-bromo-4-phenylquinoline)(15)的制备方法与配位基前驱物3的制备方法类似,改以配位基前驱物14为起始物,最后经管柱层析分离(sio2,ea/hexane=1:7),可得黄色液体,产率91%。
[0131]
配位基前驱物15的光谱数据:1h nmr(400mhz,cdcl3,298k):δ8.99(d,j=4.4hz,1h),7.79(d,j=9.1hz,1h),7.68(d,j=9.1hz,1h),7.56-7.50(m,3h),7.49-7.45(m,2h),7.40(d,j=4.4hz,1h),5.30(s,2h).
[0132]
(7-溴-4-苯基喹啉-8-基)甲胺((7-bromo-4-phenylquinolin-8-yl)methanamine)(16)的制备方法与配位基前驱物4的制备方法类似,改以配位基前驱物15为起始物,最后经管柱层析分离(sio2,dcm/meoh=15:1),可得黄绿色黏稠液体,产率82%。
[0133]
配位基前驱物16的光谱数据:1h nmr(400mhz,cdcl3,298k):δ8.95(d,j=4.3hz,1h),7.66(d,j=9.1hz,1h),7.60(d,j=9.1hz,1h),7.55-7.49(m,3h),7.47-7.43(m,2h),7.36(d,j=4.4hz,1h),4.66(s,2h).
[0134]
4-苯基-8-(三氟甲基)吡啶并[2,3-f]喹唑啉(4-phenyl-8-(trifluoromethyl)pyrido[2,3-f]quinazoline)(ppnazh,l3)的制备方法与配位基前驱物l1的制备方法类似,改以配位基前驱物16为起始物,最后经管柱层析分离(sio2,ea/hexane=1:3),可得黄色固体,产率34%。
[0135]
配位基前驱物l3的光谱数据:1h nmr(500mhz,cdcl3,298k):δ10.83(s,1h),9.17(d,j=4.3hz,1h),8.41(d,j=9.6hz,1h),8.07(d,j=9.4hz,1h),7.67(d,j=4.7hz,1h),7.60-7.57(m,3h),7.54-7.52(m,2h).
19
f nmr(470mhz,cdcl3,298k):δ-69.71(s,3f).ms(fd)calcd.for c
18h10
f3n3[m
+
]:m/z:325.1,found:325.0.
[0136]
在另一实施例中,本发明的铂错合物所使用的配位基前驱物l4(5tpnazh)的合成
步骤流程s4如下:
[0137][0138]
流程s4实验条件:
[0139]
(i)hno3,acoh,ac2o,0℃,1小时
[0140]
(ii)nbs,h2so4,tfa,50℃,16小时
[0141]
(iii)sncl2,hcl,etoh,回流,3小时
[0142]
(iv)甘油,3-硝基苯磺酸钠,feso4·
7h2o,msoh,160℃,16小时
[0143]
(v)nbs,bpo,苯,回流,隔夜
[0144]
(vi)nan3,dmf,80℃,隔夜
[0145]
(vii)pph3,h2o,thf,室温,2小时
[0146]
(viii)三氟乙脒,cui,k2co3,邻二氮菲,dmso,100℃.
[0147]
4-(叔丁基)-1-甲基-2-硝基苯(4-(tert-butyl)-1-methyl-2-nitrobenzene)(17)的制备方法如下。取一双颈瓶,加入发烟硝酸(hno3,10ml)置于冰浴中,缓慢地滴入冰醋酸(acoh,17ml)反应10分钟。取另一双颈瓶,加入4-叔丁基甲苯(4-tert-butyltoluene)(10g,67.5mmol)并与醋酸酐(ac2o,200ml)混合、置于冰浴,之后缓慢地滴入前述的混合溶液,于冰浴下反应1小时。以tlc片确认反应结束后,将反应物倒入碎冰、并用己烷萃取数次,收集有机层并以2m氢氧化钠溶液中和后,再将有机层以无水硫酸钠除水,经减压浓缩移除溶剂,以管柱层析分离(sio2,ea/hexane=1:9),可得黄色液体10g,产率77%。
[0148]
配位基前驱物17的光谱数据:1h nmr(400mhz,cdcl3,298k):δ7.97(d,j=2.1hz,1h),7.51(dd,j=8.0,2.1hz,1h),7.26(d,j=8.0hz,1h),2.56(s,3h),1.34(s,9h).
[0149]
1-溴-5-(叔丁基)-2-甲基-3-硝基苯(1-bromo-5-(tert-butyl)-2-methyl-3-nitrobenzene)(18)的制备方法如下。取一双颈瓶,加入配位基前驱物17(10g,51.7mmol)、三氟乙酸(tfa,31ml)和浓硫酸(h2so4,10ml),之后缓慢地加入nbs(18.4g,103.4mmol),于60
℃下反应16小时。以tlc片确认反应结束后,将反应物倒入碎冰之中、并与2m氢氧化钠溶液中和,溶于乙酸乙酯、并用水清洗两次,收集有机层并以无水硫酸钠除水,经减压浓缩移除溶剂,再以管柱层析分离(sio2,ea/hexane=1:7),可得黄色液体12.48g,产率89%。
[0150]
配位基前驱物18的光谱数据:1h nmr(400mhz,cdcl3,298k):δ7.78(d,j=2.0hz,1h),7.70(d.j=2.2hz,1h),2.52(s,3h),1.33(s,9h).
[0151]
3-溴-5-(叔丁基)-2-甲基苯胺(3-bromo-5-(tert-butyl)-2-methylaniline)(19).实验步骤同配位基前驱物12,改以配位基前驱物18为起始物,最后经管柱层析分离(sio2,ea/hexane=1:5),可得黄色液体,产率85%。
[0152]
配位基前驱物19的光谱数据:1h nmr(400mhz,cdcl3,298k):δ7.02(d,j=1.9hz,1h),6.64(d,j=1.9hz,1h),3.68(br,2h),2.24(s,3h),1.26(s,9h).
[0153]
7-溴-5-(叔丁基)-8-甲基喹啉(7-bromo-5-(tert-butyl)-8-methylquinoline)(20)的制备方法与配位基前驱物1的制备方法类似,改以配位基前驱物19为起始物,并将反应时间拉长至24小时,最后经管柱层析分离(sio2,ea/hexane=1:7),可得黄色固体,产率32%。
[0154]
配位基前驱物20的光谱数据:1h nmr(400mhz,cdcl3,298k):δ8.90(dd,j=4.2,1.4hz,1h),8.75(dd,j=8.7,1.4hz,1h),7.66(s,1h),7.40(dd,j=8.7,4.2hz,1h),2.90(s,3h),1.59(s,9h).
[0155]
7-溴-8-(溴甲基)-5-(叔丁基)喹啉(7-bromo-8-(bromomethyl)-5-(tert-butyl)quinoline)(21)的制备方法与配位基前驱物2的制备方法类似,改以配位基前驱物20为起始物,最后经管柱层析分离(sio2,ea/hexane=1:5),可得橘色固体,产率96%。
[0156]
配位基前驱物21的光谱数据:1h nmr(400mhz,cdcl3,298k):δ8.97(dd,j=4.1,1.6hz,1h),8.77(dd,j=8.8,1.6hz,1h),7.69(s,1h),7.45(dd,j=8.8,4.1hz,1h),5.40(s,2h),1.60(s,9h).
[0157]
8-(叠氮甲基)-7-溴-5-(叔丁基)喹啉(8-(azidomethyl)-7-bromo-5-(tert-butyl)quinoline)(22)的制备方法与配位基前驱物3的制备方法类似,改以配位基前驱物21为起始物,最后经管柱层析分离(sio2,ea/hexane=1:7),可得黄色液体,产率94%。
[0158]
配位基前驱物22的光谱数据:1h nmr(400mhz,cdcl3,298k):δ8.94(dd,j=4.0,1.4hz,1h),8.78(dd,j=8.8,1.4hz,1h),7.72(s,1h),7.45(dd,j=8.8,4.0hz,1h),5.21(s,2h),1.61(s,9h).
[0159]
(7-溴-5-(叔丁基)喹啉-8-基)甲胺((7-bromo-5-(tert-butyl)quinolin-8-yl)methanamine)(23).的制备方法与配位基前驱物4的制备方法类似,改以配位基前驱物22为起始物,最后经管柱层析分离(sio2,dcm/meoh=20:1),可得黄色黏稠液体,产率92%。
[0160]
配位基前驱物23的光谱数据:1h nmr(400mhz,cdcl3,298k):δ8.90(dd,j=4.0,1.6hz,1h),8.76(dd,j=8.8,1.6hz,1h),7.65(s,1h),7.42(dd,j=8.8,4.0hz,1h),4.57(s,2h),1.59(s,9h).
[0161]
5-(叔丁基)-8-(三氟甲基)吡啶并[2,3-f]喹唑啉(5-(tert-butyl)-8-(trifluoromethyl)pyrido[2,3-f]quinazoline)(5tpnazh,l4)的制备方法与配位基前驱物l1的制备方法类似,改以配位基前驱物23为起始物,最后经管柱层析分离(sio2,ea/hexane=1:5),可得黄色固体,产率45%。
[0162]
配位基前驱物l4光谱数据:1h nmr(500mhz,cdcl3,298k):δ10.67(s,1h),9.11(dd,j=4.3,1.6hz,1h),8.95(dd.j=8.6,1.6hz),8.13(s,1h),7.71(dd,j=8.6,4.3hz,1h),1.71(s,9h).
19
f nmr(470mhz,cdcl3,298k):δ-69.74(s,3f).ms(fd)calcd.for c
16h14
f3n3[m
+
]:m/z:305.1,found:305.1.
[0163]
[铂错合物的合成]
[0164]
本发明的铂错合物可以如下述的单一步骤法(one step)制得:
[0165]
k2ptcl4+配位基前驱物+醋酸钾
→
铂金属错合物
[0166]
其具体方法包括以下步骤:将配位基前驱物、醋酸钾与铂源混合,在适当的溶剂(例如:叔戊酸或其他高沸点的羧酸)下加热回流。待反应结束后,对粗产物进行纯化,以获得本发明的铂金属错合物。
[0167]
第二个方法为一个两步骤的合成方法:
[0168]
pt(dmso)2cl2+一当量配位基前驱物+醋酸钠
→
+二甲基亚砜
→
中间体
[0169]
中间体+另一配位基的前驱物
→
铂金属错合物
[0170]
其具体方法包括以下步骤:将一当量的配位基前驱物、醋酸钠与铂源混合,在无水甲苯下加热回流24小时后,再加入二甲基亚砜溶剂于80℃下反应24小时,得到中间体;再加入另一配位基的前驱物,在冰醋酸中加热回流。待反应结束后,对粗产物进行纯化,以获得本发明的铂金属错合物。
[0171]
本发明的铂错合物可依据各个配位基的变化选用适当的反应物及反应条件进行制备,且反应制备方式可依据本领域所熟知的技术进行变化,于此不再赘述。
[0172]
[实施例]
[0173]
以下将通过数个实施例对本发明作进一步说明,但所述实施例仅为例示说明之用,而非用以限制本发明的范围。由前述式(ia-1)、(ia-2)、(ia-3)
…
或(ib-1)、(ib-2)、(ib-3)
…
或(ic-1)、(ic-2)、(ic-3)
…
或(id-1)、(id-2)、(id-3)
…
所表示的铂错合物,后文将其简称为化合物(ia-1)、(ia-2)、(ia-3)
…
或(ib-1)、(ib-2)、(ib-3)
…
或(ic-1)、(ic-2)、(ic-3)
…
或(id-1)、(id-2)、(id-3)
…
。此种简称方式亦套用于下文中以其他化学结构式表达的铂错合物。
[0174]
实施例1
[0175]
化合物(ia-1)的制备:
[0176][0177]
取一单颈瓶,加入k2ptcl4(300mg,0.7mmol)、配位基前驱物l1(378mg,1.5mmol)及醋酸钾(2.85g,29.1mmol),抽换氮气数次后加入叔戊酸(pivoh,30ml),加热回流72小时。反应结束后,先以真空系统移除溶剂,接着加入丙酮与水强力搅拌数分钟后,抽气过滤收集固体并以丙酮与水多次清洗。将粗产物以升华纯化(10-5
mmhg,360~380℃),可得黑色固体
430mg,产率86%。
[0178]
因溶解度太差无法取得1h及
19
f nmr图谱。ms(ei)calcd.for c
24h10
f6n6pt[m
+
]:m/z:691.1,found:691.1.anal.calcd.for c
24h10
f6n6pt:c,41.69;h,1.46;n,12.15,found:c,41.74;h,1.50;n,11.77.
[0179]
实施例2
[0180]
化合物(ia-2)的制备:
[0181][0182]
实验步骤同化合物(ia-1),改以l2为配位基前驱物。将粗产物以升华纯化(10-5
mmhg,360~380℃),可得灰绿色固体,产率90%。
[0183]
因溶解度太差无法取得1h nmr及
19
f图谱。ms(ei)calcd.for c
26h14
f6n6pt[m
+
]:m/z:719.1,found:719.1.anal.calcd.for c
26h14
f6n6pt:c,43.40;h,1.96;n,11.68,found:c,43.75;h,2.07;n,11.73.
[0184]
实施例3
[0185]
化合物(ia-3)的制备:
[0186][0187]
实验步骤同化合物(ia-1),改以l3为配位基前驱物。将粗产物以升华纯化(10-5
mmhg,400~420℃),可得黄绿色固体,产率90%。
[0188]
因溶解度太差无法取得1h及
19
f nmr图谱。ms(ei)calcd.for c
36h18
f6n6pt[m
+
]:m/z:843.1,found:843.1.anal.calcd.for c
36h18
f6n6pt:c,51.25;h,2.15;n,9.96,found:c,51.25;h,2.23;n,9.78.
[0189]
实施例4
[0190]
化合物(ia-4)的制备:
[0191][0192]
实验步骤同化合物(ia-1),改以l4为配位基前驱物。反应结束后,先以真空系统移除溶剂,再以二氯甲烷与水萃取两次,收集有机层并以无水硫酸钠除水,经减压浓缩移除溶剂,再以管柱层析分离(sio2,dcm/meoh=20:1),可得蓝绿色固体。再以升华纯化(10-5
mmhg,300~320℃),可得深红色固体,产率70%。
[0193]
化合物(ia-4)的光谱数据:1h nmr(500mhz,cd2cl2,298k):δ10.84(d,j=4.3hz,2h),8.72(d,j=8.4hz,2h),7.51(s,2h),7.46-7.44(m,2h),1.69(s,18h).
19
f nmr(470mhz,cd2cl2,298k):δ-69.34(s,6f).ms(fd)calcd.for c
32h26
f6n6pt[m
+
]:m/z:803.2,found:803.2.anal.calcd.for c
32h26
f6n6pt:c,47.82;h,3.26;n,10.46,found:c,47.80;h,3.23;n,10.19.
[0194]
实施例5
[0195]
中间体(pt(l1)(dmso)cl)的制备:
[0196][0197]
取一单颈瓶,加入pt(dmso)2cl2(200mg,0.5mmol)、配位基前驱物l1(236mg,0.9mmol)及醋酸钠(39mg,0.5mmol),抽换氮气数次后加入无水甲苯(6ml),加热回流24小时。反应结束后,先以减压浓缩移除溶剂,溶于二氯甲烷并用水清洗两次,收集有机层并以无水硫酸钠除水,经减压浓缩移除溶剂,可得棕色固体粗产物。之后再加入二甲基亚砜(6ml),于80℃下反应24小时。再以tlc片确认反应结束后,将产物溶于二氯甲烷并用水清洗两次,收集有机层并以无水硫酸钠除水,经减压浓缩移除溶剂,再以管柱层析分离(sio2,dcm/meoh=20:1),可得淡黄色固体203mg,产率76%。
[0198]
中间体(pt(l1)(dmso)cl)的光谱数据:1h nmr(500mhz,acetone-d6,298k):δ9.99(d,j=5.1hz,j
pth
=28hz,1h),8.99(d,j=8.1hz,1h),8.54(d,j=9.0hz,1h),8.17(td,j=6.7,2.6hz,1h),8.07(d,j=9.0hz,1h),3.86(s,j
pth
=27hz,6h).
19
f nmr(470mhz,acetone-d6,298k):δ-70.41(s,3f).
[0199]
实施例6
[0200]
中间体(pt(l4)(dmso)cl)的制备:
[0201][0202]
实验步骤同中间体[pt(l1)(dmso)cl],改以l4为配位基前驱物。再以管柱层析分离(sio2,dcm/meoh=20:1),可得淡黄色固体,产率70%。
[0203]
中间体(pt(l4)(dmso)cl)的光谱数据:1h nmr(500mhz,acetone-d6,298k):δ10.05(dd,j=5.5,1.1hz,j
pth
=33hz,1h),9.48(dd,j=8.6,1.2hz,1h),8.15(q,j=4.7hz,1h),7.98(s,1h),3.84(s,j
pth
=28hz,6h),1.76(s,9h).
19
f nmr(470mhz,acetone-d6,298k):δ-70.44(s,3f).
[0204]
实施例7
[0205]
化合物(ib-1)的制备:
[0206][0207]
取一单颈瓶,加入中间体[pt(l1)cl(dmso)](150mg,0.3mmol)、配位基前驱物l7(70mg,0.3mmol)及醋酸钠(66mg,0.8mmol),抽换氮气数次、加入冰醋酸(6ml),加热回流12小时。反应结束后,先以真空系统移除溶剂,接着加入丙酮与水强力搅拌数分钟后,抽气过滤、收集固体并以丙酮与水清洗多次。将粗产物以升华纯化(10-5
mmhg,330~350℃),可得灰绿色固体140mg,产率82%。
[0208]
化合物(ib-1)的光谱数据:1h nmr(500mhz,dmso-d6,353k):δ9.45(d,j=4.2hz,1h),9.02(d,j=3.2hz,1h),8.90(d,j=9.1hz,1h),8.53(d,j=8.2hz,1h),8.43(d,j=8.9hz,1h),8.08(s,1h),8.00(d,j=8.8hz,1h),7.85(d,j=8.8hz,1h),7.78
–
7.72(m,2h).
19
f nmr(470mhz,dmso-d6,353k):δ-59.10(s,3f),-68.51(s,3f).ms(fd)calcd.for c
23h10
f6n6pt[m
+
]:m/z:679.1,found:679.0.anal.calcd.for c
23h10
f6n6pt:c,40.66;h,1.48;n,12.37,found:c,40.71;h,1.86;n,12.42.
[0209]
实施例8
[0210]
化合物(ib-2)的制备:
[0211][0212]
实验步骤同化合物(ib-1),改以l8为配位基前驱物。将粗产物以升华纯化(10-5
mmhg,330~350℃),可得黄色固体,产率63%。
[0213]
因溶解度太差无法取得1h及
19
f nmr图谱。ms(ei)calcd.for c
22
h9f6n7pt[m
+
]:m/z:680.1,found:680.1.anal.calcd.for c
22
h9f6n7pt:c,38.83;h,1.33;n,14.41,found:c,38.98;h,1.51;n,14.44.
[0214]
实施例9
[0215]
化合物(id-1)的制备:
[0216][0217]
取一单颈瓶,加入中间体[pt(l1)cl(dmso)](150mg,0.3mmol)、配位基前驱物l9(63mg,0.3mmol)及醋酸钠(66mg,0.8mmol),抽换氮气数次、加入冰醋酸(6ml),加热回流12小时。反应结束后,先以真空系统移除溶剂,接着加入丙酮与水强力搅拌数分钟后,抽气过滤、收集固体并以丙酮与水清洗多次。将粗产物以升华纯化(10-5
mmhg,300~320℃),可得深蓝色固体140mg,产率79%。
[0218]
化合物(id-1)的光谱数据:1h nmr(500mhz,dmso-d6,353k):δ10.25(d,j=6.0hz,1h),10.12(d,j=5.0hz,1h),8.44(d,j=7.7hz,1h),7.96(d,j=8.7hz,1h),7.71(t,j=7.4hz,1h),7.58(t,j=6.3hz,1h),7.52(d,j=9.0hz,1h),7.50(d,j=8.1hz,1h),7.02(t,j=5.5hz,1h),6.71(s,1h).
19
f nmr(470mhz,dmso-d6,353k):δ-59.16(s,3f),-68.50(s,3f).ms(fd)calcd.for c
21h10
f6n6pt[m
+
]:m/z:655.1,found:655.0.anal.calcd.for c
21h10
f6n6pt:c,38.48;h,1.54;n,12.82,found:c,38.59;h,1.85;n,12.92.
[0219]
实施例10
[0220]
化合物(id-2)的制备:
[0221][0222]
实验步骤同化合物(id-1),改以l10为配位基前驱物。将粗产物以升华纯化(10-5mmhg,300~320℃),可得黄棕色固体,产率71%。
[0223]
化合物(id-2)的光谱数据:1h nmr(500mhz,dmso-d6,353k):δ10.73(d,j=3.0hz,1h),10.54(d,j=5.9hz,1h),9.39(s,1h),8.97(d,j=7.8hz,1h),8.83(d,j=3.5hz,1h),8.48(d,j=9.0hz,1h),8.13(t,j=7.0hz,1h),8.05(d,j=8.9hz,1h),7.41(s,1h).
19
f nmr(470mhz,dmso-d6,353k):δ-59.32(s,3f),-68.46(s,3f).ms(fd)calcd.for c
20
h9f6n7pt[m
+
]:m/z:656.1,found:656.1.anal.calcd.for c
20
h9f6n7pt:c,36.60;h,1.38;n,14.94,found:c,36.75;h,1.47;n,14.99.
[0224]
实施例11
[0225]
化合物(id-3)的制备:
[0226][0227]
实验步骤同化合物(id-1),改以中间体[pt(l4)cl(dmso)]为起始物。将粗产物以升华纯化(10-5
mmhg,310~330℃),可得红色固体,产率70%。
[0228]
化合物(id-3)的光谱数据:1h nmr(500mhz,dmso-d6,353k):δ10.92(d,j=6.2hz,1h),10.86(d,j=4.3hz,1h),9.41(d,j=8.0hz,1h),8.26(t,j=8.4hz,1h),8.13(t,j=7.5hz,2h),7.97(s,1h),7.62(t,j=7.3hz,1h),7.35(s,1h),1.73(s,9h).
19
f nmr(470mhz,dmso-d6,353k):δ-59.16(s,3f),-68.60(s,3f).ms(fd)calcd.for c
25h18
f6n6pt[m
+
]:m/z:711.1,found:711.1.anal.calcd.for c
25h18
f6n6pt:c,42.20;h,2.55;n,11.81,found:c,42.28;h,2.70;n,11.86.
[0229]
实施例12
[0230]
化合物(id-4)的制备:
[0231][0232]
实验步骤同化合物(id-3),改以l10为配位基前驱物。将粗产物以升华纯化(10-5
mmhg,310~330℃),可得蓝绿色固体,产率89%。
[0233]
化合物(id-4)的光谱数据:1h nmr(500mhz,dmso-d6,353k):δ10.62(d,j=3.2hz,1h),10.50(d,j=5.6hz,1h),9.35(d,j=8.6hz,1h),9.23(s,1h),8.71(d,j=3.3hz,1h),8.02(dd,j=8.6,5.5hz,1h),7.88(s,1h),7.28(s,1h),1.72(s,9h).
19
f nmr(470mhz,dmso-d6,353k):δ-59.32(s,3f),-68.50(s,3f).ms(fd)calcd.for c
24h17
f6n7pt[m
+
]:m/z:712.1,found:712.1.anal.calcd.for c
24h17
f6n7pt:c,40.46;h,2.40;n,13.76,found:c,40.53;h,2.56;n,13.84.
[0234]
实施例13
[0235]
化合物(id-5)的制备:
[0236][0237]
实验步骤同化合物(id-3),改以l11为配位基前驱物。将粗产物以升华纯化(10-5
mmhg,300~320℃),可得粉红色固体,产率80%。
[0238]
化合物(id-5)的光谱数据:1h nmr(500mhz,dmso-d6,353k):δ10.44(d,j=4.7hz,1h),10.34(d,j=6.1hz,1h),9.18(d,j=8.6hz,1h),7.77(t,j=6.7hz,1h),7.75(d,j=5.8hz,2h),7.23(d,j=5.9hz,1h),7.05(s,1h),1.71(s,9h),1.44(s,9h).
19
f nmr(470mhz,dmso-d6,353k):δ-59.06(s,3f),-68.52(s,3f).ms(fd)calcd.for c
29h26
f6n6pt[m
+
]:m/z:767.2,found:767.2.anal.calcd.for c
29h26
f6n6pt:c,45.38;h,3.41;n,10.95,found:c,45.33;h,3.37;n,10.57.
[0239]
实施例14
[0240]
化合物(id-6)的制备:
[0241][0242]
实验步骤同化合物(id-3),改以l12为配位基前驱物。反应结束后,先以真空系统移除溶剂,将产物溶于二氯甲烷并用水清洗两次,收集有机层并以无水硫酸钠除水,经减压浓缩移除溶剂,再以管柱层析分离(sio2,ea/hexane=1:1),可得黄色固体。再以升华纯化(10-5
mmhg,280~300℃),可得黄色固体,产率60%。
[0243]
化合物(id-6)的光谱数据:1h nmr(500mhz,dmso-d6,298k):δ10.75(d,j=1.6hz,1h),10.68(d,j=5.1hz,1h),9.23(d,j=8.5hz,1h),8.16(dd,j=8.0,1.8hz,1h),8.05(d,j=8.1hz,1h),7.89(td,j=7.0,3.4hz,1h),7.62(s,1h),7.34(td,j=7.6,1.8hz,1h),7.28(d,j=1.1hz,2h),7.27(s,1h),2.26(s,6h),1.62(s,9h).
19
f nmr(470mhz,dmso-d6,298k):δ-58.59(s,3f),-68.68(s,3f).ms(fd)calcd.for c
33h26
f6n6pt[m
+
]:m/z:815.2,found:815.2.anal.calcd.for c
33h26
f6n6pt:c,48.59;h,3.21;n,10.30,found:c,48.91;h,3.34;n,10.34.
[0244]
图2为本发明化合物(id-6)的x-光晶体衍射分析图。由此证明此项合成方法确实能够有效合成本发明所需的铂错合物。
[0245]
实施例15
[0246]
化合物(id-7)的制备:
[0247][0248]
实验步骤同化合物(id-3),改以l13为配位基前驱物。再以升华纯化(10-5
mmhg,280~300℃),可得黄色固体,产率55%。
[0249]
化合物(id-7)的光谱数据:1h nmr(500mhz,dmso-d6,298k):δ11.04(s,1h),10.86(d,j=5.2hz,1h),9.42(d,j=8.7hz,1h),8.28(d,j=8.0hz,1h),8.22(dd,j=8.0,1.5hz,1h),8.15(dd,j=5.4,3.2hz,1h),7.88(s,1h),7.50(d,j=5.9hz,2h),7.34(d,j=7.9hz,2h),2.60-2.54(m,2h),1.66(s,9h),1.12(d,j=6.8hz,6h),1.05(d,j=6.7hz,6h).
19
f nmr(470mhz,dmso-d6,298k):δ-58.93(s,3f),-69.24(s,3f).ms(fd)calcd.for c
37h34
f6n6pt[m
+
]:m/z:871.2,found:871.1.anal.calcd.for c
37h34
f6n6pt:c,50.98;h,3.93;n,9.64,
found:c,51.24;h,4.03;n,9.68.
[0250]
图3为本发明化合物(ia-1)、(ia-2)、(ia-3)以及(ia-4)的蒸镀薄膜的放射光谱图。图5为本发明化合物(ib-1)以及(ib-2)的蒸镀薄膜的放射光谱图。图7为本发明化合物(id-1)、(id-2)、(id-3)、(id-4)、(id-5)、(id-6)以及(id-7)的蒸镀薄膜的放射光谱图。本发明上述化合物的发射峰位置(emλ
max
)、发光生命期(τ
obs
)及量子产率(φ)列示于下表1。
[0251]
表1
[0252][0253][0254]
[a]以真空蒸镀后的薄膜(厚度为100nm)进行发射光(photoluminescent)光谱、量子产率和发光生命期的量测。
[0255]
由图3、图5、图7及表1可知,本发明的铂错合物发光波长的高峰值(λ
max
)介于约600纳米至955纳米之间,故其应用层面相当广。例如,本发明的铂错合物(ia-1)~(ia-4)、(ib-1)~(ib-2)以及(id-1)~(id-5)的发光波长大于700纳米,落入近红外光的范围内,可应用于军事或医疗领域。而本发明的铂错合物(id-6)~(id-7)的发光波长介于可见光范围内,可应用于oled领域。
[0256]
图4为本发明化合物(ia-1)、(ia-2)、(ia-3)以及(ia-4)的热重分析图。图6为本发明化合物(ib-1)以及(ib-2)的热重分析图。图8为本发明化合物(id-1)、(id-2)、(id-3)、(id-4)、(id-5)、(id-6)以及(id-7)的热重分析图。本发明上述化合物损失5%重量的温度(td)列示于下表2、3、4中。
[0257]
表2
[0258]
化合物td(℃)
[b]
ia-1479ia-2461ia-3488ia-4431
[0259]
[b]为化合物损失5%重量的温度。
[0260]
表3
[0261]
化合物td(℃)
[b]
ib-1426ib-2442
[0262]
[b]为化合物损失5%重量的温度。
[0263]
表4
[0264]
化合物td(℃)
[b]
id-1391id-2407id-3416id-4392id-5389id-6388id-7380
[0265]
[b]为化合物损失5%重量的温度。
[0266]
由图4、图6、图8及表2~4可知,本发明的铂错合物均具有超过380℃的分解温度。这些分解温度是通过执行热重分析、并记录样品重量损失达到5%的温度而得。具较高分解温度的铂错合物将能够用较高的升华温度去执行材料的纯化、以及使用化学气相沉积以制备oled器件、不用担心材料分解。故较佳的热稳定性可以提升这些发光材料的使用效果与性能。
[0267]
综上所述,本发明的铂错合物具有两个含氮芳基螯合配体,且在两个含氮芳基螯合配体之间具有一个新增的六元环状结构,故可以更加稳定配体与平面结构刚性。本发明的铂错合物具有更佳的平面结构构型与更有效的双键轨域共轭,后者是由中心的六元环状结构提供。本发明中,这两项结构特性使得制备出的铂错合物在近红外光区具有更佳的光物理性质,例如:红移发射光谱波长暨增加发光量子效率。
[0268]
再者,当利用气相沉积法制备相关铂错合物的有机薄膜之时,由于铂错合物具有分子间pt
…
pt键结引导,亦会有利形成线性堆栈;亦由于铂错合物间的分子立体障碍减少,造成pt
…
pt的间距能够更加缩短。而这些铂错合物材料在激发后会形成mmlct激态组态,可使放光波长显著红移至近红外光区。此外,本发明铂错合物中具有两个n-pt与两个c-pt配位键结,由于c-pt的键能大于n-pt的键能,故本发明的铂错合物的整体配位键结强度会明显高于一般仅具有四个n-pt键结的铂错合物,亦可以减少分子在激发态的非放光焠息,以增加放光量子效率。最后,这些铂错合物的合成方法简易,容易进行量产,故有较佳的商品
价值。
[0269]
虽然本发明已以实施例揭示如上,然其并非用以限定本发明,任何所属技术领域中技术人员,在不脱离本发明的精神和范围内,当可作些许的更改与润饰,故本发明的保护范围当视后附的权利要求所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1