一种多环吡啶酮衍生物和药物组合物及其应用的制作方法
本发明属于药物领域,具体地,涉及一种多环吡啶酮衍生物,一种含有该多环吡啶酮衍生物的药物组合物,以及所述多环吡啶酮衍生物和所述药物组合物的应用。
背景技术:
流行性感冒主要是由流感病毒感染引起,流感平均每年可以导致三百万到五百万的住院病例和29万到65万的死亡病例。引起流感大爆发的往往是甲型流感病毒。但是近年来,随着h1n1,h5n1和h7n9等高侵袭性病毒株的出现,以及越来越多的耐药病毒株的出现,现有的抗流感药物已经不能满足人们的需求。因此,开发出具有新型作用机制的抗流感药物十分必要。
流感病毒的生命周期是一个复杂的生物学过程,可分为以下几个步骤:(i)病毒与宿主细胞表面受体结合;(ii)病毒被内吞到宿主细胞中,病毒膜和内体膜相融合;(iii)病毒核糖核蛋白(vrnps)释放到细胞质中,然后被转运到细胞核中;(iv)病毒rna的转录和复制;(v)mrna和vrnp从细胞核输出,相关蛋白的合成;(vi)子代病毒的组装,通过萌芽的形式从细胞中释放出来。流感病毒感染周期中涉及到的病毒蛋白和宿主细胞蛋白都是研发抗流感病毒药物的重要靶标。针对这些靶标已经开发了许多抗流感药物。
小分子抗流感病毒制剂主要分为五类:(i)m2离子通道蛋白抑制剂(金刚烷胺,金刚乙胺等);(ii)神经氨酸酶(na)抑制剂(扎那米韦,奥司他韦,帕拉米韦,拉尼米韦等);(iii)血凝素(ha)抑制剂(阿比多尔,硝唑尼特等);(iv)rna依赖的rna聚合酶(rdrp)抑制剂(法匹拉韦,巴洛沙韦等);(v)核蛋白(np)抑制剂(萘普生等)。到目前为止,只有少数几种抗流感病毒药物被批准上市。
目前,临床上使用的主要抗流感药物是神经氨酸酶抑制剂(nai)。但近年来,耐药性流感病毒突变株不断出现,这不仅降低了临床上抗流感药的疗效,而且对公共卫生安全进一步构成了威胁。因此,开发具有新机制的抗流感药物具有重要的意义和广阔的应用前景。
巴洛沙韦(baloxavirmarboxil),商品名xofluza,于2018年10月获得fda批准上市,是近二十年来首个具有新作用机制的抗流感药物。它由日本盐野义公司开发,并于2018年2月在日本首次获得批准上市。与神经氨酸酶抑制剂不同,巴洛沙韦可防止子代病毒体从感染的宿主细胞中释放,巴洛沙韦是一种新型的帽依赖型核酸内切酶(cen)抑制剂,帽依赖性核酸内切酶存在于甲型和乙型流感病毒的聚合酶酸性蛋白(pa)亚基中。病毒mrna转录取决于独特的“抢帽(cap-snatching)”机制:pb2与宿主中5'-cap转录物结合,pa中的帽依赖核酸内切酶在距5'-cap约12个核苷酸的位置内切,将切下来的帽结构作为引物用于病毒mrna转录。因此,抑制该核酸内切酶可以抑制mrna转录,进而抑制病毒复制。此外,与奥司他韦相比,巴洛沙韦具有不需疗程化治疗(奥司他韦连续治疗5天),仅需一天一次给药,疾病症状缓解时间与奥司他韦相比非劣效,病毒滴度和安全性方面优于奥司他韦等优势。这或将打破近20年来神经氨酸酶抑制剂主导流感市场的格局,为流感提供全新的治疗机制,得到业界广泛关注。
基于巴洛沙韦进行优化,以期得到活性更好的抗流感药物是本领域的进一步目标。
技术实现要素:
本发明的目的是提供一类作为流感病毒rna聚合酶抑制剂的新化合物,更具体地说,本发明提供一类作为流感病毒的帽依赖性核酸内切酶抑制剂的新化合物,此类化合物及其组合物可以用于预防、处理、治疗或减轻流感病毒感染后患者的症状。与已有的同类化合物相比,本发明的化合物不仅能很好的抑制流感病毒的复制,还具有更低的细胞毒性,其中一个化合物的抗流感病毒活性更是优于上市的同类化合物。因此,本发明提供的化合物相对于已有的同类化合物而言,具有更好的流感病毒活性。
为了实现上述目的,本发明的第一方面提供一种多环吡啶酮衍生物,其为式(i)所示化合物或式(i)所示化合物的立体异构体、互变异构体、氮氧化物、溶剂化物、代谢产物、药学上可接受的盐或它们的前药;
其中,
p为氢、苄基、正己基或形成前药的pr基;
a1为cr1ar1b、s或o;
a2为cr2ar2b、s或o;
a3为cr3ar3b、s或o;
a4各自独立地为cr4ar4b、s或o;
并且,由a1、a2、a3、n个a4,与a1邻接的氮原子以及与a4邻接的碳原子所构成的环的成环原子中杂原子的个数为1个或2个;
r1a和r1b各自独立地为氢、卤素、烷基、卤代烷基、烷氧基或苯基;
r2a和r2b各自独立地为氢、卤素、烷基、卤代烷基、烷氧基或苯基;
r3a和r3b各自独立地为氢、卤素、烷基、卤代烷基、烷氧基或苯基;
r4a和r4b各自独立地为氢、卤素、烷基、卤代烷基、烷氧基或苯基;
r3a和r3b任选与邻接的碳原子共同形成碳环或杂环;
n为1或2;
r1和r2各自独立地为氢、卤素、羟基、烷基、烷氧基或卤代烷基;
pr为选自以下的式a)-ac)中的基团中的至少一种:
a)-c(=o)-pr0;
b)-c(=o)-pr1;
c)-c(=o)-l-pr1;
d)-c(=o)-l-o-pr1;
e)-c(=o)-l-o-l-o-pr1;
f)-c(=o)-l-o-c(=o)-o-pr1;
g)-c(=o)-o-pr2;
h)-c(=o)-n(-k)(pr2);
i)-c(=o)-o-l-o-pr2;
j)-c(pr3)2-o-pr4;
k)-c(pr3)2-o-l-o-pr4;
l)-c(pr3)2-o-c(=o)-pr4;
m)-c(pr3)2-o-c(=o)-o-pr4;
n)-c(pr3)2-o-c(=o)-n(-k)-pr4;
o)-c(pr3)2-o-c(=o)-o-l-o-pr4;
p)-c(pr3)2-o-c(=o)-o-l-n(pr4)2;
q)-c(pr3)2-o-c(=o)-n(-k)-l-o-pr4;
r)-c(pr3)2-o-c(=o)-n(-k)-l-n(pr4)2;
s)-c(pr3)2-o-c(=o)-o-l-o-l-o-pr4;
t)-c(pr3)2-o-c(=o)-o-l-n(-k)-c(=o)-pr4;
u)-c(pr3)2-o-p(=o)(-pr5)2;
v)-c(pr3)2-pr6)2;
w)-c(=n+(pr7)2)(-n(pr7)2);
x)-c(pr3)2-c(pr3)2-c(c=o)-o-pr2;
y)-c(pr3)2-n(-k)-c(c=o)-o-pr2;
z)-p(=o)(-pr8)(-pr9);
aa)-s(=o)2-pr10;
ab)-pr11;
ac)-c(pr3)2-c(pr3)2-o-pr2;
式中,l为直链或支链状的亚烷基,或者直链或支链状的亚烯基;
k为氢或任选被取代基组a取代的烷基;
pr0为任选被取代基a取代的烷基或任选被取代基a取代的烯基;
pr1为任选被取代基a取代的碳环基、任选被取代基a取代的杂环基、任选被取代a取代的烷基氨基,或任选被取代基a取代的烷基硫基;
pr2为任选被取代基a取代的烷基、任选被取代基a取代的碳环基、任选被取代基a取代的杂环基、任选被取代基a取代的碳环烷基、任选被取代基a取代的杂环烷基,或三烷基甲硅烷基;
pr3各自独立地为氢、烷基;
pr4各自独立地为任选被取代基a取代的烷基、任选被取代基a取代的碳环基、任选被取代基a取代的杂环基、任选被取代基a取代的烷基氨基、任选被取代基a取代的碳环烷基、任选被取代基a取代的杂环烷基,或三烷基甲硅烷基;
pr5各自独立地为obn;
pr6为任选被取代基a取代的碳环基,或任选被取代基a取代的杂环基;
pr7各自独立地为任选被取代基a取代的烷基;
pr8为任选被取代基a取代的烷氧基;
pr9为任选被取代基a取代的烷氧基、任选被取代基a取代的烷基氨基、任选被取代基a取代的碳环氧基、任选被取代基a取代的杂环氧基、任选被取代基a取代的碳环氨基,或任选被取代基a取代的杂环氨基;
并且,pr8及pr9任选与邻接的磷原子共同形成任选被取代基a取代的杂环;
pr10为任选被取代基a取代的烷基、任选被取代基a取代的碳环基、任选被取代基a取代的杂环基、任选被取代基a取代的碳环烷基,或任选被取代基a取代的杂环烷基;
pr11为任选被取代基a取代的烷基、任选被取代基a取代的烯基、任选被取代基a取代的碳环基,或任选被取代基a取代的杂环基;
取代基a选自由以下基团组成的组中的至少一种:氧代基、烷基、羟基烷基、氨基、烷基氨基、碳环基、杂环基、碳环烷基、烷基羰基、卤素、羟基、羧基、烷基羰基氨基、烷基羰基氨基烷基、烷基羰氧基、烷氧基羰基、烷氧基羰基烷基、烷氧基羰氧基、烷基氨基羰氧基、烷基氨基烷基、烷氧基、氰基、硝基、叠氮基、烷基磺酰基、三烷基甲硅烷基,及磷酰基。
具体地,所述多环吡啶酮衍生物为式(ii)所示的化合物或其立体异构体、互变异构体、氮氧化物、溶剂化物、代谢产物、药学上可接受的盐或它们的前药,
其中,
p为氢、苄基、正己基或形成前药的pr基;
r1和r2各自独立地为氢、卤素、羟基、烷基、烷氧基或卤代烷基;
pr为选自以下基团中的至少一种:
a)-c(=o)-pr0;
b)-c(=o)-pr1;
g)-c(=o)-o-pr2;
h)-c(=o)-n(-k)(pr2);
i)-c(=o)-o-l-o-pr2;
l)-c(pr3)2-o-c(=o)-pr4;
m)-c(pr3)2-o-c(=o)-o-pr4;
o)-c(pr3)2-o-c(=o)-o-l-o-pr4;
v)-c(pr3)2-pr6)2;
x)-c(pr3)2-c(pr3)2-c(c=o)-o-pr2;
y)-c(pr3)2-n(-k)-c(c=o)-o-pr2;
z)-p(=o)(-pr8)(-pr9);
式中,l为直链或支链状的亚烷基;
k为氢或任选被取代基a取代的烷基;
pr0为任选被取代基a取代的烷基;
pr1为任选被取代基a取代的碳环基,任选被取代基a取代的杂环基;
pr2为任选被取代基a取代的烷基,任选被取代基a取代的碳环基,任选被取代基a取代的杂环基,任选被取代基a取代的碳环烷基,任选被取代基a取代的杂环烷基;
pr3各自独立地为氢、烷基;
pr4为任选被取代基a取代的烷基,任选被取代基a取代的碳环基,任选被取代基a取代的杂环基;
pr6为任选被取代基a取代的碳环基,任选被取代基a取代的杂环基;
pr8为任选被取代基a取代的烷氧基;
pr9为任选被取代基a取代的烷氧基,任选被取代基a取代的烷基氨基,任选被取代基a取代的碳环氧基,任选被取代基a取代的杂环氧基,任选被取代基a取代的碳环氨基,或任选被取代基a取代的杂环氨基;
并且,pr8及pr9任选与邻接的磷原子共同形成任选被取代基a取代的杂环;
取代基a选自由以下基团组成的组中的至少一种:氧代基、烷基、烷基氨基、碳环基、杂环基、、烷基羰基、卤素、羟基、烷基羰基氨基、烷基羰氧基、烷氧基羰基、烷氧基羰基烷基、烷基氨基羰氧基、烷氧基、硝基、叠氮基、烷基磺酰基、及三烷基甲硅烷基。
更具体地,式(ii)所示的化合物中,r1和r2各自独立地为氢、卤素、烷基、烷氧基;进一步优选地,r1和r2各自独立地为氢、f、cl、br、c1-c4烷基、c1-c4烷氧基;
pr为
所述c1-c4烷基包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基。所述c1-c4烷氧基为上述c1-c4烷基对应的烷氧基。
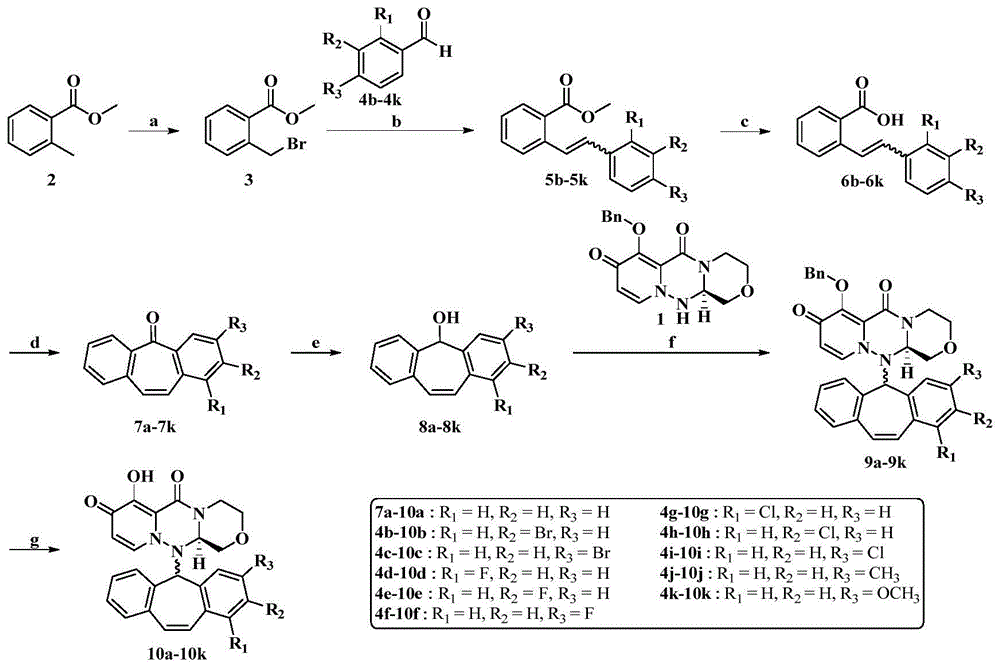
根据本发明,具体地,通式ii所示化合物选自:
(r)-12-(5h-二苯并[a,d][7]-5-环戊烯基)-7-羟基-3,4,12,12a-四氢-1h-[1,4]恶嗪[3,4-c]吡啶并[2,1-f][1,2,4]三嗪-6,8-二酮(10a);
(r)-7-羟基-12-(((r/s)-2-溴-5h-二苯并[a,d][7]-5-环戊烯基)-7-羟基-3,4,12,12a-四氢-1h-[1,4]恶嗪基[3,4-c]吡啶基[2,1-f][1,2,4]三嗪-6,8-二酮(10b);
(r)-7-羟基-12-(((r/s)-3-溴-5h-二苯并[a,d][7]-5-环戊烯基)-7-羟基-3,4,12,12a-四氢-1h-[1,4]恶嗪基[3,4-c]吡啶基[2,1-f][1,2,4]三嗪-6,8-二酮(10c);
(r)-7-羟基-12-(((r/s)-1-氟-5h-二苯并[a,d][7]-5-环戊烯基)-7-羟基-3,4,12,12a-四氢-1h-[1,4]恶嗪基[3,4-c]吡啶基[2,1-f][1,2,4]三嗪-6,8-二酮(10d);
(r)-7-羟基-12-(((r/s)-2-氟-5h-二苯并[a,d][7]-5-环戊烯基)-7-羟基-3,4,12,12a-四氢-1h-[1,4]恶嗪基[3,4-c]吡啶基[2,1-f][1,2,4]三嗪-6,8-二酮(10e);
(r)-7-羟基-12-(((r/s)-3-氟-5h-二苯并[a,d][7]-5-环戊烯基)-7-羟基-3,4,12,12a-四氢-1h-[1,4]恶嗪基[3,4-c]吡啶基[2,1-f][1,2,4]三嗪-6,8-二酮(10f);
(r)-7-羟基-12-(((r/s)-1-氯-5h-二苯并[a,d][7]-5-环戊烯基)-7-羟基-3,4,12,12a-四氢-1h-[1,4]恶嗪基[3,4-c]吡啶基[2,1-f][1,2,4]三嗪-6,8-二酮(10g);
(r)-7-羟基-12-(((r/s)-2-氯-5h-二苯并[a,d][7]-5-环戊烯基)-7-羟基-3,4,12,12a-四氢-1h-[1,4]恶嗪基[3,4-c]吡啶基[2,1-f][1,2,4]三嗪-6,8-二酮(10h);
(r)-7-羟基-12-(((r/s)-3-氯-5h-二苯并[a,d][7]-5-环戊烯基)-7-羟基-3,4,12,12a-四氢-1h-[1,4]恶嗪基[3,4-c]吡啶基[2,1-f][1,2,4]三嗪-6,8-二酮(10i);
(r)-7-羟基-12-(((r/s)-3-甲基-5h-二苯并[a,d][7]-5-环戊烯基)-3,4,12,12a-四氢-1h-[[1,4]恶嗪基[3,4-c]吡啶基[2,1-f][1,2,4]三嗪-6,8-二酮(10j);
(r)-7-羟基-12-(((r/s)-3-甲氧基-5h-二苯并[a,d][7]-5-环戊烯基)-3,4,12,12a-四氢-1h-[[1,4]恶嗪基[3,4-c]吡啶基[2,1-f][1,2,4]三嗪-6,8-二酮(10k)。
本发明提供上述化合物的制备方法,以不同取代的苯甲醛为起始原料,经过一些列反应得到通式ii所示的化合物。具体合成路线图1所示。
图1所示合成路线概括并描述了本发明通式ii所示的化合物的制备,所有的原料都是通过这些流程中描述的方式,通过有机化学领域普通技术人员熟知的方法制备的,或者商购的。本发明的全部最终衍生物都是通过这些流程中描述的方法或者通过与其类似的方法制备的,这些方法是有机化学领域普通技术人员熟知的。
本发明第二方面提供一种药物组合物,包含作为活性成分的上述多环吡啶酮衍生物以及药学上可接受的赋形剂。
本发明可以含有通式i所示化合物的衍生物及其药学上可接受的盐、水合物作为活性成分,与药学上可接受的赋形剂混合制备成组合物,并制备成临床上可接受的剂型,上述赋形剂是指可用于药学领域的稀释剂、辅助剂或载体。上述剂型是指临床上常用的注射剂、片剂、胶囊剂等。
本发明涉及的化合物或其药学上可接受的盐、水合物、前药可作为唯一的抗流感药物单独使用,或者可以与现已上市的抗流感药物联合使用,用于预防、处理、治疗或减轻流感病毒感染后患者的症状。
本发明第三方面提供上述多环吡啶酮衍生物和/或药物组合物在制备治疗或预防由具有帽依赖性核酸内切酶的病毒引起的疾病。所述具有帽依赖性核酸内切酶的病毒包括但不限于流感病毒。
本发明第四方面提供上述多环吡啶酮衍生物和/或药物组合物在制备流感病毒rna聚合酶抑制剂中的应用。
本发明第五方面提供上述多环吡啶酮衍生物和/或药物组合物在制备用于预防、处理、治疗或减轻流感病毒感染后患者的症状的药物中的应用。
通过对两株流感病毒株(a/fortmonmouth/1/1947(h1n1),a/wuhanhanfang/359/1995(h3n2))的活性抑制测试发现,本发明化合物或其药学上可接受的盐、水合物、前药对流感病毒具有显著的抑制活性,其中部分化合物活性和巴洛沙韦相当,甚至超过巴洛沙韦。
本发明的其它特征和优点将在随后具体实施方式部分予以详细说明。
附图说明
通过结合附图对本发明示例性实施方式进行更详细的描述,本发明的上述以及其它目的、特征和优势将变得更加明显。
图1为本发明多环吡啶酮衍生物的合成路线图。
具体实施方式
下面将更详细地描述本发明的优选实施方式。虽然以下描述了本发明的优选实施方式,然而应该理解,可以以各自形式实验本发明而不应被这里阐述的实施方式所限制。
在以下的实施例中,描绘了制备所述化合物的方法。应了解,以下方法及所属领域的普通技术人员已知的其他方法均可以适用于本发明所述的所有化合物的制备。实施例旨在阐述而不是限制本发明的范围。
实施例1:(r)-12-(5h-二苯并[a,d][7]-5-环戊烯基)-7-羟基-3,4,12,12a-四氢-1h-[1,4]恶嗪[3,4-c]吡啶并[2,1-f][1,2,4]三嗪-6,8-二酮(10a)的合成
步骤1:100ml反应瓶中加入20mmol化合物7a、10ml四氢呋喃和2ml无水乙醇,冰浴下缓缓加入10mmol硼氢化钠,室温下搅拌1.5小时。将反应液倒入冰水中,减压蒸掉大部分有机溶剂,用二氯甲烷萃取出产物,无水硫酸钠干燥有机相,减压蒸干有机相得到化合物8a,无需纯化,直接用于下一步反应。1hnmr(400mhz,dmso-d6)δ7.68(dt,j=7.8,1.1hz,2h),7.39(td,j=7.5,1.4hz,2h),7.34(dd,j=7.6,1.4hz,2h),7.22(td,j=7.4,1.4hz,2h),7.13(s,2h),6.08(s,1h),4.99(d,j=4.1hz,1h).
步骤2:100ml反应瓶中加入1mmol化合物1、1.2mmol化合物8a和2.5mmol的50wt.%1-丙基磷酸酐乙酸乙酯溶液,50℃搅拌过夜。将反应液倒入适量冰水中,用乙酸乙酯萃取产物,饱和食盐水洗涤有机相,无水硫酸钠干燥后减压蒸干。粗品用大硅胶板(20cm×20cm)纯化。得到化合物9a。1hnmr(400mhz,chloroform-d)δ7.65–7.57(m,2h),7.48(dt,j=4.9,2.9hz,1h),7.46–7.40(m,2h),7.40–7.33(m,4h),7.31–7.25(m,2h),7.04(d,j=6.3hz,3h),6.56(dd,j=7.7,1.3hz,1h),6.25(d,j=7.7hz,1h),5.68–5.53(m,2h),5.41(d,j=10.8hz,1h),5.33(s,1h),4.58(dd,j=13.6,2.5hz,1h),3.90(dd,j=9.9,3.0hz,1h),3.61(dd,j=11.8,3.3hz,1h),3.51(dd,j=10.8,3.1hz,1h),3.18(td,j=11.8,2.7hz,1h),3.12–3.01(m,1h),2.76(ddd,j=13.5,11.8,3.5hz,1h).
步骤3:50ml反应瓶中加入0.5mmol化合物9a、1.5mmol氯化锂和5mldma,反应液在80℃下搅拌3小时。冰浴搅拌下,向反应液中加入2ml丙酮、9ml0.5m稀盐酸和4ml,继续冰浴下搅拌1小时。产物以固体形式析出来,抽滤得到固体,干燥后得到目标化合物10a,淡粉色固体。产率92.3%。1hnmr(400mhz,chloroform-d)δ7.55–7.39(m,5h),7.34(t,j=7.5hz,1h),7.19(t,j=7.5hz,1h),7.07(s,2h),6.91(d,j=7.6hz,1h),6.24(d,j=7.7hz,1h),5.58(d,j=7.7hz,1h),5.41(s,1h),4.57(dd,j=13.5,2.6hz,1h),4.03(dd,j=10.0,3.1hz,1h),3.70(dd,j=12.0,3.4hz,1h),3.61(dd,j=11.0,3.1hz,1h),3.40–3.23(m,2h),2.86(ddd,j=15.1,11.8,3.5hz,1h);13cnmr(101mhz,chloroform-d)δ172.23,162.04,154.02,137.85,134.51,134.40,133.08,133.05,130.89,130.73,130.69,130.38,130.33,130.18,129.55,129.34,129.29,114.79,110.93,77.28,75.72,69.51,69.04,66.54,45.59;hrms-esi(m/z)calcd.forc25h22n3o4[m+h]+:428.1610,found:428.1602.
实施例2:(r)-7-羟基-12-(((r/s)-2-溴-5h-二苯并[a,d][7]-5-环戊烯基)-7-羟基-3,4,12,12a-四氢-1h-[1,4]恶嗪基[3,4-c]吡啶基[2,1-f][1,2,4]三嗪-6,8-二酮(10b)的合成
步骤1:100ml反应瓶中依次加入化合物2(3.15g,21.0mmol)、nbs(4.09g,23.0mmol)和30ml氯苯。反应液加热至70℃,缓缓加入aibn(0.13g,0.80mmol),继续在70℃下搅拌1小时。待反应液冷却至室温,减压蒸除反应液中的溶剂,得到化合物3的粗品,无需纯化,直接用于下一步反应。
步骤2:100ml反应瓶中依次加入上一步得到的化合物3、三苯基膦(5.51g,21.0mmol)和25ml丙酮,反应液回流1小时。待反应液冷却至室温,抽滤得到白色固体。100ml反应瓶中加入上述得到的白色固体、甲醇钠(1.35g,25.0mmol)和30ml甲醇。反应液室温搅拌半小时后加热回流,继续加入11mmol4b,继续回流6小时。待反应液冷却至室温,将反应液倒入大量冰水中,用二氯甲烷萃取出产物,无水硫酸钠干燥有机相,减压蒸干得到粗品。将粗品与50ml石油醚混合并超声,大部分杂质以固体形式析出,滤除固体,减压蒸干滤液得到初步纯化的化合物5b,无需继续纯化,直接用于下一步反应。1hnmr(400mhz,chloroform-d)δ8.01(m,1h),7.34–7.32(m,2h),7.25–7.13(m,3h),7.11(d,j=12.0hz,1h),6.99–6.92(m,2h),6.57(d,j=12.0hz,1h),3.90(s,3h).
步骤3:100ml反应瓶中加入上一步得到的化合物5.0mmol5b、氢氧化钾(0.56g,10.0mmol)、20ml甲醇和1ml水,反应液回流4小时。待反应液冷却至室温,将反应液倒入大量冰水中并不停搅拌,加入4m盐酸溶液酸化,粗品以固体形式析出来。抽滤得到固体,干燥后的固体与50ml石油醚混合并超声,杂质大部分溶于石油醚中,抽滤并用石油醚洗涤固体,得到初步纯化的化合物6b,无需继续纯化,直接用于下一步反应。1hnmr(400mhz,chloroform-d)δ8.13-8.11(m,1h),7.38–7.34(m,2h),7.24–7.18(m,3h),7.14(d,j=12.0hz,1h).7.01–6.94(m,2h),6.59(d,j=12.0hz,1h).
步骤4:100ml反应瓶中加入上一步得到的化合物1.0mmol6b,用20ml二氯甲烷将其溶解,室温搅拌下缓慢加入氯化亚砜(0.13g,1.1mmol),然后反应液回流1.5小时。待反应液冷却至室温,缓缓加入0.17g无水氯化铝,室温下搅拌3小时。将反应液倒入冰水中,用二氯甲烷萃取出产物,无水硫酸钠干燥有机相,减压蒸干有机相得到化合物7b的粗品,无需纯化,直接用于下一步反应。1hnmr(400mhz,chloroform-d)δ8.26–8.22(m,1h),8.11(d,j=8.5hz,1h),7.72(d,j=2.0hz,1h),7.71–7.64(m,2h),7.62–7.55(m,2h),7.12(d,j=12.1hz,1h),6.97(d,j=12.1hz,1h).
步骤5:同实施例1步骤1,得到化合物8b。1hnmr(400mhz,chloroform-d)δ7.69(d,j=7.8hz,1h),7.58(d,j=8.3hz,1h),7.56–7.49(m,2h),7.46(td,j=7.5,1.5hz,1h),7.38(dd,j=7.7,1.4hz,1h),7.32(dd,j=7.4,1.3hz,1h),7.17(d,j=11.7hz,1h),7.03(d,j=11.7hz,1h),5.37(s,1h).
步骤6:同实施例1步骤2,得到化合物9b。一对非对映异构体,比例为3:4。1hnmr(400mhz,chloroform-d)δ7.68–7.63(m,4h),7.62–7.59(m,3h),7.55–7.52(m,3h),7.48–7.45(m,4h),7.38–7.35(m,4h),7.34–7.31(m,2h),7.16–7.02(m,4h),6.93(dd,j=11.8,1.5hz,2h),6.59–6.18(m,4h),5.77–5.55(m,4h),5.43(t,j=11.4hz,2h),5.29(d,j=13.2hz,2h),4.59(ddd,j=13.5,7.1,2.5hz,2h),3.87(ddd,j=25.7,9.9,3.0hz,2h),3.63(td,j=11.5,3.3hz,2h),3.53(ddd,j=10.0,6.5,3.0hz,2h),3.26–3.13(m,2h),3.07(t,j=10.4hz,2h),2.76(dddd,j=25.1,13.5,11.7,3.5hz,2h).
步骤7:同实施例1步骤3,得到化合物10b。产率91.5%。非对映异构体,比例为3:7。1hnmr(400mhz,chloroform-d)δ7.69–7.30(m,5h),7.21(t,j=7.6hz,1h),7.11(t,j=8.9hz,1h),7.05–6.72(m,2h),6.25(dd,j=25.7,7.6hz,1h),5.63(dd,j=47.5,7.7hz,1h),5.38(s,1h),4.57(dd,j=13.2,8.6hz,1h),4.01(ddd,j=23.2,10.1,3.0hz,1h),3.66(dtd,j=36.2,9.3,6.7,3.2hz,2h),3.32(dtd,j=20.8,11.3,10.4,3.4hz,2h),2.98–2.75(m,1h);13cnmr(101mhz,chloroform-d)δ172.19,162.03,154.03,137.77,136.16,133.44,132.76,132.21,132.07,131.90,131.84,131.76,131.09,130.72,130.41,130.32,129.97,129.71,129.59,129.17,128.83,123.33,114.72,111.16,110.96,75.09,74.92,69.61,69.50,69.00,66.53,45.66;hrms-esi(m/z)calcd.forc25h21brn3o4[m+h]+:506.0715,found:506.0708.
实施例3:(r)-7-羟基-12-(((r/s)-3-溴-5h-二苯并[a,d][7]-5-环戊烯基)-7-羟基-3,4,12,12a-四氢-1h-[1,4]恶嗪基[3,4-c]吡啶基[2,1-f][1,2,4]三嗪-6,8-二酮(10c)的合成
步骤:同实施例2步骤1-7,得到化合物10c。产率93.6%。非对映异构体,比例为1:1。1hnmr(400mhz,dmso-d6)δ11.70(s,2h),7.99(d,j=2.1hz,1h),7.69(dd,j=8.3,2.1hz,1h),7.62(dq,j=8.0,3.9hz,2h),7.59–7.54(m,2h),7.54–7.47(m,4h),7.44(d,j=8.3hz,1h),7.38(td,j=7.5,1.4hz,1h),7.27–7.10(m,6h),6.35(dd,j=15.6,7.7hz,2h),5.85(d,j=2.8hz,2h),5.43(d,j=7.7hz,1h),5.34(d,j=7.6hz,1h),4.40(ddd,j=16.2,13.4,2.5hz,2h),3.85(dd,j=8.4,4.6hz,1h),3.76(dd,j=9.5,3.5hz,1h),3.59(ddd,j=14.4,11.6,3.3hz,2h),3.41(td,j=10.0,9.0,3.6hz,4h),3.29(dd,j=11.3,2.7hz,2h),2.84(ddd,j=14.7,11.8,3.5hz,1h),2.75(ddd,j=15.2,11.1,3.4hz,1h);13cnmr(101mhz,dmso-d6)δ171.39,161.71,153.44,138.58,135.93,135.03,133.86,133.67,133.62,133.48,133.39,132.73,132.29,132.14,131.84,131.57,131.42,131.26,131.18,130.95,130.50,129.86,129.71,129.62,129.40,122.67,122.26,116.00,115.93,110.36,110.33,72.63,72.52,69.94,69.69,68.22,65.94,45.72;hrms-esi(m/z)calcd.forc25h21brn3o4[m+h]+:506.0715,found:506.0709.
实施例4:(r)-7-羟基-12-(((r/s)-1-氟-5h-二苯并[a,d][7]-5-环戊烯基)-7-羟基-3,4,12,12a-四氢-1h-[1,4]恶嗪基[3,4-c]吡啶基[2,1-f][1,2,4]三嗪-6,8-二酮(10d)的合成
步骤:同实施例2步骤1-7,得到化合物10d。产率92.1%。非对映异构体,比例为1:1。1hnmr(400mhz,chloroform-d)δ7.60–7.27(m,9h),7.18(ddt,j=22.0,15.9,8.2hz,6h),7.06(t,j=9.1hz,1h),6.90(d,j=7.6hz,1h),6.71(d,j=7.6hz,1h),6.33(d,j=7.7hz,1h),6.25(d,j=7.7hz,1h),5.66(d,j=7.7hz,1h),5.57(d,j=7.7hz,1h),5.44(s,2h),4.57(ddd,j=13.4,6.0,2.5hz,2h),4.04(ddd,j=22.5,10.0,3.1hz,2h),3.67(dtd,j=35.1,11.5,3.3hz,4h),3.32(dtd,j=20.8,10.4,9.4,3.5hz,4h),2.86(qd,j=13.0,3.6hz,2h);13cnmr(101mhz,chloroform-d)δ172.20,162.00,154.07,154.03,137.78,137.72,134.31,134.20,133.00,132.93,131.91,131.62,131.04,130.71,130.56,130.41,130.34,129.88,129.64,129.57,126.17,125.77,121.91,121.46,121.38,116.33,116.19,116.10,114.75,114.69,111.09,110.97,75.10,75.04,69.69,69.54,69.01,68.98,66.53,45.61;hrms-esi(m/z)calcd.forc25h21fn3o4[m+h]+:446.1516,found:446.1507.
实施例5:(r)-7-羟基-12-(((r/s)-2-氟-5h-二苯并[a,d][7]-5-环戊烯基)-7-羟基-3,4,12,12a-四氢-1h-[1,4]恶嗪基[3,4-c]吡啶基[2,1-f][1,2,4]三嗪-6,8-二酮(10e)的合成
步骤:同实施例2步骤1-7,得到化合物10e。产率91.0%。非对映异构体,比例为1:1。1hnmr(400mhz,chloroform-d)δ7.58–7.47(m,3h),7.43(td,j=8.7,8.0,4.9hz,3h),7.37(td,j=7.6,1.3hz,1h),7.23(ddd,j=9.2,6.4,1.8hz,2h),7.19–7.08(m,4h),7.00(dd,j=11.8,4.7hz,2h),6.91(dd,j=7.2,1.9hz,3h),6.29(d,j=7.7hz,1h),6.23(d,j=7.7hz,1h),5.69(d,j=7.7hz,1h),5.59(d,j=7.7hz,1h),5.41(s,2h),4.59(ddd,j=13.5,5.3,2.5hz,2h),4.03(ddd,j=11.1,10.0,3.1hz,2h),3.72(ddd,j=11.5,7.7,3.4hz,2h),3.63(ddd,j=10.8,7.5,3.1hz,2h),3.32(dddd,j=23.3,11.3,9.4,2.6hz,4h),2.87(dtd,j=15.4,12.1,3.5hz,2h);13cnmr(101mhz,chloroform-d)δ172.24,162.07,154.07,137.78,136.47,134.14,132.53,131.93,131.59,131.09,130.68,130.40,130.31,129.97,129.68,129.51,129.11,117.15,116.94,116.35,111.03,110.96,74.91,74.81,69.51,69.05,66.55,45.66,45.60;hrms-esi(m/z)calcd.forc25h21fn3o4[m+h]+:446.1516,found:446.1506.
实施例6:(r)-7-羟基-12-(((r/s)-3-氟-5h-二苯并[a,d][7]-5-环戊烯基)-7-羟基-3,4,12,12a-四氢-1h-[1,4]恶嗪基[3,4-c]吡啶基[2,1-f][1,2,4]三嗪-6,8-二酮(10f)的合成
步骤:同实施例2步骤1-7,得到化合物10f。产率93.3%。非对映异构体,比例为1:1。1hnmr(400mhz,chloroform-d)δ7.58–7.30(m,8h),7.19(q,j=8.6,7.8hz,3h),7.05(s,5h),6.90(d,j=7.7hz,1h),6.69(d,j=8.6hz,1h),6.28(dd,j=29.0,7.7hz,2h),5.62(dd,j=39.0,7.7hz,2h),5.36(d,j=4.6hz,2h),4.59(t,j=14.8hz,2h),4.03(ddd,j=23.6,9.9,3.1hz,2h),3.83–3.53(m,4h),3.50–3.13(m,4h),3.03–2.76(m,2h);13cnmr(101mhz,chloroform-d)δ172.21,162.06,161.99,154.05,137.79,134.43,134.25,132.86,132.78,132.41,132.29,132.03,130.89,130.76,130.31,130.19,129.87,129.69,129.58,129.46,129.21,117.45,116.94,116.71,111.04,110.95,75.03,69.70,69.49,69.03,68.93,66.55,45.69,45.65.;hrms-esi(m/z)calcd.forc25h21fn3o4[m+h]+:446.1516,found:446.1506.
实施例7:(r)-7-羟基-12-(((r/s)-1-氯-5h-二苯并[a,d][7]-5-环戊烯基)-7-羟基-3,4,12,12a-四氢-1h-[1,4]恶嗪基[3,4-c]吡啶基[2,1-f][1,2,4]三嗪-6,8-二酮(10g)的合成
步骤:同实施例2步骤1-7,得到化合物10g。1hnmr(400mhz,chloroform-d)δ7.56–7.33(m,12h),7.25–7.16(m,3h),7.10(t,j=7.8hz,1h),6.90(d,j=7.6hz,1h),6.83(d,j=7.6hz,1h),6.33(d,j=7.6hz,1h),6.26(d,j=7.7hz,1h),5.68(d,j=7.7hz,1h),5.59(d,j=7.7hz,1h),5.40(s,2h),4.57(ddd,j=13.3,7.1,2.5hz,2h),4.08(dd,j=9.9,3.1hz,1h),4.01(dd,j=10.0,3.1hz,1h),3.78–3.58(m,4h),3.41–3.23(m,4h),2.86(dddd,j=15.3,13.4,11.8,3.5hz,2h);13cnmr(101mhz,chloroform-d)δ172.21,161.94,154.11,154.05,137.76,135.76,135.61,133.90,133.32,131.87,131.61,130.90,130.83,130.77,130.47,130.15,130.11,129.97,129.92,129.78,129.70,129.64,129.23,128.89,126.42,126.05,114.70,111.13,111.01,77.28,75.39,75.25,69.79,69.59,69.00,68.98,66.54,45.62,45.59;hrms-esi(m/z)calcd.forc25h21cln3o4[m+h]+:462.1221,found:462.1211.
实施例8:(r)-7-羟基-12-(((r/s)-2-氯-5h-二苯并[a,d][7]-5-环戊烯基)-7-羟基-3,4,12,12a-四氢-1h-[1,4]恶嗪基[3,4-c]吡啶基[2,1-f][1,2,4]三嗪-6,8-二酮(10h)的合成
步骤:同实施例2步骤1-7,得到化合物10h。产率92.5%。非对映异构体,比例为1:1。1hnmr(400mhz,chloroform-d)δ7.57–7.30(m,11h),7.24–7.07(m,4h),6.98(dd,j=11.8,5.5hz,2h),6.87(dd,j=16.6,7.9hz,2h),6.29(d,j=7.7hz,1h),6.22(d,j=7.7hz,1h),5.68(d,j=7.7hz,1h),5.57(d,j=7.6hz,1h),5.39(s,2h),4.57(ddd,j=13.7,7.1,2.4hz,2h),4.01(ddd,j=19.2,9.9,3.1hz,2h),3.71(td,j=11.3,3.4hz,2h),3.61(ddd,j=10.0,6.5,3.1hz,2h),3.42–3.22(m,4h),2.95–2.76(m,2h);13cnmr(101mhz,chloroform-d)δ172.19,162.02,154.02,137.79,135.89,135.25,134.19,132.89,132.07,131.90,131.73,131.69,131.09,130.70,130.48,130.41,130.33,129.94,129.78,129.71,129.58,129.27,129.14,128.91,114.75,111.14,110.96,77.28,75.00,74.86,69.59,69.51,68.99,66.52,45.67,45.62;hrms-esi(m/z)calcd.forc25h21cln3o4[m+h]+:462.1221,found:462.1208.
实施例9:(r)-7-羟基-12-(((r/s)-3-氯-5h-二苯并[a,d][7]-5-环戊烯基)-7-羟基-3,4,12,12a-四氢-1h-[1,4]恶嗪基[3,4-c]吡啶基[2,1-f][1,2,4]三嗪-6,8-二酮(10i)的合成
步骤:同实施例2步骤1-7,得到化合物10i。产率90.7%。非对映异构体,比例为1:1。1hnmr(400mhz,chloroform-d)δ7.56–7.29(m,11h),7.22(td,j=7.5,1.4hz,1h),7.13–6.99(m,4h),6.97(d,j=2.1hz,1h),6.94–6.88(m,1h),6.31(d,j=7.7hz,1h),6.24(d,j=7.7hz,1h),5.69(d,j=7.7hz,1h),5.58(d,j=7.7hz,1h),5.36(d,j=2.8hz,2h),4.60(ddd,j=19.8,13.3,2.5hz,2h),4.03(ddd,j=23.8,9.9,3.1hz,2h),3.73(ddd,j=16.3,12.0,3.4hz,2h),3.62(ddd,j=10.9,9.3,3.1hz,2h),3.42–3.23(m,4h),2.94(ddd,j=13.4,11.7,3.5hz,1h),2.84(ddd,j=13.4,11.8,3.5hz,1h);13cnmr(101mhz,chloroform-d)δ172.22,162.05,154.10,137.81,137.75,135.55,134.40,132.99,132.90,132.64,132.49,132.12,131.27,131.09,130.97,130.80,130.34,130.29,130.01,129.86,129.65,129.59,129.53,129.45,129.36,129.23,114.67,114.64,110.95,77.25,75.08,74.92,69.68,69.48,69.04,68.95,66.56,66.51,45.68,45.63,29.71;hrms-esi(m/z)calcd.forc25h21cln3o4[m+h]+:462.1221,found:462.1211.
实施例10:(r)-7-羟基-12-(((r/s)-3-甲基-5h-二苯并[a,d][7]-5-环戊烯基)-3,4,12,12a-四氢-1h-[[1,4]恶嗪基[3,4-c]吡啶基[2,1-f][1,2,4]三嗪-6,8-二酮(10j)的合成
步骤:同实施例2步骤1-7,得到化合物10j。产率85.3%。非对映异构体,比例为1:1。1hnmr(400mhz,chloroform-d)δ7.53–7.38(m,6h),7.35–7.27(m,3h),7.23(d,j=1.8hz,1h),7.16(ddd,j=12.8,7.6,1.5hz,2h),7.07–6.98(m,4h),6.88(d,j=7.6hz,1h),6.72(d,j=1.7hz,1h),6.25(dd,j=7.6,4.9hz,2h),5.67–5.46(m,2h),5.35(s,2h),4.58(ddd,j=13.5,7.6,2.5hz,2h),4.05(ddd,j=16.5,9.9,3.1hz,2h),3.70(dt,j=11.9,4.2hz,2h),3.65–3.54(m,2h),3.50–3.13(m,4h),2.86(ddt,j=12.3,8.7,2.8hz,2h),2.41(s,3h),2.20(s,3h);13cnmr(101mhz,chloroform-d)δ172.20,162.01,153.97,140.05,139.67,138.03,137.90,134.58,132.94,132.87,131.92,131.30,130.89,130.82,130.80,130.67,130.63,130.34,130.26,130.21,130.16,130.10,130.06,129.78,129.44,129.33,129.27,129.25,129.07,114.87,114.83,110.91,110.76,75.80,69.48,69.04,66.52,45.57,21.13,20.96;hrms-esi(m/z)calcd.forc26h24n3o4[m+h]+:442.1767,found:442.1758.
实施例11:(r)-7-羟基-12-(((r/s)-3-甲氧基-5h-二苯并[a,d][7]-5-环戊烯基)-3,4,12,12a-四氢-1h-[[1,4]恶嗪基[3,4-c]吡啶基[2,1-f][1,2,4]三嗪-6,8-二酮(10k)的合成
步骤:同实施例2步骤1-7,得到化合物10k。产率94.9%。非对映异构体,比例为1:1。1hnmr(400mhz,chloroform-d)δ7.70–7.31(m,6h),7.08–6.84(m,3h),6.43(s,1h),6.31(d,j=7.7hz,1h),5.65(d,j=7.7hz,1h),5.34(s,1h),4.58(d,j=12.9hz,1h),4.03(dd,j=9.8,3.0hz,1h),3.85(d,j=6.3hz,1h),3.66(s,3h),3.32(dt,j=21.7,11.1hz,2h),2.86(t,j=12.5hz,1h);13cnmr(101mhz,chloroform-d)δ172.15,160.93,153.97,138.04,132.37,131.76,130.74,130.37,129.91,129.31,128.91,128.46,115.61,115.34,110.92,75.85,69.44,69.03,66.54,55.61,45.58,29.71;hrms-esi(m/z)calcd.forc26h24n3o5[m+h]+:458.1716,found:458.1707.
化合物的生物活性研究
在以下实施例中,以本发明的部分化合物为例,检测了本发明化合物的抗病毒活性及细胞毒性。
抗病毒活性及细胞毒性测试
实施例a:细胞病变效应实验(cpeassay):
在体外细胞水平上检测化合物抑制病毒hlnla/fortmonmouth/1/1947和h3n2a/wuhanhanfang/95/359致细胞病变(cpe)的能力。
实验步骤:
(1)mdck细胞以2.5×104/孔的密度种入96孔板。
(2)24h后,细胞用pbs洗一遍,用100半数组织细胞感染量(50%tissuecultureinfectivedoses,tcid50)的病毒感染液(无血清的mem培养基)感染mdck细胞。流感病毒:a/fortmonmouth/1/1947(h1n1),a/wuhanhanfang/359/1995(h3n2)。
(3)37℃感染2h后,未吸附的病毒被移除,加入含化合物的病毒维持液(mem培养基补充2μg/ml的tpck处理的胰酶和0.08%bsa)。化合物最高检测浓度为200nm,3倍稀释,8个浓度,依次为:100nm、66.67nm、22.22nm、7.41nm、2.47nm、0.82nm、0.27nm、0.09nm。同时设置不加药的病毒对照组和无病毒感染不加药的细胞对照组。细胞毒性实验组不加入病毒,用培养基代替。均设置两个复孔。
(4)37℃培养箱中继续孵育约2天左右,待病毒对照组细胞病变程度(cytopathiceffect,cpe)为75%-100%时,读取化合物组cpe结果。
(5)通过reed&muench法计算药物的半数有效抑制浓度(50%inhibitoryconcentration,ic50),并根据tc50/ic50比值计算治疗指数(selectiveindex,si)。
抗病毒活性试验和细胞毒性试验表明,本发明化合物均具有很好的抗病毒活性,特别地,部分化合物对流感病毒(a/fortmonmouth/1/1947)和流感病毒(a/wuhanhanfang/359/1995)的抑制活性与巴洛沙韦相当;同时,本发明化合物具有很低的细胞毒性,tc50远远小于巴洛沙韦的细胞毒性。
表1本发明化合物对流感病毒(a/fortmonmouth/1/1947,a/wuhanhanfang/359/1995)体外实验tc50和ic50活性数据
注:tc50:药物半数有毒浓度;ic50:药物对病毒半数抑制浓度。
由表1可知,本发明化合物具有很好的抗流感病毒活性,同时具有很低的细胞毒性。
以上已经描述了本发明的各实施例,上述说明是示例性的,并非穷尽性的,并且也不限于所披露的各实施例。在不偏离所说明的各实施例的范围和精神的情况下,对于本技术领域的普通技术人员来说许多修改和变更都是显而易见的。
- 还没有人留言评论。精彩留言会获得点赞!